常见有机化合物中碳原子的杂化方式与成键情况
陈谦,朱国磊,邓丽华
西南林业大学化学工程学院,西南地区林业生物质资源高效利用国家林业和草原局重点实验室,昆明 650224
结构决定性质、性质反映结构,这一辨证关系在有机化学中得到充分体现。在理解有机化合物结构的基础上来学习有机化合物的性质(包括物理性质和化学性质)可以达到事半功倍的效果。由相同种类的原子构成的有机化合物中,由于各种原子的杂化方式及其成键情况的不同,可以形成不同的官能团,进而体现出不同的物理性质和化学性质[1]。所以,掌握有机化合物中各种原子的杂化方式及其成键情况是理解有机化合物结构的重要一环。本文针对常见有机化合物中碳原子的杂化方式及其成键情况进行了较为全面的归纳与整理,以方便读者准确地把握有机化合物的结构与性质。
1 碳原子核外电子排布的基态与激发态
碳原子核外有6个电子,基态电子排布为1s22s22p2。由于同处于第二电子层的2s轨道与2p轨道的能级相近,所以2s轨道的电子吸收能量后可以跃迁到2p轨道中,其基态与激发态的电子在轨道中的排布如图1所示。

图1 碳原子基态与激发态电子的轨道能级分布图
由于碳原子中参与成键的只是最外层电子,即2s轨道和2p轨道中的电子,所以基态与激发态电子的轨道能级分布图可省略为图2所示。
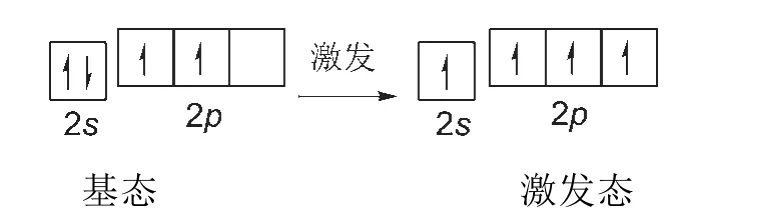
图2 碳原子第二电子层基态与激发态电子的轨道能级分布图
由图2所知,处于激发态的2s轨道和2p轨道中的电子都是未成对电子,所以都有变成成对电子的趋势,也即都有成键的趋势。
2 碳原子杂化方式与成键
碳原子在与碳原子及其他原子(如氢原子、氧原子、氮原子等)结合成键的过程中,根据成键的要求,其能量相近的原子轨道进一步线性组合形成新的原子轨道[2]。不同原子轨道的线性组合,称为原子轨道的杂化。杂化轨道的数目等于参与杂化的原子轨道数目,并包含原来的原子轨道的成分。同时,通过原子轨道线性组合所形成的杂化轨道方向性更强,成键的能力更强,也即原子轨道线性组合形成杂化轨道后更有利于成键。根据成键的需要,处于激发态的含有未成对电子的三个2p轨道中,可以贡献出一个2p轨道与2s轨道杂化,形成两个sp杂化轨道;也可以贡献出两个2p轨道与2s轨道杂化,形成三个sp2杂化轨道;还可以把三个2p轨道全部贡献出来与2s轨道杂化,形成四个sp3杂化轨道。所以根据激发态中参与杂化的2p轨道的数目的不同,可以采取sp杂化、sp2杂化,sp3杂化[3]。
2.1 sp杂化
当处于激发态的含有未成对电子的三个2p轨道中贡献出一个2p轨道与2s轨道杂化,此时形成两个sp杂化轨道。两个sp杂化轨道的空间分布呈直线型,未参与杂化的p轨道相互垂直且都垂直于杂化轨道的对称轴。通过杂化形成的两个新的sp杂化轨道可以与碳原子、氢原子、氮原子、氧原子等形成两个σ键(一氧化碳分子中只形成一个σ键);而未参与杂化的两个 2p轨道,各有一个电子,可以与碳原子、氮原子、氧原子等形成两个π键(如图3所示)。

图3 碳原子sp杂化轨道形成示意图
sp杂化轨道主要用于形成碳碳三键、碳氮三键、碳氧三键,存在于炔烃、氰基、一氧化碳、联烯、碳化二甲酰亚胺、二氧化碳、烯酮等化合物中,如图4所示。

图4 含有sp杂化轨道的化合物示意图
在炔类化合物中,碳碳三键的碳原子采取sp杂化,形成两个sp杂化轨道,其中的一个sp杂化轨道用于形成碳碳三键中的一个碳碳σ键,另一个sp杂化轨道用于与其他原子如氢(乙炔、端炔中)、碳(内炔、芳炔、烯炔中)等形成σ键。而每一个碳原子剩下的两个未参与杂化的p轨道,则以肩并肩的形式从侧面形成两个π键。
在腈类化合物中碳氮三键的碳原子采取sp杂化,形成两个sp杂化轨道,其中的一个sp杂化轨道用于形成碳氮三键中的一个碳氮σ键,另一个sp杂化轨道用于与其他原子如氢(氢氰酸中)、碳(腈类)等形成σ键。而碳原子剩下的两个未参与杂化的p轨道,则以肩并肩的形式从侧面与sp杂化的氮原子形成两个相互垂直的π键。应用较为广泛的溶剂乙腈的成键示意图如图5所示。

图5 乙腈分子的成键情况
联烯(丙二烯)中,中心碳原子采取sp杂化,形成两个sp杂化轨道,分别与两端sp2杂化的碳原子各形成一个碳碳σ键,而中心碳原子剩下的两个未参与杂化的p轨道,则以肩并肩的形式从侧面分别与两端sp2杂化的碳原子形成两个π键,此时形成的两个π键是相互垂直的(图6,丙二烯分子)。
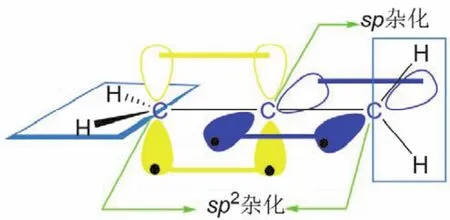
图6 丙二烯分子的成键情况
碳化二甲酰亚胺分子结构与联烯分子结构相似,中心碳原子采取sp杂化,形成两个sp杂化轨道,分别与两端sp2杂化的氮原子各形成一个碳氮σ键,而中心碳原子剩下的两个未参与杂化的p轨道,则以肩并肩的形式从侧面分别与两端sp2杂化的氮原子形成两个π键。用于肽键形成中的脱水剂二环己基碳化二甲酰亚胺(DCC)的成键示意图如图7所示。
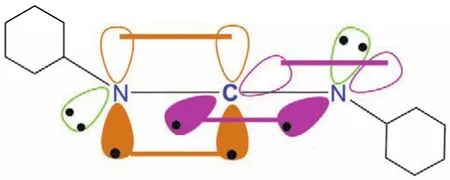
图7 二环己基碳化二甲酰亚胺(DCC)的成键示意图
二氧化碳分子结构与碳化二甲酰亚胺分子结构相似,碳原子采取sp杂化,形成两个sp杂化轨道,分别与两端sp2杂化的氧原子形成一个碳氧σ键,碳原子剩下的两个未参与杂化的p轨道,则以肩并肩的形式从侧面分别与两端sp2杂化的氧原子形成两个π键,如图8所示(二氧化碳分子)。
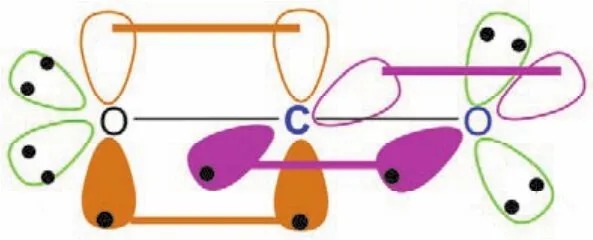
图8 二氧化碳(CO2)的成键示意图
烯酮分子结构与联烯或二氧化碳分子结构相似,中心碳原子采取sp杂化,形成两个sp杂化轨道,分别与两端sp2杂化的氧原子及碳原子形成一个碳氧σ键和一个碳碳σ键,而中心碳原子剩下的两个未参与杂化的p轨道,则以肩并肩的形式从侧面分别与两端sp2杂化的氧原子及碳原子形成两个π键,二甲基烯酮的成键示意图如图9所示。
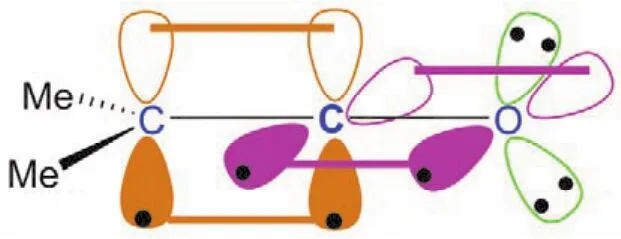
图9 二甲基烯酮的成键示意图
一氧化碳分子中的碳原子采取sp杂化,形成两个sp杂化轨道,其电子的排布与上述几种sp杂化略有不同。其中的一个sp杂化轨道用于形成碳氧三键中的一个碳氧σ键,另一个sp杂化轨道用于填充碳原子的一对孤对电子。碳原子剩下的两个未参与杂化的p轨道中,其中一个含有未成对电子的p轨道用于与氧原子中含有未成对电子的p轨道形成π键;而另一个空的p轨道则用于填充来自于氧原子的孤电子对,以形成配位性π键,如图10所示(一氧化碳分子)。

图10 一氧化碳的成键示意图
2.2 sp2 杂化
如图11所示,处于激发态的含有未成对电子的三个2p轨道中贡献出两个2p轨道与2s轨道杂化,此时形成三个sp2杂化轨道。三个sp2杂化轨道的空间分布呈平面三角形,未参与杂化的p轨道垂直于杂化轨道所在的平面。通过杂化形成的三个新的sp2杂化轨道可以与碳原子、氢原子、氮原子、氧原子等形成三个σ键;而未参与杂化的一个2p轨道,含有1个电子,可以与含有1个电子的碳、氮、氧等原子的轨道形成一个π键。

图11 碳原子sp2杂化轨道形成示意图
sp2杂化轨道主要用于形成碳碳双键、碳氮双键、碳氧双键、碳硫双键等,存在于烯烃、芳环、芳杂环、醛、酮、亚胺、羧酸、酯、酰氯、酸酐、酰胺等化合物中,如图12所示。

图12 含有sp2杂化轨道的化合物示意图
在烯烃类化合物中,碳碳双键的碳原子采取sp2杂化,形成三个sp2杂化轨道,其中的一个sp2杂化轨道用于形成碳碳双键中的一个碳碳σ键,另两个sp2杂化轨道用于与其他原子如氢(乙烯)、碳(取代烯烃)等形成σ键。而形成碳碳双键的两个碳原子剩下的一个未参与杂化的p轨道,则以肩并肩的形式从侧面形成一个π键(如图13所示,肉桂醛分子中的烯烃部分)。
在芳烃类化合物中,芳香环的碳原子采取sp2杂化,形成三个sp2杂化轨道,其中的一个sp2杂化轨道用于形成一个环外碳氢σ键、碳碳σ键或碳杂σ键(取代芳烃),另两个sp2杂化轨道用于与相邻两个碳原子形成σ键。芳香环上的每个碳原子剩下的一个未参与杂化的p轨道,则以肩并肩的形式从侧面形成一个大π键(如图13所示,肉桂醛分子中的苯基部分)。
在醛、酮、羧酸及其衍生物中,羰基的碳原子采取sp2杂化,形成三个sp2杂化轨道,其中的一个sp2杂化轨道用于与sp2杂化的氧形成碳氧σ键,另两个sp2杂化轨道可用于与氢形成碳氢σ键(醛)(如图13所示,肉桂醛分子中的醛基部分);可用于与碳形成碳碳σ键(酮),可用于与羟基、烷氧基或羧基中的氧形成碳氧σ键(注:羧酸在水溶液中易电离成羧酸根负离子,电离成负离子后,氧原子上带有一个负电荷,这样更有利于共轭,形成共振杂化体,在羧酸根负离子中两个碳氧键是等价的,即两个碳氧键都介于碳氧单键和碳氧双键之间);可用于与卤素形成碳卤σ键;可用于与氮形成碳氮σ键。羰基碳原子剩下的一个未参与杂化的p轨道,则以肩并肩的形式从侧面与sp2杂化的氧形成一个碳氧π键。
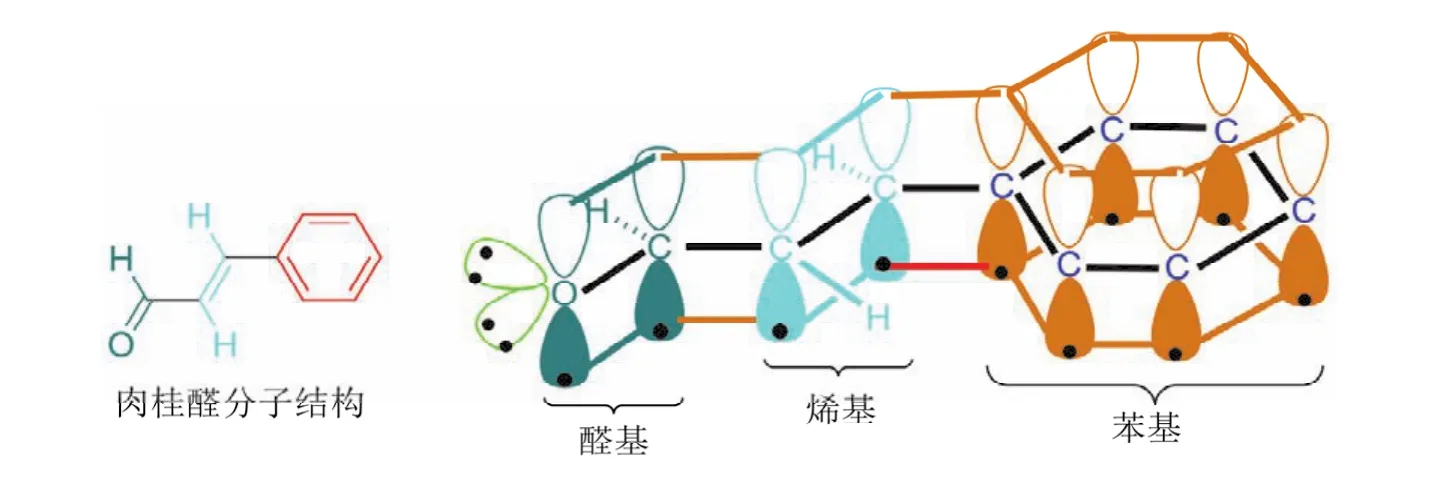
图13 肉桂醛分子成键示意图
亚胺类化合物结构与醛、酮类似,亚胺的碳原子采取sp2杂化,形成三个sp2杂化轨道,其中的一个sp2杂化轨道用于与sp2杂化的氮形成碳氮σ键,另两个sp2杂化轨道用于与氢形成碳氢σ键(醛亚胺)或与碳形成碳碳σ键(酮亚胺)。亚胺碳原子剩下的一个未参与杂化的p轨道,则以肩并肩的形式从侧面与sp2杂化的氮形成一个碳氮π键(如图14所示,苯甲醛缩苯胺(亚胺)分子成键示意图)。
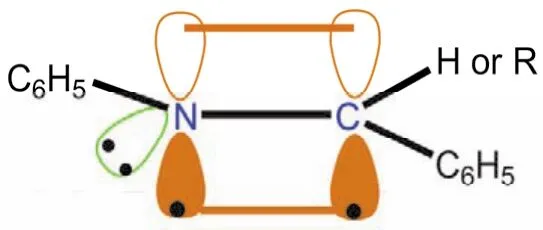
图14 亚胺分子C=N成键示意图
2.3 sp3杂化
如图15所示,当处于激发态的含有未成对电子的三个2p轨道全部贡献出来与2s轨道杂化,此时形成四个sp3杂化轨道。四个sp3杂化轨道的空间分布呈正四面体形。通过杂化形成的四个新的sp3杂化轨道可以与碳原子、氢原子、氮原子、氧原子等形成四个σ键。
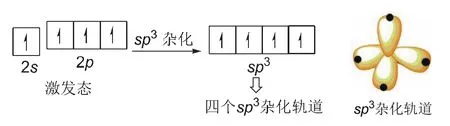
图15 碳原子sp3杂化轨道形成示意图
sp3杂化轨道主要用于形成饱和的碳碳σ键及碳氢σ键、碳氧σ键、碳氮σ键、碳硫σ键等饱和碳杂键,存在于饱和烷烃、醇、硫醇、醚、硫醚、脂肪胺等化合物中,如图16所示。
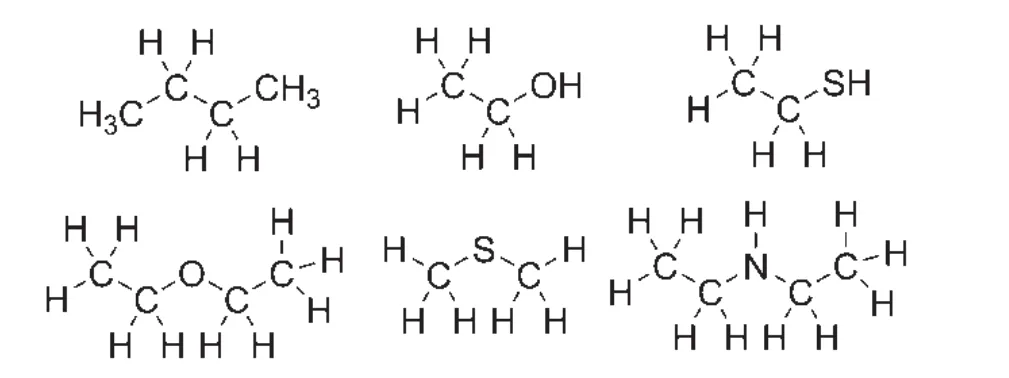
图16 含有sp3杂化轨道的化合物示意图
在饱和烷烃类化合物中,所有碳原子采取sp3杂化,形成四个sp3杂化轨道,sp3杂化轨道的碳原子要么用于与邻近的碳原子形成碳碳σ键,要么用于与邻近的氢原子形成碳氢σ键。
在醇及醚类化合物中,碳原子采取sp3杂化,形成四个sp3杂化轨道,sp3杂化轨道的碳原子除了两类用于与邻近的碳原子、氢原子形成碳碳σ键及碳氢σ键外,连氧碳原子的sp3杂化轨道还用于与sp3杂化的氧原子形成碳氧σ键(醇、醚中的连氧碳含有一个碳氧σ键;缩醛/酮中的连氧碳含有两个碳氧σ键;原酸酯中含有三个碳氧σ键)。硫醇及硫醚类化合物中成键情况类似于醇及醚类化合物中,区别在于此时连硫碳原子形成的是碳硫σ键。
在脂肪胺类化合物中,碳原子采取sp3杂化,形成四个sp3杂化轨道,sp3杂化轨道的碳原子除了两类用于与邻近的碳原子或氢原子形成碳碳σ键及碳氢σ键外,连氮碳原子的sp3杂化轨道还用于与sp3杂化的氮原子形成碳氮σ键。
3 结语
大学生学习有机化学时觉得有机化学知识庞杂,觉得有机化合物性质不易掌握,对学习有机化学有畏难情绪,给有机化学教学带来一定的困扰。在有机化学的教学中,让学生学会从分析有机化合物结构入手来学习有机化合物的性质和规律则能较容易地掌握有机化学知识,从而提高教学效果。一方面,碳原子与碳原子之间可以形成碳链;另一方面,碳原子还可以与碳原子或其他杂原子之间形成官能团,而不同的碳链(如烷烃链、烯烃链)和不同的官能团中碳原子的杂化方式是不一样的。所以,想要正确地分析有机化合物结构和理解、掌握有机化合物性质,熟知各种有机化合物中碳原子的杂化方式与成键情况是必要的。本文以碳原子的核外电子排布、基态、激发态为基础,按照碳原子sp杂化、sp2杂化、sp3杂化的顺序归纳了碳原子的杂化方式,并列举了各种杂化状态的常见有机化合物中的成键情况。对帮助学生学习有机化学知识、掌握有机化合物性质和规律,克服学生对学习有机化学的畏难情绪,提高有机化学教学效果将起到积极的作用。

