反刍动物肠道菌群与宿主肠道黏膜免疫互作及其调控研究进展
杜 梅 梁泽毅 张剑搏 丁学智,2*
(1.中国农业科学院兰州畜牧与兽药研究所,甘肃省牦牛繁育重点实验室,兰州 730050;2.中国农业科学院兰州畜牧与兽药研究所,农业农村部兽用药物创制重点实验室,兰州 730050)
微生物组学和生物信息学等技术的快速发展,极大地促进了人们对动物肠道菌群结构、功能及其与宿主肠道免疫系统相互作用的认知。健康状态下肠道菌群与宿主共生,维持宿主正常生理功能,参与机体免疫系统调节,协同拮抗病原入侵等过程的发生。病原菌入侵或其他因素干扰造成肠道菌群稳态失衡,可能导致病原体感染、有害病原菌过度生长或炎性疾病发病率增加。目前,关于肠道菌群与宿主肠道免疫系统相互作用在其他哺乳动物上的研究较为深入[1-3]。然而,家畜品种、饲养环境、不同生长阶段营养需求模式及机体代谢差异等因素,极大地限制了反刍动物肠道菌群与宿主肠道免疫互作的系统研究。研究表明,新生反刍动物早期有益菌群的快速定植可促进回肠黏膜免疫系统功能的发育。随着年龄递增和饲料摄入量增加,肠道细菌总数与肠黏膜免疫基因的表达显著相关[4],表现为肠道菌群在宿主营养物质消化、机体免疫和健康等方面起着非常重要的导向作用,尤其是与宿主腹泻[5]、乳房炎[6]、副结核病[7]和炎症性肠病[8]等疾病发生关系密切。因此,明晰反刍动物肠道菌群组成与功能及其与宿主肠道免疫反应的调控机理,对预防疾病的发生及维护动物健康尤为重要。本文通过对相关文献的积累和回顾,综述了反刍动物肠道菌群组成与宿主肠道免疫系统互作关系,介绍了不同外源调控方式对反刍动物肠道菌群及其肠道免疫功能的调控机理,以期为后抗生素时代家畜健康养殖与应用技术开发提供科学依据。
1 反刍动物肠道菌群与肠道黏膜免疫系统
1.1 反刍动物肠道菌群组成与功能
反刍动物肠道菌群组成上以细菌为主,其中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)最丰富,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和软壁菌门(Tenericutes)等次之[9-10]。厚壁菌门在纤维素降解方面起着重要作用[11],而拟杆菌门可提高复合碳水化合物的利用率,并促进有机物的发酵[12]。瘤胃球菌科(Ruminococcaceae)是反刍动物结肠黏膜中的优势科,主要参与纤维饲料的发酵,其产生的短链脂肪酸(short chain fatty acids,SCFAs)与维持肠道健康密切相关[13]。奶牛肠道普氏菌属(Prevotella)、瘤胃球菌属(Ruminococcus)和消化链球菌属(Peptostreptococcus)在饲料消化中具有重要作用,而丁酸弧菌属(Butyrivibrio)、不动杆菌属(Acinetobacter)和密螺旋体属(Treponema)等与上皮细胞增殖和动物肠道健康有关[9]。此外,双歧杆菌属(Bifidobacterium)、粪杆菌属(Faecalibacterium)和乳酸杆菌属(Lactobacillus)等细菌广泛存在于新生反刍动物的空肠和回肠中,对提高机体对营养物质的消化与吸收、增强机体免疫及相关疾病预防等方面发挥作用[14]。反之,某些肠道细菌可诱导疾病的发生,如副结核分枝杆菌(Mycobacteriumaviumssp.paratuberculosis,MAP)可引起反刍动物感染副结核病[6]。牛[15]、山羊[16]和绵羊[17]结肠中发现弯曲杆菌属(Campylobacter)的富集与组织的局部炎症密切相关。另有研究表明,山羊体内梭状芽孢杆菌属(Clostridium)如产气荚膜梭菌(C.perfringens)、艰难梭菌(C.difficile)和破伤风梭菌(C.tetani)等是引发和诱导肠道疾病发生的主要病原体[18];回肠分节丝状菌属(Candidatusarthromitus)、密螺旋体属(Treponema)和梭菌属(Clostridium)3个菌属相对丰度的变化是诱发山羊回肠局部炎症的原因之一[19]。在患有腹泻的新生犊牛小肠中观察到大肠杆菌(Escherichiacoli)的相对丰度显著升高[20]。此外,牛粪便中存在厌氧真菌和产甲烷菌如甲烷短杆菌属(Methanobrevibacter)和甲烷球菌属(Methanosphaera),尽管它们在肠道中发挥的作用与瘤胃相似,但目前尚无直接证据表明其参与肠道免疫功能的调控[21-23]。
1.2 反刍动物肠道黏膜免疫系统
肠道免疫系统是机体免疫系统的重要组成部分,普遍存在于肠道黏膜并直接暴露于外部抗原环境中[24],且肠道黏膜免疫系统为90%以上的潜在病原体提供了第1道免疫防御屏障[25]。动物肠道黏膜免疫系统主要由物理屏障、化学屏障、模式识别受体和免疫细胞等组成,其中物理屏障包括黏膜层和上皮层,在阻止肠腔中致病菌入侵方面起着关键作用[26]。黏膜层是第1道物理屏障,含有分泌型网状糖化黏蛋白,可捕捉有害菌群使其无法到达黏膜层;化学屏障包括抗菌肽(antimicrobial peptides,AMPs)和分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA),可抑制黏膜层致病菌的生长;模式识别受体(pattern recognition receptor,PRRs)如Toll样受体(Toll-like receptors,TLRs)和Nod样受体(nucleotide-binding oligomerization domain-like receptors,NLRs)具有区分病原体和非致病性共生菌的能力,识别入侵的病原微生物并激活固有免疫系统,从而产生快速反应,引起炎症反应或修复应答,防止病原体入侵并减少对宿主的损伤[27];执行上述免疫功能的肠道免疫细胞如巨噬细胞、树突状细胞(dendritic cells,DCs)可选择性接触、摄取、运输外部抗原,将抗原吞噬并转运至抗原递呈细胞(antigen-presenting cells,APCs)从而被清除;其他肠道免疫细胞如T淋巴细胞、B淋巴细胞等,分化为不同的效应细胞,介导分泌不同的细胞因子,产生免疫应答、修复或重塑黏膜免疫屏障[28]。成熟的T细胞可递呈特异性抗原并被激活分化为不同的效应T细胞和记忆性T细胞,其中辅助性T细胞(helper T cells,Th)和调节性T细胞(regulatory T cells,Tregs)是T细胞通过产生细胞因子调节适应性免疫应答的主要效应细胞;同时,Th17、Tregs等对维持肠道黏膜免疫系统的完整性起关键作用[29]。
2 反刍动物肠道菌群与宿主肠道黏膜免疫系统的互作
反刍动物肠道菌群的组成对免疫系统发育和功能具有重要影响,并与宿主肠道黏膜免疫系统相互协助维护机体健康。一方面,宿主免疫反应有益于肠道菌群在肠道黏膜快速定植,并形成共生菌隔离屏障,防止致病菌入侵宿主,维持屏障完整性[14];另一方面,肠道菌群参与模式识别受体识别共生菌和致病菌,抑制并清除病原菌,或通过调节树突状细胞、巨噬细胞、T淋巴细胞和B淋巴细胞等免疫细胞清除病原菌的方式影响宿主免疫反应[30]。因此,深入研究并揭示肠道菌群与宿主互作机制,对反刍动物肠道疾病防控具有重要意义。
2.1 反刍动物肠道菌群维持宿主肠道黏膜屏障完整性
反刍动物肠道菌群通过多种机制(如竞争抑制、分泌有机酸和抗菌肽等物质)抑制致病菌增殖,并通过调控紧密连接蛋白的表达和上皮通透性影响肠道屏障功能,从而调节肠道微生态平衡并影响肠道健康。研究表明,反刍动物肠道共生菌如脆弱拟杆菌(Bacteroidesfragilis)在免疫系统发育中起重要作用,脆弱芽孢杆菌荚膜产生的免疫球蛋白A(IgA)有助于将共生菌定植于上皮表面,提供定植优势[14]。若肠道内有益共生菌增加,可在黏液层中产生β-防御素等抗菌肽,对阻止病原菌的侵袭和增殖至关重要[31]。反刍动物肠道如牦牛肠道中的紫单胞菌科(Porphyromonadaceae)、拟杆菌科(Bacteroidaceae)、普雷沃氏菌科(Paraprevotellaceae)等菌群可通过代谢肠道内的碳水化合物产生SCFAs[32],小尾寒羊后肠也聚集了大量产生SCFAs的菌群[33]。上述肠道菌群代谢产生SCFAs,为免疫细胞提供能量,促进黏蛋白的分泌,阻止致病菌在肠道黏膜上的定植[34];其中丙酸和丁酸可增加抗菌肽分泌,维护其黏膜屏障功能[35]。断奶前犊牛小肠中黏膜相关细菌和内容物中细菌总数增加时,其紧密连接蛋白基因如闭合蛋白(CLDN)-3、CLDN-4、闭锁蛋白(OCLN)、闭合小环蛋白(ZO)-1、ZO-2和ZO-3表达上调,该类型基因编码调节肠道通透性的蛋白质,降低肠道通透性,增强肠道屏障功能[8]。Wang等[36]报道,粪杆菌属的细菌通过分泌丁酸盐,使紧密连接蛋白基因如ZO-1、OCLN等的表达上调,进而增强肠道屏障功能。反刍动物采食高谷物饲粮后,大量未消化的营养物质到达后肠并刺激后肠发酵,改变了肠腔和黏膜中菌群的相对丰度,使得盲肠和结肠中菌群发酵增加导致其内容物中pH降低、内毒素脂多糖浓度增加,上皮紧密连接遭到破坏,在生产中家畜肠道亚急性酸中毒的风险增加,诱发局部炎症的产生[19]。
2.2 反刍动物肠道菌群与宿主TLRs的互作
TLRs是固有免疫中重要的模式识别受体,识别共生菌并维持肠道内环境稳态;致病菌入侵肠道激活TLRs信号通路诱发炎症反应[37]。TLR1、TLR2、TLR4~6和TLR10可识别细菌表面相关的分子模式,TLR3、TLR7~9可识别病毒和细菌的核酸[38]。由于细菌多样性在整个肠道中分布各异,其数量可能代表细菌配体的变化,不同的细菌配体在调节TLRs表达和固有黏膜免疫反应中起重要作用[39]。当致病菌入侵肠道时,一旦突破了肠道黏膜屏障,就会被TLRs识别,TLRs与致病菌或病毒激动剂结合后,通过髓样分化因子88(myeloid differentiation factor 88,MyD88)途径诱导信号传导,引起促炎细胞因子和趋化因子以及宿主防御肽的释放,进而激活免疫细胞反应,发挥直接或间接杀菌作用[40]。研究报道,TLR2突变会增加奶牛对MAP的易感性,且在MAP感染的绵羊小肠中发现TLR6的表达上调,表明TLR2和TLR6在宿主对MAP的免疫应答中起重要作用,直接影响机体肠道健康[41]。牛肠上皮细胞(intestinal epithelial cell,IEC)在营养吸收和免疫屏障调节中具有重要作用,其IEC原代细胞培养是研究益生菌对牛宿主影响的理想模型[42]。Chiba等[43]在验证牛IEC作为研究抗病毒反应的模型系统的研究中,证实了TLR3的表达。此外,牛IEC对TLR3激动剂聚肌胞苷酸[poly(I:C),PIC]的刺激有较强的反应,并涉及到促炎细胞因子和Ⅰ型干扰素的显著上调,上述反应与牛和其他宿主的各类肠道病毒感染一致。Takanashi等[44]在评估TLR4在牛IEC中的表达对热稳定性肠毒性大肠杆菌(enterotoxigenicE.coli,ETEC)的响应的过程中,观察到TLR4对病原体相关分子模式(pathogen-associated molecular patterns,PAMP)的识别表现为丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)和核转录因子-κB(nuclear factor-kappa B,NF-κB)途径的激活和细胞因子的产生。体外试验表明,移除3周龄犊牛回肠中的共生菌群后,TLR5和TLR6的表达显著上调,表明共生菌群可能在调节宿主相关TLRs表达方面发挥作用[45]。Jiao等[46]对山羊的研究同样表明结肠中普氏菌属、瘤胃球菌属与TLR2信号通路相关;颤螺菌属(Oscillospira)相对丰度与TLR2和TLR4基因表达之间的正相关关系表明其可能参与宿主免疫成熟过程,但具体功能尚不清晰。因此,TLRs通过识别PAMP激活信号通路,诱导促炎细胞因子表达,且不同的细菌配体在调节TLRs表达和固有黏膜免疫反应中起重要作用。
2.3 反刍动物肠道菌群对宿主肠道免疫细胞的影响
肠道黏膜免疫系统中具体执行免疫功能的是各类免疫细胞,如适应性免疫中的T淋巴细胞、B淋巴细胞以及其他固有免疫细胞(树突状细胞、自然杀伤细胞等),免疫细胞的稳态是维持炎症反应与免疫耐受之间平衡的重要因素。羔羊结肠黏膜中肿瘤坏死因子(tumor necrosis factor,TNF)和干扰素-γ(interferon-γ,IFN-γ)基因表达分别与副拟杆菌属(Parabacteroides)和双歧杆菌属的相对丰度呈负相关,与布劳特氏菌属(Blautia)和未分类的瘤胃球菌科(unclassified Ruminococcaceae)的相对丰度呈正相关,证明细胞因子基因表达的变化与结肠黏膜中特定细菌丰度的变化有关[47]。新生犊牛去除回肠段的内容物可降低绒毛高度和黏膜下淋巴滤泡的大小,且分布于上皮内和固有层的CD4+、CD8+、NK细胞、巨噬细胞和树突状细胞等数量显著减少,表明肠道菌群对黏膜细胞免疫功能的发挥具有调控作用[45]。粪杆菌可通过分泌代谢物刺激上皮细胞产生白细胞介素(IL)-10,抑制NF-κB的激活和促炎细胞因子IL-8的产生,降低犊牛腹泻率及减少炎症性肠病发病率(如克罗恩病)[48-49]。Malmuthuge等[50]研究发现,乳酸杆菌为犊牛回肠优势菌时,参与机体炎症反应的趋化因子C-X-C趋化因子配体(C-X-C chemokine ligand,CXCL)9、CXCL10和CXCL11的表达上调,表明乳酸杆菌的定植对新生犊牛的黏膜免疫系统具有启动效应,抑制病原菌诱导炎症反应的发生;当拟杆菌属为优势菌时,犊牛回肠中磷脂酶Cε1(phospholipase C epsilon 1,PLCE1)、趋化因子配体22(CCL22)和表皮生长因子受体(epidermal growth factor receptor,EGFR)的表达上调,从而刺激肠道T细胞分化,增强T细胞依赖型免疫反应。此外,反刍动物肠道中其他共生菌如分节丝状菌(segmented filamentous bacterium)、脆弱拟杆菌、梭菌属(Clostridium)等均可参与免疫系统的调节,其作用机制如图1所示。肠腔中脆弱拟杆菌、梭菌属可参与碳水化合物(如纤维素)的发酵,产生SCFAs直接或间接地促进转化生长因子-β的产生,进而促进Tregs细胞分化,产生IgA和IL-10缓解炎症反应;同时,微生物产生的其他次级代谢产物还可上调分泌IL-22的3型先天性淋巴细胞,诱导抗菌肽的产生,发挥免疫功能[51]。
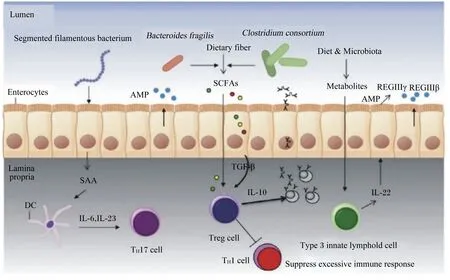
Segmented filamentous bacterium:分节丝状菌;Clostridium consortium:梭状芽胞杆菌;Bacteroides fragilis:脆弱拟杆菌;SAA:血清样蛋白A serum like protein A;DC:树突状细胞 dendritic cell;IL-6:白细胞介素-6 interleukin-6;IL-23:白细胞介素-23 interleukin-23;Th17 cell:辅助性T细胞17 helper T cells 17;Dietary fiber:膳食纤维;SCFAs:短链脂肪酸 short chain fatty acid;TGF-β:转化生长因子-β transforming growth factor-β;Treg cell:调节性T细胞 regulatory T cell;Diet:饲粮;Microbiota:菌群;Metabolites:代谢物;Type 3 innate lymphold cell:3型先天性淋巴细胞;IL-22:白细胞介素-22 interleukin-22;AMP:抗菌肽 antimicrobial peptides;REGⅢγ:再生源蛋白Ⅲγ regenerating protein Ⅲγ;REGⅢβ:再生源蛋白Ⅲβ regenerating protein Ⅲβ;Lumen:肠腔;Enterocytes:肠上皮细胞;Lamina propria:固有层;Suppress excessive immune response:抑制过度免疫反应。
研究报道,宿主肠道感染鼠伤寒沙门氏菌(Salmonellatyphimurium)后,激活NF-κB信号通路,诱导细胞因子IL-1、IL-6、IL-8、TNF-2、TNF-α、IFN-γ和粒细胞-巨噬细胞集落刺激因子(GM-CSF)的合成与释放,产生炎症反应,机体则表现出腹痛、腹泻等症状,如犊牛口服108和109菌落形成单位鼠伤寒沙门氏菌特定菌株,其表现出上述病原菌感染症状,宿主随即启动多种免疫防御机制,包括嗜中性粒细胞募集和激活、NF-κB通路激活及细胞因子的释放和细胞凋亡等[52]。沙门氏菌(Salmonella)感染的犊牛,其体内白细胞、中性粒细胞、淋巴细胞增加,中性粒细胞/淋巴细胞比率增加[53]。
综上所述,肠道菌群和肠道免疫系统间通过互相作用维持宿主健康,当肠道菌群结构紊乱(致病菌大量增殖)时,肠道固有免疫被激活并释放各类炎症细胞因子,进而激活适应性免疫来清除有害菌或病原菌,维护宿主肠道健康;与此同时,肠道免疫系统对肠道菌群一直处于防御状态,当肠道菌群中共生菌和有害菌之间的动态平衡被打破,肠道免疫系统被激活,从而发挥清除病原菌或有害菌的免疫反应,重新建立肠道菌群的动态平衡,维护宿主肠道健康。
3 添加益生菌和益生元对反刍动物肠道免疫系统的调控
目前,肠道菌群为肠道病理学及其他领域新的治疗提供了潜在的作用靶点。益生菌和益生元被证明具有无毒副作用、无残留和不产生抗药性等优点,在提升动物的生长性能、促进肠道有益菌的定植、改善肠道菌群结构、调节机体免疫系统及维护机体健康等方面具有重要作用,是当前国内外研究的重点且被广泛用作抗生素替代品[54]。
益生菌作为一种非特异性免疫调节因子,使肠黏膜相关淋巴组织活化,刺激肠道免疫器官发育,动物抗体水平和巨噬细胞活性被提高,并且诱导T淋巴细胞、B淋巴细胞和巨噬细胞产生细胞因子,通过淋巴细胞再循环使全身免疫系统活化[55]。除双歧杆菌、乳酸菌和酵母菌(Saccharomycesyeast)等,芽孢杆菌(Bacillus)、肠球菌(Enterococcus)和粪杆菌等对反刍动物肠道黏膜免疫系统也具有重要调控作用[56]。灭活的乳酸菌能刺激家畜树突状细胞增殖和IFN-γ的产生,使Tregs分泌升高,还能显著提高肠黏膜IgA的含量[57]。此外,乳酸菌可增强外周血T淋巴细胞和B淋巴细胞的活性,使特异性免疫和非特异性免疫增强,提高动物的抗病能力和免疫能力[58]。益生菌(如乳酸菌或芽孢杆菌)通常作用于幼龄反刍动物小肠段,降低病原体对肠黏膜的黏附性,被认为是稳定肠道菌群平衡并抑制病原菌定植有效手段[59]。研究表明,用乳酸杆菌和双歧杆菌复合制剂饲喂3~5日龄犊牛,其血清免疫球蛋白G(IgG)和IgA含量显著高于空白对照组,淋巴细胞的转化率显著升高,犊牛的特异性和非特异性免疫水平显著增强[60]。同时,添加乳酸杆菌可降低犊牛腹泻率并改变粪便中乳酸杆菌与大肠杆菌的比值[61]。植物乳杆菌RG14可促进断奶羔羊空肠黏膜分泌IL-6,但IL-1β、IL-10和TNF的含量降低;同时,β-防御素等抗菌肽进入肠腔,促进紧密连接蛋白-1(TJP-1)、CLDN-1和CLDN-4的表达,增强肠黏膜屏障功能[62]。因此,植物乳杆菌是提高断奶羔羊免疫功能和促进胃肠道健康的潜在饲料添加剂。为反刍动物补充枯草芽孢杆菌(Bacillussubtilis)可促进紧密结合蛋白的表达,提高肠道屏障的完整性,并降低IL-8的表达量,减缓免疫应激[63]。此外,外源添加枯草芽孢杆菌还可提高湖羊免疫球蛋白、IFN-γ、IL-2和IL-6含量,提高免疫力[64]。Ma等[5]对患有乳房炎奶牛补充干酪乳杆菌(Lactobacilluscasei)等益生菌,发现益生菌在一定程度上改变了肠道菌群功能,抑制致病菌感染从而缓解奶牛乳房炎症状,表明肠道菌群失调可能是引发乳房炎的原因之一,恢复肠道菌群功能的益生菌(如干酪乳杆菌)是潜在的治疗策略。综上可知,乳酸菌作为益生菌可拮抗病原菌群,调节肠道微生态平衡,增强免疫屏障功能。此外,乳酸菌还具有活化免疫防御系统、激活巨噬细胞的吞噬能力、增强细胞免疫和体液免疫等功能[65]。
益生元,包括非淀粉多糖、膳食纤维、菊粉、低聚果糖等,是一类不易被消化的无生物活性的低聚糖类,通过选择性刺激1种或几种细菌的生长与活性对宿主产生有益的影响,从而改善机体健康。甘露寡糖(mannan oligosaccharides,MOS)能够被肠道有益菌发酵,同时产生大量的酸性物质,降低肠道的pH,抑制肠道致病菌生长繁殖。研究发现,饲喂MOS可提高犊牛肠道中乳酸杆菌和双歧杆菌的数量,降低大肠杆菌、沙门氏菌等致病菌的数量;MOS与病原菌在肠壁上易结合的特异性糖分子的受体结构相似,故能阻碍病原菌与肠黏膜上皮细胞特异性糖分子结合,使外源致病菌难以在肠道黏附和定植,并最终随粪便排出体外[66]。此外,MOS增加小肠原始淋巴细胞和T淋巴细胞活性,同时还能促进淋巴细胞释放IFN-γ,释放的IFN-γ会激活巨噬细胞并促使巨噬细胞移向并吞噬病原菌[67]。菊粉是一类天然果聚糖,进入肠道后可以改变肠道菌群的组成,能够增加肠道中双歧杆菌和乳酸杆菌的数量并提高其活性等,促进有益菌群的增殖,抑制腐败菌的增殖活动,从而保护肠道健康,这种作用被称为益生效应[68-69]。给新生小牛犊补充菊粉,2周后结肠中乳酸菌和双歧杆菌的相对丰富度显著增加,与肠道免疫屏障紧密结合,激活宿主肠道黏膜免疫系统,维持肠道健康[70-71]。综上所述,益生元主要通过改善肠道有益菌的调节机制发挥免疫作用,维持反刍动物机体健康。
尽管益生菌和益生元作为抗生素替代物在提高机体肠道免疫方面具有重要作用,但实际生产中通过调控家畜肠道内环境以改善机体免疫及提高生产性能的人工干预措施也备受关注。目前报道较多的外源调控措施主要有:粪菌移植、初乳饲喂、饲粮配方以及饲粮中外源添加中草药类(大黄)、植物提取物(单宁、黄芪多糖)等(表1)。粪菌移植是将供体的粪便菌群移植给目标受体,用于代谢性疾病、肠炎、自身免疫性疾病等的治疗[72]。初乳中含有免疫球蛋白、生长激素、生长因子、细胞因子、酶等丰富的活性成分,饲喂初乳除了提供幼畜被动免疫外,还可促进幼畜小肠微生物的快速定植,对肠道健康起重要作用[73]。合理的饲粮配方以及外源饲料添加剂除了满足各阶段动物生长的需要,还可改善肠道菌群结构,调节营养素在宿主体内的代谢。

表1 反刍动物肠道菌群及宿主肠道免疫的调控
4 小 结
反刍动物肠道健康是保证其发挥最佳生产性能的基础。在当前的集约化生产体系中,由于养殖环境、饲料来源及生产目标等综合因素的影响,反刍动物肠道患腹泻和炎症性肠病的现象较为普遍。在各种肠道疾病发生过程中宿主与肠道菌群之间存在双向关系,即宿主肠道免疫系统调控肠道菌群结构,反之微生物菌群也会影响宿主肠道免疫。利用最新的生物技术手段(多组学、高通量测序及纯培养技术),可以区分特定肠道菌群的位置,确定菌群多样性及其功能,并探索菌群与宿主肠道免疫之间的关系。因此,明晰疾病发生过程中宿主与肠道菌群之间的相互作用机制,是确定精准时间调控窗口、促进肠道健康发育和提高饲料转化效率的前提。目前,已有大多研究基于模式动物小鼠、猪、鸡等报道了肠道菌群与免疫之间的关系、次级代谢物(如胆汁酸等)和外援添加剂对肠道菌群和肠道免疫的调控以及脑-肝-肠轴对肠道菌群和宿主肠道免疫的调控机制,但在反刍动物中却鲜有报道。随着“饲料全面禁止添加抗生素”计划的实施,绿色、无残留添加剂的应用将成为趋势。因此,今后的研究可基于多组学平台和生物信息学等技术,聚焦于肠道疾病发生的潜在标识物(肠道中关键菌群及其酶或代谢物)筛选,绿色添加剂、次级代谢物和脑-肝-肠轴等对肠道菌群和宿主肠道免疫的调控机制方面的研究,进一步拓展对机体营养代谢及肠道菌群与肠道免疫间的相互作用的认知,以期为推动反刍家畜无抗饲料的应用及绿色健康养殖提供科学依据,为某些疾病的微生物诊断和治疗方法建立奠定理论基础。

