哺乳动物雷帕霉素靶蛋白信号通路调控猪肠上皮细胞精氨酸转运的机制
肖 昊 赵 一 王 丽 谭碧娥
(1.广东省农业科学院动物科学研究所,农业部华南动物营养与饲料重点实验室,畜禽育种国家重点实验室,岭南现代农业科学与技术广东省实验室茂名分中心,广东省畜禽育种与营养研究重点实验室,广州 510640;2.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,湖南省动物营养生理与代谢过程湖南省重点实验室,长沙 410125)
肠道是仔猪生长发育的核心和快速生长的基础,氨基酸作为肠道优先利用的重要营养物质,对肠道生长发育发挥起着重要的作用,其中精氨酸(Arg)在调节动物营养代谢和生长发育等多种生理功能中发挥着重要作用[1]。Arg能刺激蛋白质合成、细胞增殖、DNA合成、细胞保护作用和迁移等细胞合成代谢途径[2-5]。本课题组前期研究表明应激因素通过下调哺乳动物雷帕霉素靶蛋白(mTOR)信号通路相关蛋白的水平及活性,破坏断奶仔猪肠道形态和功能,饲粮中加入适量的Arg可通过激活mTOR信号通路缓解仔猪肠道损伤,改善肠上皮细胞增殖和胞内蛋白质合成[6];Arg增加了脂多糖(LPS)处理下猪肠上皮细胞中涉及mTOR信号通路的蛋白质的合成[5]。溶酶体氨基酸转运体溶质载体家族蛋白38成员A9(SLC38A9)和CASTOR1是mTOR复合物1(mTORC1)信号通路的Arg传感器[7]。研究发现,通过雷帕霉素(Rap)抑制mTOR后Arg在细胞内的浓度较细胞外升高了42.2%[8]。然而,目前对于mTORC1失调所引发的信号通路及对Arg摄取与代谢了解甚少。
y+(高亲和力、非Na+依赖转运体)和Na+依赖转运体(如b0,+、B0,+和y+L)系统是Arg转运的2个主要的转运系统。肠上皮细胞中70%的L-Arg都是通过y+系统运输。本课题组前期研究表明,L-硝基精氨酸甲酯可通过抑制一氧化氮(NO)通路增加Arg摄取以及阳离子氨基酸转运载体2(CAT2)和L型氨基酸转运载体1(LAT1)的蛋白表达[9]。然而,Arg的降解和转运对调节Arg通量的作用尚未明晰。本研究利用Rap抑制mTOR信号通路,基于mTOR信号通路探讨其在猪肠上皮细胞Arg摄取中的作用机制。
1 材料与方法
1.1 试验材料
猪肠上皮细胞(IPEC-J2细胞)以及Arg缺失的DMEM-H培养基配制、细胞培养、实时荧光定量PCR(qRT-PCR)、Western blotting等试验所需试剂与耗材的来源均同前期相关研究[10]。
1.2 试验设计及方法
1.2.1 细胞培养
用含不同浓度Arg(100、350 μmol/L)和Rap(0、10 nmol/L)的DMEM-H培养基培养IPEC-J2细胞,细胞培养方法参照前期相关研究[10],培养3 d后,收集细胞用于细胞周期、RNA提取、蛋白检测。
1.2.2 细胞增殖检测
1.2.2.1 四甲基偶氮唑蓝(MTT)法检测吸光度(OD)值
将IPEC-J2细胞按照1×104个/孔接种于96孔培养板中,以含不同浓度Rap(0、5、10、25、50、100 nmol/L)的DMEM-H培养基培养3 d后,参照MTT试剂盒说明书检测OD值。
1.2.2.2 细胞计数
将IPEC-J2细胞按照1×105个/孔接种于24孔培养板中,以含不同浓度Rap(0、5、10、25、50、100 nmol/L)的DMEM-H培养基培养3 d后,磷酸盐缓冲液(PBS)洗3次,使用胰蛋白酶消化细胞,终止消化后1 000 r/min离心,去除上清液,重悬细胞后使用血细胞计数器计量细胞数量。
1.2.2.3 5-乙炔基-2’脱氧尿嘧啶核苷(EdU)检测
EdU检测试剂盒购于瑞博生物技术有限公司,检测步骤按照说明书进行,简要的过程主要包括EdU标记、细胞固定化、Apollo染色、DNA染色及图像摄取及分析。除了试剂盒中具备的,所用甘氨酸、多聚甲醛等试剂均为国产分析纯。采用荧光显微镜观察,在不同波长下获取图像,得到的红色细胞为增殖细胞,蓝色细胞为所有细胞,计算细胞增殖率。
细胞增殖率(%)=(增殖细胞数目/所有细胞数目)×100。
1.2.2.4 细胞周期检测
采用凯基细胞周期检测试剂盒(KGA521)检测Arg或Rap处理后细胞周期变化,检测步骤参照试剂盒说明书进行。使用胰蛋白酶收集细胞后,轻轻吹打,混匀,使细胞分散成单个细胞。细胞用75%乙醇4 ℃固定过夜后,试验当天4 000 r/min离心2 min,去除上清液,每1×106个细胞加入0.5 mL碘化丙啶染液(500 μL染色缓冲液、25 μL 20×碘化丙啶染色液、10 μL 50×RNaseA)。重悬细胞,37 ℃避光温浴30 min,4 ℃或冰浴避光保存,流式细胞仪分析细胞周期。
1.2.3 RT-qPCR检测
RNA提取、测定,cDNA的获得以及RT-qPCR的操作方法等参照前期相关研究[11]。以β-肌动蛋白(β-actin)作为内参,采用2-△△Ct法计算目的基因mRNA的相对表达量。本试验中所有引物均由上海生工生物有限公司合成,引物序列见表1。

表1 Arg转运载体的引物序列
1.2.4 Western blotting检测
按照Tan等[5]的方法进行蛋白表达检测。包括蛋白激酶Cα(PKCα)、阳离子氨基酸转运载体1(CAT1)、CAT2和β-actin在内的所有一抗购置于Santa Cruz Biotechnology公司。精氨酸酶Ⅰ、精氨酸酶Ⅱ、诱导型一氧化氮合酶(iNOS)、细胞外信号调节激酶(Erk)、磷酸化Erk(p-Erk)、cFos和磷酸化cFos(p-cFos)购置于美国Cell Signaling Technology公司。所有的目的蛋白的表达量均与β-actin进行对比。
1.2.5 细胞Arg摄取检测
处理细胞后,移去培养基,转移缓冲液冲洗细胞3次(37 ℃)。随后每孔加1 mL含[3H]Arg的转移缓冲液(2 μCi/mL,5 μmol/L),摇床轻轻摇动5 min。弃去培养液,预冷的转移缓冲液快速洗涤细胞3次。吹干细胞,每孔加500 μL 1 mol/L氢氧化钠(NaOH),37 ℃溶解细胞,然后加入250 μL乙酸,混匀。测定蛋白质的含量用50 μL细胞溶液。另取500 μL细胞溶液于18 mL闪烁计数瓶中,加15 mL闪烁液。25 ℃静置过夜后测定[3H]Arg的每分钟衰变数(DPM)。Arg的摄取率结果以nmol/(min·mg prot)表示。
1.3 数据分析
试验数据用Excel 2019初步整理后,用SPSS 19.0软件对样本进行单因素方差分析和Turkey检验,使用Graph Prime 7生成数据图。数据均是以100 μmol/L Arg组(对照组)作为参照的相对表达量表示。P<0.05表示差异显著,P<0.01表示差异极显著。结果用平均值±标准误(mean±SE)表示。
2 结果与分析
2.1 Rap抑制猪肠上皮细胞增殖
如图1-A可见,随着培养基中Rap的浓度从0 nmol/L升至100 nmol/L,OD值也随之逐渐下降,并从10 nmol/L开始出现极显著降低(P<0.01)。细胞计数结果显示,细胞数量随着Rap浓度的增加而降低,其中在10 nmol/L时细胞数量减少1/2(图1-B)。因此,选取10 nmol/L作为随后试验中抑制mTOR信号通路的Rap工作浓度。培养基中Arg浓度为100 μmol/L时,添加10 nmol/L Rap后mTOR(P<0.01)和磷酸化mTOR(p-mTOR)(P<0.01)的蛋白表达量及其下游的真核翻译起始因子4E结合蛋白1(4EBP1)(P>0.05)和磷酸化4EBP1(p-4EBP1)(P<0.01)的蛋白表达量均有不同程度的降低,表明10 nmol/L Rap抑制了mTOR信号通路(图2)。在添加10 nmol/L Rap条件下,将培养基中Arg浓度由100 μmol/L提高到350 μmol/L,极显著提高了4EBP1、p-4EBP1和磷酸化p70核糖体S6激酶(p-P70S6K)的蛋白表达量(P<0.01)。EdU检测结果(图3)表明,培养基中Arg浓度为100 μmol/L时,添加Rap极显著降低了细胞的增殖率(P<0.01),而在Arg浓度为350 μmol/L的培养基中添加Rap对细胞的增殖率没有产生显著影响(P>0.05)。

数据柱标注“**”表示与0 nmol/L相比差异极显著(P<0.01)。Value columns with “**” mean extremely significant difference compared with 0 nmol/L (P<0.01).

Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin;4EBP1:真核翻译起始因子4E结合蛋白1 eukaryotic translation initiation factor 4E-binding protein 1;p-4EBP1:磷酸化真核翻译起始因子4E结合蛋白1 phosphorylated eukaryotic translation initiation factor 4E-binding protein 1;p-P70S6K:磷酸化p70核糖体S6激酶 phosphorylated p70 ribosomal protein S6 kinase;mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;p-mTOR:磷酸化哺乳动物雷帕霉素靶蛋白 phosphorylated mammalian target of rapamycin;β-actin:β-肌动蛋白。

A:荧光显微镜观察图 fluorescence microscope observation map;B:增殖率 proliferation rate。Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin;DAPI:4′,6-二脒基-2-苯基吲哚 4′,6-diamidino-2-phenylindole;EdU:5-乙炔基-2′脱氧尿嘧啶核苷 5-ethynyl-2′-deoxyuridine;Merge:融合。
2.2 Rap抑制细胞周期运转
细胞周期分析结果显示,当培养基中Arg浓度为100或350 μmol/L时,添加Rap后细胞大部分停留在G1期,相对于100 μmol/L Arg组,100 μmol/L Arg+Rap组和350 μmol/L Arg+Rap组的G2期和S期细胞数量均极显著降低(P<0.01),凋亡细胞数量也随之极显著降低(P<0.01)(图4)。结合2.1中结果,表明Rap抑制了mTOR信号通路的活性,从而抑制猪肠上皮细胞增殖,提高Arg浓度能显著改善Rap对细胞增殖的抑制作用。

A:流式细胞直方图 flow cell histogram;B:细胞周期数据统计结果 cell cycle data statistical results。 Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin;Channels:通道;Apoptosis:细胞凋亡;Dip:二倍体 diploid;G1:G1期 G1-phase;G2:G2期 G2-phase;S:S期 S-phase。
2.3 Rap通过激活磷脂酰肌醇-3-羟激酶(PI3K)-蛋白激酶(Akt)-B细胞淋巴瘤2(Bcl2)信号通路抑制细胞凋亡
图4显示,Rap抑制IPEC-J2细胞凋亡。通过Western blotting检测结果发现,在Arg浓度为100或350 μmol/L的培养基中添加Rap均极显著促进了B细胞淋巴瘤-xL(Bcl-xL)的蛋白表达量,极显著降低了细胞色素C(Cyt-C)的蛋白表达量(P<0.01)。而仅在Arg浓度为100 μmol/L的培养基中添加Rap能够极显著降低半胱氨酸蛋白酶3(Caspase 3)和活化的半胱氨酸天冬氨酸蛋白酶3(Cleaved Caspase 3)(17 ku)的蛋白表达量(P<0.01);将培养基中Arg浓度由100 μmol/L提高到350 μmol/L后,添加Rap极显著降低了Bcl2相关x蛋白(Bax)的蛋白表达量(P<0.01),极显著提高了Caspase 3和Cleaved Caspase 3(19 ku)的蛋白表达量(P<0.01)(图5)。

Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin;Cyt-C:细胞色素C cytochrome C;Bax:Bcl2相关x蛋白 Bcl2 associated X protein;Bcl-xL:B细胞淋巴瘤-xL B-cell lymphoma-extra large;Caspase 3:半胱氨酸蛋白酶3 cysteine aspartic acid specific protease 3;Cleaved Caspase 3:活化的半胱氨酸天冬氨酸蛋白酶3 cleaved cysteine aspartic acid specific protease 3。
图6显示,培养基中Arg浓度为100 μmol/L时,添加Rap后p-PI3K和p-Akt的蛋白表达量均极显著降低(P<0.01),而Akt的蛋白表达量极显著升高(P<0.01)。将培养基中Arg浓度由100 μmol/L提高到350 μmol/L后,添加Rap极显著提高了p-PI3K、Akt和p-Akt的蛋白表达量(P<0.01)。因此,Rap抑制猪肠上皮细胞凋亡可能是通过激活PI3K-Akt-Bcl2信号通路实现的。

Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin;Akt:蛋白激酶 protein kinase;p-Akt:磷酸化蛋白激酶 phosphorylated protein kinase;PI3K:磷脂酰肌醇-3-羟激酶 phosphatidylinositol-3-hydroxykinase;p-PI3K:磷酸化磷脂酰肌醇-3-羟激酶 phosphorylated phosphatidylinositol-3-hydroxykinase;β-actin:β-肌动蛋白。
2.4 PKCα-Erk/cFos-CAT2信号通路可能是Rap调控Arg转运载体促进Arg摄取的关键通路
为进一步探讨mTOR信号通路在细胞Arg摄取过程中的作用,利用同位素示踪法检测了Rap处理下不同培养基处理的细胞中Arg的摄取率。图7显示,提高培养基中Arg浓度,IPEC-J2细胞的Arg摄取率极显著上升(P<0.01)。而在不同浓度Arg培养基中添加Rap后,IPEC-J2细胞的Arg摄取率均极显著上升(P<0.01),表明Arg浓度对其没有影响。为进一步探讨Rap通过何种机制促进Arg的转运,本试验检测了Arg转运载体的mRNA和蛋白表达量。图8显示,在Arg浓度为100或350 μmol/L的培养基中添加Rap极显著提高了CAT2的mRNA表达量(P<0.01),且极显著降低了LAT1的mRNA表达量(P<0.01),而在Arg浓度为350 μmol/L的培养基中添加Rap则极显著降低了CAT1的mRNA表达量(P<0.05)。将培养基中Arg浓度由100 μmol/L提高到350 μmol/L,CAT1、CAT2和LAT1的mRNA表达量没有显著变化(P>0.05)。图9显示,在Arg浓度为100或350 μmol/L的培养基中添加Rap均极显著降低了CAT1和质子偶联氨基酸转运蛋白1(PAT1)的蛋白表达量(P<0.01),极显著增加了钠离子依赖的中性氨基酸转运蛋白2(SNAT2)的蛋白表达量(P<0.01)。而在100 μmol/L Arg培养基中添加Rap和350 μmol/L Arg培养下则极显著提高了CAT2的蛋白表达量(P<0.01)。

Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin。

Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin;CAT1:阳离子氨基酸转运载体1 cationic amino acid transporter 1;CAT2:阳离子氨基酸转运载体2 cationic amino acid transporter 2; LAT1:L型氨基酸转运载体1 L-type amino acid transporter 1 。

Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin;CAT1:阳离子氨基酸转运载体1 cationic amino acid transporter 1;CAT2:阳离子氨基酸转运载体2 cationic amino acid transporter 2;PAT1:质子偶联的氨基酸转运蛋白1 proton-coupled amino acid transporter 1;SNAT2: 钠离子依赖的中性氨基酸转运蛋白 2 sodium-coupled neutral amino acid transporter 2;β-actin:β-肌动蛋白。
上述结果表明,CAT2无论是在蛋白水平还是在mRNA水平的表达量,在100 μmol/L Arg +Rap处理下都是上调的,因此猜测CAT2是Rap调控Arg摄取率上升的关键转运载体。72 h培养后结果(图10)表明,100 μmol/L+Rap处理极显著提高了PKCα、p-Erk、p-cFos、cFos和CAT2的蛋白表达量(P<0.01),极显著降低了Rictor的蛋白表达量(P<0.01);而350 μmol/L Arg+Rap处理则极显著降低了PKCα和Rictor的蛋白表达量(P<0.01),极显著提高了p-Erk的蛋白表达量(P<0.01)。结果提示,Rap抑制mTOR信号通路后可能通过PKCα-Erk/cFos-CAT2信号通路调控Arg转运载体促进Arg的摄取。
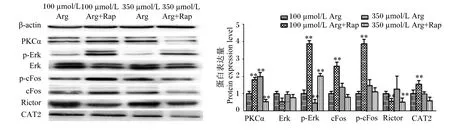
Arg:精氨酸 arginine;Rap:雷帕霉素 rapamycin;PKCα:蛋白激酶Cα protein kinase Cα;Erk:细胞外信号调节激酶 extracellular signal-regulated kinase;p-Erk:磷酸化细胞外信号调节激酶 phosphorylated extracellular signal-regulated kinase;CAT2:阳离子氨基酸转运载体2 cationic amino acid transporter 2。
3 讨 论
氨基酸在动物肠道应激损伤的修复中起着关键作用。本课题组在研究呕吐毒素对肠道黏膜的应激损伤中发现,呕吐毒素能显著降低空肠和回肠黏膜中的p-Akt和p-mTOR的蛋白表达量,同时降低空肠黏膜中p-4EBP1的蛋白表达量[6]。饲粮中添加氨基酸如谷氨酸能显著降低呕吐毒素对Akt/mTOR/4EBP1信号通路的抑制作用[11]。mTOR是细胞生长和增殖的一个关键的调节因子,通过磷酸化作用调控mRNA的翻译来调节很多生理过程,包括蛋白质合成、核糖体生物合成及自噬作用等[12-13]。本课题组前期研究表明,Arg浓度影响猪肠上皮细胞营养核心通路mTOR信号通路及蛋白质合成的信号通路,适宜提高Arg浓度通过激活mTOR信号通路降低蛋白质降解,有助于提高细胞增殖[14]。本研究发现,mTOR抑制剂Rap能极显著降低猪上皮细胞增殖,提高Arg浓度可通过提高细胞增殖率缓解mTOR抑制对细胞的损伤。本课题组前期研究还表明,mTOR信号通路的激活是Arg缓解细胞应激损伤的重要机制[4],其中Arg分解代谢产物如多胺和NO可能参与对DNA的修复作用[15],促进细胞周期的正常进程[16]。此外,Arg也能有效缓解LPS对猪肠上皮细胞周期的抑制作用[5]。本试验结果显示,添加Rap抑制mTOR信号通路,进而抑制细胞周期,然而提高Arg浓度并不能改善Rap对细胞周期的抑制作用。由于提高Arg浓度能促进细胞周期中S期细胞数量且激活mTOR信号通路[5],猜测Arg可能主要通过mTOR信号通路来实现对细胞周期的调控,因此mTOR信号通路被抑制后即使提高培养基中的Arg浓度也不能有效缓解Rap对细胞周期的抑制作用。mTORC1激活后能调节下游效应,主要的下游信号为核糖体S6激酶(S6K)和4EBP,S6K和4EBP主要用来调节RNA的转录和蛋白质的翻译合成[12]。本研究发现添加Rap后PI3K-Akt信号通路被抑制,而提高Arg浓度可有效缓解Rap带来的抑制作用。
细胞凋亡受到Bcl2家族、半胱氨酸蛋白酶(Caspase)家族以及癌基因如p53等多基因调控。本研究发现添加Rap极显著降低了细胞凋亡率,抑制猪肠上皮细胞的凋亡。Hosoi等[17]的研究表明,在人横纹肌肉瘤细胞中Rap诱导非p53依赖的细胞凋亡。本研究显示,长期的Rap处理抑制细胞增殖,减少了细胞自发性的凋亡;提高Arg浓度缓解了Rap对猪肠上皮细胞增殖的抑制作用;提高Arg浓度对细胞周期没有显著影响,猜测提高Arg浓度可能通过影响细胞的凋亡来缓解Rap的抑制作用;同时,提高Arg浓度加强了对细胞凋亡的抑制。Cyt-C对启动细胞凋亡起着重要作用,从线粒体释放是细胞凋亡的关键步骤。本试验检测了Cyt-C的蛋白表达量,添加Rap降低了Cyt-C的蛋白表达量。Bcl2家族和Caspase家族蛋白也是调控凋亡的重要蛋白。Bcl2家族蛋白可以分为两大类:第1类为抗凋亡蛋白,主要有Bcl2、Bcl-xL、B细胞淋巴瘤-W(Bcl-W)等;第2类为促凋亡蛋白,主要包括Bax、Bcl2拮抗/杀伤因子(Bak)、B细胞淋巴瘤-XS(Bcl-XS)、Bcl-xL/Bcl2相关死亡促进因子(Bad)、BH3结构域凋亡激动剂(Bid)等[18-20]。Rap提高抗凋亡蛋白Bcl-xL的蛋白表达量,同时抑制促凋亡蛋白Bax和Caspase 3的蛋白表达量,从而抑制猪肠上皮细胞凋亡,提高Arg浓度加剧抑制凋亡,缓解细胞损伤。
本研究中,外源性添加高浓度Arg显著提高Arg的摄取率。Arg的转运主要是通过细胞膜上的特殊阳性转运载体——y+(包括CAT1、CAT2、CAT3、CAT4载体蛋白)、B0+(ATB0+)、b0+(b0+AT)以及y+L(包括y+LAT1、y+LAT2载体蛋白)系统实现的[20]。Rap促进了Arg转运载体CAT2的蛋白及mRNA表达,降低了LAT1的mRNA以及CAT1和LAT1的蛋白及mRNA表达,暗示着提高Arg转运主要归功于CAT2和LAT1的表达。CAT2主要负责转入Arg,而LAT1负责转出Arg。因此增加的CAT2和降低的LAT1促使了Arg的摄取。Visigalli等[8]发现,在人内皮细胞中Rap能通过CAT2来刺激Arg的转运。在大鼠的骨骼肌中,CAT2A在应激状况下被激活,如外科手术创伤或是食物缺乏。这就意味着CAT2A可能作为从蛋白质分解出的Arg的输出通道。考虑到mTOR复合物分为mTORC1和mTOR复合物2(mTORC2),大部分时候只有mTORC1对Rap敏感,而mTORC2对其不敏感。长期的Rap处理可以降低mTORC2的活性。Rap可能通过影响mTORC1的表达,从而提高mTORC2的活性来促使CAT2的表达。上述结果表明,长期的Rap处理抑制细胞PI3K-Akt信号通路及mTORC2的活性,从而抑制细胞凋亡。本试验结果显示添加Rap后CAT2、PKCα和Erk的蛋白表达量随之上升。由此可以说明,细胞在处于Rap应激的状况下生长因子和营养物质通过mTOR信号通路促进蛋白质合成和细胞生长。因此,抑制mTOR信号通路将会使营养物质的转运减少[21]。综合以前的试验结果,CAT1表达与营养刺激有关,随着mTOR信号通路的活性变化,而只有CAT2的表达受到极端环境的刺激[21]。Rap处理下细胞内的Arg摄取增加主要取决于CAT2的蛋白表达量增加及mTOR信号通路被抑制而引起的蛋白质的水解[8]。由于提高Arg浓度后CAT2的蛋白表达量下降,但是细胞内的Arg转运和Arg的浓度都比对照组要高,因此可能存在一个未知的通路影响着Arg的摄取。Visigalli等[8]发现,添加肿瘤坏死因子-α(TNF-α)也能通过提高CAT2的蛋白表达量来提高Arg的转运,这主要是通过激活核转录因子-κB(NF-κB)信号通路来实现,同时也与TNF-α激活PI3K-Akt-mTOR信号通路有关;此外,同时添加Rap和TNF-α能更进一步提高Arg的转运。由此推测,在Rap添加后细胞可能通过激活NF-κB信号通路来激活CAT2的表达。本试验同时检测到转录因子Erk和cFos的蛋白表达量上升。因此,推测Rap抑制mTOR信号通路,细胞内蛋白质分解增加,细胞激活PI3K-Akt信号通路来抑制凋亡,而Rap应激使得转录因子Erk、cFOS处于高表达水平,从而进入细胞核参与CAT2的转录使其表达量上升,从而使得细胞内的Arg浓度上升,这是细胞的一种对环境刺激而产生的反馈机制。激活PKCα-Erk/cFos-CAT2信号通路,使得Arg浓度上升,CAT2的蛋白表达量极显著上升,促进Arg转运,缓解细胞损伤。这些结论还需要设计更进一步的试验进行验证。
4 结 论
① Rap显著抑制猪肠上皮细胞周期运转,抑制mTOR信号通路,提高Arg浓度可有效缓解Rap对细胞增殖的抑制。
② Rap通过激活PI3K-Akt-Bcl2信号通路抑制细胞凋亡。
③ Rap可能通过PKCα-Erk/cFos-CAT2信号通路调控CAT2的表达,从而促进Arg的摄取,修复细胞损伤。
——雷帕霉素

