羊肚菌蛋白水解物及其硒化衍生物的细胞保护作用和安全性研究
张强,王梦锦,马玉涵,孙玉军,王松华
(安徽科技学院 生命与健康科学学院,安徽 凤阳,233100)
硒(Se)是人类和动物必需的微量元素。它是硫氧还蛋白还原酶、谷胱甘肽过氧化物酶、碘甲状腺原氨酸脱碘酶、甲酸脱氢酶和硒代磷酸合成酶等许多含硒蛋白酶的关键活性成分,这些酶在DNA合成、甲状腺激素代谢、生殖以及细胞保护等方面发挥着极其重要的作用[1-3]。硒具有抗氧化、抗炎、免疫刺激、抗病毒、预防心血管和神经退行性疾病等多种生理功能[3-4]。人体内的硒有助于预防和治疗克山病、大骨节病、心血管疾病、白内障、关节炎、糖尿病以及癌症等多种人体疾病[5-6]。然而,硒缺乏现象在大多数国家普遍存在[3,7]。在中国,大约51%的土壤中硒缺乏,39%~61%的人口每天硒摄入量偏低[8]。因此,补硒成为近年来营养和公共卫生领域研究的热点问题之一。
硒补充剂分为无机硒(如亚硒酸钠)和有机硒(如硒多糖、硒蛋白等)2种。与无机硒相比,有机硒具有毒性低、生物利用率高、生物活性强等优点,受到了营养和食品学家的普遍关注[9]。有机硒既可以通过富硒培养技术进行生物转化,也可以通过分子修饰法进行人工合成。生物转化法制备的有机硒含硒量偏低,生产周期也比较长。因此,有机硒的人工合成引起了人们的极大兴趣[3]。多糖[10]、蛋白质[6]、肽聚糖[11]和维生素[5]等多种生物活性物质的硒化修饰已被广泛报道。它已成为制备有机硒和改进活性物质功能特性的一种非常有前途的方法。但相关研究主要集中在修饰工艺的优化、硒化产物的表征以及体外生物活性的评估等方面。迄今为止,通过硒化修饰制备的有机硒的细胞保护作用和安全性的研究尚未见报道。
羊肚菌(Morchellaesculenta)是世界上最有价值的药食两用真菌之一。羊肚菌蛋白是开发功能性食品的优良原料,但目前还没有得到充分利用。先前的研究表明,与原羊肚菌蛋白水解物(morchella protein hydrolysate,MPH)相比,在微波辅助下合成的硒化羊肚菌蛋白水解物(Se-MPH;硒含量59.0 mg/g),其抗氧化、降血糖和酪氨酸酶抑制活性均显著增强[12]。本文拟在前期研究的基础上,探讨MPH和Se-MPH对H2O2诱导的Caco-2细胞氧化损伤的保护作用及其机制;借助细胞毒性试验、红细胞溶血实验、细菌回复突变(bacterial reverse mutation, Ames )试验和鸡胚绒毛尿囊膜(chick embryo chorioallantoic membrane,CAM)试验评估了MPH和Se-MPH的安全性。本研究将为开发利用MPH和Se-MPH新型功能性成分提供理论和实验依据。
1 材料与方法
1.1 试剂
Caco-2细胞,中国科学院上海细胞库;细胞培养试剂,美国Gibco公司;丙二醛(malondialdehyde, MDA)检测试剂盒,南京建成生物工程研究所;活性氧(reactive oxygen species, ROS)含量检测、基于末端脱氧核苷酸转移酶标记 (terminal dexynucleotidyl transferase-mediated dUTP nick end labeling, TUNEL)的细胞凋亡检测、总蛋白质提取和定量的试剂盒以及增强型化学发光(enhanced chemiluminescent system, ECL)试剂盒,南京凯基生物科技发展有限公司;抗体(一抗和二抗),Santa Cruz生物技术有限公司;其他化学试剂均为国产分析纯。
1.2 MPH和Se-MPH的制备
MPH的制备参照先前报道的方法[13-14]。将羊肚菌菌丝体在25 ℃、150 r/min的摇床中振荡培养72 h。然后,采用碱提(pH 12.0)酸沉(pH 4.1)法提取羊肚菌蛋白。用木瓜蛋白酶,在pH 6.0、[E]/[S]为2%、反应温度45 ℃、反应时间3 h的条件下水解羊肚菌蛋白,即得MPH。
Se-MPH的制备采用微波辅助法[12]。按Na2SeO3与MPH(质量比4∶1)向质量分数1%的MPH中加入Na2SeO3,调节pH至5.0。将50 mL上述溶液置于密闭容器中,在250 W功率水平下微波加热20 min(工作模式:4 min on,5 min off)。反应结束后,冷却,转入截留分子质量300 Da的透析袋中,用蒸馏水透析48 h。将袋中溶液于4 000×g离心15 min,上清液冻干,得Se-MPH。
1.3 细胞培养与分组
Caco-2细胞解冻后接种于含10%胎牛血清和1%青霉素/链霉素的达尔伯克氏改良伊戈尔培养基,并置于37 ℃、5%CO2的细胞培养箱中进行培养。为探讨MPH和Se-MPH对H2O2诱导的细胞氧化损伤的保护作用及其机制,细胞分组如下:(1)对照组(control):正常Caco-2细胞;(2)模型组(model):用完全培养基预处理细胞1 h,然后用300 μmol/L H2O2处理细胞6 h;(3)MPH组:用250 μg/mL MPH预处理细胞1 h,然后用300 μmol/L H2O2处理细胞6 h;(4)Se-MPH:用250 μg/mL Se-MPH预处理细胞1 h,然后用300 μmol/L H2O2处理细胞6 h;(5)阳性对照组(VC):用250 μg/mL VC预处理细胞1 h,然后用300 μmol/L H2O2处理细胞6 h。
1.4 细胞ROS水平和MDA含量的测定
细胞经分组处理后,用磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤1次,收集细胞,加入用无血清培养基稀释的终浓度为10 μmol/L的2′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorofluorescein diacetate, DCFH-DA),于细胞培养箱(37 ℃、5%CO2饱和湿度)内孵育20 min。以无血清细胞培养基洗涤细胞3次,用流式细胞仪(Ex=488 nm;Em=530 nm)检测细胞ROS水平。至于MDA含量的测定,将处理后的细胞用冷的PBS洗涤1次,在1 000 μL PBS溶液中超声处理2 min,离心(4 ℃、13 000×g)10 min。收集上清液,采用MDA检测试剂盒,根据说明书的指导,检测MDA含量。
1.5 细胞凋亡的TUNEL法检测
采用TUNEL试剂盒检测细胞凋亡。简言之,先对处理结束后的各组细胞进行爬片处理,然后用4%的多聚甲醛固定30 min,PBS洗涤3次。将细胞用1%Triton X-100在室温下透化处理15 min,PBS洗涤3次。加入100 μL TUNEL反应混合液,于37 ℃温育60 min,用PBS洗涤3次。用100 μL 4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)工作液于暗处在37 ℃条件下将细胞核染色5 min,然后在荧光显微镜下进行观察和拍照。
1.6 蛋白质免疫印迹(Western blot, WB)分析
根据使用说明书,用总蛋白质提取试剂盒提取各组Caco-2细胞的总蛋白,用二辛可宁酸 (bicinchoninicacid, BCA)蛋白检测试剂盒进行蛋白定量,然后通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)(浓缩胶浓度5%,分离胶浓度12%)分离蛋白,在300 mA恒流90 min条件下,将蛋白转移到硝酸纤维素膜上。用Tris-盐酸洗膜缓冲液(Tris-buffered saline-Tween 20,TBST)洗膜(10 min×3次),并用50 g/L的脱脂乳封闭液封闭处理1.5 h,再次用TBST洗膜(10 min × 3次)。将膜转入孵育盒中,加入一抗,于4 ℃摇床振荡孵育过夜。吸弃一抗,TBST洗膜(10 min×3次),加入二抗,室温孵育1.5 h。TBST洗膜(10 min×3次),使用ECL试剂盒显色,凝胶成像系统采集数据,通过Gel-Pro32软件,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参定量各蛋白的表达水平。
1.7 细胞毒性检测
细胞毒性的测定参照HONG等[15]的方法并稍作修改。将Caco-2细胞(1 × 105个/mL)接种在96孔板(每孔100 μL),并置于37 ℃,5% CO2的培养箱中培养24 h。去除培养液,用不同浓度的样品进行处理。处理结束后,每孔加入20 μL 噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT](5 mg/mL),继续孵育3 h。弃上清,细胞用PBS洗涤后向每孔加入150 μL 二甲基亚砜,在摇床中振荡混匀10 min,用酶标仪测定490 nm处的吸光度值。
1.8 红细胞溶血实验
溶血活性测定参照HOU等[16]的方法并稍作修改。用抗凝管从小鼠眼球取新鲜血液,4 ℃、3 000 r/min离心5 min。小心吸弃上层清液,加入约下层红细胞5倍体积的PBS溶液,并按上述方法重新离心清洗3次。将所得红细胞用PBS配成体积分数4%的细胞悬液,向10 mL离心管中依次加入2 mL细胞悬液,2 mL不同浓度的样品溶液,然后置于生化培养箱中,37 ℃孵育30 min。孵育结束后,4 ℃、3 000 r/min离心5 min,小心吸出上层溶液,测定其在540 nm的吸光度值,以PBS代替样品作为阴性对照,0.1%的Triton X-100代替样品作为阳性对照。样品管的吸光度为A,阴性对照管的吸光度为A0,阳性对照管的吸光度为AT,溶血率计算如公式(1)所示:
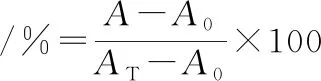
(1)
1.9 Ames试验
按照GB 15193.4—2003的方法进行试验。选用组氨酸营养缺陷型的鼠伤寒沙门氏菌TA97、TA98、TA100和TA102共4个标准菌株,采用标准平皿掺入法进行测试。受试药物设置5 000、2 500、500和100 μg/皿4个剂量组,另设阳性对照组[敌克松(Dixon):50 μg/皿;NaN3:3 μg/皿;2-氨基芴(2-aminofluorene,2-AF):20 μg/皿]和阴性对照组(生理盐水),在加和不加S9的条件下进行试验,每个浓度设3个平行皿,试验重复2次。其具体为:向2 mL融化并保温在45 ℃的上层培养基中依次加入细菌培养液0.1 mL,受试物溶液0.1 mL,S9混合液或磷酸盐贮备液0.5 mL,立即混匀,迅速倒于底层培养基表面,使之均匀分布,水平放置,凝固后于37 ℃恒温培养48 h,记录回复突变菌落数。
1.10 CAM试验
CAM试验参照LAI等[17]的方法并稍作修改。将受精蛋在(37±0.5) ℃、相对湿度65%的条件下孵化6 d。然后,在无菌操作下,用牙科钻在气室处打一个直径约1 cm的小孔,并去除蛋壳膜以露出CAM。将直径约5 mm的无菌滤纸放置在CAM上,用灭菌透明胶封口,继续孵育24 h。用微量注射器将0.1 mL样品加到滤纸上,连续加样3 d。以质量分数0.4%和4%的SDS为阳性对照,0.9%生理盐水为阴性对照。在第10天,用固定液[V(甲醇)∶V(丙酮)=1∶1)]对鸡胚绒毛尿囊膜进行固定,制成尿囊膜标本,用相机拍照记录实验结果。
1.11 数据分析
无特殊说明,实验重复3次,数据以平均值±标准差表示,用SPSS 19.0软件进行单因素方差分析,当P<0.05时认为数据差异具有统计学意义。
2 结果与分析
2.1 对H2O2诱导的细胞氧化应激的保护作用
当前,蛋白水解物抗氧化活性的研究大多数局限于体外化学实验模型,对其在生物系统中的抗氧化作用知之甚少。因此,本研究利用Caco-2细胞探讨了MPH和Se-MPH对H2O2诱导的细胞氧化应激的保护作用。
ROS(超氧阴离子自由基、羟基自由基和过氧化氢等)生成是氧化应激的一个重要指标[18]。在氧化应激条件下,ROS生成与细胞内抗氧化防御之间的平衡被破坏。ROS的过量产生会诱导细胞毒性,破坏膜脂、蛋白质和核酸,从而导致细胞损伤或死亡[19]。因此,我们首先研究了MPH和Se-MPH对H2O2处理的Caco-2细胞内ROS产生的影响。由图1-A、图1-B可知,模型组的ROS生成量明显高于对照组(P<0.05),表明H2O2引发了Caco-2细胞的氧化应激;与模型组比较,MPH、Se-MPH或VC处理组显著降低了H2O2诱导的Caco-2细胞ROS生成(P<0.05),提示MPH和Se-MPH可减轻H2O2诱导的氧化应激。
脂质过氧化作为ROS在生物体内引发的主要现象之一,会加剧细胞的氧化损伤。MDA作为膜脂质过氧化的主要副产物和细胞膜氧化的生物标志物,会进一步扩大ROS的作用,引发一系列连锁反应,破坏核酸和蛋白质等生物大分子,并导致各种人体疾病[20-21]。MPH和Se-MPH对模型细胞MDA水平的影响如图1-C所示。由图1-C可以看出,伴随ROS的生成,模型组的MDA水平明显高于对照组(P<0.05)。用MPH、Se-MPH或VC预处理模型细胞显著降低了H2O2诱导的MDA产生(P<0.05)。这表明,MPH和Se-MPH可以抑制模型细胞的脂质过氧化,进而保护细胞免受氧化损伤。
上述实验结果表明,MPH和Se-MPH可以阻止ROS产生,抑制脂质过氧化,从而减轻了细胞的氧化应激及由此造成的细胞损伤。MPH和Se-MPH对Caco-2细胞氧化应激的保护作用可能与其所具有的还原性和自由基清除活性有关,这些活性在之前的研究中已经得到证实[12]。
Nrf2信号通路可以帮助细胞抵御氧化应激,维持氧化还原平衡,并在与氧化应激相关的多种人类疾病中发挥重要作用[22-23]。当细胞受到氧化剂、亲电试剂、某些疾病以及外源性天然小分子物质的刺激时,Nrf2信号通路被激活,诱导II相解毒酶和抗氧化酶[如血红素加氧酶-1(HO-1)和醌氧化还原酶1(NQO1)]的表达,从而引发细胞的抗氧化响应,保护机体免受氧化损伤[24]。一些研究表明,多酚[25]、酚苷[24]和姜黄素[26]等各种天然抗氧化剂可通过激活Nrf2信号通路来保护细胞免受氧化应激。为进一步阐明MPH和Se-MPH对细胞氧化应激保护作用的分子机制,采用Western blot方法研究了MPH和Se-MPH对Nrf2信号通路的影响(图2)。结果显示,与对照组相比,模型组细胞中Nrf2、NQO1和HO-1的蛋白表达水平均显著提高(P<0.05),表明H2O2在诱导细胞氧化应激的同时也会促进Nrf2细胞信号通路的激活;与模型组相比,MPH、Se-MPH或VC处理组细胞中Nrf2、NQO1和HO-1的蛋白表达水平均进一步显著增加(P<0.05),提示Nrf2细胞信号通路的激活可能是MPH和Se-MPH发挥对Caco-2细胞氧化应激保护作用的一个重要机制。
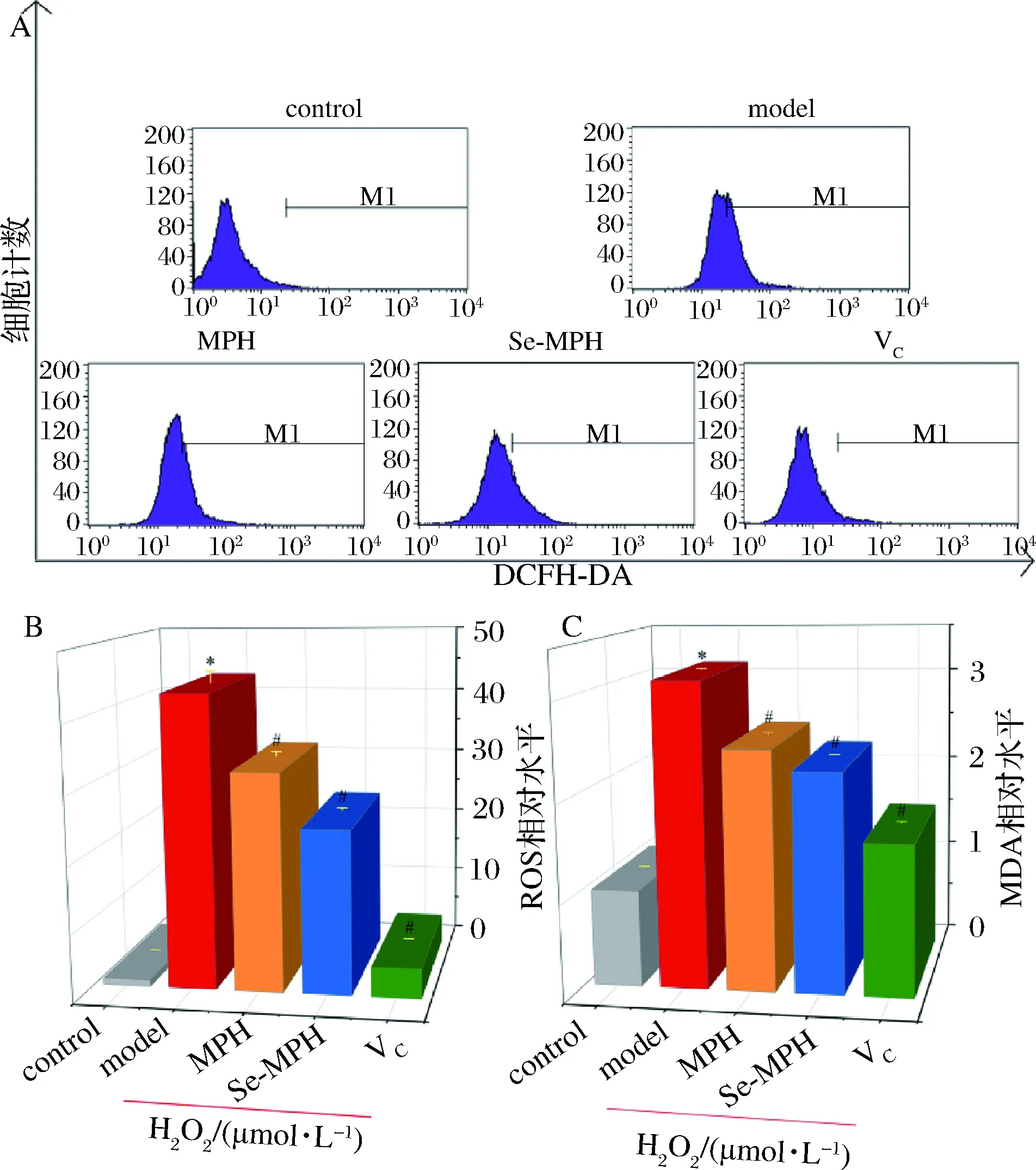
A-ROS水平的流式结果;B-ROS相对水平;C-MDA相对水平图1 MPH和Se-MPH对H2O2处理的Caco-2细胞ROS产生和脂质过氧化的影响Fig.1 Effects of MPH and Se-MPH on ROS production and lipid peroxidation in H2O2-treated Caco-2 cells注:*为与对照组相比差异显著(P < 0.05),#为与模型组相比差异显著(P<0.05)(下同)
2.2 对H2O2诱导的细胞凋亡的保护作用
细胞凋亡在机体生长、发育的调节和稳态维持等许多生理过程中发挥着重要作用。癌症、自身免疫疾病以及神经退行性疾病等诸多疾病的发生与细胞增殖和凋亡间的不平衡密切相关[27]。许多研究已经证实,天然抗氧化剂可通过抑制细胞凋亡来保护细胞免受氧化损伤[24-25,28]。因此,本研究探讨了MPH和Se-MPH对H2O2诱导的Caco-2细胞凋亡的影响。TUNEL染色(图3-A)显示,与对照组相比,模型组TUNEL阳性细胞(绿色)显著增加;与模型组相比,MPH、Se-MPH或VC处理组的TUNEL阳性细胞显著下降。这表明,MPH和Se-MPH可通过抑制细胞凋亡而保护细胞免受氧化损伤。
细胞凋亡受上游B细胞淋巴瘤白血病2 (B celllymphoma leukemia 2, Bcl-2)家族[促凋亡蛋白Bcl-2相关X 蛋白(Bcl-2 associated X protein, Bax)和抗凋亡蛋白Bcl-2]和下游caspase家族[细胞凋亡执行者半胱氨酸天冬氨酸蛋白酶-3 (cysteine-aspartic acid protease-3, caspase-3)]蛋白的调节[29]。因此,为探索MPH和Se-MPH潜在的抗凋亡机制,本研究以GAPDH为内参,用Western blot检测了这些凋亡相关蛋白的表达水平(图3-B)。由图3-B可知,与对照组相比,模型组Bax和caspase-3的表达水平显著升高,Bcl-2的表达水平显著降低(P<0.05);然而,与模型组相比,用MPH、Se-MPH或VC预处理细胞显著逆转了Bax,Bcl-2和caspase-3蛋白的表达,提示MPH和Se-MPH能通过调节Bax、Bcl-2和caspase-3等凋亡相关蛋白的表达来发挥抗细胞凋亡作用,这与CHANG等[24]在酚苷以及JIANG等[30]在多糖上的研究结果一致。

A-Western blot检测Nrf2、NQO1和HO-1的蛋白表达;B-Nrf2相对含量;C-NQO1相对含量;D-HO-1相对含量图2 MPH和Se-MPH对Nrf2、NQO1和HO-1的蛋白表达的影响Fig.2 Effects of MPH and Se-MPH on protein expressions of Nrf2, NQO1, and HO-1 under oxidative stress
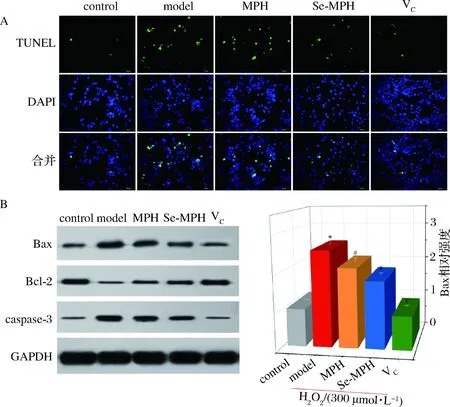

A-TUNEL法检测的细胞凋亡(×200);B-细胞凋亡相关蛋白表达的Western blot分析和各蛋白表达水平的定量图3 MPH和Se-MPH对细胞凋亡及凋亡相关蛋白表达的影响Fig.3 Effects of MPH and Se-MPH on cell apoptosis and apoptosis-related protein expression
2.3 MPH和Se-MPH的安全性
2.3.1 细胞毒性
细胞活力或细胞毒性试验是评估活性化合物或药物体外毒性的最常用的检测方法之一,因为这些物质可能导致不可逆转的细胞损伤[31]。不同浓度的MPH和Se-MPH与Caco-2细胞孵育后的细胞毒性试验结果如图4所示。由图4可以看出,与对照相比,在测试浓度条件下,用MPH或Se-MPH处理的细胞活力未发生显著变化(P>0.05),表明MPH和Se-MPH没有细胞毒性。类似地,GOMEZ等[28]研究发现,浓度低于0.2 mg/mL的红罗非鱼内脏水解物对Caco-2细胞没有细胞毒性作用;XU等[32]研究证实,富硒大米蛋白水解物在浓度高达160 μg/mL时不会对PC12和RAW264.7细胞产生毒性。
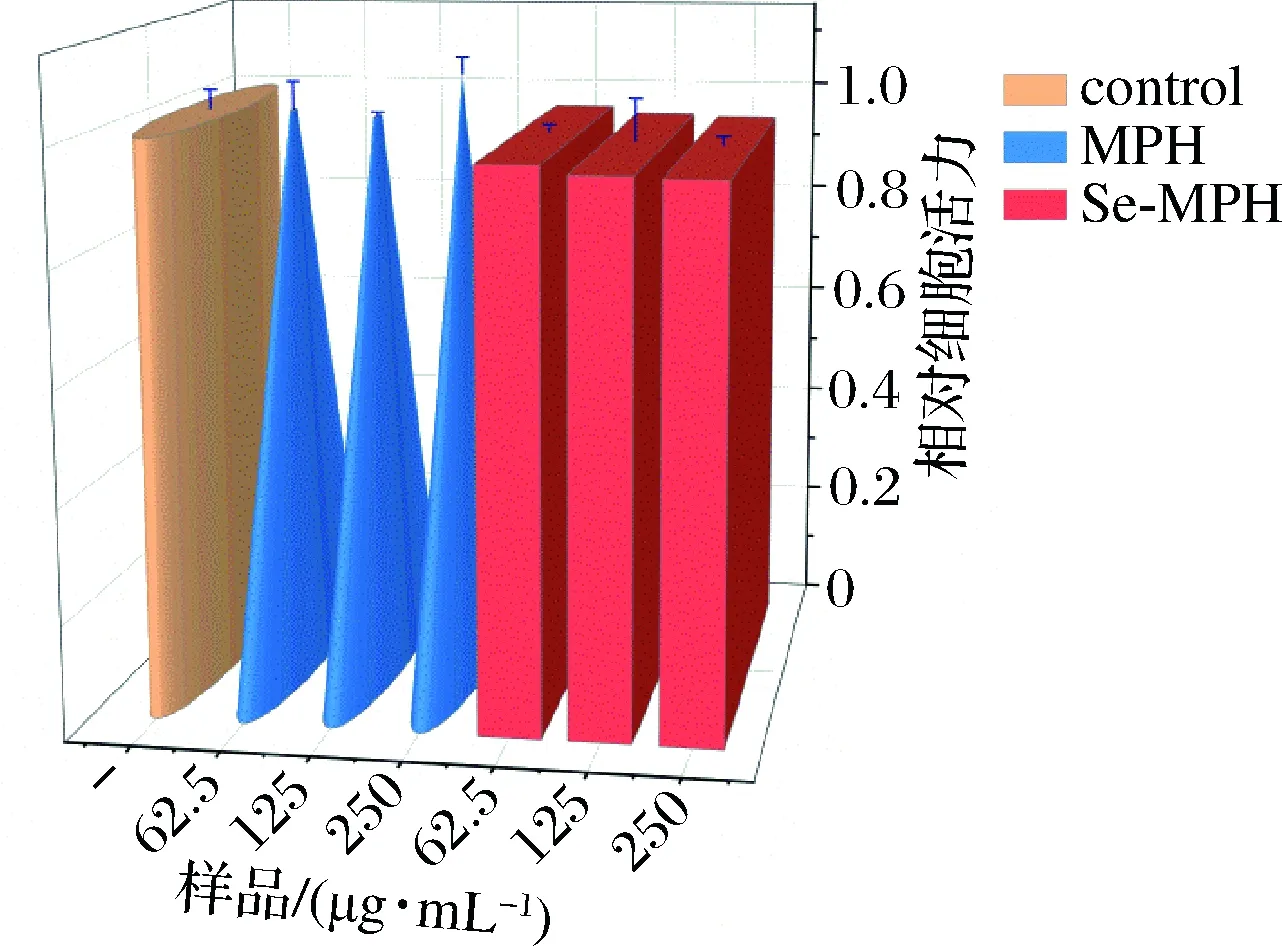
图4 MPH和Se-MPH对Caco-2细胞的细胞毒活性Fig.4 Cytotoxic activity of MPH and Se-MPH towards Caco-2 cells
2.3.2 溶血活性
红细胞溶血实验是体外检测受试物安全性的可靠方法之一,常用于体内毒理学评价之前的细胞刺激性评估[33]。一般认为受试物的溶血率在20%以下即为无刺激性;溶血率低于5%,即适用于血液环境[17,34]。本研究对MPH和Se-MPH作用于小鼠红细胞的溶血活性进行了检测,结果如图5所示。由图5可以看出,在实验浓度范围内,MPH和Se-MPH的溶血率均低于5%,表明MPH和Se-MPH对红细胞没有造成损伤,即MPH和Se-MPH具有良好的血液相容性。
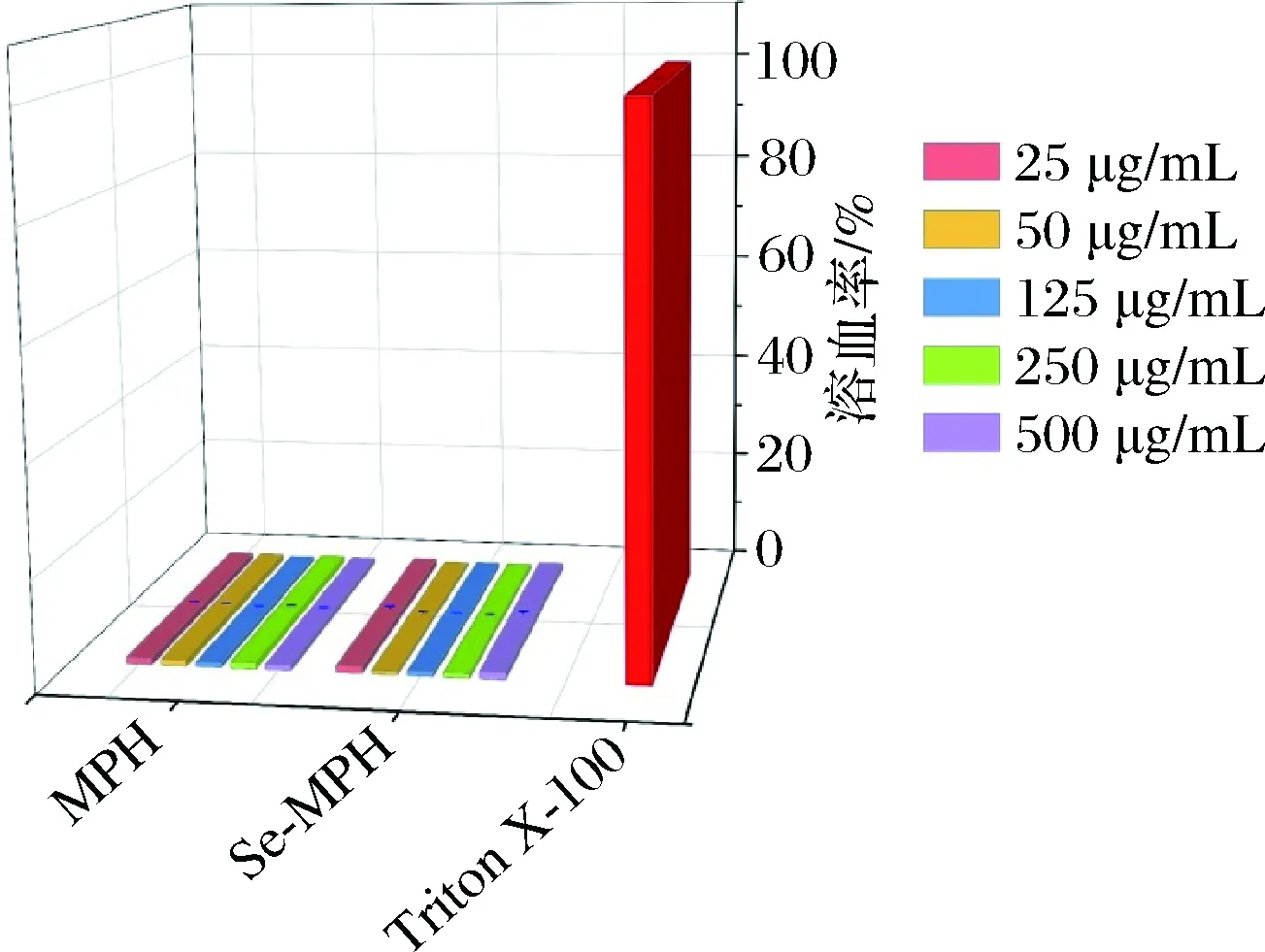
图5 MPH和Se-MPH对小鼠红细胞的溶血活性Fig.5 Hemolytic activity of MPH and Se-MPH toward mouse erythrocytes
2.3.3 体外致突变活性
Ames试验是一种快速灵敏的检测受试物致突变或致癌作用的体外实验技术,常用于评估受试物的遗传毒性效应[35]。一般认为受试物的回复突变菌落数与阴性对照组回复突变菌落数的比值即回复突变率≥2时,试验结果为阳性[36]。MPH和Se-MPH的Ames试验结果见表1。在4种试验浓度下,无论是否加S9, 4株试验菌(TA97、TA98、TA100和TA102)的回复突变率均小于2,且均未发现明显的量效关系,而各阳性对照组均显示出强烈的诱变作用(回复突变率远大于2),与阴性对照组差异显著(P<0.05)。这些结果表明,在本研究条件下,MPH和Se-MPH均无致突变活性。
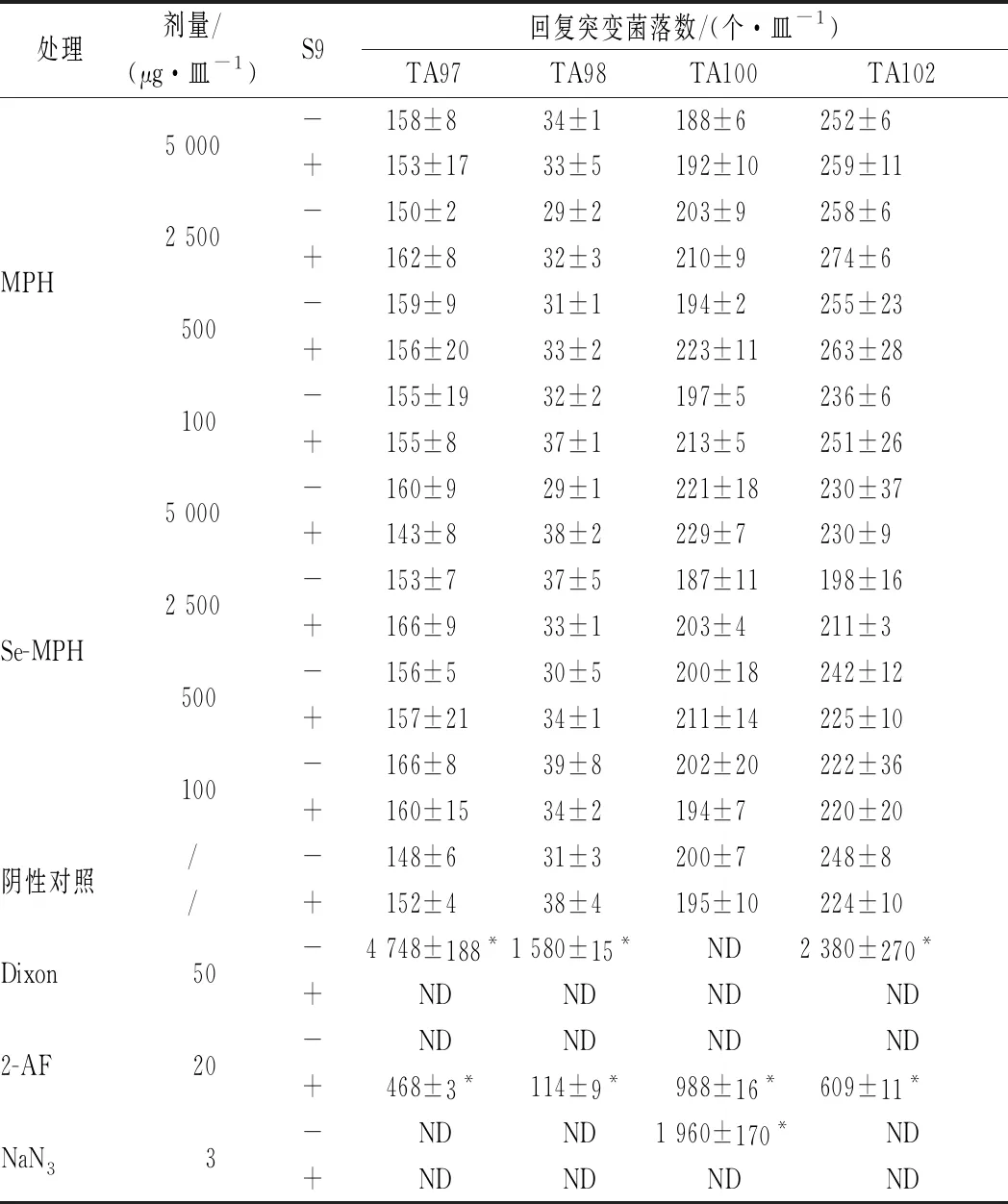
表1 Ames实验结果Table 1 The results of Ames test
2.3.4 CAM试验结果
CAM试验已被广泛用于评估药物、杀虫剂和许多其他化学物质的急性毒性、炎症反应以及促新血管生成潜力[37]。由于CAM试验操作相对简单、快速,低成本,且不涉及动物伦理学问题,已逐渐取代残酷的Draize眼刺激性试验,常用于化妆品和眼用制剂的安全性研究[37-38]。MPH和Se-MPH的CAM试验结果如图6所示。由图6可知,阴性对照组的鸡胚血管网络明显,形态学结构清晰,无出血和渗血现象出现;阳性对照组中低剂量(质量分数0.4%)SDS处理的鸡胚血管网络不清晰,形态学结构模糊,末端血管有明显的出血现象,高剂量(质量分数4%)SDS处理的鸡胚血管网络消失,蛋白质变性,鸡胚明显死亡;而用MPH和Se-MPH处理的鸡胚,无论低剂量还是高剂量,在血管的形态学方面均未发现明显的变化,也未观察到明显的出血和渗血现象。上述结果表明,MPH和Se-MPH对鸡CAM的组织细胞无毒性和刺激性。

图6 CAM模型血管形态学观察Fig.6 Photographs from CAM assay taken during morphological observation of chick embryo blood vessels
3 结论
MPH和Se-MPH可通过减轻细胞氧化应激和抑制凋亡来保护Caco-2细胞免受H2O2诱导的氧化损伤。这种保护作用可能主要归因于Nrf2信号通路的激活和凋亡相关蛋白表达的调节。安全性评估结果表明,MPH和Se-MPH无细胞毒性、溶血活性和致突变活性,在CAM试验中不会引起鸡胚血管形态改变和出血,即MPH和Se-MPH对鸡胚血管没有毒性和刺激性,具有良好的安全性。因此,MPH和Se-MPH有望作为潜在的营养/功能性成分或医药成分在医疗保健领域得到广泛应用。

