先天性心脏病手术后残余解剖畸形患者体外膜肺氧合支持的效果分析
刘明璐 杨寅愉 张 蔚 姜 磊 沈 佳 郭 铮 于新迪 黄坚鹄 王 伟
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是一种有创的高级生命支持技术,用于支持传统治疗无效的严重心肺功能衰竭患者。其适应证包括低心输出量(心排指数<2.0 L·min-1·m-2)、心脏手术后不能脱离心肺转流(cardiopulmonary bypass,CPB)、心脏骤停后心肺复苏效果不佳以及呼吸衰竭、肺动脉高压、难治性心源性休克、难治性心律不齐、体外心肺复苏和等待心脏移植等[1,2]。自二十世纪七十年代ECMO首次应用于小儿先天性心脏病(简称先心病)术后以来,随着高难度系数、复杂心脏畸形手术的开展不断增加,ECMO在小儿心脏手术围术期的应用也随之增加,及时有效的ECMO支持对降低先心病病死率和改善预后具有十分重要的意义。据体外生命支持组织(Extracorporeal Life Support Organization,ELSO)统计显示,心脏手术后新生儿和儿童ECMO支持的存活率分别为52.6%和51.6%,这说明ECMO支持的小儿心脏外科手术患者病死率仍然较高。据文献报道这部分患者的死亡原因可能与术后依然存在解剖畸形有关[3]。残余解剖畸形是指明显影响血液动力学的严重心脏解剖畸形[4]。本研究回顾性分析了2017年1月1日至 2020年6月30日上海儿童医学中心收治的经ECMO支持的先心病术后患者临床资料,总结残余解剖畸形和非残余解剖畸形患者的临床结局,进一步探讨残余解剖畸形的后续处理方式对患者转归的影响。
材料与方法
一、研究对象及分组
选择2017年1月1日至2020年6月30日在上海儿童医学中心行心脏手术后使用ECMO的患者作为研究对象。纳入标准:先心病进行体外开胸手术矫治的患者;排除标准:住院期间进行心脏移植的患者、先心病手术后先接受心室辅助再改为ECMO的患者、手术前接受ECMO的患者。最终本研究共纳入132例心脏手术后需要ECMO支持的患者,根据是否存在残余解剖畸形分为残余组(n=26)和非残余组(n=106);根据残余解剖畸形患者的病种情况分为简单先心病(n=2)和复杂先心病(n=24);根据残余解剖畸形的种类分为瓣膜问题、残余梗阻和残余分流。残余组26例根据是否进行手术干预分为干预组(n=6)和非干预组(n=20)。同一次住院期间进行多次ECMO的患者记为1例。
二、相关定义
残余解剖畸形是指明显影响血液动力学的严重心脏解剖畸形。对残余解剖畸形采用的干预方式:手术再次干预(中央分流术、瓣膜整形术、动脉环缩术、心室流出道重建术等)、心导管干预(支架置入术、球囊扩张术)。本研究将动脉导管未闭、室间隔缺损(ventricular septal defect,VSD)、房间隔缺损(atrial septal defect,ASD)、肺动脉狭窄(pulmonary stenosis,PS; 重度除外) 归为简单先心病,其余病种归为复杂先心病。根据残余解剖畸形所在位置及其导致的问题,分为瓣膜问题、残余梗阻和残余分流。
三、 ECMO应用
1. 适应证:不能脱离CPB、心输出量低、心脏骤停需要心肺复苏、肺动脉高压、难治性心源性休克、呼吸衰竭、难治性心律不齐、体外心肺复苏和等待心脏移植[5,6]。对于ECMO支持的患者,通过超声心动图检查心脏解剖矫治结果,必要时采用心导管手术诊断是否存在解剖问题。
2. ECMO管理:ECMO安装和管理[1]简述如下:采用Rotaflow或Sorin离心泵、中空纤维膜式氧合器(Medos HILITE 800LT、2400LT、Sorin Lilliput 2或Maquet 5050膜式氧合器)。所有患者采用经胸插管、静脉-动脉模式建立循环支持。动脉灌注管置于升主动脉,静脉引流管置于右心房,部分患者增加左心房插管以减轻左心负荷。
根据患者体重和病种维持流量在60~150 mL·kg-1·min-1,根据患者病情变化、血流动力学监测情况、乳酸水平、血气分析结果等适时调整流量,维持平均动脉血压(mean arterial pressure,MAP)在40~70 mmHg,持续监测MAP、中心静脉压、经皮血氧饱和度、血气及尿量等。ECMO支持期间使用肝素抗凝维持激活凝血时间(activated clotting time,ACT)在160~180 s,活化部分凝血活酶时间(activated partial thromboplastin time,APTT)在50~70 s。维持血小板水平>50×109~80×109/L,红细胞比容0.32~0.40,纤维蛋白原>1.5 g/L。
定期检测肝肾等重要脏器的功能,待心功能有明显恢复后考虑撤离ECMO,撤机前逐渐降低流量,当患者对辅助流量的要求低于20~50 mL·kg-1·min-1时尝试停机,如血压下降≥30%,则暂缓撤机,反之,则撤离ECMO。
四、 残余解剖畸形的处理
发现残余解剖畸形后即由外科医师、监护医师和体外循环医师协商讨论,决定下一步治疗方案。在进行心导管检查时发现的残余解剖畸形,必要时可直接进行心导管干预;如果残余解剖畸形需要进行手术干预,应结合患者情况尽早进行。
五、数据采集
收集患者的性别、年龄、体重等一般情况;收集体外循环时间、主动脉阻断时间、机械通气时间、 ECMO辅助时间、重症监护室(intensive care unit,ICU)住院时间、总住院时间、ECMO脱机率、院内存活率、残余解剖畸形的种类、所采取的手术干预方式、干预结果等临床资料。
六、统计学分析
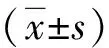
结 果
一、先心病手术后总体情况
本中心进行10 946台CPB手术,术后需要ECMO支持的132例,占所有手术的1.21%,ECMO支持患者的存活率为47%,其中新生儿和儿童存活率分别为52.17%和46.78%。残余解剖畸形26例,占ECMO治疗例数的19.69%。接受ECMO支持的患者中,有50例(38%)因体外循环不能撤机进行ECMO支持,存活22例(44%);51例(39%)因低心输出量而接受ECMO,存活29例(56%); 31例(23%)因心脏骤停需要心肺复苏进行ECMO支持,存活12例(38%)。因不同适应证接受ECMO支持的患者存活率差异没有统计学意义(χ2=1.980,P=0.372)。
26例残余解剖畸形和106例非残余解剖畸形患者的临床资料见表1。残余组中的ECMO辅助时间为(5.26±2.17)d,非残余组为(3.96±2.77)d,差异有统计学意义(t=2.241,P=0.027)。残余组存活5例,存活率19%;非残余组存活58例,存活率54%,两组存活率差异有统计学意义(χ2=10.539,P=0.001)。残余组体外循环时间为(253.3±157.34)min,非残余组为(193.9±152.06)min,差异无统计学意义(t=1.772,P=0.079)。残余组总住院时间(24.42±17.58)d,非残余组为(28.60±18.95)d,差异无统计学意义(t=-1.021,P=0.309)。
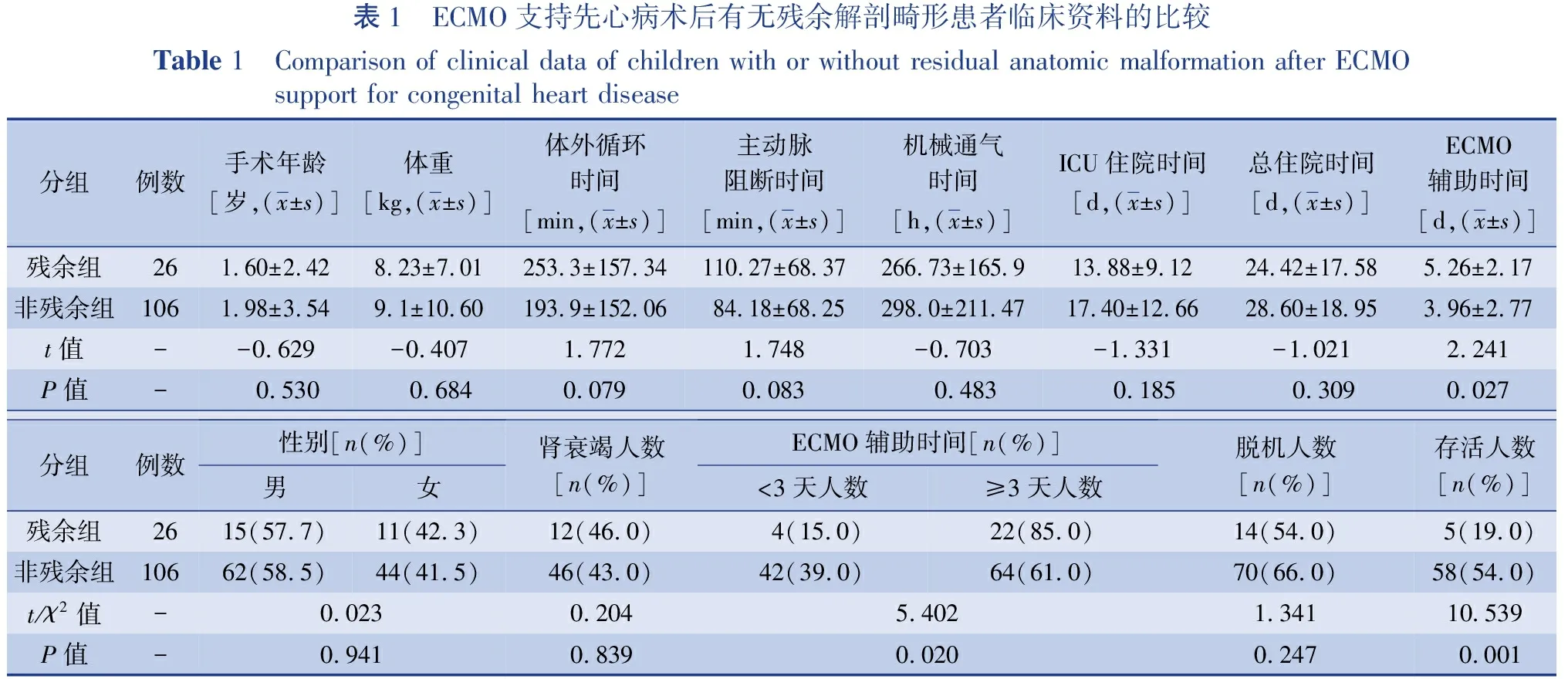
表1 ECMO支持先心病术后有无残余解剖畸形患者临床资料的比较Table 1 Comparison of clinical data of children with or without residual anatomic malformation after ECMO support for congenital heart disease分组例数手术年龄[岁,(x±s)]体重[kg,(x±s)]体外循环时间[min,(x±s)]主动脉阻断时间[min,(x±s)]机械通气时间[h,(x±s)]ICU住院时间[d,(x±s)]总住院时间[d,(x±s)]ECMO辅助时间[d,(x±s)]残余组261.60±2.428.23±7.01253.3±157.34110.27±68.37266.73±165.913.88±9.1224.42±17.585.26±2.17非残余组1061.98±3.549.1±10.60193.9±152.0684.18±68.25298.0±211.4717.40±12.6628.60±18.953.96±2.77t值 --0.629 -0.407 1.772 1.748 -0.703-1.331-1.0212.241P值- 0.530 0.6840.0790.083 0.483 0.185 0.3090.027分组例数性别[n(%)]男女肾衰竭人数[n(%)]ECMO辅助时间[n(%)]<3天人数≥3天人数脱机人数[n(%)]存活人数[n(%)]残余组2615(57.7)11(42.3)12(46.0)4(15.0)22(85.0)14(54.0)5(19.0)非残余组10662(58.5)44(41.5)46(43.0)42(39.0)64(61.0)70(66.0)58(54.0)t/χ2值 -0.023 0.204 5.4021.34110.539P值-0.9410.8390.0200.2470.001
二、先心病术后残余解剖畸形类型
所有ECMO支持患者都进行超声心动图评估,行心导管检查。共26例先心病术后存在残余解剖畸形,其中瓣膜问题13例,残余梗阻12例,残余分流5例,部分患者存在多种残余解剖畸形,包括二尖瓣反流合并主动脉瓣关闭不全,室间隔缺损合并主动脉狭窄,室间隔缺损合并右室流出道残余梗阻,肺动脉狭窄合并下腔静脉狭窄,见表2。
三、残余解剖畸形患者的病种情况
26例先心病手术后残余解剖畸形患者包括简单先心病2例,VSD 1例,PS 1例;复杂先心病24例, VSD 合并ASD 1例,法洛四联征(tetralogy of Fallot,TOF)1例,右室双出口(double outlet right ventricle,DORV)5例,完全性心内膜垫缺损(complete endocardial cushion defect,CAVC)2例,主动脉缩窄(coarctation of aorta,CoA)3例,动脉闭锁(pul-monary atresia,PA)2例,完全性肺静脉异位引流(total anomalous pulmonary venous connection,TAPVC)1例,大动脉转位(transposition of great arteries,TGA)5例,永存动脉干(persistent truncus arteriosus,PTA)1例,主动脉弓中断(interrupted aortic arch,IAA)3例。简单先心病存活1例,存活率50%;复杂先心病存活4例,存活率17%,简单先心病和复杂先心病的存活率差异无统计学意义(χ2=1.057,P=0.354),见表3。
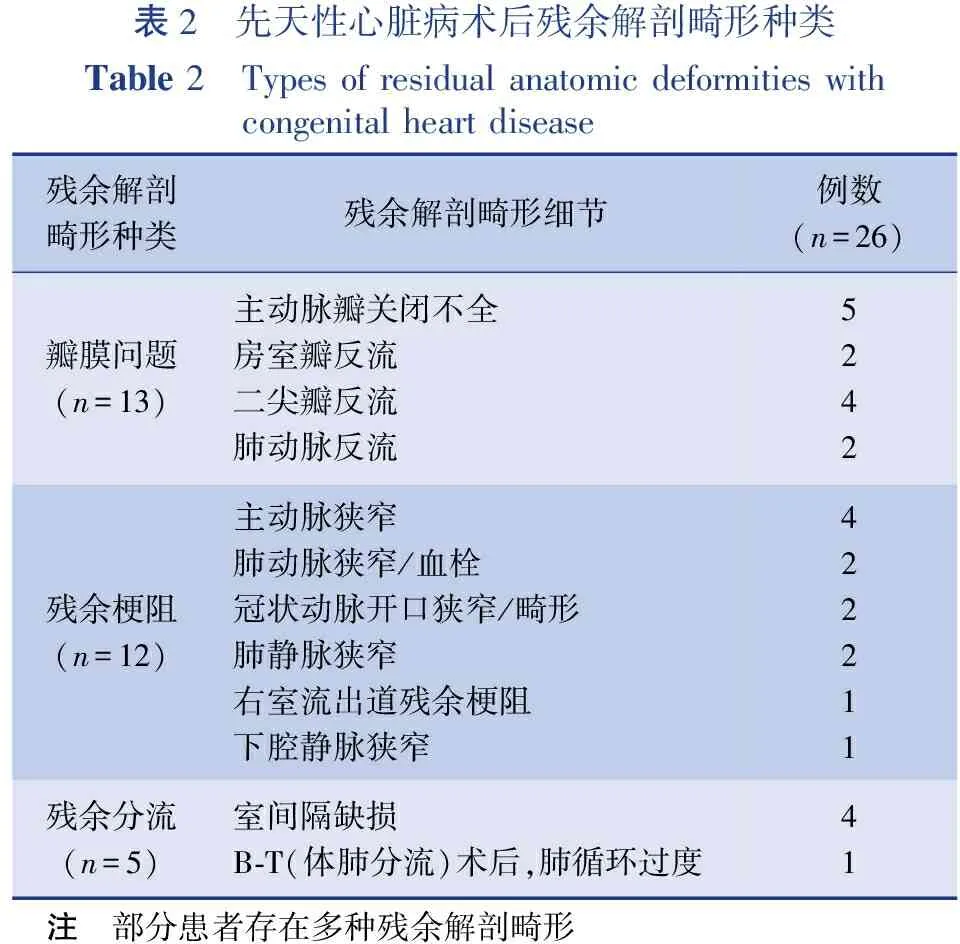
表2 先天性心脏病术后残余解剖畸形种类Table 2 Types of residual anatomic deformities with congenital heart disease残余解剖畸形种类残余解剖畸形细节例数(n=26)瓣膜问题(n=13)主动脉瓣关闭不全房室瓣反流二尖瓣反流肺动脉反流5242残余梗阻(n=12)主动脉狭窄肺动脉狭窄/血栓冠状动脉开口狭窄/畸形肺静脉狭窄右室流出道残余梗阻下腔静脉狭窄422211残余分流(n=5)室间隔缺损B-T(体肺分流)术后,肺循环过度41 注 部分患者存在多种残余解剖畸形

表3 残余解剖畸形患者的病种情况Table 3 Disease types in children with residual anatomical malformations 病种类型病种例数手术类型残余解剖畸形细节复杂先心病(n=24)PTA1PTA姑息手术B-T术后肺循环过度DORV5DORV纠治术室间隔缺损合并主动脉狭窄、主动脉关闭不全、肺动脉反流、房室瓣反流、室间隔缺损、右室流出道残余梗阻CoA3CoA纠治术主动脉狭窄TAPVC1TAPVC纠治术肺静脉狭窄IAA2IAA纠治术主动脉狭窄TGA4TGA根治术主动脉瓣关闭不全(n=2)、冠脉畸形、肺动脉反流PA/VSD2PA/VSD根治术主动脉瓣关闭不全、肺动脉狭窄CAVC2AVSD修补术房室瓣反流、二尖瓣反流VSD/ASD1VSD根治术, ASD修补术二尖瓣反流IAA1IAA纠治术室间隔缺损TOF1TOF根治术下腔静脉梗阻、肺动脉狭窄TGA1TGA分期手术肺动脉反流简单先心病(n=2)PS1右室流出道疏通术肺动脉狭窄VSD1VSD根治术二尖瓣反流
四、先心病手术后残余解剖畸形患者手术干预方式
26例先心病手术后残余解剖畸形患者中有5例行外科手术干预,1例行心导管介入治疗(表4),干预后均携带ECMO回监护室。
五、 先心病手术后残余解剖畸形患者干预组与非干预组临床资料比较
表5显示了手术干预组和非干预组手术后残余解剖畸形患者的ECMO数据和预后信息。在6例手术干预患者中,4例成功脱机(67%),3例存活,存活率50%,而20例非干预患者中有10例脱机(50%),2例存活,存活率10%,干预组的存活率高于非干预组,差异有统计学意义(χ2=4.754,P=0.029)。干预组体外循环时间为(172.83±125.22)min,非干预组为(277.45±160.58)min,差异无统计学意义(t=-1.460,P=0.157)。干预组的ECMO时间为(4.97±1.33)d,非干预组为(5.35±2.38)d,差异无统计学意义(t=-0.375,P=0.711)。非干预组的死亡原因较多,主要是低心排出量综合征(low cardiac output syndrome,LCOS)和呼吸系统并发症,多器官功能衰竭(multiple organ dysfunction syndrome,MODS)和心律失常。干预组死亡原因均为LCOS。

表4 先天性心脏病手术后残余解剖畸形患者的手术干预方法Table 4 Surgical interventions of residual anatomic malfor-mation in children with congenital heart disease 干预措施例数(n=6)B-T分流术(中央分流)1二尖瓣整形术1左肺动脉支架置入术+下腔静脉狭窄球囊扩张术1肺动脉环缩术2右室流出道重建术(管道)1
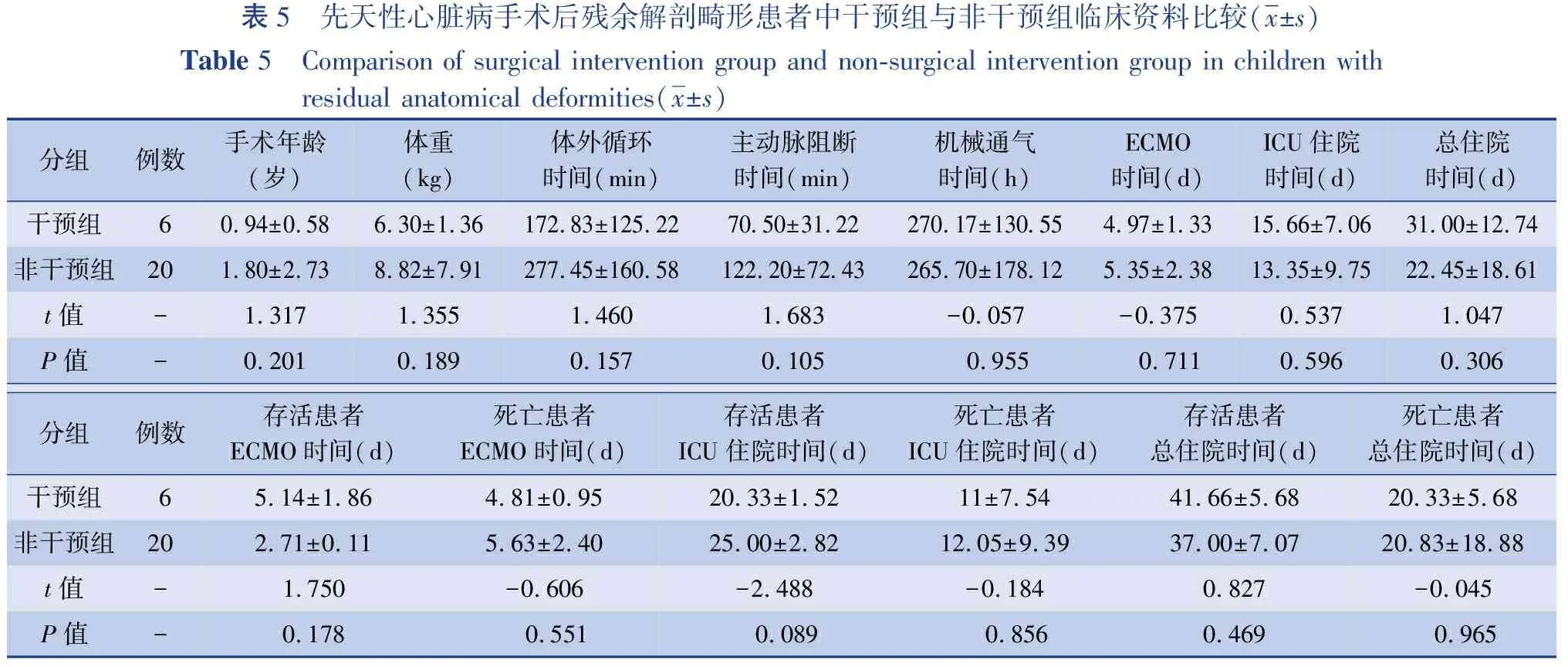
表5 先天性心脏病手术后残余解剖畸形患者中干预组与非干预组临床资料比较(x±s)Table 5 Comparison of surgical intervention group and non-surgical intervention group in children with residual anatomical deformities(x±s)分组例数手术年龄(岁)体重(kg)体外循环时间(min)主动脉阻断时间(min)机械通气时间(h)ECMO时间(d)ICU住院时间(d)总住院时间(d)干预组60.94±0.586.30±1.36172.83±125.2270.50±31.22270.17±130.554.97±1.3315.66±7.0631.00±12.74非干预组201.80±2.738.82±7.91277.45±160.58122.20±72.43265.70±178.125.35±2.3813.35±9.7522.45±18.61t值 -1.317 1.355 1.460 1.683 -0.057 -0.3750.5371.047P值-0.2010.1890.1570.105 0.955 0.7110.5960.306分组例数存活患者ECMO时间(d)死亡患者ECMO时间(d)存活患者ICU住院时间(d)死亡患者ICU住院时间(d)存活患者总住院时间(d)死亡患者总住院时间(d)干预组65.14±1.864.81±0.9520.33±1.5211±7.5441.66±5.6820.33±5.68非干预组202.71±0.115.63±2.4025.00±2.8212.05±9.3937.00±7.0720.83±18.88t值 -1.750 -0.606-2.488-0.1840.827-0.045P值-0.178 0.551 0.089 0.8560.469 0.965
讨 论
ECMO是支持严重心肺功能衰竭患者的最终手段,在小儿先心病手术后, 0.6%~2%的患者无法维持自身循环,需要ECMO支持[7,8]。据ELSO统计显示,心脏手术后新生儿和儿童ECMO支持的存活率分别为52.6%和51.6%,与本组病例新生儿和儿童ECMO支持的存活率分别为52.17%和46.78%类似[8,9]。
本组132例患者中,26例有残余解剖畸形,发生率为19.69%,这些患者的生存率仅19%,明显低于无残余解剖畸形的ECMO患者。同解剖矫治完全的病例相比,残余解剖畸形会导致血流动力学异常,心脏负荷增加或心肌供血减少,从而引起低心输出量和不能脱离CPB以及使用ECMO预后不佳的情况[4,10]。Agarwal等[4]研究表明心脏手术后接受ECMO的患者中有28%发生残余解剖畸形,残余解剖畸形患者的生存率为46%,且残余解剖畸形较非残余解剖畸形患者的ECMO支持时间明显延长。Howard等[10]研究显示心脏手术后接受ECMO的新生儿中有60%发现残余解剖畸形,残余解剖畸形新生儿的生存率为49%,进行手术干预的残余解剖畸形新生儿生存率为53%。由此可见,即使在先心病矫治手术中采用了经食道超声检查手术矫治,但仍然有部分患者存在残余解剖畸形,其原因可能包括: ①经食道超声检测的局限,使得部分畸形特别是心外畸形漏诊; ②手术结束时,心脏本身的运动尚未完全恢复,可掩盖部分畸形的表现; ③术后意外情况行心肺复苏按压时影响原先纠治的解剖结构; ④有些解剖畸形无法用手术方法纠正等。因此,对于先心病手术后使用ECMO的病例,即使在术中采用经食道超声进行了解剖学检查,依然要考虑存在残余解剖畸形的可能性[11,12]。
本研究26例残余解剖畸形中大部分病例可通过超声心动图发现,经胸超声心动图检查是一项针对ECMO患者的易于执行的床旁影像学检查[13],但是超声心动图对评估ECMO残余解剖畸形存在一定局限性,比如ECMO的使用会影响超声检查的清晰度,对心室流出道和心外血管的残余解剖畸形探查不准确[13]。心导管检查一直是先心病患者解剖和生理评估的金标准。然而心导管属于有创操作,且对设备要求较高,患者必须在ECMO支持下实施转运,这使得临床上更倾向于采用非侵入性的替代方案。根据美国心脏协会的建议,对严重怀疑有残余解剖畸形而非侵入性检查无法诊断时应该使用心导管检查[14]。本组有2例在ECMO支持下行心导管检查以明确诊断,1例残余梗阻病例直接进行了介入治疗。
本组26例存在解剖畸形的患者中,共有30处解剖畸形,以各类瓣膜问题发生最多,达13例;其次是残余梗阻,为12例;另有5例存在残余分流。有6例进行了再次手术矫治,其中有3例存活出院,手术干预组存活率达50%,与术后无解剖畸形患者存活率54%基本相同。这说明在ECMO支持过程中及时发现残余畸形,并积极进行干预,可以达到较理想的治疗效果。而未进行再次矫治的患者虽然撤离ECMO的比例并不低,也达到50%,但整体出院率仅10%。这说明即使在ECMO支持下,这部分患者心功能有一定恢复,且能耐受脱离ECMO支持的状态,但是由于解剖畸形的存在,撤离ECMO后心功能会逐渐恶化。 故ECMO支持不能改变先心病手术后存在残余解剖畸形患者的长期预后。
本组26例存在解剖畸形的患者中,死亡原因主要包括LCOS、呼吸系统并发症、心律失常和 MODS,以 LCOS 比例最高。LCOS是先心病手术后的主要并发症,也是主要死亡原因。术后发生 LCOS 的原因主要包括复杂先心病比例高,术前心功能不全,手术影响心功能状态,术中心肌缺血时间长或心肌保护不当,以及瓣膜问题、残余梗阻、残余分流等残余解剖畸形。残余解剖畸形患者中,呼吸系统并发症、心律失常和 MODS在死亡原因中占比较高,主要原因包括术前肺动脉高压,术后心功能受损和术后的全身炎症反应。除此之外还有手术年龄,CPB时间长[15],复杂先心病比例高等原因。根据患者不同的死亡原因,提前采取对应的措施可以降低病死率,对于本组死亡原因为LCOS的患者,可以通过积极纠治解剖畸形、加强围手术期心功能保护,制定个体化手术方案来降低LCOS,提高患者生存率[16,17]。对于死亡原因为呼吸系统并发症、心律失常和 MODS的患者,可以通过积极纠治解剖畸形、术前纠治肺高压、加强心功能保护、加强对炎症指标变化的监控、制定个性化手术方案来提高患者生存率。
本组病例中19.69%的患者发现残余解剖畸形,残余组的总病死率高达81%(21/26),其中残余解剖未进行干预的患者病死率为90%(18/20),而残余解剖进行手术干预的患者病死率为50%(3/6);相比非残余组病死率为46%,残余畸形组总病死率更高。在残余解剖畸形组中,进行手术干预的患者存活率较非干预组显著提高,手术干预组的存活率高达50%。因此对于残余解剖畸形应该积极予以矫治[4,18]。
在本研究手术干预的6例患者中,3例存活患者为双心室生理,3例死亡患者均为单心室生理。既往研究表明,ECMO支持的单心室患者比双心室患者存活率更低[19,20],残余病变伴或不伴有单心室生理的患者均应该进行积极的早期干预[4,18]。
本研究也存在一定局限性。第一,本研究受到单中心回顾性研究的固有局限。第二,较小的样本量限制了对于有无残余解剖畸形患者的结局差异的影响因素分析。第三,存在其他混杂因素影响。
综上,在先心病手术进行ECMO支持后,应该及早评估是否有残余解剖畸形,超声心动图是最方便的检查方式,但对于高度怀疑存在残余解剖畸形而非侵入性检查无法诊断时应该使用心导管检查。对于存在残余解剖畸形者,早期评估和干预可以改善其临床结局。

