地膜覆盖对黄土高原地区两种种植密度下玉米叶片代谢组的影响
牛 丽 白文波 李 霞 段凤莹 侯 鹏 赵如浪 王永宏 赵 明 李少昆 宋吉青,* 周文彬,*
地膜覆盖对黄土高原地区两种种植密度下玉米叶片代谢组的影响
牛 丽1,2,3白文波1李 霞2段凤莹2侯 鹏2赵如浪4王永宏4赵 明2李少昆2宋吉青1,*周文彬2,*
1中国农业科学院农业环境与可持续发展研究所 / 农业农村部农膜残留污染防治重点实验室, 北京 100081;2中国农业科学院作物科学研究所, 北京 100081;3中国农业大学水利与土木工程学院, 北京 100083;4宁夏农林科学院农作物研究所, 宁夏永宁 750105
在黄土高原地区, 对覆膜条件下玉米叶片代谢组变化规律的研究是探索覆膜增产生理机制的重要方面。本研究采用气相色谱-四极杆-飞行时间质谱(GC-QTOF)技术, 对2种覆膜方式(塑料膜覆盖和不覆盖)、2个密度(7.5×104株 hm–2和10.5×104株 hm–2)和2个品种(郑单958和先玉335)的吐丝期玉米叶片进行了代谢组学分析。从差异代谢物个数来看, 先玉335对覆膜的响应大于郑单958, 较高的种植密度缩小了覆膜与无覆膜处理间叶片代谢的差异。主成分分析表明, 覆膜处理和品种均对代谢物组成产生了重大影响。覆膜引起的代谢谱差异主要是由柠檬酸等有机酸和氨基酸造成的; 品种引起的代谢组差异主要是由辛酸等烷酸和酚类造成的。相关分析表明, 叶绿醇、白藜芦醇、葡萄糖-6-磷酸与玉米籽粒产量呈显著正相关关系, 而甘油与之呈显著负相关关系。在覆膜条件下, 与呼吸作用及清除光呼吸产物相关的缬氨酸、异亮氨酸及蛋氨酸, 与三羧酸循环相关的异柠檬酸以及可减轻光抑制的蛋氨酸、N-乙酰基天冬氨酸等代谢物的水平整体呈升高趋势。以上结果表明, 在覆膜条件下, 消除光呼吸产物及减少光抑制的相关代谢物的积累是叶片净光合速率提高的代谢基础; 抗氧化及能量代谢相关的代谢物在提高产量的过程中发挥了重要作用。
地膜覆盖; 叶片; 代谢组; 产量; 抗氧化; 玉米
近年来, 气候变化对世界主要农作物的产量产生了一些负面影响[1]。随着全球气候持续变暖, 干旱的发生频率将会增加[2]。为保证粮食安全, 满足人们日益增长的粮食需求, 农业生产需要迅速适应气候变化, 以减缓或消减气候变化带来的不良效应。适当的作物管理措施是实现这一目标的主要途经[3]。黄土高原是我国典型的干旱和半干旱气候区, 年均降雨量为250~600 mm, 当地农业以旱地雨养农业为主[4]。该区太阳辐射充足, 经常出现春季低温, 作物生育期内降雨不足且难以预测。因此, 低温、缺水和强蒸发是限制该地区作物生产的主要因素[5]。提高作物水分利用效率(water use efficiency, WUE)对当地农业的可持续发展和粮食安全至关重要[6]。在过去几十年中, 已经发展形成了多种农田管理措施来提高水分利用效率, 如雨水收集措施[7]、地膜(塑料薄膜)覆盖、农作物秸秆覆盖[8]、砾石覆盖[9]以及滴灌措施[10]等。地膜覆盖作为最有效的措施之一, 可提高雨养农业区作物的水分利用效率, 在玉米、小麦、棉花和马铃薯等作物上得到广泛应用[11-14]。
玉米是黄土高原的主要作物之一, 其种植面积占黄土高原耕地面积的27.3%[15]。近年来, 地膜覆盖因其减少土壤水分蒸发、提高土壤含水量和表土温度等作用已被广泛应用于该地区的玉米种植[16-18]。此外, 地膜覆盖可以通过增加阳光的反射率和膜下空气流动的阻力来改善土壤表面的微气候[19], 以及减少杂草和害虫的危害[20]。在干旱和半干旱地区, 前人对地膜覆盖在作物生产中的应用研究主要集中在土壤–植物–大气连续体(soil-plant-atmosphere continuum, SPAC)的水热传输情况、作物的生长发育、产量、品质和水分利用效率等指标的量化上。研究表明, 地膜覆盖通过提高土壤含水量和土壤温度, 提高了作物产量, 改善了作物品质, 同时提高了水分利用效率[11,21]。在生理水平上, 地膜覆盖条件下的作物比无地膜覆盖的作物表现出, 更高的叶绿素含量[21]、核酮糖-1,5-二磷酸羧化酶(RubisCO)活性[22]、抗氧化活性[23]、电子传递速率[24]和热耗散[21], 故具有较强的光合能力。
作物原初代谢与产量密切相关。近年来, 特定环境条件下作物代谢标记物筛选的研究引起了人们的关注[25-27]。前人采用289个玉米自交系对与玉米农艺性状相关的代谢组进行全基因组关联分析发现, 木质素前体含量与木质素含量、植株高度及干物质产量显著相关, 这表明代谢组可用来预测农艺性状, 建立基因型和表型之间的关联[25]。Witt等[26]研究表明, 玉米在干旱胁迫下, 氨基酸、糖、糖醇和三羧酸循环的中间体代谢物含量普遍增加, 这种趋势并没有因为品种耐旱性的改变而变化。水稻代谢组研究也鉴定到了抗旱性的代谢标记候选物丝氨酸、苏氨酸和苏糖酸[27]。大田中小麦和玉米的农艺性状和代谢数量性状位点定位在相同的基因组区域, 表明了代谢性状在品种选育中的重要作用[25,28]。
玉米产量既取决于叶片对籽粒的同化物供应(源), 也取决于籽粒容纳这些同化物的潜力(库)[29]。目前, 玉米抗逆品种的选育主要关注库潜力的提升[30],而源潜力提升机制仍需要进一步深入研究。水分胁迫影响叶片的生理和代谢, 尤其影响光合作用, 从而降低叶片的源能力[31]。与其他器官相比, 水分胁迫对叶片的代谢产物组成的影响最大[26]。叶片代谢和源能力密切相关, 故叶片代谢组与籽粒产量之间存在密切关系。在叶片结构上, 地膜覆盖条件下生长的玉米叶片, 具有更高的气孔密度, 因此具有较高的净光合速率[32]。密植是玉米增产的重要农艺措施, 但密植通常使玉米叶片叶绿体形态发生变化, 叶绿体及基粒数量减少, 叶绿素、含量降低, 净光合速率降低, 叶肉细胞的膜结构逐渐受损[33]。综上所述, 从代谢组学水平分析栽培措施对作物的影响, 可以系统地揭示特定栽培措施条件下作物产量形成的生理代谢基础, 获得产量的代谢标记物。然而, 地膜覆盖对作物代谢组的影响还鲜有报道。本文通过研究不同密度和品种的玉米叶片代谢组对地膜覆盖的响应, 以期探明地膜覆盖提高玉米产量和水分利用效率的代谢基础, 筛选出与产量密切相关的代谢标记物, 为黄土高原旱作区玉米栽培和品种选育提供理论依据和研究方向。
1 材料与方法
1.1 试验地点
田间试验于2018年在宁夏固原市原州区进行。该地属黄土高原丘陵地区(36°18'53''N, 106°22'20''E), 海拔1769 m, 属中温带半干旱气候区, 年平均降水量约为400 mm, 且季节分布不均, 约60%的降水集中在7月至9月。年日照时数、年平均气温和无霜期分别为2518.3 h、6.2°C和151 d。试验地土壤类型为褐土, 0~40 cm土层土壤容重为1.27 g cm−3, 土壤有机质7.86 g kg−1, 总氮0.81 g kg−1, 碱解氮55.6 mg kg−1, 速效磷12.8 mg kg−1, 速效钾158.0 mg kg−1。
1.2 试验设计和田间管理
试验采用裂区试验设计, 主区为覆膜方式, 裂区为种植密度, 裂裂区为品种。主区覆膜方式为: (1)宽(80 cm)窄(40 cm)行垄沟全膜覆盖(FM, 图1-A), (2) 宽(80 cm)窄(40 cm)行垄沟无覆盖(NM, 图1-B); 裂区种植密度为: (1) 低密度7.5×104株 hm–2; (2) 高密度10.5×104株hm–2; 裂裂区玉米品种为: (1)郑单958 (Zhengdan 958, ZD958); (2) 先玉335 (Xianyu 335, XY335)。郑单958和先玉335是在中国广泛种植的2个玉米栽培品种, 低密度7.5×104株 hm–2目前在中国许多地区被推荐种植, 而高密度10.5×104株hm–2通常可以获得更高的产量[34]。本试验以覆膜方式为基础, 设置不同的栽培品种和密度组合, 共包括以下8个处理: (1) FMZL, 地膜覆盖低密度种植的ZD958; (2) FMZH, 地膜覆盖高密度种植的ZD958; (3) FMXL, 地膜覆盖低密度种植的XY335; (4) FMXH, 地膜覆盖高密度种植的XY335; (5) NMZL, 无覆盖低密度种植的ZD958; (6) NMZH, 无覆盖高密度种植的ZD958; (7) NMXL, 无覆盖低密度种植的XY335; (8) NMXH, 无覆盖高密度种植的XY335。
玉米生长在宽窄行垄沟结构的沟中。A: FM, 宽(80 cm)窄(40 cm)行垄沟全膜覆盖; B: NM, 宽(80 cm)窄(40 cm)行垄沟无覆盖。
The maize was grown in the furrows of ridge-furrow construction with wide - narrow rows. A: FM, ridge-furrow construction with alternating wide (80 cm) and narrow (40 cm) ridges and full plastic film mulching; B: NM, ridge-furrow construction with alternating wide (80 cm) and narrow (40 cm) ridges and no mulching.
供试小区行长9.6 m, 宽4 m, 小区面积38.4 m2, 每个处理设3次重复, 共24个小区。在取样和测量时, 将每个小区1 m的边缘排除在外。试验前对地块进行旋耕、平整, 播种前9 d 进行施肥、起垄和地膜覆盖。于2018年4月27日, 用点播器将2粒玉米种子播于沟槽底部5 cm深处。播种后1个月进行间苗, 每穴留1株幼苗。播种前施用尿素、磷酸氢二铵和硫酸钾作为基肥, 折合纯N 123 kg hm−2, P2O5138 kg hm−2, K2O 75 kg hm−2。拔节期追施尿素和磷酸氢二铵以防止养分胁迫, 折合纯氮200 kg hm−2, P2O569 kg hm−2。按照当地常规管理措施进行杂草和病虫害防控。玉米整个生育期内除自然降水外无人工灌水, 玉米于2018年10月3日收获。
1.3 取样与测量方法
1.3.1 叶片代谢组测定 于玉米吐丝期, 每小区随机选择6株玉米植株, 在晴朗无云的上午9:00—9:30, 取穗位叶快速放入液氮中, 用干冰运回实验室, 存放于-80°C超低温冰箱。将约50 mg冷冻研磨的玉米叶片样品与700 μL甲醇(100%)和30 μL核糖醇内标储备液(0.2 mg mL–1)混合后, 在70°C恒温混合器(Eppendorf)中震荡15 min。以14,000转 min–1离心10 min后, 将上清液转移至新离心管中。加入400 μL氯仿和800 μL水, 然后将离心管小心涡旋15 s, 以14,000转 min–1离心15 min。从上部极性相中吸取2等份50 μL上清液至1.5 mL新离心管中, 放置真空浓缩仪(Eppendorf)室温干燥过夜。制备完成的极性初级代谢物经衍生化后, 通过气相色谱-四极杆-飞行时间质谱仪(GC-QTOF)进行代谢组分析[35]。所得的质谱保留时间(RI)使用TagFinder软件以及数据库Golm Metabolome Database (GMD)进行代谢物的鉴定及量化[36-37]。原始检测丰度通过内标(核糖醇)和样品鲜重进行标准化。将所有代谢组学数据除以所有品种和处理中每种代谢物的中值对数据进行归一化, 并对得到的数值进行log2转化, 得到的数据用于进一步的分析。筛选组间差异代谢物时采用单维分析和多维分析相结合的方法。在正交偏最小二乘方-判别分析(OPLS-DA分析)中, 变量权重值(VIP)可用来表示各代谢物的含量对组间样本分类判别的解释能力和影响强度, 一般认为VIP>1的代谢物为差异代谢物。同时利用T检验对组间差异代谢物进行检验。故筛选差异代谢物的标准为VIP>1且-value<0.05。采用具有数据分析、数据可视化及数据处理功能的软件MultiExperiment Viewer (version 4.8.1, the Institute of Genomic Research, Rockville, MD, USA)基于Pearson相关性进行层次聚类。使用R software (http://www.r-project.org/; R package pca Methods)进行概率主成分分析(PCA)。使用SPSS 12.5 (SPSS Inc., Chicago, IL, USA)进行相关性分析。
1.3.2 单株产量 在成熟期, 每个小区排除1 m的边界, 随机选取15株收获测产。以14%的籽粒含水量来计算籽粒产量, 用整株干重来表示生物量。
2 结果与分析
2.1 地膜覆盖对玉米叶片代谢组的影响
将经过标准化且log2对数转换后的代谢组数据进行主成分分析(PCA)以得到不同处理间代谢组差异的总体轮廓。由图1可知, 第一主成分(PC1)和第二主成分(PC2)共同贡献了总方差的48.1%。其中ZD958和XY335两个品种间的差异主要是通过PC1来区分(34.5%), 覆膜和无覆膜处理的玉米叶片代谢组差异主要通过PC2被区分开来(13.6%), 而不同种植密度间的差异不明显。以上结果表明代谢组之间的差异主要来源于品种间差异以及覆膜和无覆膜处理的差异(图2-A)。
载荷代表不同代谢物对于每个主成分的贡献, 较高的正载荷和负载荷分别代表相应的代谢物与某一主成分的得分具有较高的正负相关性。图2-B~C显示了PC1 (区分品种)和PC2 (区分覆膜和无覆膜处理)的前10个正负载荷。PC1正载荷的代谢物在ZD958中水平较高, 而在XY335中水平较低, 而负载荷的代谢物水平表现出相反的趋势。同时, PC2正载荷的代谢物水平在覆膜处理中较高, 在无覆膜处理中较低, 而负载荷的代谢物水平表现出相反的趋势。在第一主成分上导致代谢谱分离的代谢物主要有辛酸等烷酸和对苯二酚等酚类, 在第二主成分上导致代谢组分离的代谢物主要有柠檬酸等有机酸和蛋氨酸等氨基酸。
为了深入了解不同处理对玉米叶片代谢组的影响, 通过对覆膜或不覆膜处理、不同密度及不同品种之间进行两两比较, 以VIP >1且< 0.05为阈值, 筛选出具有显著差异的代谢物。从差异代谢物数量来看, 地膜覆盖因素和品种因素造成的差异代谢物数目较多, 而密度因素造成的差异代谢物的数目较少。XY335对地膜覆盖的响应大于ZD958。密度对代谢物的影响在覆膜条件下较大(图3)。
ZD958和XY335对覆膜的响应存在一定的共性, 但这种共性会因密度而异。低密度条件下, 与无覆膜相比, ZD958和XY335覆膜处理后产生25个共同差异代谢物; 高密度条件下, 这 2个品种在覆膜后与无覆膜相比产生14个共同的差异代谢物。在低密度和高密度情况下, ZD958品种进行覆膜处理时产生了26个共同的差异代谢物; 而XY335品种在这2种密度下进行覆膜处理时, 产生了23个共同的差异代谢物。综合不同密度和不同品种的共性, 覆膜会引起10种代谢物的差异, 其中对苯二酚、3,4-二羟基苯甲酸、核糖酸、香草酸、尿嘧啶和1,3-二羟基吡啶含量降低, 而缬氨酸、蛋氨酸、异柠檬酸和N-乙酰基天冬氨酸含量升高(图4)。
A: 第一主成分(PC1)和第二主成分(PC2)的得分图; B: PC1前十位正载荷和负载荷的代谢物; C: PC2前十位正载荷和负载荷的代谢物。FMZL: 地膜覆盖低密度种植的ZD958; FMZH: 地膜覆盖高密度种植的ZD958; FMXL: 地膜覆盖低密度种植的XY335; FMXH: 地膜覆盖高密度种植的XY335; NMZL: 无覆盖低密度种植的ZD958; NMZH: 无覆盖高密度种植的ZD958; NMXL: 无覆盖低密度种植的XY335; NMXH: 无覆盖高密度种植的XY335。其中绿色色块代表较低的含量, 红色色块代表较高的含量。
A: scores of the first principal component (PC1) and the second principal component (PC2). B: the top ten negative and metabolites of PC1. C: the top ten negative and metabolites of PC2. FMZL: ZD958 with low planting density and plastic film mulching; FMZH: ZD958 with high planting density and plastic film mulching; FMXL: XY335 with low planting density and plastic film mulching; FMXH: XY335 with high planting density and plastic film mulching; NMZL: ZD958 with low planting density and no mulching; NMZH: ZD958 with high planting density and no mulching; NMXL: XY335 with low planting density and no mulching; NMXH: XY335 with high planting density and no mulching. Among them, green represents lower expression abundance, and red represents higher expression abundance.
处理同图2。Treatments are the same as those given in Fig. 2.
以低密度种植的ZD958品种为例, 地膜覆盖使41种代谢物的含量发生了变化。对这些代谢物进行层次聚类分析发现, 代谢物的含量在地膜覆盖处理和无覆盖处理之间存在着较大的差异。此外, 在不同品种和密度之间也存在一定的差异(图5)。根据不同处理间代谢物含量的变化趋势, 可将代谢物分为以下3类: 第一类是在进行地膜覆盖处理后含量升高的代谢物, 主要为氨基酸、糖酵解过程产物及抗氧化物质, 包括缬氨酸、蛋氨酸、葡萄糖-6-磷酸、异柠檬酸、磷酸烯醇式丙酮酸、白藜芦醇、叶绿醇和异亮氨酸等物质。总体来说, XY335的此类代谢物含量低于ZD958; 高密度条件下此类代谢物的含量低于低密度条件。第二类是在进行地膜覆盖处理后, 含量变化不大的代谢物, 主要为一些糖类, 包括岩藻糖、3,6-脱水-D-葡萄糖和核糖酸, 总体趋势为XY335的含量高于ZD958。第三类是在进行地膜覆盖处理后含量降低的代谢物, 主要为有机酸和渗透调节相关的物质, 包括柠檬酸、谷氨酸、琥珀酸、对苯二酚、甘油和肌酐等物质。在地膜覆盖条件下, XY335的此类代谢物含量高于ZD958; 高密度条件下的此类代谢物含量高于低密度。在无地膜覆盖条件下, XY335的此类代谢物含量低于ZD958。
处理同图2。数字表示2组处理间具有显著差异的代谢物数目。
Treatments are the same as those given in Fig. 2. The numbers indicate the numbers of metabolites with significant differences between the two treatments.
处理同图2。其中绿色色块代表较低的含量, 红色色块代表较高的含量。
Treatments are the same as those given in Fig. 2. Among them, green represents lower expression abundance, and red represents higher expression abundance.
2.2 地膜覆盖对玉米叶片代谢网络的影响
以低密度种植的ZD958品种为例, 在主要代谢通路中, 覆膜使16种已注释代谢物的含量产生了变化。综合所有处理来看, 在覆膜条件下整体上调的代谢物有8个, 分别是葡萄糖-6-磷酸、蛋氨酸、磷酸烯醇丙酮酸、异亮氨酸、多巴、缬氨酸、N-乙酰基天冬氨酸和异柠檬酸。其中, 葡萄糖-6-磷酸和磷酸烯醇丙酮酸是和糖酵解过程密切相关的代谢物。在覆膜条件下整体下调的代谢物有8个, 分别是甘油、O-磷酸-L-丝氨酸、柠檬酸、对苯二酚、琥珀酸、N-乙酰鸟氨酸、肌酐和谷氨酸, 其中肌酐和脯氨酸代谢相关, 而甘油和脯氨酸都属于渗透调节物质; O-磷酸-L-丝氨酸与光呼吸的产物丝氨酸可以相互转化(图6)。
2.3 玉米产量与代谢物水平的相关性分析
对单株籽粒产量及产量构成的分析表明, 地膜覆盖条件下, ZL、ZH、XL和XH的单株籽粒产量分别比无覆盖条件下增加了12.70%、22.14%、23.37%和4.87%。从产量组成要素来看, 地膜覆盖对产量的提高主要是通过增加每穗籽粒数来实现的, 其对ZL、ZH、XL和XH每穗籽粒数的提高幅度分别为17.02%、10.61%、16.87%和18.32%。方差分析表明, 覆膜、密度和品种均对单株产量产生显著影响。覆膜和密度、密度和品种及覆膜、密度和品种三者对单株籽粒产量的影响存在交互作用。对于郑单958品种, 覆膜对高密度下的单株籽粒产量的提高幅度较大, 而对于先玉335品种, 则是对低密度下单株籽粒产量的提高幅度较大(表1)。
红色圆代表在地膜覆盖处理下总体上调的物质, 绿色圆代表在地膜覆盖处理下总体下调的物质。8个不同的色块从左到右依次代表FMZL、FMZH、FMXL、FMXH、NMZL、NMZH、NMXL、NMXH, 处理同图2。其中绿色色块代表较低的含量, 红色色块代表较高的含量。
Red circles represent substances that are generally up-regulated under plastic film mulching treatment, and green circles represent substances that are generally down-regulated under plastic film mulching treatment. Eight different color blocks from left to right represent FMZL, FMZH, FMXL, FMXH, NMZL, NMZH, NMXL, and NMXH, respectively. Treatments are the same as those given in Fig. 2. Among them, green block represents lower expression abundance, and red represents higher expression abundance.
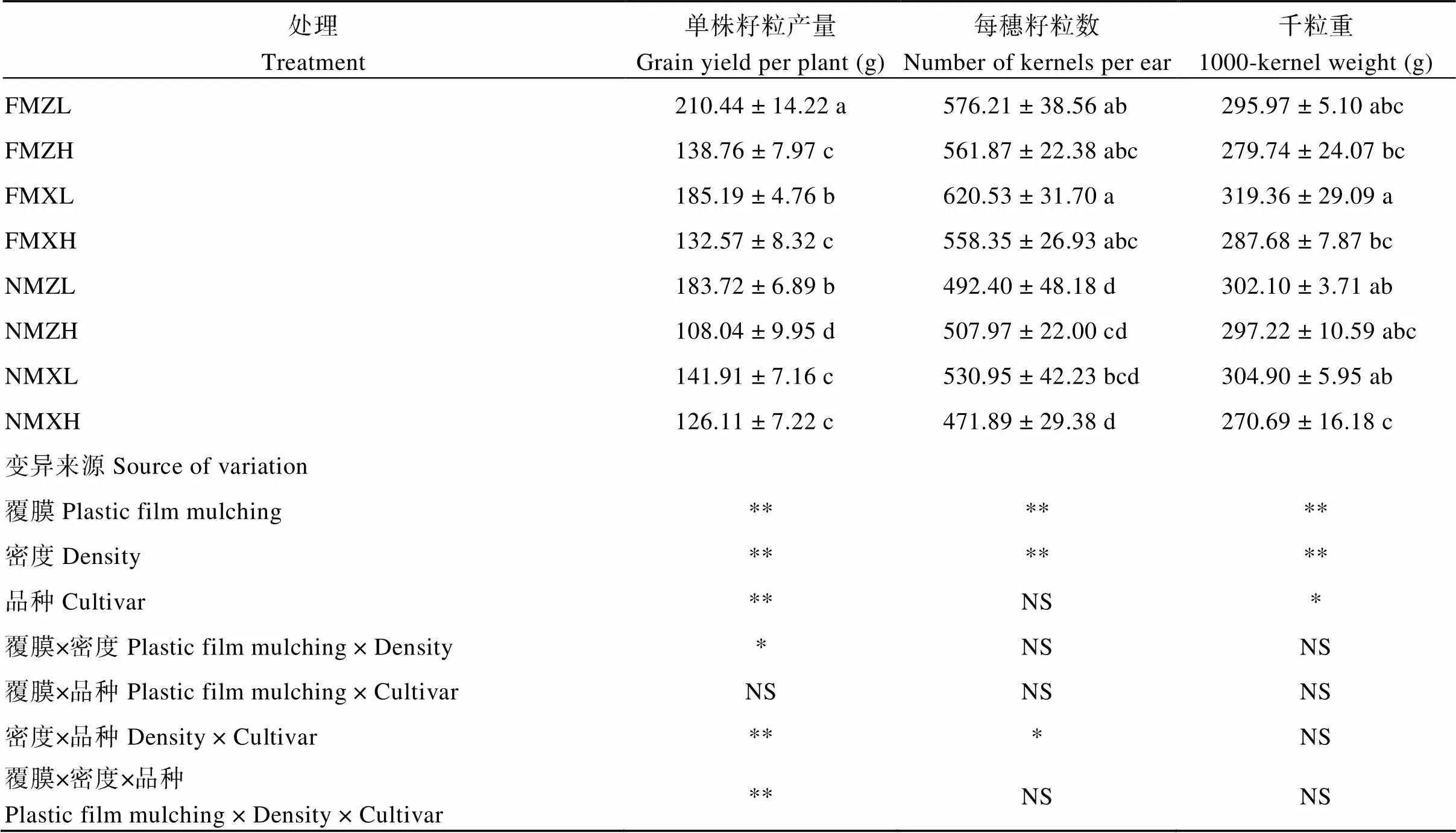
表1 玉米单株籽粒产量及产量构成要素
数据代表平均值±标准差, 采用Duncan’s多重比较, 每一列中不同的小写字母表示处理之间在0.05水平上差异显著。处理同图2; 方差分析表中*表示显著差异(*< 0.05; **< 0.01); NS, 不显著。
Values represent means ± SD, values within a column followed by different lowercase letters indicate significant differences at< 0.05 by Duncan’s multiple range test. Treatments are the same as those given in Fig. 2. * and ** indicate significant differences at the0.05 and 0.01 probability levels, respectively. NS, not significant.
进一步将玉米籽粒产量及生物量与其代谢物含量进行相关性分析, 以期筛选出与产量直接相关的代谢标记物。结果表明, 白藜芦醇、叶绿醇和葡萄糖-6-磷酸与玉米籽粒产量呈显著正相关关系, 而甘油与之呈显著负相关关系(图7)。此外, 甘油与玉米生物量呈显著负相关关系(图8)。说明在产量较高的玉米植株中, 白藜芦醇、叶绿醇和葡萄糖-6-磷酸这3种代谢物的含量也高度积累, 其可作为潜在的产量相关代谢标记物, 用于优良品种的选育。
3 讨论
3.1 农艺措施与代谢组之间的关系
已有研究提出采用相关标记物的策略用于分子标记辅助育种[38]。基于GC-MS的代谢组具有高通量、稳健性以及分析主要代谢物的能力[39], 在分子标记辅助育种方面具有良好的前景。本文采用这一方法对不同处理的玉米叶片代谢组进行了研究, 在覆膜、密度和品种这3个因素中, 对代谢组影响最大的是品种, 其次是覆膜, 影响最弱的是密度(图2和图3)。这从代谢层面说明了选育抗逆高产品种的重要性。从差异代谢物的数目来看, 较高的种植密度缩小了覆膜与无覆膜处理间的差异(图3和图4), 这可能是由于较高的种植密度使单株玉米叶片光合能力变差、膜结构受损, 从而导致代谢变差导致[33]。长期以来, 人们认为氨基酸积累是对非生物胁迫的标志性反应[40]。干旱胁迫期间氨基酸谱的变化归因于各种机制, 包括蛋白质合成减少[41], 蛋白质降解增加[42], 以及受底物和酶活性调节的生物合成。氨基酸在植物抗逆性中起着重要的作用[43], 研究者在干旱胁迫[39]和渗透胁迫[42]条件下的植物叶片中发现许多氨基酸的积累。在本研究中, 无地膜覆盖条件下, 玉米叶片普遍积累的氨基酸有O-磷酸-L-丝氨酸、N-乙酰基鸟氨酸和谷氨酸(图5)。O-磷酸-L-丝氨酸可以和丝氨酸相互转化, 而丝氨酸是光呼吸的产物, 可在一定程度上反映光呼吸的强弱[44]。叶片中O-磷酸-L-丝氨酸的积累表明叶片光呼吸较强。N-乙酰基鸟氨酸是从谷氨酸到精氨酸的酶促生物合成过程中间体。谷氨酸在植物体内含氮化合物的转化中具有重要作用, 它可以转化为脯氨酸。在无地膜覆盖的玉米叶片中观察到了谷氨酸的积累(图5), 一方面谷氨酸可作为渗透调节物质起作用, 另一方面谷氨酸可作为前体物质转化成脯氨酸[45]。脯氨酸可以调节渗透压, 清除自由基, 作为亲水物质减少蛋白和酶类的降解, 从而缓解干旱对叶片细胞的伤害[46]。
和分别是通过Pearson相关分析得出的相关系数和值。
andare the correlation coefficient and-value from Pearson correlation analysis, respectively.
和分别是通过Pearson相关分析得出的相关系数和值。
andare the correlation coefficient and-value from Pearson correlation analysis, respectively.
3.2 地膜覆盖使叶片胁迫保护氨基酸积累、光抑制减轻
支链氨基酸(缬氨酸和异亮氨酸)以及其他与支链氨基酸共享合成途径的氨基酸(蛋氨酸)通常会在各种非生物胁迫条件下积累[39]。它们被认为是相溶性溶质[47]以及呼吸电子传递链中的电子供体[48]。本研究中, FM处理下缬氨酸、异亮氨和蛋氨酸的含量增加(图5), 这与FM处理下叶片呼吸作用的增加有关[32]。琥珀酸是连接三羧酸循环和谷氨酸分流的代谢物[49], 因此这2种途径之间的平衡可能影响琥珀酸的含量。在FM处理下, 琥珀酸和谷氨酸的含量均呈现降低的趋势, 而三羧酸循环中异柠檬酸含量呈升高的趋势(图5和图6), 表明在FM处理下叶片可能通过降低谷氨酸代谢来维持三羧酸循环。FM处理使玉米叶片中蛋氨酸含量普遍增加(图5和图6), 蛋氨酸可能与胁迫保护有关, 干旱胁迫条件下, 叶片蛋氨酸含量较高的小麦品种具有较高的产量[50], 由此可见, 蛋氨酸对FM处理下玉米产量的提高也有一定的贡献。
在蛋氨酸和其他天冬氨酸衍生氨基酸的生物合成过程中会消耗还原力三磷酸腺苷(ATP)和还原型辅酶I (II)——NAD(P)H, 这有利于维持能量稳态, 防止光系统II (PSII)因过度还原而产生氧化应激损伤(即光抑制)[50-51]。天冬氨酸家族氨基酸的生物合成可能会起到一种能量库的作用来缓解叶绿体能量失衡。研究表明, 高丝氨酸脱氢酶是控制天冬氨酸从天冬酰胺向天冬氨酸家族氨基酸生物合成的酶, 在干旱胁迫条件下, 叶绿体NADPH/NADP+比值通常会升高, 此时苏氨酸对该酶的变构反馈抑制显著减轻从而可以消耗过多的NADPH[52]。在FM处理条件下, 蛋氨酸和N-乙酰基天冬氨酸含量增加(图5和图6), 这意味着FM减轻了叶片的光抑制, 从而提高了叶片的净光合速率[32]。蛋氨酸是丝氨酸的下游产物, 它的生物合成对植物的另一种应激保护机制可能是对光呼吸产物丝氨酸的消耗, 蛋氨酸合成会使光呼吸的反应平衡向右移动(远离2-磷酸乙醇酸、乙醇酸、乙醛酸、甘氨酸和丝氨酸), 从而维持卡尔文循环, 抑制光呼吸中间体(2-磷酸乙醇酸、乙醇酸和乙醛酸)的产生[50], 在本研究中, 地膜覆盖条件下玉米叶片中O-磷酸-L-丝氨酸的含量降低(图5和图6)而该物质可与丝氨酸相互转化, 这进一步表明地膜覆盖使玉米叶片光呼吸减弱。
3.3 产量与代谢物之间的相关性
筛选代谢标记物用于大田作物产量的指示物对抗逆品种的选育具有重要意义[53-54]。在冷胁迫条件下, 玉米的生物量与叶片棉子糖含量呈负相关[53]; 在花期干旱胁迫条件下, 玉米叶片中的甘氨酸和肌醇含量与玉米籽粒呈显著负相关[54]。在本试验中, 和玉米产量密切相关的代谢物主要包括: 叶绿醇、白藜芦醇、葡萄糖-6-磷酸和甘油(图7)。相比于无覆盖处理, 地膜覆盖提高了作物产量[32]。白藜芦醇可以清除活性氧自由基, 减轻膜脂的过氧化程度[55], 从而有利于产量的提高(表1)。叶绿醇作为叶绿素的组分, 可在一定程度上反映叶绿素的变化趋势。此外, 叶绿醇也具有抗氧化作用[56]。作为糖酵解和磷酸戊糖途径的重要参与者, 葡萄糖-6-磷酸在为生命活动提供能量的过程中发挥了重要作用。因此, 以上代谢物可能在栽培措施带来的增产中发挥了重要作用, 是不同栽培措施条件下与产量相关的重要代谢指示物。通过逐步回归分析, 得到了籽粒产量(GY)与白藜芦醇含量(MLRes)的模型关系GY=120.6× MLRes-52.6 (=0.829,=0.011)。由于样品是从难以控制生长条件的大田获得, 会受到多种因素的干扰, 通常认为绝对值在0.72到0.88之间,低于0.05或0.01是高度可信的, 之前在大田中进行的一些代谢组研究也得到了类似的结果[27]。甘油可防止羟基自由基的产生, 清除活性氧中间体, 从而保护细胞膜免受氧化伤害, 在胁迫条件下是一种理想的胞内抗胁迫保护剂[57]。在本研究中, 甘油含量与籽粒产量和生物量呈显著负相关(图8), 这表明, 较少的抗胁迫保护剂的生成有利于产量的提高。目前来看, 代谢组研究通常用于评估代谢物组成中明显的自然差异, 即用于寻找代谢标记物的植物通常处于同一种生长条件下[25-27]。然而, 加入其他的因素会不会使原来的产量代谢标记物发生改变尚不清楚。本研究中的栽培管理措施涉及地膜覆盖、密度和品种, 这些因素带来的差异不仅仅属于自然差异, 在这种情况下鉴定到的代谢物与产量之间的相关性则具有较高的保守性; 另一方面, 此类研究也可为栽培措施调控作物生理代谢的相关研究提供一定的参考。
4 结论
本文对黄土高原地区2个覆膜处理、2个种植密度及2个品种的玉米叶片代谢组进行了研究。先玉335对覆膜的响应程度(差异代谢物数目)大于郑单958, 较高的种植密度缩小了覆膜与无覆膜处理间叶片代谢组的差异。另外, 在覆膜条件下, 可消除光呼吸产物及可减轻光抑制的蛋氨酸、N-乙酰基天冬氨酸等代谢物的水平整体呈升高趋势, 这一现象在代谢水平上解释了覆膜条件下玉米叶片净光合速率提高的原因, 进一步丰富了覆膜提高玉米产量的生理机制。通过相关性分析, 发现与籽粒产量及生物量密切相关的代谢标记物主要是与抗氧化作用及能量代谢相关的代谢物, 从而揭示了此类代谢物在提高产量过程中的重要贡献。
[1] Lobell D B, Schlenker W, Costa-Roberts J. Climate trends and global crop production since 1980., 2011, 333: 616–620.
[2] Sherwood S, Fu Q. Climate change: a drier future?, 2014, 343: 737–739.
[3] Iglesias A, Garrote L. Adaptation strategies for agricultural water management under climate change in Europe., 2015, 155: 113–124.
[4] Li F M, Wang P, Wang J, Xu J Z. Effects of irrigation before sowing and plastic film mulching on yield and water uptake of spring wheat in semiarid Loess Plateau of China., 2004, 67: 77–88.
[5] Li S X, Wang Z H, Malhi S S, Li S Q. Nutrient and water management effects on crop production, and nutrient and water use efficiency in dryland areas of China., 2009, 102: 223–265.
[6] Liu Q F, Chen Y, Liu Y, Wen X X, Liao Y C. Coupling effects of plastic film mulching and urea types on water use efficiency and grain yield of maize in the Loess Plateau, China., 2016, 157: 1–10.
[7] Mzirai O B, Tumbo S D. Macro-catchment rainwater harvesting systems: challenges and opportunities to access runoff., 2010, 7: 789–800.
[8] 张万恒, 张恒嘉, 王泽义, 高佳. 秸秆覆盖方式对西北旱作马铃薯产量效益的影响. 农业工程, 2018, 8(12): 85–88. Zhang W H, Zhang H J, Wang Z Y, Gao J. Effect of straw mulching on yield of potato in drought region of Northwest China., 2018, 8(12): 85–88 (in Chinese with English abstract).
[9] 唐学芬, 赵文举, 李宗礼, 郁文. 压砂地土壤盐分空间变异规律. 水土保持通报, 2016, 36(3): 18–23. Tang X F, Zhao W J, Li Z L, Yu W. Variation pattern of soil Salinity of gravel-sand mulched field., 2016, 36(3): 18–23 (in Chinese with English abstract).
[10] 李憑峰, 谭煌, 王嘉航, 杨培岭. 滴灌水肥条件对樱桃产量、品质和土壤理化性质的影响. 农业机械学报, 2017, 48(7): 236–246. Li P F, Tan H, Wang J, Yang P L. Effects of drip irrigation water and fertilizer conditions on cherry yield, quality and soil physical and chemical properties., 2017, 48(7): 236–246 (in Chinese with English abstract).
[11] Zhang X D, Yang L C, Xue X K, Kamran M, Ahmad I, Dong Z Y, Liu T N, Jia Z K, Zhang P, Han Q F. Plastic film mulching stimulates soil wet-dry alternation and stomatal behavior to improve maize yield and resource use efficiency in a semi-arid region., 2019, 233: 101–113.
[12] 王星垚, 李援农, 银敏华, 徐袁博, 任全茂, 徐路全. 不同地膜对土壤水热状况和冬小麦植株氮素的影响. 节水灌溉, 2018, (2): 40–46. Wang X Y, Li Y N, Yin M H, Xu Y B, Ren Q M, Xu L Q. Effects of different mulch films on soil hydrothermal regimes and the plant nitrogen accumulation and translocation of winter wheat., 2018, (2): 40–46 (in Chinese with English abstract).
[13] 李昊, 李世平, 南灵, 李河, 郭清卉. 中国棉花地膜覆盖产量效应的meta分析. 农业机械学报, 2017, 48(7): 228–235. Li H, Li S P, Nan L, Li H, Guo Q H. Meta-analysis of effect of plastic film mulching on cotton yield in China., 2017, 48(7): 228–235 (in Chinese with English abstract).
[14] Hou F Y, Dong S X, Xie B T, Zhang H Y, Li A X, Wang Q M. Mulching with plastic film improved the root quality of summer-sown sweet potato ((L.) Lam.) in Northern China., 2019, 18: 982–991.
[15] 薛吉全, 张仁和, 李凤艳, 张兴华. 陕西玉米育种现状、问题与对策. 玉米科学, 2008, 16(2): 144–146. Xue J Q, Zhang R H, Li F Y, Zhang X H. Current status, problem and strategy of maize breeding in Shananxi Province., 2008, 16(2): 139–141 (in Chinese with English abstract).
[16] Gan Y T, Siddique K H M, Turner N C, Li X G, Niu J Y, Yang C, Liu L P, Chai Q. Ridge-furrow mulching systems-an innovative technique for boosting crop productivity in semiarid rain-fed environments., 2013, 118: 429–476.
[17] Hou P, Cui Z L, Bu L D, Yang H S, Zhang F S, Li S K. Evaluation of a modified hybrid-maize model incorporating a newly developed module of plastic film mulching., 2014, 54: 2796–2804.
[18] Wang Y J, Xie Z K, Malhi S S, Vera C L, Zhang Y B, Guo Z H. Effects of gravel-sand mulch, plastic mulch and ridge and furrow rainfall harvesting system combinations on water use efficiency, soil temperature and watermelon yield in a semi-arid Loess Plateau of northwestern China., 2011, 101: 88–92.
[19] Mo F, Wang J Y, Zhou H, Luo C L, Zhang X F, Li X Y, Li F M, Xiong L B, Kavagi L, Nguluu S N, Xiong Y C. Ridge-furrow plastic-mulching with balanced fertilization in rainfed maize (L.): an adaptive management in east African Plateau., 2017, 236: 100–112.
[20] Mckenzie C L, Lapointe S L, Duncan L W. Landscape fabric as a physical barrier to neonate(Coleoptera: Curculionidae)., 2001, 84: 721–722.
[21] Wang C B, Wang H, Zhao X M, Chen B H, Wang F L. Mulching affects photosynthetic and chlorophyll a fluorescence characteristics during stage III of peach fruit growth on the no mulching semiarid Loess Plateau of China.(Amsterdam), 2015, 194: 246–254.
[22] Hou F Y, Zhang L M, Xie B T, Dong S X, Zhang H Y, Li A X, Wang Q M. Effect of plastic mulching on the photosynthetic capacity, endogenous hormones and root yield of summer-sown sweet potato ((L.) Lam.) in Northern China., 2015, 37: 1–10.
[23] Ali S, Xu Y Y, Jia Q M, Ahmad I, Ma X C, Henchiri M, Ren X L, Zhang P, Cai T, Zhang J H, Jia Z K. Ridge-furrow mulched with plastic film improves the anti-oxidative defence system and photosynthesis in leaves of winter wheat under deficit irrigation., 2018, 13: e0200277.
[24] Ali S, Xu Y Y, Jia Q M, Ma X C, Ahmad I, Adnan M, Gerard R, Ren X L, Zhang P, Cai T, Zhang J H, Jia Z K. Interactive effects of plastic film mulching with supplemental irrigation on winter wheat photosynthesis, chlorophyll fluorescence and yield under simulated precipitation conditions., 2018, 207: 1–14.
[25] Riedelsheimer C, Lisec J, Czedik-Eysenberg A, Sulpice R, Flis A, Grieder C, Altmann T, Stitt M, Willmitzer L, Melchinger A E. Genome-wide association mapping of leaf metabolic profiles for dissecting complex traits in maize., 2012, 109: 8872–8877.
[26] Witt S, Galicia L, Lisec J, Cairns J, Tiessen A, Araus J L, Palacios-Rojas N, Fernie A R. Metabolic and phenotypic responses of greenhouse-grown maize hybrids to experimentally controlled drought stress., 2012, 5: 401–417.
[27] Degenkolbe T, Do P T, Kopka J, Zuther E, Hincha D K, Köhl K I. Identification of drought tolerance markers in a diverse population of rice cultivars by expression and metabolite profiling., 2013, 8: e63637.
[28] Hill C B, Taylor J D, Edwards J, Mather D, Langridge P, Bacic A, Roessner U. Detection of QTL for metabolic and agronomic traits in wheat with adjustments for variation at genetic loci that affect plant phenology., 2015, 233: 143–154.
[29] Jones R J, Simmon S R. Effect of altered source-sink ratio on growth of maize kernels., 1983, 23: 129–134.
[30] Tollenaar M, Lee E A. Dissection of physiological processes underlying grain yield in maize by examining genetic improvement and heterosis., 2006, 51: 399–408.
[31] Osakabe Y, Yamaguchi-Shinozaki K, Shinozaki K, Tran L P. ABA control of plant macroelement membrane transport systems in response to water deficit and high salinity., 2014, 202: 35–49.
[32] Niu L, Yan Y, Hou P, Bai W, Zhao R, Wang Y, Li S, Du T, Zhao M, Song J, Zhou W. Influence of plastic film mulching and planting density on yield, leaf anatomy, and root characteristics of maize on the Loess Plateau., 2020, 8: 548–564.
[33] Ren B Z, Liu W, Zhang J W, Dong S T, Liu P, Zhao B. Effects of plant density on the photosynthetic and chloroplast characteristics of maize under high-yielding conditions., 2017, 104: 12.
[34] 明博, 谢瑞芝, 侯鹏, 李璐璐, 王克如, 李少昆. 2005–2016年中国玉米种植密度变化分析. 中国农业科学, 2017, 50: 1960–1972. Ming B, Xie R Z, Hou P, Li L L, Wang K R, Li S K. Changes of maize planting density in China. 2017, 50: 1960–1972 (in Chinese with English abstract).
[35] Glaubitz U, Erban A, Kopka J, Hincha D K, Zuther E. High night temperature strongly impacts TCA cycle, amino acid and polyamine biosynthetic pathways in rice in a sensitivity-dependent manner., 2015, 66: 6385–6397.
[36] Kopka J, Schauer N, Krueger S, Birkemeyer C, Usadel B, Bergmuller E, Dormann P, Weckwerth W, Gibon Y, Stitt M, Willmitzer L, Fernie A R, Steinhauser D. GMD@CSB.DB: the golm metabolome database., 2005, 21: 1635–1638.
[37] Hummel J, Strehmel N, Selbig J, Walther D, Kopka J. Decision tree supported substructure prediction of metabolites from GC-MS profiles., 2010, 6: 322–333.
[38] Jannink J L, Lorenz A J, Iwata H. Genomic selection in plant breeding: from theory to practice., 2010, 9: 166–177.
[39] Obata T, Fernie A R. The use of metabolomics to dissect plant responses to abiotic stresses., 2012, 69: 3225–3243.
[40] Stewart G R, Larher F. Accumulation of Amino Acids and Related Compounds in Relation to Environmental Stress. In: Miflin B J, eds. Amino Acids and Derivatives. New York: Academic Press, 2001. pp 609–635.
[41] Good A G, Zaplachinski S T. The effects of drought stress on free amino acid accumulation and protein synthesis in., 1994, 90: 9–14.
[42] Huang T F, Jander G. Abscisic acid-regulated protein degradation causes osmotic stress-induced accumulation of branched-chain amino acids in., 2017, 246: 737–747.
[43] Rai V K. Role of amino acids in plant responses to stresses., 2002, 45: 481–487.
[44] Bauwe H, Hagemann M, Kern R, Timm S. Photorespiration has a dual origin and manifold links to central metabolism., 2012, 15: 269–275.
[45] 秦岭, 陈二影, 张艳亭, 杨延兵, 孔清华, 张华文, 王海莲, 王润丰, 管延安, 阮颖. 干旱及复水对谷子脯氨酸积累和基因表达的影响. 分子植物育种, 2018, 16: 7460–7465. Qin L, Chen E Y, Zhang Y T, Yang Y B, Kong Q H, Zhang H W, Wang H L, Wang R F, Guan Y A, Ruan Y. Effects of drought and rehydration on proline accumulation andgene expression from foxtail millet ((L.) Beauv)., 2018, 16: 7460–7465 (in Chinese with English abstract).
[46] Filippou P, Antoniou C, Fotopoulos V. The nitric oxide donor sodium nitroprusside regulates polyamine and proline metabolism in leaves ofplants., 2013, 56: 172–183.
[47] Joshi V, Joung J, Fei Z J, Jander G. Interdependence of threonine, methionine and isoleucine metabolism in plants: accumulation and transcriptional regulation under abiotic stress., 2010, 39: 933–947.
[48] Araújo W L, Tohge T, Ishizaki K, Leaver C J, Fernie A R. Protein degradationan: an alternative respiratory substrate for stressed plants., 2011, 16: 489–498.
[49] Fait A, Fromm H, Walter D, Galili G, Fernie A R. Highway or byway: the metabolic role of the GABA shunt in plants., 2008, 13: 14–19.
[50] Yadav A K, Carroll A J, Estavillo G M, Rebetzke G J, Pogson B J. Wheat drought tolerance in the field is predicted by amino acid responses to glasshouse-imposed drought., 2019, 70: 4931–4948.
[51] Ravanel S, Gakiere B, Job D, Douce R. The specific features of methionine biosynthesis and metabolism in plants., 1998, 95: 7805–7812.
[52] Bryan J K. Differential regulation of maize homoserine dehydrogenase under physiological conditions., 1990, 92: 785–791.
[53] Lamari N, Zhendre V, Urrutia M, Bernillon S, Maucourt M, Deborde C, Prodhomme D, Jacob D, Ballias P, Rolin D, Sellier H, Rabier D, Gibon Y, Giauffret C, Moing A. Metabotyping of 30 maize hybrids under early-sowing conditions reveals potential marker-metabolites for breeding., 2018, 14: 132.
[54] Obata T, Witt S, Lisec J, Palacios-Rojas N, Florez-Sarasa I, Araus J L, Cairns J E, Yousfi S, Fernie A R. Metabolite profiles of maize leaves in drought, heat and combined stress field trials reveal the relationship between metabolism and grain yield., 2015, 169: 2665–2683.
[55] Mahal H S, Mukherjee T. Scavenging of reactive oxygen radicals by resveratrol: antioxidant effect., 2006, 32: 59–71.
[56] Islam M T, Ali E S, Uddin S J, Shaw S, Islam M A, Ahmed M I, Chandra Shill M, Karmakar U K, Yarla N S, Khan I N, Billah M M, Pieczynska M D, Zengin G, Malainer C, Nicoletti F, Gulei D, Berindan-Neagoe I, Apostolov A, Banach M, Yeung A W K, El-Demerdash A, Xiao J, Dey P, Yele S, Jóźwik A, Strzałkowska N, Marchewka J, Rengasamy K R R, Horbańczuk J, Kamal M A, Mubarak M S, Mishra S K, Shilpi J A, Atanasov A G. Phytol: a review of biomedical activities., 2018, 121: 82–94.
[57] Eastmond P J. Glycerol-insensitivemutants:seedlings lack glycerol kinase, accumulate glycerol and are more resistant to abiotic stress., 2004, 37: 617–625.
Effects of plastic film mulching on leaf metabolic profiles of maize in the Loess Plateau with two planting densities
NIU Li1,2,3, BAI Wen-Bo1, LI Xia2, DUAN Feng-Ying2, HOU Peng2, ZHAO Ru-Lang4, WANG Yong-Hong4, ZHAO Ming2, LI Shao-Kun2, SONG Ji-Qing1,*, and ZHOU Wen-Bin2,*
1Key Laboratory of Prevention and Control of Residual Pollution in Agricultural Film, Ministry of Agriculture and Rural Affairs / Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences, Beijing 100081, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3College of Water Resources and Civil Engineering, China Agricultural University, Beijing 100083, China;4Ningxia Academy of Agriculture and Forestry Sciences, Crops Research Institute, Yongning 750105, Ningxia, China
In the Loess Plateau, the study of leaf metabolomics under plastic mulching is an important step to explore the mechanism of plastic film mulching to increase grain yield in maize. Metabolomics analysis was performed on the leaves of two maize cultivars (Zhengdan 958 and Xianyu 335) under two planting densities (7.5×104and 10.5×104plant hm–2) and two mulching modes (plastic film mulching and no mulching ) at silking stage using gas chromatography-quadrupole-time of flight mass spectrometry (GC-QTOF) technology. In term of the number of differential metabolites, the response of Xianyu 335 to plastic film mulching was greater than that of Zhengdan 958. The higher planting density reduced the difference in leaf metabolism between plastic film mulching and no mulching. The principal component analysis revealed that both the mulching treatment and the cultivar had significant impacts on the composition of the metabolites. The separation of metabolic spectrum along plastic film mulching was mainly driven by organic acids such as citric acid and amino acids; the separation along cultivar was mainly driven by alkanoic acids and phenols. Correlation analysis indicated that resveratrol, phytol and glucose-6-phosphate had significant positive correlations with maize grain yield, whereas glycerol had a significant negative correlation with it. Under plastic film mulching condition, the levels of valine, isoleucine and methionine related to respiration and elimination of photorespiration products; isocitrate related to tricarboxylic acid cycle, methionine, N-acetylaspartic acid and other metabolites that could reduce photoinhibition showed an overall increasing trend. These results indicated that, under plastic film mulching condition, the antioxidant and energy metabolism-related metabolites played important roles in increasing grain yield. The elimination of photorespiration products and the accumulation of metabolites to alleviate photoinhibition were the metabolic bases for the increase of net photosynthetic rate in maize leaves.
plastic film mulching; leaf; metabolome; yield; antioxidant; maize
10.3724/SP.J.1006.2021.03053
本研究由国家重点研发计划项目(2016YFD0300102)资助。
This study was supported by the National Key Research and Development Program of China (2016YFD0300102).
周文彬, E-mail: zhouwenbin@caas.cn, Tel: 010-82108609; 宋吉青, E-mail: songjiqing@caas.cn
E-mail: niulipipi@163.com
2020-09-11;
2020-12-01;
2021-01-04.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20210104.1347.008.html

