硫酸镁对高氧脑损伤新生大鼠的神经保护作用▲
刘永青 赵钰玮 张 健 刘光辉
(安徽医科大学附属省儿童医院新生儿科,合肥市 230051,电子邮箱:2967520671@qq.com)
随着新生儿急救技术和重症监护水平的不断提高,新生儿的死亡率明显下降[1],但新生儿脑损伤的发生率并没有随之下降。据统计,新生儿中枢神经系统疾病占新生儿常见病的33.7%,早产儿存活者中约10%发生脑瘫,25%~50%的极低出生体重儿会出现认知、行为或社交障碍[2],这使得家庭和医疗机构的负担日益沉重。氧疗是危重新生儿常用的重要治疗方法之一,但高浓度氧气对于新生儿尤其早产儿存在一定副作用。目前国内外已经证实吸入高浓度氧能引起早产儿支气管肺发育不良和视网膜病变[3-4],越来越多的临床研究和动物实验也证实高浓度氧是引起早产儿严重神经系统后遗症的高危因素之一[5]。近年来,多项研究表明硫酸镁具有神经系统保护作用[6-8],但其对高氧性脑损伤是否具有治疗作用尚不明确。本实验通过建立高氧性脑损伤的动物模型,探究硫酸镁对未成熟脑神经发育的保护作用。
1 材料与方法
1.1 实验动物 SD新生大鼠30只,雌雄不限,体重20~25 g,由安徽医科大学实验动物中心提供,实验动物生产许可证号:scxk(皖)2017-00。新生小鼠同母鼠同笼饲养于室温(20℃~24℃)、相对湿度45%~55%的环境,12 h/12 h明暗交替,给予充足灭菌饮食,适应性喂养6 d后进行实验。
1.2 药品与试剂 硫酸镁注射液(上海锦帝九州药业,产品批号:19024110020);谷氨酸、γ-氨基丁酸(γ-aminobutyric acid,GABA)检测试剂盒(武汉基因美生物科技有限公司,产品批号:JYM0952Ra、JYM0325Ra);过氧化脂质(lipid peroxide,LOP)试剂盒(江苏酶免实业有限公司,产品批号:MM-0890R1);TRIzol试剂(Invitrogen公司,Lot:79406);SYBR Green实时反转录试剂盒(TakaRa公司,产品批号:RR820A);PCR试剂(TakaRa公司,产品批号:RR820A)。PCR引物由美国Invitrogen公司提供,白细胞介素(interleukin,IL)-1上游引物序列为5′-ATCAGCACCTCACAGCTTCC-3′,下游引物序列为5′-CTCTCCTCCCGATGAGTAGGC-3′;内参β-肌动蛋白(β-actin)上游引物序列为5′-CCCGCGAGTACAACCTTCTTG-3′,下游引物序列为5′-GTCATCCATGGCGAACTGGTG-3′。
1.3 仪器与设备 数字测氧仪(ProOx Model 110,BioSpherix公司);紫外可见分光光度计(北京普析通用仪器有限责任公司,型号:TU-1810);实时荧光PCR仪(美国ABI公司,型号:7500)。
1.4 模型的制备及分组 按随机数字表法将30只新生大鼠分为对照组、高氧组、硫酸镁组各10只。高氧组及硫酸镁组新生大鼠同哺乳母鼠共置于高氧箱中24 h,持续通入医用氧气,并用数字测氧仪持续监测箱内氧气浓度,维持箱内氧气浓度为80%左右;而对照组新生大鼠与哺乳母鼠置于同室空气中饲养。新生大鼠出现活动少,反应差,精神萎靡,呼吸促,四肢末端和口鼻处不同程度发绀,则提示成功建立高氧性脑损伤模型。硫酸镁组大鼠建模成功后,分别于生后第7天、第8天、第9天腹腔注射50 mg/kg硫酸镁。对照组和高氧组不做处理。
1.5 标本的采集和处理 将各组新生大鼠随机等分为两个亚组,分别于日龄10 d、14 d断头取脑。用10%水合氯醛2.0 mL腹腔注射麻醉后,将新生大鼠固定于自制手术板上,开胸暴露心脏,在左心室插入灌流针并固定,同时剪开大鼠右心耳,通过灌流针缓慢灌注4℃的磷酸盐缓冲溶液,直至肝脏颜色转白并且右心耳流出液体为澄清,断头取脑,将标本转入-80℃超低温冰箱中保存。
1.6 酶联免疫吸附法测定谷氨酸、GABA、LOP浓度 冰上进行组织匀浆操作,4℃下10 000 r/min离心5 min,吸取上清800 μL,另补充200 μL磷酸盐缓冲液制备成1 000 μL液体,再次以10 000 r/min离心5 min,吸取上清900 μL作为待测样品。分别设空白孔、标准孔、待测样品孔,在酶标包被板上标准品孔准确加样50 μL,待测样品孔先加样品稀释液40 μL,然后再加待测样品10 μL,进行温育(37℃、30 min)、洗涤,每孔加入酶标试剂50 μL后再次进行温育(37℃、30 min)、洗涤,在加入显色剂后10 min加入终止剂,以空白孔调零,450 nm波长处依序测量各孔的吸光度。
1.7 实时荧光定量PCR法测定IL-1 mRNA表达水平 冰上进行组织匀浆操作,4℃下10 000 r/min离心5 min后加入200 μL氯仿,待其自然分层后4℃下10 000 r/min继续离心10 min后吸取上清,加入等体积的异丙醇沉淀RNA,弃去上清,75%乙醇清洗RNA后干燥RNA。反转录反应过程:在0.2 mL微量离心管(EP管)中加入总RNA 5 μL、Oligo(dT)1 μL、无RNA酶水6 μL,置于65℃下孵育5 min,立即冰浴3 min;在上述管中加入5×反应缓释液4.0 μL、10 mmol/L dNTP 2.0 μL、RNasin 1.0 μL、M-MuLV 1 μL;混匀后进行反转录:42℃ 60 min,70℃ 5 min,获得cDNA。配置反应体系(20 μL):cDNA 2.0 μL,2×SYBR Green实时PCR预混液10 μL,PCR上游引物0.4 μL,PCR下游引物0.4 μL,50×ROX 0.4 μL,超纯水6.8 μL。PCR反应溶液在95℃下预变性30 s,在95℃下变性5 s,60℃下退火和延伸34 s,循环数设定相对表达水平为40。以β-肌动蛋白(β-actin)作为内参。采用2-ΔΔCt法计算IL-1 mRNA的相对表达水平。
1.8 统计学分析 采用SPSS 21.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 3组不同日龄新生大鼠脑组织LOP、谷氨酸浓度、谷氨酸/GABA比值的比较 无论是日龄10 d的大鼠还是日龄14 d的大鼠,高氧组谷氨酸浓度、谷氨酸/GABA比值、LPO浓度均较对照组和硫酸镁组升高(均P<0.05)。见表1。
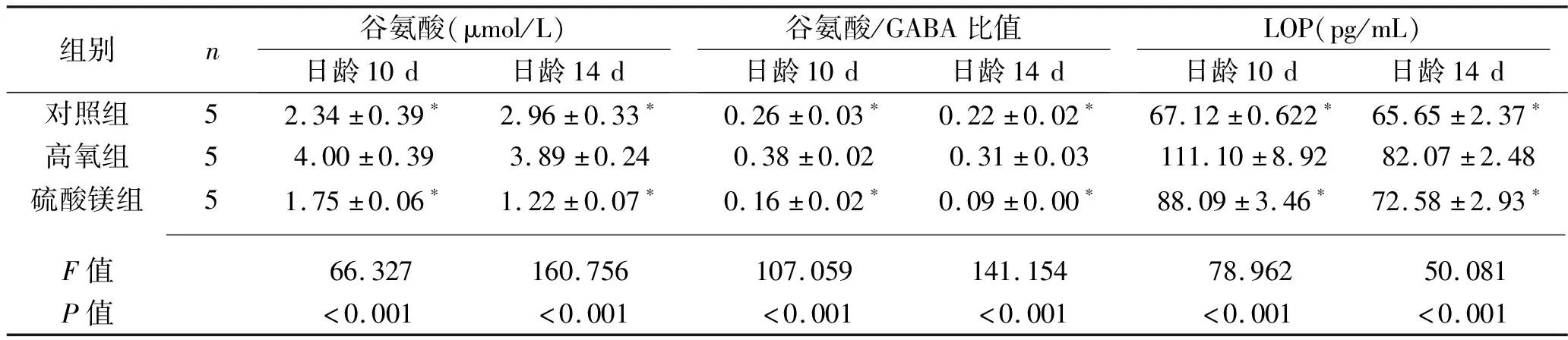
表1 3组不同日龄大鼠脑组织的LOP、谷氨酸浓度、谷氨酸/GABA比值的比较(x±s)
2.2 3组不同日龄新生大鼠脑组织IL-1 mRNA相对表达水平的比较 无论是日龄10 d还是日龄14 d的大鼠,高氧组的IL-1 mRNA相对表达水平均高于硫酸镁组和对照组(均P<0.05)。见表2。
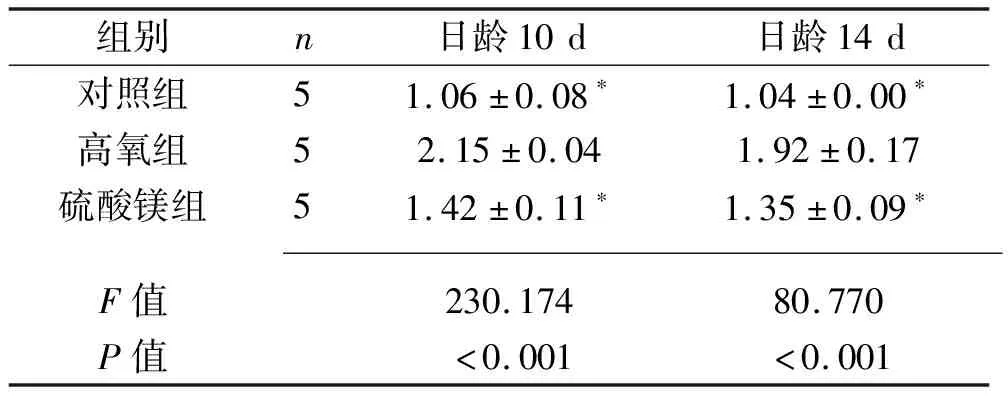
表2 3组不同日龄新生大鼠脑组织IL-1 mRNA相对表达水平的比较(x±s)
3 讨 论
镁离子作为人体必需元素之一,是细胞新陈代谢所需的多种金属活化酶的重要成分,涉及细胞的蛋白质合成、脂质与核酸代谢、糖异生、氧化磷酸化等重要生物学过程,并参与维持细胞膜的稳定性[9]。国内外多项研究表明硫酸镁具有减轻兴奋性中毒、抗炎、抗氧化等作用[10-12],但大部分研究主要针对产前的预防和产后缺氧缺血性损伤的治疗。新生儿尤其是早产儿暴露于高氧环境中,神经系统损伤的发生率显著增加[13]。在生理状态下,机体的活性氧维持在正常水平,当机体清除机制失败或者抗氧化剂不足时会导致氧化产物累积,过度的氧化应激将破坏核苷酸、蛋白质及脂质,使细胞功能受损[14]。由于日龄6 d新生鼠大脑发育情况与28~32周早产儿大脑相似[15],为明确早产儿高氧性脑损伤后硫酸镁是否具有神经保护作用,本实验通过建立日龄6 d新生大鼠高氧性脑损伤模型,探讨硫酸镁对高氧性脑损伤大鼠是否具有神经保护作用。
谷氨酸是中枢神经系统中主要的兴奋性氨基酸递质,脑内95%以上的突触是以谷氨酸为递质的兴奋性突触。谷氨酸通过谷氨酸转运体进入神经胶质细胞内转化为谷氨酰胺,从而保护神经元,避免兴奋性毒性损伤神经元[16]。而GABA是神经系统中主要的抑制性氨基酸,在生理状态下,两者保持动态平衡[17]。本实验结果显示,与对照组大鼠比较,高氧组新生大鼠脑组织损伤后产生大量谷氨酸,且谷氨酸/GABA比值明显升高,即两者之间平衡被打破;而硫酸镁组大鼠脑组织谷氨酸含量、谷氨酸/GABA比值均较高氧组大鼠降低,说明硫酸镁对高氧性脑损伤大鼠具有抑制兴奋性氨基酸的作用。Huang等[18]通过微透析评估脊髓损伤大鼠细胞外谷氨酸水平,发现注射AC105(聚乙二醇+镁离子溶液)可显著降低细胞外谷氨酸水平,同样提示镁离子可减轻兴奋性氨基酸的神经毒性。考虑可能是因为硫酸镁能够阻断谷氨酸受体的N-甲基-天冬氨酸-亚型,并拮抗N型、P型和L型钙通道,防止钙流入的同时限制乙酰胆碱释放和神经肌肉接头处的刺激,从而可预防细胞内钙离子过量引起的兴奋性损伤[10]。
LPO是不饱和脂肪酸经自由基作用所形成的过氧化物。正常状态下其浓度较低,机体出现病理改变时脂质过氧化反应可增强,从而导致LPO浓度增加,引起细胞及细胞膜功能及结构受损[19]。Peker等[20]在大鼠脊髓辐射损伤后24 h测定丙二醛水平以评估脂质过氧化水平,发现硫酸镁组丙二醛水平显著低于对照组(腹腔注射生理盐水),认为硫酸镁对辐射诱导的大鼠脊髓氧化应激有明显的神经保护作用。本实验结果显示,高氧损伤后新生大鼠脑组织LPO浓度增高,而硫酸镁组大鼠经硫酸镁干预后脑组织LPO浓度低于高氧组,提示硫酸镁有抑制氧化应激反应的作用。这可能与镁离子竞争性结合磷脂离子连接点,抑制活性氧簇和一氧化氮的生成及脂质过氧化、黄嘌呤氧化酶生成,减少超氧化物歧化酶增多有关[21]。
高氧暴露会极大增加细胞间隙的氧自由基释放,从而激活核因子κB信号通路介导炎症因子释放,引起下游 IL-1β、肿瘤坏死因子α 等炎症因子的增多,破坏了血脑屏障,导致炎症因子及有害物质迅速透过血脑屏障[22]。Zhang等[23]研究发现硫酸镁可降低胎盘缺氧孕鼠脑脊液中的细胞因子水平;Burd等[24]通过给孕鼠模型宫内注射脂多糖,发现硫酸镁组宫内胎鼠的脑组织中细胞因子表达量明显下降。上述两个研究结果均提示,镁离子可以抑制损伤脑组织的炎性因子生成和活化,以及炎症介质的表达,减轻炎症反应造成的神经细胞损伤。本实验结果显示,高氧损伤后新生大鼠脑组织IL-1 mRNA相对表达水平升高,而硫酸镁组mRNA表达水平较高氧组明显下降,提示硫酸镁可显著降低脑组织中高氧所致的炎症因子水平,从而起到保护神经系统的作用。
综上所述,硫酸镁可抑制脑组织兴奋性氨基酸的产生、氧化应激反应和炎症反应,对高氧性脑损伤新生大鼠具有神经保护作用。

