富硒黑木耳多糖的理化性质及抗氧化活性研究
吕明帅,赵博,孙文玉,万水晶,刘春延,张国财
(东北林业大学 林学院,哈尔滨 150040)
黑木耳(Auriculariaauricula),是我国栽培的主要食用菌之一,具有较高的食用和药用价值[1]。多糖作为黑木耳中重要的活性化合物之一,具有抗氧化、降血脂、抗肿瘤及增强免疫力的作用[2-3]。硒是维持人体健康的必需微量元素[4],适当的硒元素补充可提高机体的抗氧化水平和免疫力。多糖硒是硒在食用菌中一种重要的赋存形式[5]。研究表明,黑木耳具有较强的富硒能力,多糖与硒结合成为多糖有机硒化合物,更易被人体吸收[6]。近年来已开发出多种黑木耳制成的保健食品及调味品,如黑木耳饮料、黑木耳香辣酱、黑木耳果醋、黑木耳即食品等[7-10]。因此,开发富硒黑木耳多糖膳食补充剂具有广阔的应用前景。
多糖的提取、分离纯化是研究多糖构效关系的基础,只有相对纯度较高的多糖组分,才能更好地分析其结构,从而探究其重要的生物活性[11]。然而,目前对于富硒黑木耳多糖的研究均集中于粗多糖的体外抗氧化活性分析[12],且对其体内抗氧化活性的研究未见报道,富硒黑木耳多糖理化性质和生物活性关系的探索有待进一步研究。
因此,本文利用超声波辅助提取法对富硒黑木耳多糖进行提取,对提取的多糖进行了分离纯化,进而与普通黑木耳多糖相应级分的物化特性和抗氧化活性进行了比较分析,探究其活性机制,为富硒黑木耳的综合开发利用提供了理论依据和参考。
1 材料与方法
1.1 材料与试剂
富硒黑木耳子实体:吉林省白石山林业局提供;清洁级BALD/C小白鼠:哈尔滨医科大学附属第二医院实验动物中心;葡萄糖标准品、硒标准品、2,3-二氨基萘:美国Sigma公司;总还原能力试剂盒、抗羟基自由基试剂盒、ABTS自由基试剂盒、MDA试剂盒、T-SOD试剂盒、GSH-Px试剂盒:南京建成生物工程研究所;单糖标准品:Dr.Ehrenstorfer GmbH公司;其余化学试剂均为分析纯(AR)。
1.2 仪器与设备
HH-420数显三用恒温水浴锅 常州申光仪器有限公司;JY92-IIDN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;UV-5100紫外分光光度计 上海元析仪器有限公司;DBS-100电脑全自动部分收集器 上海沪西分析仪器有限公司。
1.3 试验方法
1.3.1 富硒黑木耳多糖的提取
以亚硒酸钠为硒源,用硒添加量为20 mg/kg的培养料栽培黑木耳,将栽培得到的富硒黑木耳子实体粉碎过80目筛。参照参考文献[13],采用超声辅助法(水浴时间为2.3 h,超声时间为30 min,料液比1∶57 (m/V)进行提取,提取后的样品在8500 r/min条件下离心10 min,抽上清液,采用Sevage法除去蛋白,80%乙醇醇沉,离心后分别用丙酮、乙醚、乙醇洗涤沉淀,透析(截留量10 kDa)72 h,冻干,得富硒黑木耳粗多糖。普通黑木耳采用上述相同工艺流程进行提取。
1.3.2 富硒黑木耳粗多糖的纯化及理化特性分析
1.3.2.1 富硒黑木耳粗多糖的纯化
将DEAE-52纤维素预处理并装柱(2.8 cm×65 cm),取富硒与普通黑木耳粗多糖各20 mg于10 mL蒸馏水充分溶解,加入柱内。采用恒流泵上样,0~1 mol/L NaCl梯度洗脱,流速设为1 mL/min,从而分离不同的多糖组分。将收集液体透析(截留量10 kDa)72 h,浓缩,冻干,得到富硒及普通黑木耳多糖相应组分。进一步利用Sephacryl S-400柱(1.6 cm×50 cm)分离纯化,流速设定为0.15 mL/min,得富硒及普通黑木耳纯多糖相应级分[14]。
1.3.2.2 多糖硒含量的测定
采用荧光分光光度法对样品多糖硒含量进行测定[15]。线性回归得标准曲线为:m=15042n+149.27(m为荧光读数;n为试管中硒含量,μg),r2=0.9996,线性范围为0~0.5 μg。多糖硒含量按公式(1)计算:
(1)
式中:mx为多糖中总硒质量,μg;my为多糖中无机硒质量,μg;mz为硒多糖质量,g。
1.3.2.3 纯度鉴定及分子量测定
采用高效凝胶渗透色谱法进行纯度及分子量测定[16]。对标准分子量葡聚糖进行HPSEC分析,得多糖分子量标准曲线为:y=0.5212x+11.513(y为log10Mw,x为保留时间,r2=0.9851)。
1.3.2.4 单糖组成测定
按照赵博[17]的方法进行单糖组成分析。色谱柱选用Agilent HP-5弹性石英毛细管色谱柱(30 m×0.32 mm×0.5 μm),升温程序:130 ℃保持5 min,4 ℃/min,240 ℃保持5 min,载气N2的流速为50 mL/min,空气为30 mL/min,H2为37 mL/min。
1.3.2.5 糖醛酸含量测定
采用间羟基联苯比色法测定[18],标准曲线方程为:a=9.8114b+0.0443(a为吸光度;b为硒多糖糖醛酸含量),r2=0.9947,糖醛酸质量分数按公式(2)计算:
糖醛酸质量分数/%=糖醛酸质量/样品质量。
(2)
1.3.3 多糖体外抗氧化活性测定
按照试剂盒说明书测定总还原力、羟基自由基清除能力和ABTS清除能力。
1.3.4 多糖体内抗氧化活性测定
1.3.4.1 小鼠饲养及给药
雄性BALD/C小白鼠48只,8周,体重(20±2) g,饲养温度(20±2)℃,湿度40%~60%,光照12 h/d,自由饮食饮水,饲料为维持性饲料。试验前适应生活24 h后,随机分为8组,每组6只。分为正常对照组(N)、普通黑木耳多糖(AAP-2)低剂量组L(50 mg/(kg·d))、中剂量组M(100 mg/(kg·d))、高剂量组H(200 mg/(kg·d))、富硒黑木耳多糖(Se-AAP-2)低剂量组L(50 mg/(kg·d))、中剂量组M(100 mg/(kg·d))、高剂量组H(200 mg/(kg·d))。在为期30 d的试验周期内,对照组每天灌胃0.1 mL生理盐水,试验组每天灌胃0.1 mL对应浓度的多糖溶液。
1.3.4.2 血清及组织的制备
试验第29天小白鼠空腹处理,第30天摘眼取血,于4 ℃、3000 r/min条件下离心15 min,获得血清样品。小白鼠脱颈处死后,摘取肝、肾、心等器官,用预冷生理盐水充分冲洗,分析天平称重,按1∶10 (m/V)加入冷生理盐水,冰浴研磨后在4 ℃,8000 r/min条件下离心15 min,获得组织匀浆。将组织匀浆及血清置于-80 ℃冰箱中保存。肝、肾、心及血清的MDA含量、T-SOD及GSH-Px活性均按照试剂盒说明书进行测定。
1.4 数据分析
采用SPSS 22.0软件处理数据,并进行单因素方差分析。
2 结果与分析
2.1 富硒对黑木耳多糖物理化学特性的影响
2.1.1 DEAE-52纤维素柱纯化
DEAE-52纤维素层析柱对黑木耳多糖的分离效果较好,随着NaCl溶液浓度的逐渐增加,富硒及普通黑木耳多糖在纯化后均得到2个多糖组分,各组分峰的峰形对称(见图1中a和b),由于第1组分量均较少,故收集第2组分以供Sephacryl S-400柱纯化。

图1 普通黑木耳多糖(a)和富硒黑木耳多糖(b)DEAE-52洗脱曲线
2.1.2 Sephacryl S-400柱纯化
经过DEAE-52分离后得到的组分经过Sephacryl S-400层析柱,均显示单一对称峰(见图2中a和b),纯化效果明显,纯化后的富硒黑木耳多糖为Se-AAP-2、普通黑木耳多糖为AAP-2。
图2 普通黑木耳多糖纯化组分(a)和富硒黑木耳多糖纯化组分(b)Sephacryl S-400洗脱曲线
2.1.3 多糖的物理化学特性
AAP-2与Se-AAP-2均呈现单一峰,即所得多糖为均一多糖组分(见图3中a和b)。

图3 普通黑木耳硒多糖纯化组分(a)、富硒黑木耳硒多糖纯化组分(b)的HPSEC图谱
由表1可知,AAP-2和Se-AAP-2中硒含量分别为0.2 μg/g和1.67 μg/g, 二者相差8.35倍(P<0.01),说明硒已成功富集于AAP-2分子中。对两种多糖糖醛酸含量的测定结果表明,AAP-2组分的糖醛酸含量为18.36%,Se-AAP-2组分为24.55%,差异显著(P<0.01),由此可知,富硒可以显著提高黑木耳多糖糖醛酸含量,这与Ye等[19]的测定结果相一致。高效凝胶排阻渗透色谱分析表明AAP-2与Se-AAP-2均为多糖均一组分。经计算得到,AAP-2与Se-AAP-2分子量分别为634.85 kDa和485.48 kDa,存在显著差异(P<0.01)。单糖组成分析结果表明,AAP-2和Se-AAP-2均由甘露糖和葡萄糖组成。其中,AAP-2的摩尔比为甘露糖∶葡萄糖为1∶1.28,Se-AAP-2摩尔比为甘露糖∶葡萄糖为1∶1.31,摩尔比接近,且二者差异不显著(P>0.01),说明富硒并未对黑木耳多糖AAP-2产生显著影响。

表1 普通黑木耳硒多糖与富硒黑木耳硒多糖物理化学特性分析
2.2 体外抗氧化活性比较分析
2.2.1 总还原力测定
两种多糖均具有一定的还原能力,且随着浓度的增加其吸光值亦不断提升,呈显著的浓度依赖性(见图4中a)。当质量浓度为20 mg/mL时,AAP-2和Se-AAP-2的吸光值分别为0.402和0.448,吸光值增加了11.4%。富硒后的多糖总还原能力显著提升(P<0.05)。多糖的总还原力越强,其抗氧化活性也会提高[20]。

图4 黑木耳多糖体外抗氧化能力测定
2.2.2 羟基自由基清除能力测定
当质量浓度在2~13 mg/mL时,不同质量浓度的富硒黑木耳多糖和未富硒黑木耳多糖对·OH均有较好的清除能力(见图4中b),且随着质量浓度的增加,清除率逐渐上升,当达到13 mg/mL时,富硒多糖和普通多糖对·OH的清除率分别为63.27%和55.57%,富硒后黑木耳多糖的清除率提高了8.6%。Se-AAP-2和AAP-2清除·OH的IC50值分别为5.66 mg/mL和8.05 mg/mL,IC50值降低了42.2%,差异显著(P<0.05),IC50的值越小,说明多糖的活性越强。
2.2.3 ABTS自由基清除能力测定
当两种多糖的质量浓度在0~20 mg/mL范围内时,具有一定的剂量依赖性,浓度越高对ABTS自由基的清除能力越强(见图4中c)。在20 mg/mL时,Se-AAP-2和AAP-2的清除率达到最高,分别为81.26%和72.13%,Se-AAP-2的清除率提高了9.13%。Se-AAP-2和AAP-2清除ABTS的IC50值分别7.26 mg/mL和9.17 mg/mL,富硒后黑木耳多糖的IC50值降低了26.4%,差异显著(P<0.05),即富硒黑木耳多糖对ABTS自由基的清除能力强于普通黑木耳多糖。
2.3 体内抗氧化活性比较分析
由表2可知,与AAP-2的空白对照组相比,AAP-2和Se-AAP-2的MDA含量显著降低,说明黑木耳多糖对小鼠脏器及血清具有缓解作用。AAP-2和Se-AAP-2各组的MDA含量都随着多糖浓度的增大而降低。当多糖浓度相同时,Se-AAP-2含量均低于AAP-2。但在肝中,只有在高浓度处理时,二者存在显著差异(P<0.05),说明富硒后的黑木耳多糖对小鼠肝脏有更好的缓解作用。在肾中,在中、高浓度处理时二者存在显著差异(P<0.05)。在心中,低浓度与对照组不存在显著性差异,只有在高浓度时二者存在显著差异(P<0.05)。在血清中,只有在高浓度时二者存在显著差异。此结果说明富硒后的黑木耳多糖对肝和肾的缓解作用更为明显,心和血清只有在高浓度时缓解作用显著。
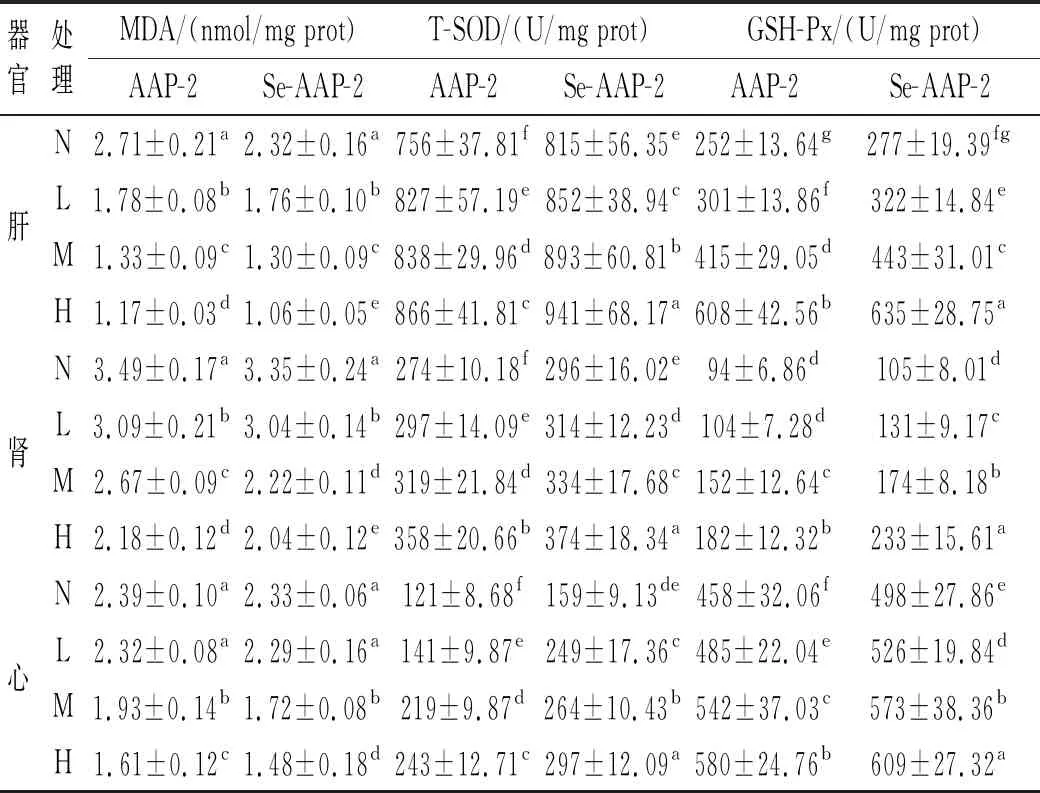
表2 普通黑木耳硒多糖与富硒黑木耳硒多糖体内抗氧化活性分析

续 表
与AAP-2的空白对照组相比,AAP-2和Se-AAP-2的T-SOD活性显著提高。AAP-2和Se-AAP-2各组的T-SOD活性都随着多糖浓度的增大而提高。当多糖浓度相同时,Se-AAP-2活性均高于AAP-2。但在肾和血清中,只有在高浓度处理时二者存在显著差异(P<0.05),说明在低浓度时二者对小鼠肾和血清的促进作用没有显著性差异。在肝和心中,在不同浓度下,二者均存在显著差异(P<0.05)。此结果说明富硒后的黑木耳多糖对肝和心的促进作用更为明显,肾和血清只有在高浓度时促进作用显著。
与AAP-2的空白对照组相比,AAP-2和Se-AAP-2的GSH-Px活性显著提高。AAP-2和Se-AAP-2各组的GSH-Px活性都随着多糖浓度的增大而提高。在肝、肾和心中,在相同浓度时,二者均存在显著性差异(P<0.05),说明富硒黑木耳多糖对小鼠肝、肾和心的促进作用更为明显。在血清中,在低、中浓度时二者没有显著性差异,只有在高浓度处理时二者存在显著差异(P<0.05)。此结果说明富硒黑木耳多糖对小鼠肝、肾和心的促进作用优于普通黑木耳多糖,血清只有在高浓度时促进作用显著。
3 结论
抗氧化是多糖主要的生物活性之一[21],供氢或电子传递能力的强弱决定了多糖的抗氧化活性[22-23]。大量研究证实,多糖的抗氧化活性是多种因素共同作用的结果,其中分子量、单糖组成、糖醛酸含量与其抗氧化活性关系十分密切[24-25]。通常,相比高分子量多糖,低分子量多糖因具有与自由基接触的更大机会而具有更高的抗氧化活性[26-27]。同时,糖醛酸的羧基作为活泼的氢供给基团,可通过供氢清除自由基,使其转化为稳定的化合物而阻断氧化连锁反应,进而赋予多糖较强的抗氧化活性[28-29]。在体外抗氧化试验中,Se-AAP-2的总还原力、羟基自由基及ABTS自由基清除能力均优于AAP-2,这可能是由于Se-AAP-2具有较低的分子量和较高的糖醛酸含量[30],与Li等比较富硒和普通灰树花子实体多糖的结果相一致[31]。在体内抗氧化试验中,MDA作为一种醛类物质,可以改变生物大分子的活性。GSH-Px的活性中心是硒半胱氨酸,在胞浆内通过分解H2O2起到保护细胞膜结构和功能的作用。T-SOD则通过歧化O2-形成H2O2,而H2O2在GSH-Px的作用下分解为水,从而达到消除自由基的作用[32]。Se-AAP-2显著提升了T-SOD、GSH-Px的抗氧化活性,降低了MDA含量,可能是因为随着体内硒多糖的代谢,多糖中的硒参与了GSH-Px的合成,从而使得富硒后的黑木耳多糖体内抗氧化活性优于普通黑木耳多糖。此外,研究表明多糖中硒的存在还可激活其异头碳区域的氢原子,从而提高其抗氧化活性[33-34],这也可能是Se-AAP-2抗氧化能力得到显著提升的重要因素。
本文采用超声辅助提取法对富硒黑木耳多糖进行提取。利用DEAE-52纤维柱和Sephacryl S-400柱分别从富硒黑木耳硒多糖和普通黑木耳多糖中获得相应级分的Se-AAP-2与AAP-2。物化特性和抗氧化活性对比分析结果表明,富硒并未对AAP-2的单糖组成及摩尔比产生显著影响,硒基团的赋存、分子量的降低及糖醛酸含量的提高可能是导致Se-AAP-2抗氧化活性高于AAP-2的主要原因。

