大孔树脂纯化仙草黄酮及成分测定
上官宇晨,黄丽媛,黄熊,何传波,魏好程,熊何健*
(1.集美大学 食品与生物工程学院,福建 厦门 361021;2.福建省漳州市漳浦县海洋与渔业局,福建 漳州 363200)
仙草(MesonaBlume.)又名仙人草,为唇形科(Labiatae)凉粉草属(MesonaBl.),主要分布于我国福建、广东、广西等省份,作为一种药食两用的植物资源[1],广泛应用于凉茶、烧仙草和龟苓膏等传统食品的加工[2]。《中华本草》中记载仙草味甘、性寒,有清暑凉血及利尿之功效。现有研究表明,仙草还具有抗氧化、防中暑、降血压、治疗关节疼痛等的功效,且黄酮类物质是仙草主要的功能成分之一。传统仙草产品的加工工艺较为单一,为提高仙草多糖的提取率和增加烧仙草的风味,加工过程中常加入较高浓度的碱进行碱煮,长时间高温碱处理对仙草中的黄酮类化合物会产生极大的破坏[3],造成仙草黄酮资源的浪费。
黄酮类物质的分子量较小,易被人体消化吸收,具有抗氧化、抗菌、降血糖及降胆固醇等功能[4-7],在食品与医药行业应用广泛[8-9]。黄酮类化合物可以作甜味剂、增鲜剂用于增加调味品的风味,也可以作为功能性调味品的功效成分[10],仙草黄酮的分离纯化能为开发相关功能性调味品、保健食品提供研究基础。
大孔树脂吸附是依靠树脂和被吸附物质之间的范德华引力、静电作用或氢键的作用达到分离、净化的目的,具有操作简便、富集效果明显、稳定性好、选择性强、可重复利用等优点[11-12],广泛应用于花色苷、多酚、黄酮类物质的分离纯化[13-14]。近年来,关于大孔树脂吸附植物中黄酮的研究较多,但来源于不同植物的黄酮类物质极性及组成有所不同,所选用的大孔树脂的类型差异较大。极性是反映树脂解吸能力的重要因素,极性越大,树脂对黄酮的解吸能力越弱[15]。Sephadex LH-20具有清洁、简单、高效等优点,广泛应用于分离天然活性物质,适用于黄酮组分的分离[16]。
目前国内仙草的研究主要集中于仙草多糖及相关产品的研发,仙草黄酮的研究尚处于起步阶段。本研究采用大孔树脂柱层析法纯化仙草黄酮,并进一步分离、鉴定出两个主要组分,为工业化制备仙草黄酮提供了技术依据。
1 材料与方法
1.1 材料与仪器
仙草:产自福建省龙岩市;芦丁、甲醇:均为分析纯,国药集团化学试剂有限公司;大孔吸附树脂(HPD-100):沧州宝恩化工有限公司;Sephadex LH-20:瑞典GE Healthcare公司;乙腈:美国Sigma公司;甲酸:阿拉丁公司;氘代甲醇:色谱纯,国药集团化学试剂有限公司。
玻璃层析柱(Φ16 mm×200 mm)和(Φ20 mm×600 mm);HD-21-88自动柱层析仪 上海琪特分析仪器有限公司;JDG-0.2冷冻干燥机 兰州科近真空冻干技术有限公司;Ultimate 3000高效液相色谱仪 Dionex公司;Avance Ⅱ 400 MHz全数字化核磁共振谱仪 瑞士Bruker公司。
1.2 实验方法
1.2.1 仙草黄酮的提取及含量的测定
仙草黄酮提取液的配制:取100 g仙草粉末(过80 目筛),以1∶15 (g/mL)的料液比加入45%乙醇溶液,25 ℃恒温水浴提取2 h,提取2次,合并滤液,减压浓缩回收乙醇,浓缩液过滤、离心(4000 r/min,20 min),定容至250 mL,置于4 ℃冰箱内保存备用。
含量的测定:参考Yang等[17]的方法并稍作修改,采取NaNO2-Al(NO3)3法,以芦丁为标准品,绘制标准曲线y=0.0011x+0.0251,R2=0.9998,在0.0~400 μg/mL范围内具有良好的线性关系,总黄酮含量计算公式见式(1),将样品适度稀释后同上法测定并计算样品黄酮含量。
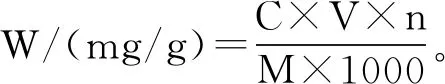
式(1)
式中:W为样品黄酮含量,mg/g;C为样品液中芦丁浓度,μg/mL;V为样品液体积,mL;n为样品测定时的稀释倍数;M为样品的质量,g。
1.2.2 大孔树脂HPD-100静态吸附动力学曲线
称取2.0 g预处理的HPD-100树脂置于150 mL锥形瓶中,加入50 mL仙草黄酮提取液(20 mg/mL),置于恒温振荡器(30 ℃、150 r/min)中反应1,2,4,6,8,12,24 h,过滤,树脂用蒸馏水充分清洗,加入45%乙醇50 mL于相同条件下洗脱24 h后过滤,分别测定各树脂平衡液和解吸液中黄酮的浓度,绘制其静态吸附动力学曲线,见公式(2)和公式(3)。
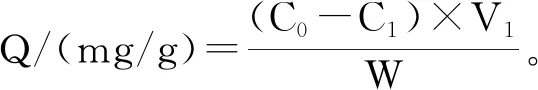
式(2)
D=(C2×V2)/[(C0-C1)×V1)]×100%。
式(3)
式中:Q为树脂吸附量,mg/g;C0为吸附前样液初始浓度,mg/mL;C1为大孔树脂吸附后样液浓度,mg/mL;D为解吸率,%;C2为大孔树脂解吸后样液浓度,mg/mL;V1为样液初始体积,mL;V2为解吸液体积,mL;W为大孔树脂质量,g。
1.2.3 大孔树脂HPD-100纯化条件优化
1.2.3.1 上样量的选择
称取10 g HPD-100大孔树脂湿法装柱。取10 mg/mL仙草黄酮溶液进行上样,上样流速3 BV/h(1 BV 10 mL),上样量1,2,3,4,5,6,7,8,9,10,11,12,13,14,15 BV,振荡吸附后(25 ℃,150 r/min,24 h),水洗,再用3 BV 60%浓度的乙醇溶液解吸,测定各组洗脱液中黄酮含量。
1.2.3.2 上样流速的选择
按上述实验优化条件上样,分别以1,2,3,4,5 BV/h的流速通过树脂,吸附8 h,按式(2)测定最终的吸附量。
1.2.4 优化大孔树脂(HPD-100)分离纯化仙草黄酮工艺中动态吸附、解吸实验
1.2.4.1 洗脱液浓度的选择
按上述实验优化条件上样,待上柱吸附完全后,用蒸馏水洗至流出液无检出黄酮,分别用30%、40%、50%、60%、70%乙醇以6 BV/h的流速洗脱,每5 min收集一管,测定每管流出液中黄酮的浓度。
1.2.4.2 洗脱流速的选择
按上述实验优化条件上样,待上柱吸附完全后,用蒸馏水洗至流出液无检出黄酮,再分别用1,3,6 BV/h的60%乙醇洗脱,每5 min收集一管,测定每管流出液中黄酮的浓度。
1.2.5 Sephadex LH-20分离仙草黄酮组分
按上述优化条件柱层析纯化仙草黄酮提取液,洗脱液真空浓缩、冻干后得到仙草黄酮样品(crudeMesonaBlume. flavonoids,CMBF)。用甲醇配制10 mg/mL CMBF样品液,过滤处理后,于Sephadex LH-20层析柱(Φ16 mm×60 mm)分离,用30%、50%、70%、90%甲醇各100 mL进行梯度洗脱,洗脱速度为0.5 mL/min,每7 min收集一管,用HPLC检测并收集合并相同吸收峰的样品,然后进行真空减压浓缩,冷冻干燥后,冷藏备用,进行下一步的分析鉴定。
1.2.6 高效液相色谱分析
采用高效液相色谱分析纯化后的仙草黄酮组分,分析条件:流动相A为乙腈,B为0.1%甲酸,C18色谱柱(Agilent ZORBAX SB-C18,4.6 mm×250 mm,5 μm),进样体积:10 μL,检测波长:280 nm,柱温:30 ℃,梯度洗脱:0~10 min,90%~80% B,10~35 min,80%~70% B,35~55 min,70%~90% B,流速1 mL/min。
1.2.7 核磁共振谱分析
依据参考文献[18],取5 mg的仙草黄酮纯化组分MBF1、MBF2溶解于0.5 mL DMSO-d6中并转移至专用的核磁管内,以四甲基硅烷为内标物,在Bruker核磁共振仪上测定氢谱1H-NMR、13C-NMR。
1.3 数据处理
本文所有实验样本均设3次平行,数据表示为平均值±标准差,统计分析采用Origin 9.0和MestReNova软件。
2 结果与分析
2.1 仙草黄酮在HPD-100树脂上的静态吸附动力学曲线
由图1可知,在0~8 h内,随着吸附时间的延长,树脂的吸附量也随之增加。吸附8 h后,随着时间的增长,曲线趋于平缓,树脂基本达到饱和吸附量。在1~2 h内,HPD-100树脂吸附速度较快,吸附量快速接近饱和吸附量的90%,解吸实验结果表明HPD-100的解吸率最高为(86.47±0.27)%,说明HPD-100大孔吸附树脂对仙草黄酮有良好的吸附效果。
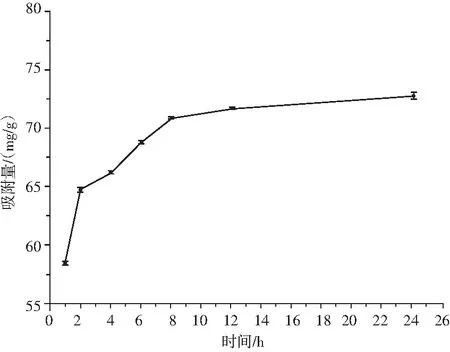
图1 HPD-100大孔树脂的静态吸附曲线
2.2 实验条件的确定
2.2.1 上样量的确定
由图2可知,随着粗提液上样量的增加,流出液中黄酮的质量浓度增大。上样量为3 BV时,流出液中仙草黄酮的浓度为(0.51±0.07) mg/mL,约为上样液浓度的5%。当上样量高于3 BV时,流出液中仙草黄酮的浓度快速上升,吸附的黄酮发生大量泄漏,因此选择上样量为3 BV时样品泄漏的损失最小。
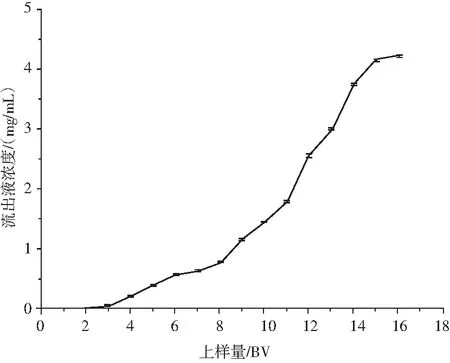
图2 上样量对HPD-100大孔树脂吸附仙草黄酮的影响
2.2.2 上样流速的确定
由图3可知,HPD-100树脂对仙草黄酮的吸附量随着上样流速的增加而减少,可能是由于大孔树脂的吸附速度有限,在同样的吸附速率下流速加快、相对吸附时间减少,同时流速过大,导致有效成分与树脂接触时间不充分,不能被树脂吸附完全。但流速过慢,影响了生产效率,延长了生产周期,增加了生产成本。与上样流速1 BV/h相比,在3 BV/h的流速条件下,HPD-100树脂对仙草黄酮的吸附量仅下降了(4.23±0.08)%。而单位时间内粗提物的上样量提高了2倍。综合考虑,选择3 BV/h为最佳上样流速。
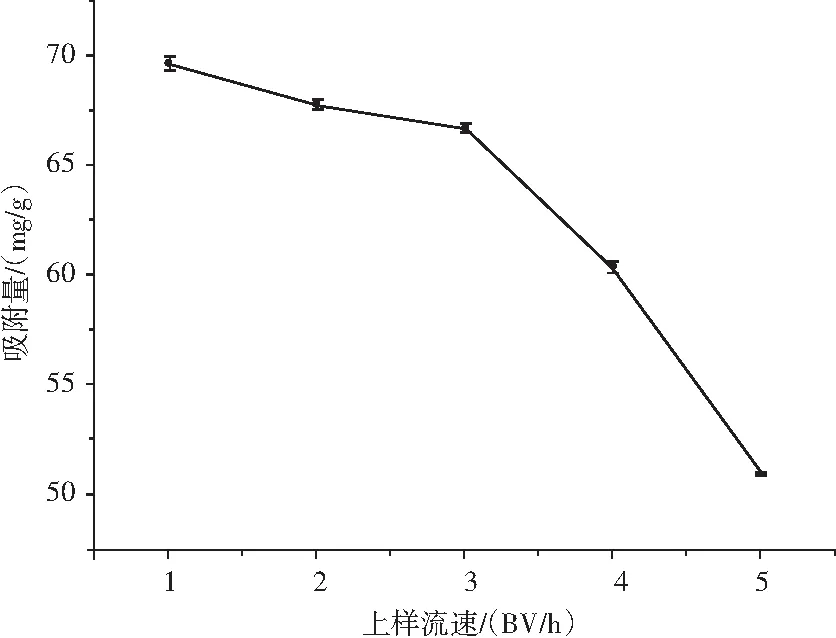
图3 上样流速对HPD-100大孔树脂吸附仙草黄酮的影响
2.2.3 洗脱浓度的确定
由图4可知,用30%乙醇洗脱时,流出液黄酮的浓度最低,且洗脱峰不集中,有拖尾峰。用60%乙醇浓度洗脱树脂时,流出液黄酮的浓度最大。当乙醇浓度上升或者下降时,洗脱量降低,这可能是在60%乙醇的极性条件下易破坏仙草黄酮与HPD-100大孔树脂的作用位点,使得仙草黄酮容易被置换,提高了解吸的效率。综合考虑,选择最佳洗脱剂为60%乙醇。
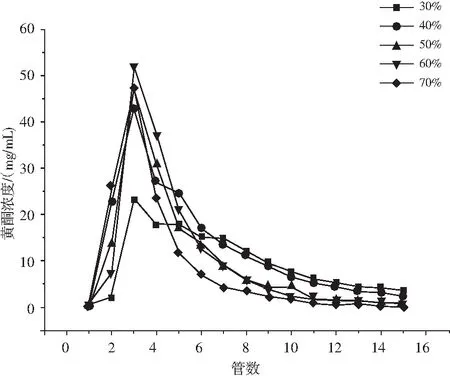
图4 洗脱剂浓度对HPD-100大孔树脂解吸仙草黄酮的影响
2.2.4 洗脱速率的确定
由图5可知,当洗脱流速为3 BV/h时,仙草黄酮解吸浓度最高,但洗脱峰形不均一,洗脱时间长,效率较低。当洗脱流速达到9 BV/h时,仙草黄酮解吸浓度最低,有较明显的拖尾峰,这可能是因为流速过快,吸附的黄酮类物质未被完全洗脱下来。当洗脱流速为6 BV/h时,黄酮解吸浓度较高且洗脱峰较为对称。综合考虑,最佳洗脱流速为6 BV/h。
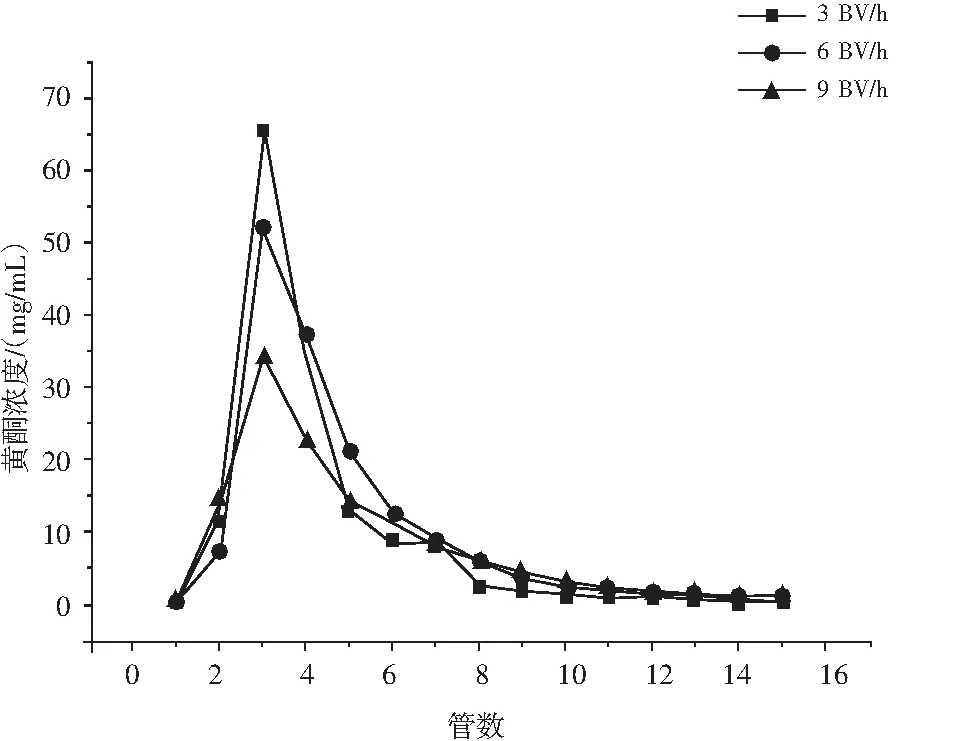
图5 洗脱速率对HPD-100大孔树脂解吸仙草黄酮的影响
2.3 仙草黄酮的分离与结构鉴定
仙草黄酮提取液经大孔树脂纯化、真空浓缩、冻干后得到仙草黄酮样品(crudeMesonaBlume. flavonoids,CMBF),利用Sephadex LH-20柱层析对CMBF进一步分离得2 个化合物MBF1、MBF2。HPLC分析结果见图6,CMBF峰形较杂,两种组分MBF1、MBF2均由单一峰组成,且2个样品纯度都达到90%以上,确定2种物质为单一化合物,进行核磁共振谱分析。
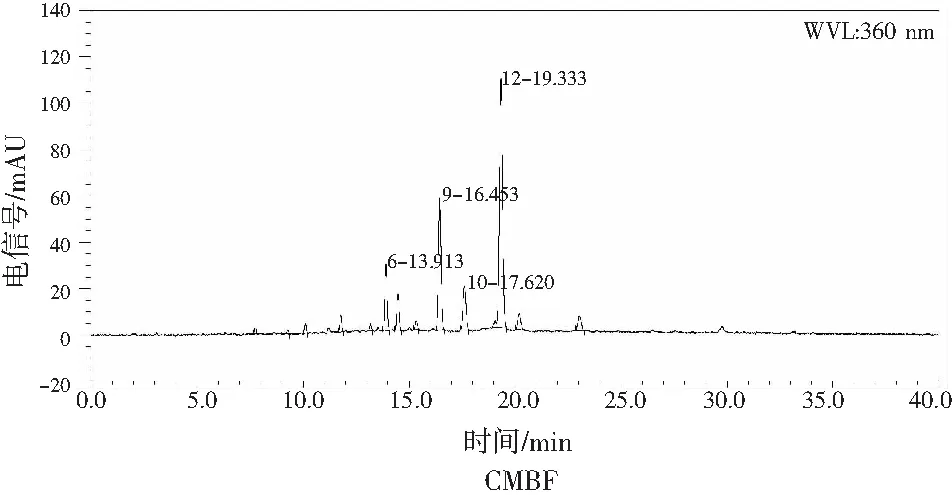
图6 仙草黄酮液相色谱图
MBF1,褐色粉末,分子量为360.0845,分子式为C18H16O8,1H-NMR(CD3OD, 400 MHz): δH7.49 (1H, d, J=15.9 Hz, H-7), 7.02(1H, d, J=1.6 Hz, H-2), 6.91(1H, dd, J=8.2, 1.6 Hz, H-6), 6.75 (1H, d, J=8.2 Hz, H-5), 6.75 (1H, br s, H-2′), 6.66 (1H, d, J=8.0 Hz, H-5′), 6.62 (1H, br d, J= 8.0 Hz, H-6′), 6.26 (1H, d, J=15.9 Hz, H-8), 5.09 (1H, br d, J=8.0 Hz, H-8′), 3.09 (1H, br d, J=13.3 Hz, H-7′b), 2.92 (1H, dd, J=13.3, 8.0 Hz, H-7′a)。13C-NMR (CD3OD, 100 MHz): δC169.1 (s,C-9),149.4 (s, C-4),146.7 (s, C-3),146.6 (d, C-7),146.0 (s, C-3’),144.8 (s, C-4’),131.2 (s, C-1’),128.0 (s, C-1),122.9 (d, C-6),121.8 (d, C-6’),117.5 (d, C-2’),116.5 (d, C-5’),116.2 (d, C-5),115.7 (d, C-8),115.1 (d, C-2), 38.8 (t, C-7’)。上述光谱数据与文献[19]对比基本一致,可确定MBF1为迷迭香酸(见图7)。
MBF2,浅黄色粉末,分子量为448.1006,分子式为C21H20O11,1H-NMR (CD3OD, 400 MHz): δH8.04 (2H, d, J=8.8 Hz, H-2’, H-6’), 6.88 (2H, d, J=8.8 Hz, H-3’, H-5’), 6.38 (1H, br s, H-8), 6.19 (1H, br s, H-6), 5.22 (1H, d, J=7.2 Hz, H-1′), 3.68 (1H, dd, J=11.9, 2.1 Hz, H-6’′a), 3.52 (1H, dd, J=11.9, 5.5 Hz, H-6’′b), 3.27-3.47(3H, m, H-2’’,H-3’’,H-4’’), 3.19 (1H, ddd, J = 9.7, 5.5, 2.1 Hz, H-5’’)。13C-NMR (CD3OD, 100 MHz): δC179.4 (s, C-4), 166.6 (s, C-7),163.0 (s, C-5),161.6 (s, C-4’),159.0 (s, C-2),158.5 (s, C-9),135.4 (s, C-3),132.3 (d, C-2’, C-6’),122.8 (s, C-1’),116.1 (d, C-3’, C-5’),105.5 (s, C-10),104.1 (d, C-1’’),100.1 (d, C-6),94.9 (d, C-8),78.4 (d, C-5’’), 78.0 (d, C-3’’), 75.7 (d, C-2’’), 71.3 (d, C-4’’), 62.6 (t, C-6’’)。上述光谱数据与文献[20]对比基本一致,可确定MBF2为紫云英苷(见图7)。
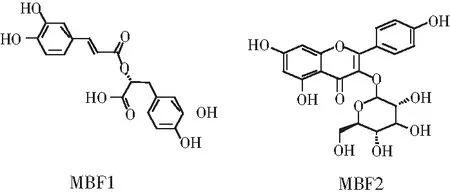
图7 MBF1、MBF2的结构
3 结论
黄酮类化合物在食品保鲜、抑菌方面应用广泛,为了更好地利用仙草中的黄酮类化合物,本研究通过考察HPD-100大孔树脂对仙草黄酮的吸附和解吸能力,发现短时间内HPD-100树脂吸附量能快速达到饱和吸附量的90%,解吸率最高为(86.47±0.27)%,可以认为HPD-100大孔树脂是分离仙草黄酮的一种理想树脂。其最佳纯化工艺参数为:上样量为3 BV,上样流速为3 BV/h,洗脱剂乙醇浓度为60%,洗脱流速为6 BV/h。经Sephadex LH-20进一步分离纯化得到两个单体化合物,通过1H-NMR、13C-NMR进行鉴定,确定两种纯化物为迷迭香酸与紫云英苷。
本实验采用大孔树脂法纯化仙草黄酮,操作简单,效果明显,仙草原料经乙醇溶液提取黄酮后,仍可加工仙草胶类传统食品。仙草黄酮的分离制备及进一步的功能活性研究有助于仙草黄酮保健食品以及调味食品的高效开发。

