炮制对草乌中乌头类生物碱经皮吸收的影响及其贴剂的设计与评价
王启隆,刘 超,权 鹏,方 亮*,王延年*
1.沈阳药科大学中药学院,辽宁 沈阳 110000
2.沈阳药科大学药学院,辽宁 沈阳 110000
草乌是毛茛科植物北乌头Aconitum kusnezoffiiReichb.的干燥块根。《中国药典》2020年版记载草乌具有祛风除湿、温经止痛的功能,用于风寒湿痹、关节疼痛、心腹冷痛、寒疝作痛及麻醉止痛等[1]。乌头碱、新乌头碱、次乌头碱、苯甲酰乌头碱(BAC)、苯甲酰新乌头碱(BMA)和苯甲酰次乌头碱(BHA)被认为是草乌中具有主要药理作用的乌头类生物碱(aconitine alkaloids,AAs)[2]。因为草乌具有很高的毒性,所以临床上经常将草乌炮制后使用,草乌炮制后毒性较高的双酯型AAs(乌头碱、次乌头碱、新乌头碱)水解成毒性较低的单酯型AAs(BAC、BHA、BMA),毒性大大降低[3]。
经皮给药系统(transdermal drug delivery system,TDDS)是最适合草乌的给药方案之一。一方面,由于角质层对药物透过皮肤有较高的屏障作用,使药物的经皮渗透量有限,提高了草乌的用药安全性。另一方面,6 种AAs 注射后半衰期均小于1 h[4],因此能维持血药浓度相对稳定的贴剂,满足草乌的长效镇痛、抗炎作用。而且经皮给药也可减少给药频率,患者可自行给药,提高患者依从性[5]。以往研究,炮制草乌只是用来减弱其毒性[6]。但是很少提及炮制对草乌中6 种AAs 经皮吸收的影响,以及比较分别含有生、制草乌提取物的贴片的疗效。压敏胶分散型贴剂是制备工艺简单和生产成本较低的一种贴剂。压敏胶层既发挥贴敷皮肤的作用,又具有形成药物储库、控制药物释放的作用,适合中药的特点[7]。本研究分别将生、制草乌提取物制成压敏胶分散型贴剂。通过体外透皮实验,探讨生、制草乌提取物中6 种AAs 的透皮行为差异,并优化透皮贴片处方。最后,考察含生、制草乌提取物的最佳贴片抗炎、镇痛效果的差异。
1 材料与仪器
1.1 试剂与药材
生草乌(批号170528)购自安徽亳州中药材市场,经沈阳药科大学中药学院中药炮制与制药研究室主任王延年副教授鉴定为毛茛科植物北乌头A.kusnezoffiiReichb.的干燥块根。对照品乌头碱(批号17110910)、新乌头碱(批号17111010)、次乌头碱(批号17111310)、BAC(批号17102610)、BMA(批号18032406)、BHA(批号18032807)购自北京中科质检生物技术有限公司,6 种对照品的质量分数均在 98%以上。DURO-TAK®87-2287、87-4098、87-2852,德国汉高公司;ScotchPak™ 9744防黏层和CotranTM9707 背衬层,美国3M 公司;油酸,上海麦克林生化有限公司;氮酮,上海阿拉丁试剂有限公司;Transcutol®P(TP)、Labrafil®M 1944 CS(LM)、Plurol®Oleique CC497(POCC)和CapryolTM90(CP),法国Gattefossé公司;辛癸酸甘油酯(glycerol monocaprylocaprate,ODO),河南郑州河食品科技有限公司;NKA-II 型号大孔吸附树脂,天津市光复科技发展有限公司;弗氏完全佐剂(complete Freund’s adjuvant,CFA),美国Sigma- Aldrich 公司;双氯芬酸二乙胺贴剂,韩国Samyang生物制药有限公司,72 mg/30 cm2。
1.2 实验动物
Wistar 雄性大鼠,体质量180~220 g;KM 雄性小鼠,体质量18~22 g;大鼠和小鼠均购自沈阳药科大学实验动物中心。本实验经沈阳药科大学实验动物伦理委员会批准,批准号:No.SYPU- IACUC-C2019-12-14-207 和 No.SYPU-IACUC- C2019- 12-20-107。
1.3 仪器
Chromaster 型高效液相色谱仪,日本Hitachi公司;TSY-1 多功能扩散仪,沈阳药科大学和延边大学联合研制;Xiang Yi H-2050R 高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;AL-104电子天平,梅特勒-托利多仪器有限公司;FE20 型实验室pH 计,上海梅特勒-托利多仪器有限公司;CJJ-6 六联磁力搅拌器,上海君竺仪器有限公司;TB-1 实验用框式涂布器,上海锴凯科技贸易有限公司;SZ-96 自动纯水蒸馏器,上海亚荣生化仪器厂;科德士宠物用电推剪,深圳科德士电子厂;Braun3770 贴面剃须刀,博朗上海有限公司。
2 方法与结果
2.1 生草乌的炮制
根据《中国药典》2020年版方法将生草乌进行炮制[1]。将生草乌用饮用水冲洗干净,然后用饮用水浸泡72 h,直至内无白干心。将草乌放入沸水中煮5 h,切成2 mm 左右的薄片,放入40 ℃的烘箱中烘干。
2.2 6 种AAs 的提取
根据文献方法[8]分别从生草乌和制草乌中提取6 种AAs,用75%乙醇分别溶解生草乌和制草乌粉末(10 mL 溶剂∶1 g 药材粉末),超声提取40 min。提取液经大孔吸附树脂柱富集纯化,得到的样品真空干燥。获得的淡黄色粉末经HPLC 分析。生草乌中乌头碱、次乌头碱和新乌头碱总量为0.23%,BMA、BAC 和BHA 的总量为0.021%。制草乌中BMA、BAC 和BHA 的总量为0.063%,乌头碱、次乌头碱和新乌头碱总量为0.018%,均符合《中国药典》2020年版标准。AAs 在经过富集纯化后得到的生草乌提取物粉末和制草乌提取物粉末中的质量分数分别为59.3%、59.1%。经过炮制,BAC、BMA和BHA 的质量分数分别由3.8%、9.2%、0.4%提高至22.7%、32.9%、2.1%,而乌头碱、次乌头碱和新乌头碱的质量分数分别由19.6%、24.3%、2.0%降低至0.5%、0.6%、0.3%。
2.3 压敏胶分散型贴剂的制备工艺
采用溶剂蒸发法分别制备包含生草乌和制草乌提取物的贴片[9]。将生、制草乌提取物及“2.6.2”项中所选6 种化学渗透增强剂(油酸、LM、CP、POCC、TP、氮酮,用量均为10%)分别按质量加入适量乙醇中,室温下与压敏胶搅拌2 h,得到混合均匀的药物-压敏胶混合物。然后用实验室涂层装置将得到的混合物涂在ScotchpakTM9744 防黏层上。将涂好的防黏层在室温下放置15 min,然后在50 ℃的烘箱中烘15 min 以除去溶剂。然后将背衬(ScotchpakTM9707)覆盖在烘干后的防黏层上。最后将药物-压敏胶层裁剪成0.95 cm2进一步使用。
2.4 6 种AAs 分析方法的建立
2.4.1 色谱条件 色谱柱为Kromasil C18柱(250 mm×4.6 mm,5 μm)。根据《中国药典》2020年版稍加修改,流动相为乙腈-四氢呋喃(25∶15,A)和0.1 mol/L 醋酸铵(每升纯化水中加入冰醋酸0.5 mL,B);梯度洗脱条件:0~16 min,6%~20% A;16~50 min,20%~25% A;50~60 min,25%~6% A;体积流量1 mL/min;柱温35 ℃;进样体积20 μL;检测波长235 nm。
2.4.2 线性关系考察 分别精密称取6 种AAs 对照品适量,加甲醇制成质量浓度均为400 μg/mL 的6种对照品的母液,分别精密移取6 种对照品母液各1 mL 置于同一10 mL 量瓶中,加甲醇稀释至刻度,得混合对照品溶液。
分别精密移取混合对照品溶液0.10、0.25、0.50、1.00、2.00、4.00 mL 至100 mL 量瓶中,加甲醇稀释至刻度,摇匀,即得混合对照品系列溶液。照“2.4.1”项色谱条件进行HPLC 检测,见图1。
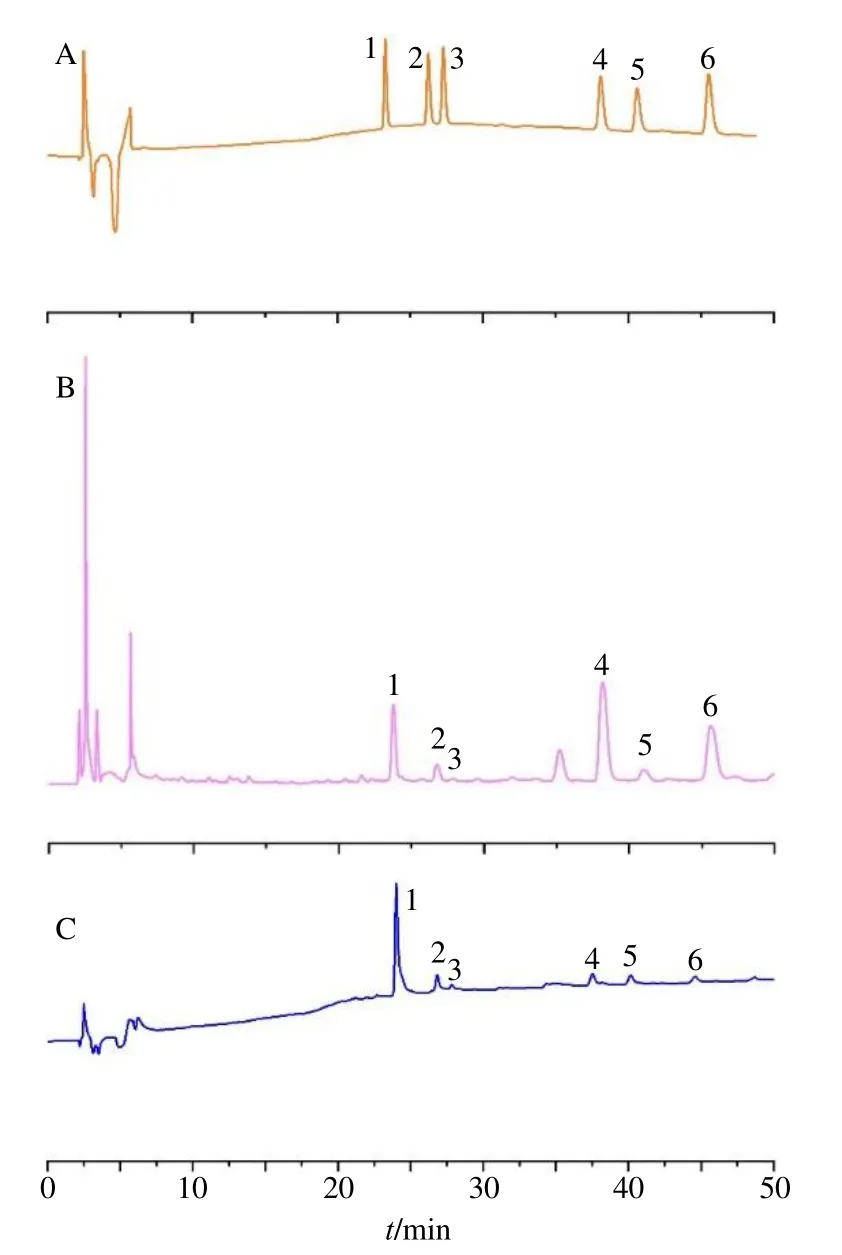
图1 6 种AAs 混合对照品 (A)、生草乌样品 (B) 和制草乌样品 (C) 的HPLC 图Fig.1 HPLC of six AAs mixed reference substances (A), AKR sample (B) and AKRC sample (C)
以进样质量浓度值为横坐标(X),峰面积值为纵坐标(Y),绘制标准曲线并进行线性回归,得回归方程分别为BMAY=18 558X+545.28,R2=0.999 8,线性范围0.42~39.91 μg/mL;BACY=17 127X+3 667.9,R2=1.000 0,线性范围0.41~41.20 μg/mL;BHAY=14 691X+2 074.4,R2= 0.999 9,线性范围0.42~40.20 μg/mL;新乌头碱Y=18 914X-1 484.5,R2=0.999 8,线性范围0.39~39.10 μg/mL;次乌头碱Y=16 612X+3170,R2= 0.999 8,线性范围0.41~41.20 μg/mL;乌头碱Y=17 481X-639.5,R2=0.999 6,线性范围0.41~39.60 μg/mL;结果表明6 种AAs 在线性范围均呈良好线性关系。本实验所用HPLC 的检测限为0.05 μg/mL。
2.4.3 精密度试验 配制低、中、高质量浓度(1.00、5.00、25.00 μg/mL)的由6 种AAs 组成的混合对照品溶液。在同1 d 平行操作6 次测定3 种不同质量浓度混合对照品溶液峰面积,并代入“2.4.2”项中线性回归方程,求得样品质量浓度,计算出RSD,得到该方法的日内精密度。3 种不同质量浓度混合对照品溶液同法连续测定3 d,根据相同的方法计算,即得到该方法的日间精密度。低、中、高质量浓度样品的日内精密度RSD 为乌头碱1.21%、1.75%、1.13%,次乌头碱1.25%、1.69%、1.81%,新乌头碱1.32%、1.57%、0.89%,BAC 1.28%、1.87%、1.15%,BHA 1.31%、0.75%、1.93%,BMA 1.26%、1.73%、1.29%;日间精密度RSD 为乌头碱1.57%、1.16%、1.36%,次乌头碱1.65%、1.88%、1.21%,新乌头碱1.42%、1.17%、1.89%,BAC 1.78%、0.67%、1.25%,BHA 1.61%、1.35%、1.83%,BMA 1.86%、1.53%、1.79%。结果表明本实验分析方法日内精密度和日间精密度均达到分析要求(RSD<2%)。
人文精神的最终表现为人文关怀,在悦纳自己、理解自己、自尊自爱的基础上,学会理解他人,尊重他人,产生利他心理。这是初中学生人格发展的高级阶段,实际的习得还需要通过日常的学习生活慢慢体会。在这种情况下,教师就必须对自己的教学行为有较高的要求,通过建立良好的师生关系,为学生树立一个“理解他人、尊重他人、关怀他人”的行为典范,以此凸显人文精神。例如,教师在教学之后,可以就某一问题与学生进行讨论,主动为学生提供帮助;在学生提出问题时应明确地、耐心地解答;在课下遇到有困难的学生应给予支持和关怀等。
2.4.4 稳定性试验 将“2.2”项提取出的生、制草乌溶液分别在提取后的0、2、4、8、12、24、36、48 h 在“2.4.1”项色谱条件下进样分析,记录色谱峰面积。生草乌提取液中6 种AAs 峰面积RSD 分别为乌头碱0.82%、次乌头碱0.67%、新乌头碱0.85%、BAC 1.04%、BHA 1.11%、BMA 0.76%。制草乌提取液中6 种AAs 峰面积RSD 分别为乌头碱1.02%、次乌头碱0.79%、新乌头碱0.91%、BAC 1.11%、BHA 1.34%、BMA 1.20%。结果表明生、制草乌提取液中的6 种AAs 均在48 h 内稳定。
2.4.5 重复性试验 分别取“2.2”项下同一时间提取出的生、制草乌溶液6 份,按“2.4.1”项色谱条件进行分析,生草乌提取液中6 种AAs 质量分数RSD 分别为乌头碱1.01%、次乌头碱1.15%、新乌头碱1.22%、BAC 1.38%、BHA 1.21%、BMA 1.36%,制草乌提取液中6 种AAs 质量分数RSD 分别为乌头碱0.91%、次乌头碱1.19%、新乌头碱0.98%、BAC 1.05%、BHA 0.84%、BMA 0.96%,RSD 均小于2%,表明该方法重复性良好。
2.4.6 加样回收率试验 取已知含5 mg 6 种AAs的草乌样品2 g,共9 份,3 份为1 组,分别精密加入含不同质量(4、5、6 mg)的6 种AAs 混合对照品溶液。按“2.2”项下的超声提取40 min 操作,得低、中、高质量浓度供试品溶液,在“2.4.1”项色谱条件分析测定,结果见表1。
2.5 体外经皮透过实验
2.5.1 离体鼠皮的制备和体外透皮实验 参考本课题组前期研究进行透皮实验[10]。雄性Wistar 大鼠用0.20 mg/mL 乌拉坦iv 麻醉,用宠物修剪器剃除其腹部的粗毛,再用剃须刀剃除残余的短毛。在麻醉状态下将大鼠脱颈椎处死后,立刻用弯剪刀剪下腹部皮肤并去除皮下的脂肪组织。通过显微镜检查皮肤的完整性,用生理盐水清洗皮肤,-70 ℃冷冻保存,1 周内用完。使用多功能透皮扩散仪(体积3.5 mL,有效扩散面积1.77 cm2)做体外透皮实验。制备的大鼠皮肤夹在供体室和接收室之间,将皮肤固定在扩散池上,角质层面向上,以pH 7.4 的磷酸盐缓冲液(PBS)为接收液,池内置磁力搅拌子,转速约600 r/min,保持透皮仪内温度恒定为32 ℃。在2、4、6、8、10、12、24 h 取2.0 mL 接收液样品后,立即将相同体积的新鲜接收液加入接收室中,以维持室内的漏槽条件。样品在0 ℃、16 000 r/min 离心7 min,再用HPLC 法分析上清液。计算药物单位面积累积渗透量(Qn)。
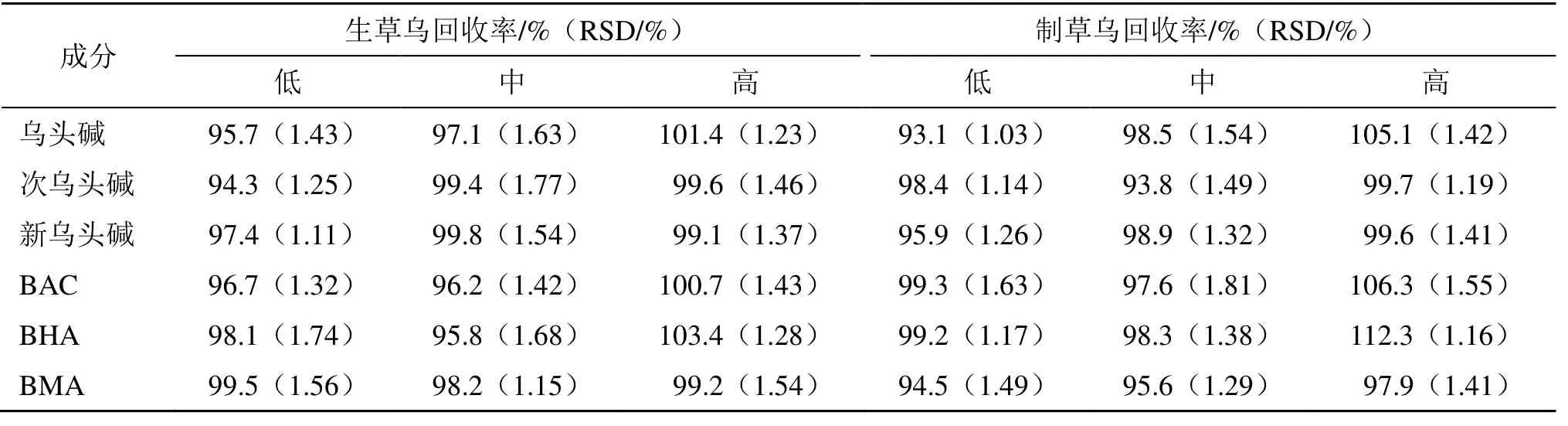
表1 生草乌和制草乌提取液中乌头碱、次乌头碱、新乌头碱、BAC、BHA 和BMA 的回收率 (n = 3)Table 1 Recoveries of aconitine, hypaconitine, mesaconitine, BAC, BHA and BMA in AKR and AKRC extract (n = 3)
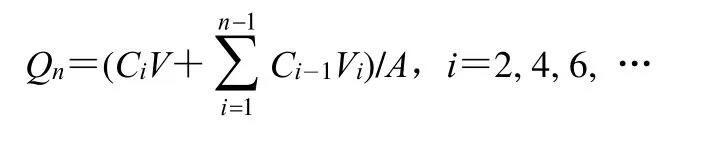
V为扩散池的体积(3.5 mL),Vi为每次取样的体积,Ci和Ci-1分别为第i次和第i-1 次取样时接收液中的药物质量浓度,A为有效扩散面积(0.95 cm2)
2.5.2 生、制草乌中6 种AAs 的经皮渗透性差异比较 在本实验中,选择ODO 作为药物溶剂,因为ODO 被证实对药物没有经皮渗透增强作用,且溶解度参数接近压敏胶(pressure-sensitive adhesive)[11]。分别将提取的生、制草乌粉末过饱和溶解在ODO中,来探究炮制草乌对其6 种AAs 的经皮渗透的影响。结果发现只有BMA 被检测到,表明BMA 是6种AAs 中最容易透过皮肤的。此外,BMA 是生草乌和制草乌中最重要的生物活性成分之一。因此,以BMA 24 h 的Qn(Q24)为指标来筛选最佳处方。制草乌供给液中BMA 的Q24(5.51±0.69)μg/cm2显著高于生草乌供给液中BMA 的Q24(2.53±0.31)μg/cm2(P<0.05)。
2.6 生、制草乌贴剂的处方筛选
2.6.1 压敏胶的筛选 由于压敏胶是透皮贴剂的最主要成分之一,在本研究中选择3 种市售聚丙烯酸酯压敏胶(DURO-TAK®87-2852、87-4098、87- 2287)进行考察。生、制草乌提取物均与压敏胶以1∶10 的比例混合,分别得到含有10%生、制备草乌提取物的混合物。再将得到的混合物制成透皮贴剂。透皮贴片的Q24见表2。结果显示,压敏胶为DURO-TAK®87-4098 的生、制草乌提取物透皮贴片中BMA 累积渗透量均显著高于DURO-TAK®87-2287、87-2852。
表2 压敏胶种类筛选结果 (± s, n = 4)Table 2 Screening results of pressure-sensitive adhesive type (± s, n= 4)

表2 压敏胶种类筛选结果 (± s, n = 4)Table 2 Screening results of pressure-sensitive adhesive type (± s, n= 4)
与处方DURO-TAK® 87-4098 比较:*P<0.05*P < 0.05 vs DURO-TAK® 87-4098
压敏胶 生草乌Q2 4 /(μg·cm-制2) 草乌 DURO-TAK® 87-4098 1.36±0.15 3.20±0.15 DURO-TAK® 87-2287 0.91±0.11* 2.11±0.24* DURO-TAK® 87-2852 0.73±0.10* 1.62±0.18*
2.6.2 贴剂中促透剂的筛选 本实验考察了6 种渗透促进剂(10%)对生、制草乌中BMA 的促透作用。发现油酸对生、制草乌中的BMA 渗透促进作用均最大,渗透增强比(ER)分别为4.57、9.93。进一步探索油酸用量对生、制草乌提取物中BMA皮肤渗透性的影响,结果见表3。10%、15%的油酸用量的Q24均明显高于5%油酸且10%、15%油酸用量的Q24无显著性差异。为了减少压敏胶与化学促进剂潜在副作用,选择使用10%油酸。
表3 渗透促进剂筛选结果 (± s, n = 4)Table 3 Screening results of permeation enhancers (± s, n = 4)
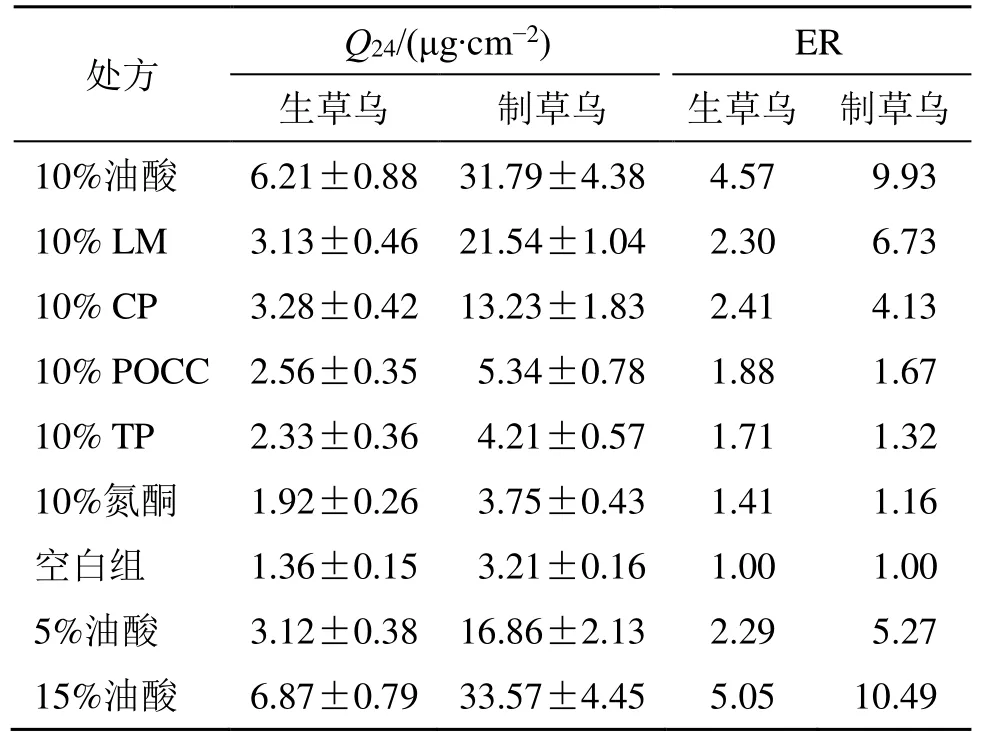
表3 渗透促进剂筛选结果 (± s, n = 4)Table 3 Screening results of permeation enhancers (± s, n = 4)
处方 生草Q乌24 / (μg·cm制-2草) 乌 生草乌E R制 草乌 10%油酸 6.21±0.88 31.79±4.38 4.57 9.93 10% LM 3.13±0.46 21.54±1.04 2.30 6.73 10% CP 3.28±0.42 13.23±1.83 2.41 4.13 10% POCC 2.56±0.35 5.34±0.78 1.88 1.67 10% TP 2.33±0.36 4.21±0.57 1.71 1.32 10%氮酮 1.92±0.26 3.75±0.43 1.41 1.16 空白组 1.36±0.15 3.21±0.16 1.00 1.00 5%油酸 3.12±0.38 16.86±2.13 2.29 5.27 15%油酸 6.87±0.79 33.57±4.45 5.05 10.49


表4 生、制草乌贴剂的最佳处方Table 4 Optimal formulation of patches of AKR and AKRC extract
2.7 含生、制草乌提取物的透皮贴剂的药效学比较研究
2.7.1 抗炎活性评估 采用CFA 诱导的大鼠佐剂性关节炎模型来评价本实验透皮贴片的抗炎活性。取雄性Wistar 大鼠30 只,随机分为5 组,每组6只。按如下方式处理:(1)空白对照组:不给予贴剂;(2)阴性对照组:给予不含药物的空白贴片(30 cm2);(3)阳性对照组:给予双氯芬酸二乙胺贴剂(6 cm2,含双氯芬酸二乙胺14.70 mg);(4)生草乌贴剂:给予生草乌透皮贴剂(30 cm2,含AAs 17.30 mg);(5)制草乌贴剂:给予制草乌透皮贴剂(30 cm2,含AAs 17.30 mg)。注射CFA 前测量大鼠双侧后爪的体积作为基线值。空白对照组大鼠的双侧后爪注射生理盐水0.1 mL,其他组分别注射CFA 0.1 mL。注射CFA 后,在0.5、3、5、7、9、11 d 测量足爪体积。在第5 天,除空白对照组外,其余组均在大鼠腹部皮肤上贴上对应的透皮贴片,贴敷7 d。各组大鼠足肿胀度(S)按下式计算。

其中Vn和Vt分别是大鼠注射CFA 前后的足趾体积
贴片的抗炎作用如图2 所示。虽然这些贴片是应用于非炎症区域的,但是与阴性对照组相比,阳性对照组和实验组在9 d 和11 d 仍表现出明显抑制爪肿胀效应(P<0.05)。此外,制草乌组的抗炎作用明显优于生草乌组(P<0.05)。各组间两侧后足抑肿程度比较均无统计学差异(P>0.05)。因此,炮制增强了草乌贴剂的抗炎作用,本研究进一步验证局部应用生、制草乌透皮贴剂后,AAs 主要通过血液循环传递药物至关节组织,从而达到治疗类风湿性关节炎的作用[12]。

图2 造模后左、右后足足趾肿胀度变化曲线 (n = 6)Fig.2 Profiles of swelling degree of left and right feet after CFA injection (n = 6)
2.7.2 镇痛作用评估 采用小鼠醋酸扭体实验探究生、制草乌贴片的镇痛作用差异。选用体质量在18~22 g 雄性KM 小鼠50 只。在小鼠腹部相同位置剃毛,给药前不麻醉。将小鼠随机分为5 组,每组10 只,按如下处理:(1)空白对照组:不给药;(2)阴性对照组:给予不含药物的空白贴片(4.5 cm2);(3)阳性对照组:给予双氯芬酸二乙胺贴剂(4.5 cm2,双氯芬酸二乙胺11.05 mg);(4)生草乌贴剂组:给予生草乌透皮贴剂(4.5 cm2,AAs 2.6 mg);(5)制草乌贴剂组:给予制草乌透皮贴剂(4.5 cm2,AAs 2.6 mg)。给药3 h 后,去除贴剂,将每只小鼠ip 0.2 mL 醋酸溶液(1%)以引起扭体反应,并记录20 min 内的扭体次数(W),计算疼痛抑制率来评估止痛效果。一般认为,疼痛抑制率高于50%,表明镇痛制剂是有效的[13]。如表5 所示,生、制草乌组与空白对照组相比均显著减少了扭体次数(P<0.05)。而且发现制草乌贴剂的镇痛效果比生草乌贴剂更显著(P<0.05)。结果表明,炮制增强了草乌贴剂的镇痛作用。
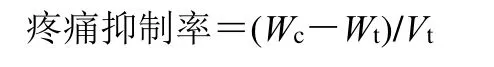
Wc和Wt分别是空白对照组和实验组的平均扭体次数
表5 生、制草乌贴剂对醋酸所致疼痛的镇痛作用 (± s,n = 10)Table 5 Analgesic effect of AKR patch and AKRC patch on pain induced by acetic acid (± s, n = 10)
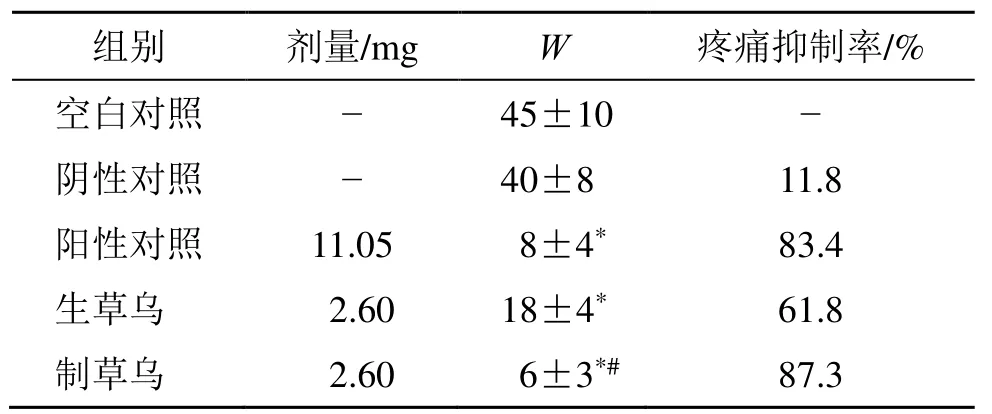
表5 生、制草乌贴剂对醋酸所致疼痛的镇痛作用 (± s,n = 10)Table 5 Analgesic effect of AKR patch and AKRC patch on pain induced by acetic acid (± s, n = 10)
与空白对照组比较:*P<0.05;与生草乌组比较:#P<0.05*P < 0.05 vs blank control group; #P < 0.05 vs AKR group
组别 剂量/mg W 疼痛抑制率/% 空白对照 - 45±10 - 阴性对照 - 40±8 11.8 阳性对照 11.05 8±4* 83.4 生草乌 2.60 18±4* 61.8 制草乌 2.60 6±3*# 87.3
3 讨论
多年来,草乌因其显著的药效和不良反应受到人们的关注。更是许多中药处方的主要成分[14]。乌头碱、HAC 和MAC 是草乌的主要有毒成分。在之前的研究中仅证明炮制草乌可以降低其毒性[15]。然而,炮制草乌是否也能改善其中6 种主要AAs 的经皮吸收,并提高其疗效仍不清楚。在本研究中,将草乌制成贴剂,使其缓慢和少量地进入体内,这增加了药物的安全性和药效持续时间。
然而,以往的文献很少提及AAs 在草乌中的透皮渗透性差异。因为药物在皮肤中的扩散是被动扩散,依赖于浓度梯度,而且药物的相对分子质量越小,越容易渗透到皮肤中[16]。而BMA 在生、制草乌中是最丰富的成分之一,在AAs 中相对分子质量仅大于BHA。因此,推测BMA 在AAs 具有最强的透皮渗透性。通过药物溶液的体外透皮实验证实了此猜想。
本实验考察了贴剂中压敏胶种类、化学促透剂种类及其浓度、药物含量对生、制草乌提取物经皮渗透量的影响。其中 DURO-TAK®87-2287 和DURO-TAK®87-2852 2 个压敏胶均显著低于DURO-TAK®87-4098 的Q24。这可能因为这2 种压敏胶中的羟基和羧基与BMA 中的羟基存在氢键相互作用,使BMA 从压敏胶中的释放能力降低[9]。油酸是考察的6 种化学促透剂中效果最好的,原因可能是油酸中的羧基与BMA 的羟基形成氢键,破坏了DURO-TAK®87-4098 压敏胶中的酯基与BMA的羟基之间的氢键相互作用,从而促进贴剂中的药物释放[17]。
由于BMA 呈碱性,可与油酸形成离子对,形成了中性分子,从而增强其经皮渗透性。此外,油酸可与角质层的细胞间脂质相互作用,破坏脂质排列,从而增加细胞间脂质的流动性,增强药物的经皮渗透能力[9]。虽然通过溶液系统实验只能检测到BMA,但仍需要对最佳贴剂中其他5 种AAs 的累积透皮量进行测定。
在本实验中,发现含制草乌提取物最佳贴片中AAs 的Q24约为含生草乌提取物最佳贴片的2 倍。因为在草乌炮制后,在本实验所用的扩散池模型中几乎不吸收的毒性AAs 含量降低,而在AAs 中具有最强透皮性BMA 含量增加,从而增强了草乌中AAs 的经皮透过量。因此,炮制草乌不仅降低了毒性AAs 的含量,而且促进了AAs 的经皮吸收。对于透皮贴剂,药物经皮吸收的结果通常与体内治疗效果密切相关,活性药物成分累积渗透量越多,通常治疗效果好[18]。因此,AAs 经皮渗透量较高的制草乌贴剂的镇痛和抗炎效果应优于生草乌贴剂,该推论在药效学实验中得到验证。因此,炮制草乌不仅可以提高其用药安全性,而且可以提高在皮肤外部使用草乌时的有效性。
本实验制备了分别含有生、制草乌提取物的压敏胶分散型透皮贴片,显示出良好的镇痛抗炎作用。而且,发现BMA 在AAs 中具有最强的经皮渗透性。因此,炮制草乌提高了草乌贴片的有效性和安全性。制备的含制草乌提取物的透皮贴片可作为治疗类风湿性关节炎的候选药物。
利益冲突所有作者均声明不存在利益冲突

