不同批次新生牛血清对CHO细胞培养效果的研究
马春英,王美皓,马 花,佛生福,乔自林,马忠仁,王家敏
(1.西北民族大学 生物医学研究中心甘肃省动物细胞技术创新中心,甘肃 兰州 730030;2.西北民族大学 生物工程与技术国家民委重点实验室,甘肃 兰州 730030;3.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;4.兰州百灵生物技术有限公司,甘肃 兰州 730010)
CHO细胞(Chinese hamster ovary cell)由Puck TT于1957年从成年中国仓鼠卵巢组织分离、培养、建立的,呈上皮样贴壁生长.该细胞被广泛应用于各种诊断性、治疗性蛋白质的表达,包括重组抗体、重组单体蛋白及重组融合蛋白等,CHO细胞已经成为了生物制品领域最主要的生产细胞[1-5].贴壁型的传代细胞可用细胞工厂和微载体技术规模化培养,生产中可将细胞生长和蛋白表达控制在最适条件范围内,提高细胞密度和蛋白表达量,实现大批次量、小批间差,产品更具有稳定性和安全性,节省大量的劳动力、生产场地和能源消耗,降低生产成本[6-7].血清具有终止胰蛋白酶消化,提供细胞生长所需的贴壁因子、免疫球蛋白、胰岛素等其他营养物质.在动物血清中牛血清又是最常用、最合适、最有效的培养基成分.在培养基中加入适量的牛血清,不仅可以有效促进细胞的生长繁殖,还能够缩短细胞的生长周期,从而加快生物制品的生产,提高生物制品的产量,为生物制品生产企业带来更多的利润[8].目前市场上血清种类繁多,质量参差不齐,因此研究不同种类血清对细胞培养的影响,建立快速有效的血清筛选方法具有重要的现实意义[9].本文通过兰州民海生物工程有限公司生产的不同批号国产优级新生牛血清对CHO细胞复苏和传代培养的对比试验研究,寻找对CHO细胞培养效果最佳的国产新生牛血清,从而为生物制品的研发节约成本、节省时间.
1 材料与方法
1.1 材料
细胞:贴壁培养型CHO细胞从ATCC引进,引进后由甘肃省动物细胞技术创新中心冻存.
培养基:F12购自兰州百灵生物技术有限公司,批号20170115.
血清:6个批号的新生牛血清,购自兰州民海生物工程有限公司,使用时按10%(V/V)添加到培养基中,编号及批号信息见表1.

表1 新生牛血清编号及批号信息表
微载体:Cytodex1,GE Healthcare Cytodex-1;货号:17-0488-03;批号:10225274;产地:瑞典;包装:5kg;有效期:2022.04.
微载体处理方法:称取10 g微载体至2 L微载体处理瓶中,加入1.0 L(10 g)新鲜配制的PBS(无Ca2+、Mg2+,pH7.2)溶胀3h,再用PBS(无Ca2+、Mg2+,pH7.2)清洗3遍,定容至1.0 L(10 g),121 ℃、60 min高压灭菌,灭菌结束后,待载体放置室温用F12清洗3遍后定容至475 mL,最后补加25 mL新生牛血清(10% NBS),配制成20 g/L浓度的微载体悬液,取样菌检.
主要试剂及仪器:0.25%胰蛋白酶、0.2%台盼蓝、结晶紫染液、T75细胞培养瓶、60 mm细胞培养皿、250 mL双侧臂悬浮培养瓶、磁力搅拌器、生物微倒置显微镜、CO2培养箱、细胞计数仪等.
1.2 方法
1.2.1 静置培养CHO细胞传代稳定性观察
用含有10% 新生牛血清的F12完全培养基复苏CHO细胞,待细胞生长至致密单层时,分别用含有6个批号新生牛血清的F12培养基培养并连续传代5代,传代时细胞均按照1∶4比例,置于5%CO2、37 ℃培养箱中培养.每代细胞在24 h、48 h拍照观察细胞形态、长势、致密程度.
1.2.2 静置培养CHO细胞克隆形成率分析
克隆形成率是指贴壁细胞在低细胞密度下的集落形成,也就是克隆效率,是判断细胞增殖能力的重要指标之一.取第3代、第4代、第5代的6个批号新生牛血清培养生长状态良好且铺满单层的CHO细胞,消化,制成细胞悬液,按照100个细胞/皿的细胞量接种细胞培养皿,并做平行3皿.将细胞培养皿放置5%CO2、37 ℃培养箱中进行培养8天,出现集落后,用吸管吸去培养液,用PBS清洗,无水甲醇固定,结晶紫染色.观察并对细胞集落计数,计算平均值.
克隆形成率(%)=(所形成集落数/接种细胞数)×100%
1.2.3 微载体悬浮培养CHO细胞生长状态、生长曲线及生长动力学分析
取第5代6个批号新生牛血清培养生长状态良好且铺满单层的CHO细胞,分别用0.25%的胰蛋白酶消化,用0.2%台盼蓝染色计数,在250 mL双侧臂悬浮培养瓶中,按细胞15个/球,接种至200 mL 2 g/L Cytodex1微载体悬液内,50 rpm、5%CO2、37 ℃培养,每24 h取样观察细胞生长状态,结晶紫计数.按照此方法,对培养至第6代、第9代的CHO细胞重复上述试验,计算三次平均值,绘制细胞生长曲线.并比较6个批号新生牛血清培养CHO细胞的平均最大増殖密度、平均倍增时间[10]、平均比生长速率[11].
倍增时间=T/A,A=log2(Y/X)
X为初始接种细胞数,Y为细胞最大増殖密度前一天的细胞数,T为培养时间.
比生长速率=(lnXn/Xn-1)/(tn-tn-1)
X为活细胞密度,t为培养时间,n和n-1为2个取样计数时间点.
1.2.4 使用Graphpad prism 8软件进行统计学分析,计量资料以均数±标准差表示,采用t检验,以P<0.05为差异有统计学意义.
2 结果
2.1 静置培养CHO细胞传代稳定性观察
分别用含有10%血清复苏CHO工作库细胞,细胞生长良好(图1),传代2代后转为分别含有6个批号新生牛血清培养,连续传代培养5代,均能较好促进细胞的生长增殖,细胞形态呈扁平状,形态较为规则,细胞贴壁后呈三角形及不规则扁平的多角形,中央有扁圆形核,细胞之间相互衔接或呈镶嵌状紧密排列.6个批号新生牛血清分别培养CHO细胞至第5代效果(见图2),结果发现6个批号新生牛血清培养CHO细胞长势和形态无明显差异.
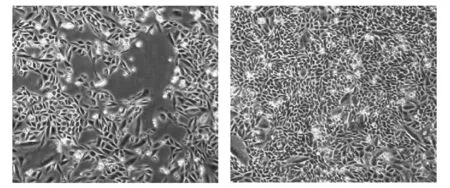
图1 CHO细胞复苏静置培养状态(A:24h,40×;B:48h,40×)

图2 6个批号新生牛血清静置培养CHO细胞(第5代)效果比较(40×)
2.2 静置培养CHO细胞克隆率分析
6个批号新生牛血清培养CHO细胞均形成了有效的集落数,平均集落形成率从高到低依次为D、F、B、E、C、A血清组,分别为103.67±2.33%,93.67±2.33%,84.00±2.00%,57.00±6.00%,51.33±3.33%,37.67±1.67%,且D、F、B组显著高于E组,A组显著低于E组(P<0.05).集落形成效果见图3,克隆形成率分析结果见图4.

图3 6个批号新生牛血清静置培养CHO细胞形成集落
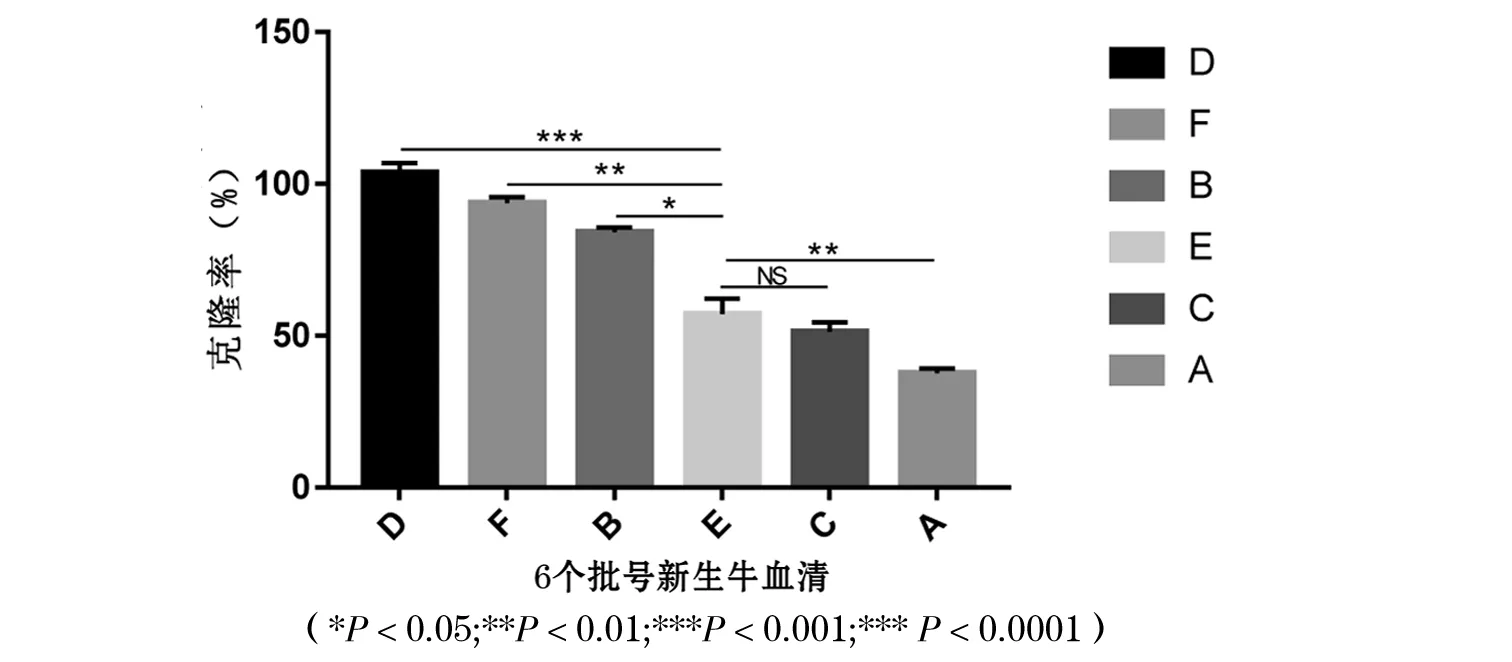
图4 6个批号新生牛血清静置培养CHO细胞克隆率比较
2.3 微载体悬浮培养CHO细胞生长状态、生长曲线及生长动力学分析
6个批号新生牛血清微载体悬浮培养CHO细胞效果比较见图5,生长曲线分析见图6,平均比生长速率分析见图7,平均最大增殖密度和平均倍增时间比较分析见图8、图9和表2.6个批号新生牛血清均能实现CHO细胞的微载体悬浮培养,对比发现B、D、F优于A、C,E最差;细胞生长曲线均呈“S”型,但D、F、B试验组能较好促进CHO细胞的生长增殖,生长动力学分析发现平均比生长速率、平均倍增时间和最大增殖浓度从高到低依次为D、F、B、E、A、C血清组,且D、F组显著高于E组(P<0.05).

图5 6个批号新生牛血清分别微载体悬浮培养CHO细胞效果比较(100×)

图6 6个批号新生牛血清微载体悬浮培养CHO细胞生长曲线
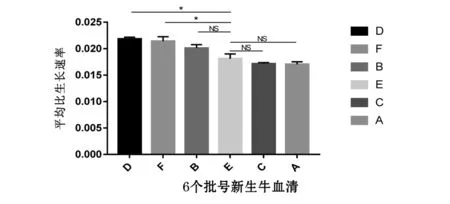
图7 6个批号新生牛血清微载体悬浮培养CHO细胞平均比生长速率(*P<0.05)
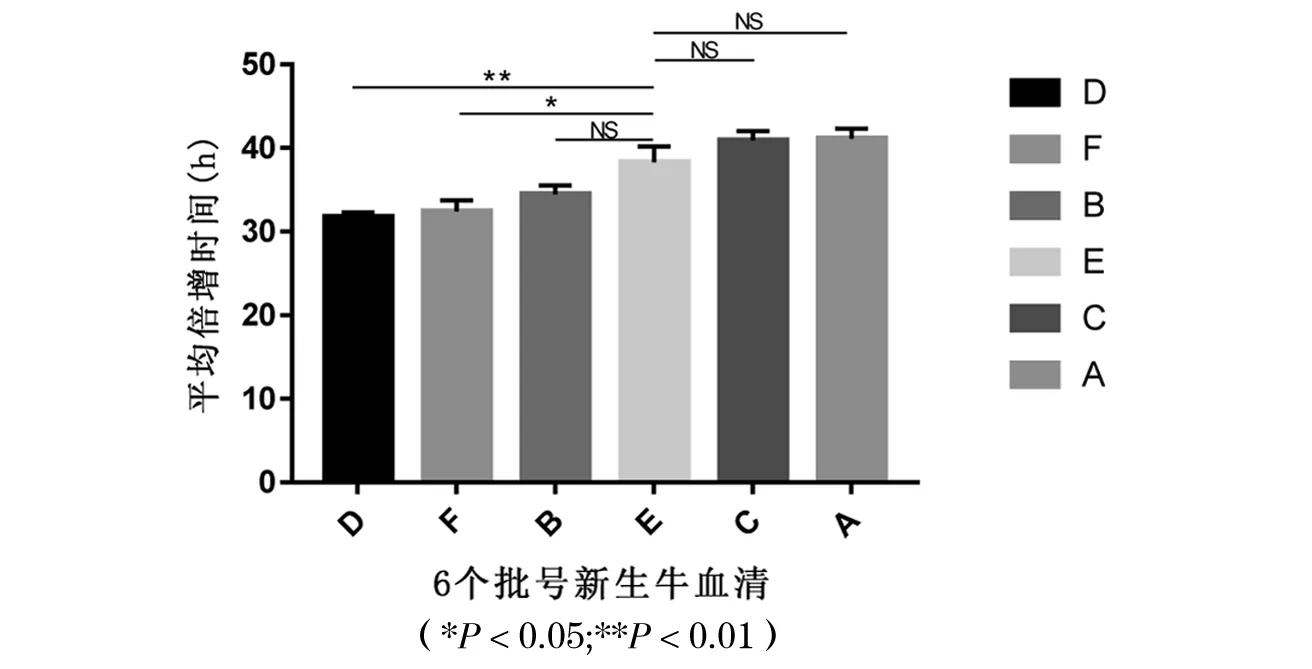
图8 6个批号新生牛血清培养CHO细胞微载体悬浮平均倍增时间

图9 6个批号新生牛血清培养CHO细胞微载体悬浮平均最大增殖密度

表2 6个批号新生牛血清CHO细胞微载体悬浮培养平均倍增时间和平均最大增殖密度
3 讨论与结论
CHO 细胞系在生物制药领域备受瞩目,主要原因:首先,CHO 细胞系具有很高的安全性(CHO基因组内不携带任何人源性病毒);其次,CHO细胞系表达的重组蛋白能够获得类似于人源蛋白的翻译后修饰,表达的重组蛋白更具生物活性[12].
在培养贴壁型CHO细胞时,血清是最常用、最合适、最有效的培养基成分.血清选择不当,不仅会导致细胞生长缓慢、连续传代培养过程中细胞生长不稳定,而且由于血清价格昂贵,大规模生产时成本高.血清的选择直接关系到研发进度和生物制品生产企业的经济效益[13].本研究针对以上问题,分别用静置培养传代稳定性观察、克隆形成率和微载体悬浮培养生长曲线、生长动力学分析评价了国产新生牛血清对CHO贴壁细胞的促生长效果的影响.结果显示,6个批次血清中,CHO细胞在3组新生牛血清中能连续传代和扩大培养,细胞生长动力学较稳定.
本试验通过研究不同批次的新生牛血清对CHO细胞培养效果的影响,不仅在短时间内成功筛选出了培养CHO细胞的最佳血清,而且也为生物制品生产中CHO细胞扩大培养提供试验依据.这种快速有效的血清筛选方法缩短了疫苗研发、生产的时间,节省了疫苗企业的生产成本.
本研究中6个批号的国产新生牛血清培养CHO细胞均形成了有效的集落数,平均集落形成率从高到低依次为D、F、B、E、C、A血清组,分别为103.67±2.33%,93.67±2.33%,84.00±2.00%,57.00±6.00%,51.33±3.33%,37.67±1.67%.6个批号新生牛血清均能实现CHO细胞的微载体悬浮培养,对比发现B、D、F优于A、C,E最差,且D、F、B组显著高于E组,A组显著低于E组(P<0.05);生长动力学分析发现平均比生长速率、平均倍增时间和最大增殖浓度从高到低依次为D、F、B、E、C、A血清组,且D、F组显著高于E组(P<0.05).这可能与不同批次新生牛血清中所含的激素及其他活性物质等组份与比例不同有关[14-15].如纤维粘连素、胰岛素、α2巨球蛋白、胎球蛋白、转铁蛋白、血小板促生长因子、表皮细胞生长因子、神经细胞生长因子等在细胞培养中各自发挥的生理功能,还有待进一步研究.另外,胎牛血清的免疫球蛋白含量要远远低于新生牛血清,胎牛的血清相对来说比较纯,所以培养细胞的效果会更佳[16].除此之外还可能是由于牛血清中存在大量的脂蛋白,贮存不当会造成血清营养流失,导致给细胞供应营养的能力减弱,造成了细胞的生长缓慢[17-18].

