山西省窖藏薯类块茎中2种短体线虫的种类鉴定
丰叶青 姚亚楠 杜娟 杨艺萌 徐玉梅 赵增旗 王建明

摘要 :本文采用传统形态学与分子生物学相结合的方法,对采自山西省窖藏马铃薯和薯蓣块茎中的短体线虫进行了种类鉴定。结果表明,从马铃薯块茎中分离出的短体线虫形态学特征与斯克里布纳短体线虫Pratylenchus scribneri一致,其SSU序列与P.scribneri美国群体相似性达99.8%。从薯蓣块茎中分离出的短体线虫形态学特征与咖啡短体线虫P.coffeae一致,其ITS序列与P.coffeae浙江群体相似性达98.8%。斯克里布纳短体线虫首次在我国马铃薯块茎中发现,咖啡短体线虫首次在山西省薯蓣块茎中发现。
关键词 :山西; 马铃薯; 薯蓣; 斯克里布纳短体线虫; 咖啡短体线虫; 鉴定
中图分类号:
S 432.45
文献标识码: A
DOI: 10.16688/j.zwbh.2020036
Identification of two species of Pratylenchus (Nematoda: Pratylenchidae) from
the tubers of potato and yam in storage in Shanxi province
FENG Yeqing1, YAO Yanan1, DU Juan1, YANG Yimeng1, XU Yumei1*, ZHAO Zengqi1,2, WANG Jianming1
(1. College of Plant Protection, Shanxi Agricultural University, Jinzhong 030801, China;
2. Manaaki Whenua-Landcare Research, Auckland 1072, New Zealand)
Abstract
Two species of Pratylenchus, collected from the tubers of potato and yam in storage in Shanxi province, were identified based on morphological and molecular analyses in this study. The results showed that the morphological characteristics of the nematode population extracted from potato tubers were consistent with those of P.scribneri. It had 99.8% nucleotide similarity in SSU gene sequence with an American P.scribneri population. The morphological characteristics of the nematode population extracted from yam tubers were consistent with those of P.coffeae, with a 98.8% nucleotide similarity in ITS gene sequence with a Zhejiang Pcoffeae population. P.scribneri was first reported in potato tubers in China and P.coffeae was first found in yam tubers in Shanxi.
Key words
Shanxi province; potato; yam; Pratylenchus scribneri; Pratylenchus coffeae; identification
短體属线虫Pratylenchus Filipjev是一类根部迁移性、内寄生的植物病原线虫,可引起多种作物的根腐线虫病,其寄主范围和地理分布广泛,对寄主作物具有严重的经济危害性[1],可给农业生产造成极大的损失[2]。
目前全球范围内已报道的短体线虫有效种为106种[36],我国报道的有30余种,其中有些种类因缺乏详细的形态学或分子生物学数据而暂不列为有效种[79]。目前将咖啡短体线虫P.coffeae、穿刺短体线虫P.penetrans、伤残短体线虫P.vulnus、玉米短体线虫P.zeae、蒿短体线虫P.artemisiae和薯蓣短体线虫P.dioscoreae共6种列为中国种。
2017年-2019年,在对山西省薯类线虫病害进行调查的过程中,从窖藏马铃薯和薯蓣块茎中各分离到一种短体线虫。为明确其种类,本文采用了形态学和分子生物学相结合的方法,对马铃薯和薯蓣块茎中分离到的短体线虫进行了鉴定。
1 材料与方法
1.1 线虫样本的采集和分离
2019年4月自山西省晋中市太谷区桑梓村(112°37′46″E,37°26′54″N,海拔817 m)采集马铃薯Solanum tuberosum和薯蓣Dioscorea polystachya窖藏块茎样本,装入自封袋带回实验室。将2种块茎用自来水冲洗干净,晾干,切成约1 cm3的小块,采用浅盘法[10]分离,12 h后收集线虫。
1.2 线虫的杀死固定、形态观察和测量
挑取若干条线虫制成临时玻片,在体视显微镜(Motic SMZ-168,中国)下初步观察其形态特征。然后用4%甲醛热杀死固定,采用改进的甘油乙醇法[11]脱水,用脱水后的线虫制作永久玻片[12]。利用微分干涉光学显微镜(Nikon 80i,日本)观察、拍照并测量。采用de Man公式分析数据,并参照Castillo等[13]的方法进行种类鉴定。
1.3 线虫的DNA提取、PCR扩增测序和系统发育树构建
线虫DNA提取采用蛋白酶K法[1415]。
SSU PCR扩增采用2对引物:分别为上游引物1096F(5′-GGTAATTCTGGAGCTAATAC-3′)和下游引物1912R(5′-TTTACGGTCAGAACTAGGG-3′);上游引物1813F(5′-CTGCGTGAGAGGTGAAAT-3′) 和下游引物2646R(5′-GCTACCTTGTTACGACTTTT-3′)[16]。ITS PCR扩增采用上游引物FerF(5′-CGTAACAAGGTAGCTGTAG-3′)和下游引物rDNA2(5′-TTTCACTCGCCGTTACTAAGG-3′)[1718]。
20 μL反应体系:2×Easy Taq PCR SuperMix 10 μL,引物(10 μmol/L)各1 μL,DNA 2 μL,ddH2O 6 μL。扩增程序:95℃预变性3 min;94℃变性60 s,53℃退火45 s,72℃延伸45 s,共40个循环;最后72℃延伸10 min。
PCR扩增产物送生工生物工程(上海)股份有限公司进行双向测序。用Sequencher 5.2.2软件检查测序结果并进行序列拼接。将获得的序列在GenBank中进行同源性比对,采用MrBayes 3.2.7构建系统发育树,用FigTree V 1.4.3软件读取结果。
2 结果与分析
通过形态学和分子生物学特征,将从窖藏马铃薯和薯蓣块茎中分离到的短体线虫分别鉴定为斯克里布纳短体线虫P.scribneri和咖啡短体线虫P.coffeae。具体鉴定结果如下:
2.1 斯克里布纳短体线虫Pratylenchus scribneri Steiner in Sherbakoff & Stanley, 1943
2.1.1 形态特征描述
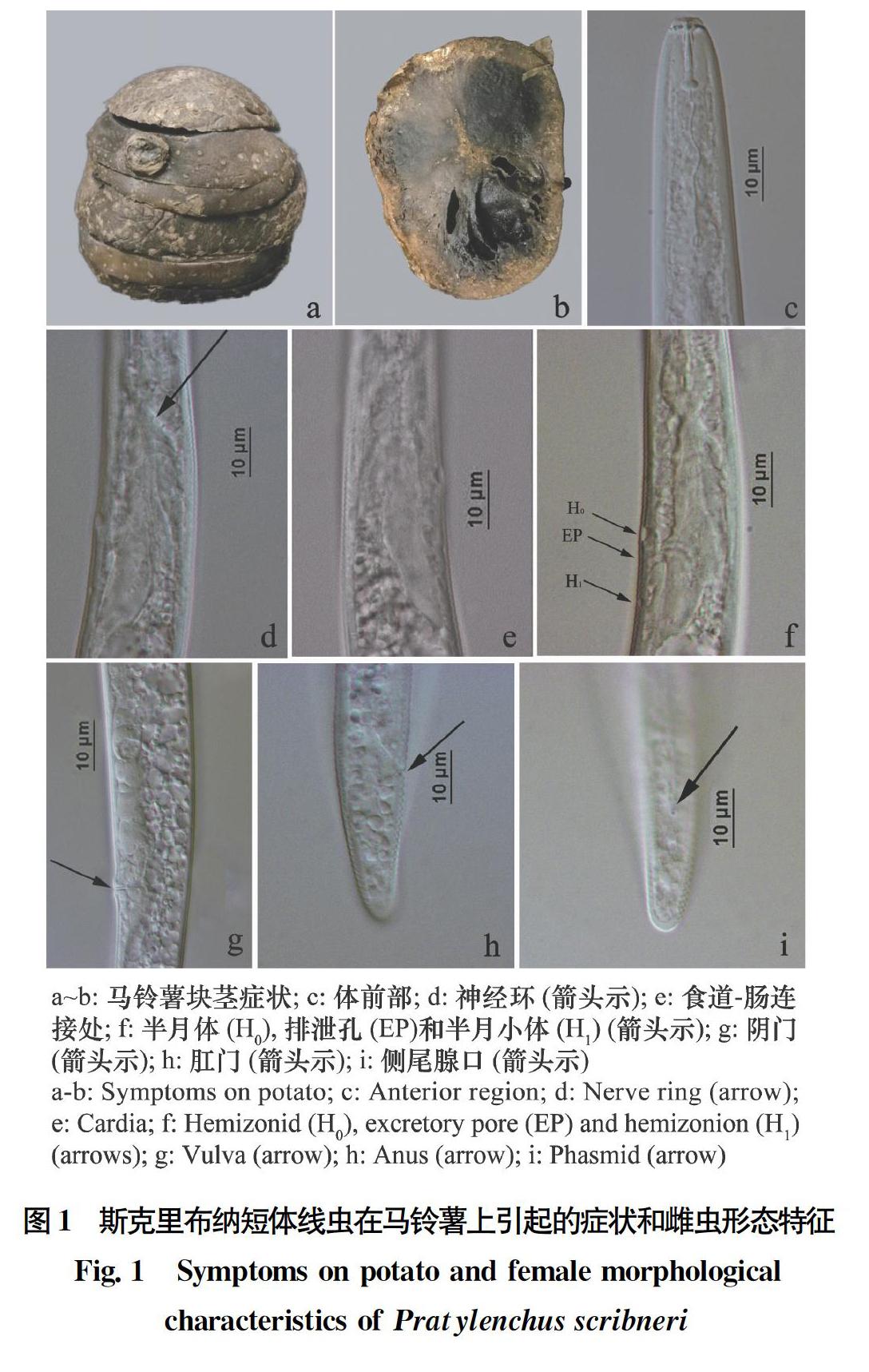
马铃薯块茎症状(图1a, b):块茎表皮有凹陷斑点且皱缩变黑,切开薯块,皮下组织颗粒状干腐,内部组织出现腐烂变黑。
雌虫(图1):唇区稍缢缩,唇环2条,第1条唇环比第2条唇环略窄;口针发达,基部球高度骨化,圆形。中食道球卵圆形,直径约占该处体宽的2/3。食道腺腹面覆盖肠前端,覆盖长度为30.3(19.4~38.6)μm。神经环距离体前端68.4(60.7~75.6)μm;排泄孔距离体前端85.9(82.6~90.1)μm;半月体在排泄孔前,距离体前端83.4(80.4~87.0)μm;半月小体在半月体后13.5(12.4~14.2)μm处。侧线4条。单个卵巢向体前端延伸,受精囊退化,卵圆形或近圆形,内有5~9个精子;后阴子宫囊长27.9(24.8~30.4)μm;阴门横裂,阴道长8.4(6.9~10.1)μm。尾部锥形或亚圆柱形,尾部有环纹15~24条,末端无环纹;侧尾腺口位于尾的中前部。
雄虫:未见。
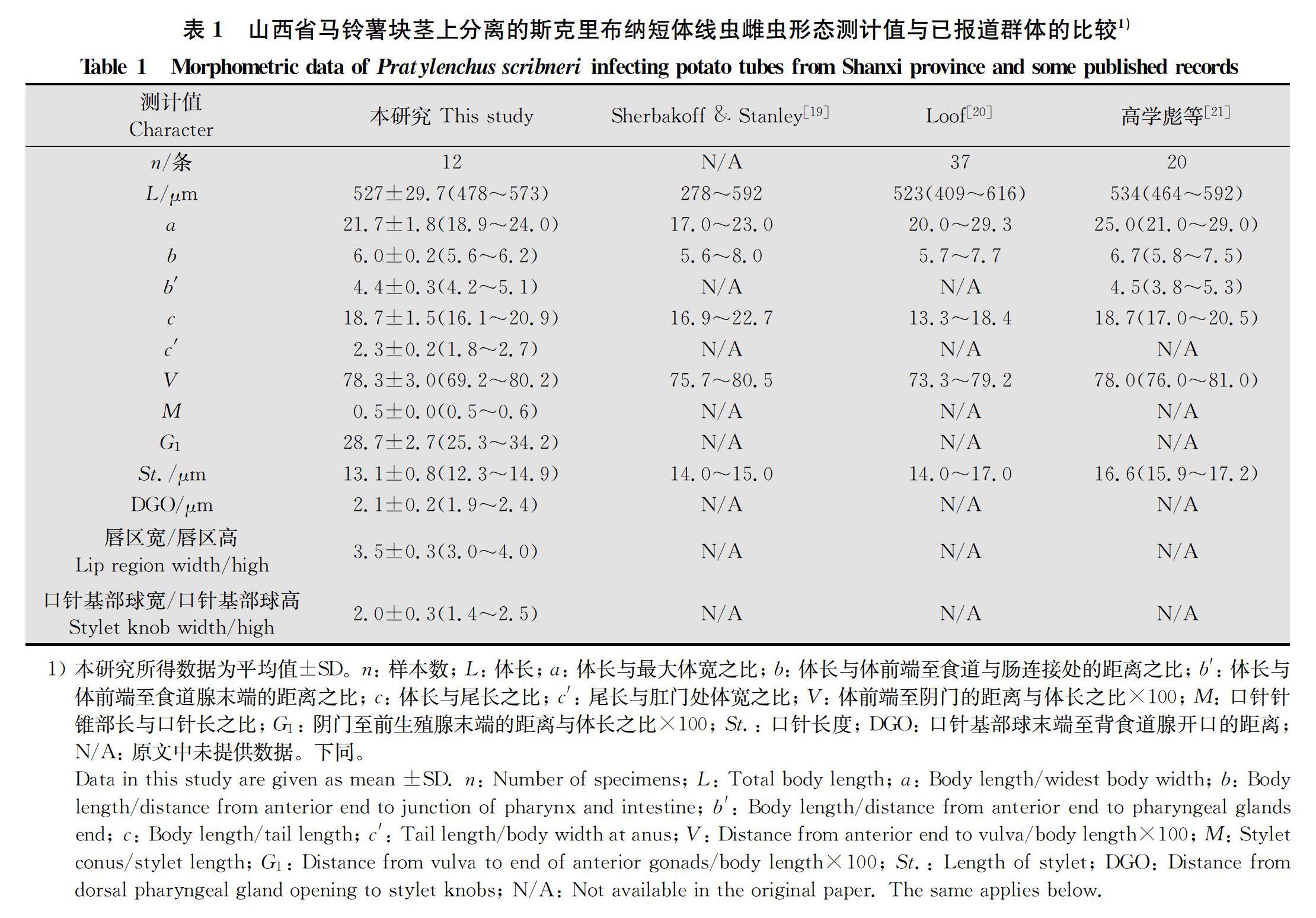
2.1.2 形态测计值
测量结果见表1。
1) 本研究所得数据为平均值±SD。n: 样本数; L: 体长; a: 体长与最大体宽之比; b: 体长与体前端至食道与肠连接处的距离之比; b′: 体长与体前端至食道腺末端的距离之比; c: 体长与尾长之比; c′: 尾长与肛门处体宽之比; V: 体前端至阴门的距离与体长之比×100; M: 口针针锥部长与口针长之比; G1: 阴门至前生殖腺末端的距离与体长之比×100; St.: 口针长度; DGO: 口针基部球末端至背食道腺开口的距离; N/A: 原文中未提供数据。下同。
Data in this study are given as mean ±SD. n: Number of specimens; L: Total body length; a: Body length/widest body width; b: Body length/distance from anterior end to junction of pharynx and intestine; b′: Body length/distance from anterior end to pharyngeal glands end; c: Body length/tail length; c′: Tail length/body width at anus; V: Distance from anterior end to vulva/body length×100; M: Stylet conus/stylet length; G1: Distance from vulva to end of anterior gonads/body length×100; St.: Length of stylet; DGO: Distance from dorsal pharyngeal gland opening to stylet knobs; N/A: Not available in the original paper. The same applies below.
2.1.3 分子生物学鉴定
从马铃薯块茎分离的线虫SSU基因序列长度为1 488 bp,提交到NCBI获得基因序列号MT379647,与NCBI上序列比对结果显示其与P.scribneri美国群体(MK292133)相似性达99.8%。
以大豆孢囊线虫Heterodera glycines(KF241988)为外群,采用TIM2+I+G模型构建SSU系统发育树(图2)。本试验分离的线虫与P.scribneri(EU669927,EU130811-12,MK292133)和P.agilis(EU130794)在同一分支上,置信度為100%。而P.agilis是P.scribneri的同物异名[13, 22]。
2.1.4 鉴定结果
本研究分离的线虫鉴定代码:A1-B2-C2-D3-E2-F4-G3-H1-I2-J1-K1与P.scribneri模式种代码一致[13]。根据以上形态学特征和分子生物学分析,将马铃薯块茎中的线虫鉴定为斯克里布纳短体线虫P.scribneri。
2.2 咖啡短体线虫Pratylenchus coffeae (Zimmermann, 1898) Filipjev & Schuurmans Stekhoven, 1941
2.2.1 形态特征描述
薯蓣块茎症状(图3a):发病块茎产生浅黄色至褐色的坏死病斑,剖开表皮,病组织呈红褐色,严重时呈褐色干腐状。块茎变脆,易断。
雌虫(图3):唇区稍缢缩,唇环2条,偶有一侧2条,另一侧1或3条。头架骨化,口针发达,口针基部球圆形或椭圆形;背食道腺开口距口针基部2.6(2.1~3.3)μm。中食道球卵圆形。食道腺从腹面覆盖肠的前端,覆盖长度38.7(28.2~52.5)μm。排泄孔距离体前端88.1(78.1~93.7)μm,半月体距离体前端85.0(77.2~91.8)μm,半月小体在半月体后12.3(11.0~13.9)μm。侧线4条,偶尔5条或6条。单卵巢,卵母细胞单行排列,受精囊明显,卵圆形或圆形,有精子。后阴子宫囊长37.2(30.4~448)μm。尾端亚圆柱形、平截或有缺刻,尾部有环纹22~31条。侧尾腺孔小,位于尾部的中前部。
雄虫(图3):交合刺细长,18.7(17.1~21.0)μm。引带长4.6(3.6~5.8)μm。交和伞发达,长38.8(33.6~44.8)μm,从泄殖腔口前包到尾部末端。
2.2.2 形态特征测计值
测量结果见表2。
2.2.3 分子生物学鉴定
从薯蓣块茎分离线虫的ITS基因序列长度为1 009 bp,提交到NCBI獲得的基因序列号为MT379651,与NCBI上相关序列比对结果显示其与P.coffeae中国浙江群体(KC490927)相似性达98.8%。
以大豆孢囊线虫(LC030369)为外群,采用TPM2uf+I+G模型构建ITS系统发育树(图4),本研究分离的线虫与P.coffeae(FJ827744,KC490927和MH134508)聚在一个分支上,置信度为100%。
2.2.4 鉴定结果
本研究从薯蓣块茎分离的线虫鉴定代码:A1-B2-C2-D3-E3-F6-G2-H1-I2-J1,2,3-K1与P.coffeae模式种代码一致[13]。根据以上形态学特征和分子生物学分析,将薯蓣块茎中的线虫鉴定为咖啡短体线虫P.coffeae。
3 讨论
最初报道斯克里布纳短体线虫P.scribneri来自美国马铃薯块茎,目前,P.scribneri广泛分布于世界多地和多种寄主上[13]。在中国,最早是1985年黎少梅等[24]在河南的高粱、梨、菠菜、番茄、茄子上发现P.scribneri,随后张绍升[25]在福建香蕉上发
现该线虫,但是均以名录形式列出,未有详细特征描述;孙严等[26]在新疆的葡萄上发现该线虫并对其形态特征进行了简单描述;高学彪等[21]在冀、晋、豫、鲁、苏5省调查发现该线虫引起一种玉米新病害,并对该线虫的形态特征进行了详细描述,这是在国内首次发现P.scribneri具有危害性;随后安徽、北京、广东、广西、贵州、海南、黑龙江、湖北、湖南、江西、吉林、辽宁、内蒙古、青海、四川、上海、天津、西藏、云南、浙江等地[9, 2736]陆续报道了该线虫。但是在马铃薯上未见报道,仅高学彪等[37]用室内盆栽试验证明P.scribneri对马铃薯有致病性。本研究首次在我国马铃薯块茎中发现P.scribneri,其形态特征与文献报道基本相符[1921],但有些特征不同,如口针较短,有半月小体,受精囊中有少量精子。这可能是不同地理和寄主环境造成的差异。
薯蓣根腐线虫病是一种广泛分布的世界性病害,目前国内报道引起该病的短体线虫有3种:咖啡短体线虫 [23,3840]、穿刺短体线虫[41]和薯蓣短体线虫 [42]。黄文华等[23]在江苏沛县的调查表明,薯蓣普遍受短体线虫危害,田间一般发病率为30%~80%,严重时高达100%。贺哲等[40]在江西瑞昌发现由P.coffeae引起的根腐线虫病发生十分普遍,严重影响薯蓣的产量和品质。本研究是首次在山西发现咖啡短体线虫危害薯蓣,其形态描述和测量值与Loof[20]对咖啡短体线虫的描述一致;与黄文华等[23]的描述除b值和口针长度略小外,其他描述一致。
本研究报道的P.scribneri首次在中国马铃薯块茎中发现,P.coffeae首次在山西薯蓣块茎中发现,两者均是在储藏期发现。其中P.scribneri是我国进境植物检疫性线虫,后期将进一步跟踪调查其田间危害,并对其发生区域进行深入调查研究。
参考文献
[1] PERRY R N, MOENS M. Plant nematology [M]. Wallingford, UK: CABI Publishing, 2006.
[2] 刘海璐, 王暄, 李红梅, 等. 我国黄淮麦区10个短体线虫样品种类的分子鉴定[J]. 中国农业科学, 2018, 51(15): 7892.
[3] 王倩倩, 顾建锋, 李红梅, 等. 荷兰进境铃兰苗中铃兰短体线虫的鉴定[J]. 南京农业大学学报, 2019, 42(5): 835841.
[4] 杜宇, 邓宗汉, 丁元明, 等. 四种短体线虫的形态和分子生物学鉴定[J]. 植物病理学报, 2020, 50(1): 2839.
[5] XUE Qing, BERT W, GAMLIEL A, et al. Phylogeography and molecular species delimitation of Pratylenchus capsici n.sp., a new root-lesion nematode in Israel on pepper (Capsicum annuum) [J]. Phytopathology, 2019, 109(5): 847858.
[6] NGUYEN H T, TRINH Q P, COUVREUR M, et al. Molecular and morphological characterisation of a new root-lesion nematode, Pratylenchus horti n.sp. (Tylenchomorpha: Pratylenchidae), from Ghent University Botanical Garden [J]. Nematology, 2019, 21(7): 739752.
[7] 江麗辉, 边勇, 汪万春. 短体线虫Pratylenchus spp. 非中国种问题探讨[M]∥廖金铃, 彭德良, 段玉玺. 中国线虫学研究(第三卷). 北京: 中国农业科学技术出版社, 2010: 116122.
[8] 徐玉梅, 赵增旗, 王建明, 等. 中国检疫性植物线虫鉴定手册[M]. 北京: 中国农业出版社, 2014.
[9] 王宁. 口岸进境截获短体属线虫的种类鉴定[D]. 南京: 南京农业大学, 2014.
[10]WHITEHEAD A G, HEMMING J R. A comparison of some quantitative methods of extracting small vermiform nematodes from soil [J]. Annals of Applied Biology, 1965, 55(1): 2538.
[11]SEINHORST W. A rapid method for the transfer of nematodes from fixative to anhydrous glycerine [J]. Nematologica, 1959, 4(1): 6769.
[12]HOOPER D J. Handling, fixing, staining and mounting nematodes [M]∥SOUTHEY J F. Laboratory methods for work with plant and soil nematodes. London, U.K: Ministry of Agriculture, Fisheries and Food, 1986: 5980.
[13]CASTILLO P, VOVLAS N. Pratylenchus (Nematoda: Pratylenchidae): diagnosis, biology, pathogenicity and management [M]. Leiden-Boston: Brill, 2007.
[14]WILLIAMS B D, SCHRANK B, HUYNH C. et al. A genetic mapping system in Caenorhabditis elegans based on polymorphic sequence-tagged sites [J]. Genetics, 1992, 131(3): 609624.
[15]ZHENG Jingwu, SUBBOTIN S A, HE Shuishan, et al. Molecular characterisation of some Asian isolates of Bursaphenlenchus xylophilus and B.mucronatus using PCR-RFLPs and sequences of ribosomal DNA [J]. Russian Journal of Nematology, 2003, 11(1): 1722.
[16]HOLTERMAN M, VAN DER WURFF A, VAN DEN ELSEN S, et al. Phylum-wide analysis of SSU rDNA reveals deep phylogenetic relationships among nematodes and accelerated evolution toward crown clades [J]. Molecular Biology and Evolution, 2006, 23(9): 17921800.
[17]FERRIS V R, FERRI S M, FAGHIHI J. Variation in spacer ribosomal DNA in some cyst-forming species of plant-parasitic nematodes [J]. Fundamental and Applied Nematology, 1993, 16(2): 177184.
[18]VRAIN T C, WARKARCHUK D A, LVESQUE A C, et al. Intraspecific rDNA restriction fragment length polymorphism in the Xiphinema americanum group [J]. Fundamental and Applied Nematology, 1992, 15(6): 563573.
[19]SHERBAKOFF C D, STANLEY W W. The more important diseases and insect pests of crops in Tennessee [R]. Tennessee Agriculture Experiment Station Bulletin, 1943,186: 1142.
[20]LOOF P A A. Taxonomic studies on the genus Pratylenchus (Nematoda) [J]. Tijdschrift over Plantenziekten, 1960, 66(2): 2990.
[21]高学彪, 程瑚瑞, 方中达. 玉米根腐线虫病的病原鉴定和致病性研究[J]. 植物病理学报, 1992, 15(1): 5055.
[22]HERNNDEZ M, JORDANA R, GOLDARACENA A, et al. SEM observations of nine species of the genus Pratylenchus Filipjev, 1936 (Nematoda: Pratylenchidae) [J]. Journal of Nematode Morphology and Systematics, 2000, 3(2): 165174.
[23]黄文华, 高学彪, 吕继宏. 山药根腐线虫病的病原鉴定和致病性研究[J]. 华南农业大学学报, 1994, 15(3): 3538.
[24]黎少梅, 冯志新, 许克林. 河南省主要农作物线虫名录[J]. 河南农业大学学报, 1985, 19(3): 257269.
[25]张绍升. 福建省香蕉寄生线虫种类调查[J]. 福建果树, 1991, 12(2): 3031.
[26]孙严, 王寿华. 吐鲁番地区葡萄根围线虫的种类[J]. 新疆农业科学, 1992, 29(6): 262263.
[27]于焦, 金惺惺, 秦萌, 等. 西藏农作物短体线虫种类的鉴定和描述[J]. 华中农业大学学报, 2017, 36(5): 2024.
[28]丁晓帆, 王雪, 李想, 等. 海南省甘蔗根际寄生线虫调查与鉴定[J]. 甘蔗糖业, 2015(5): 1722.
[29]陈艳, 高利媛, 马腾, 等. 高羊茅根际一种短体线虫的分离与鉴定[J]. 草业科学, 2015, 32(6): 988993.
[30]江晓帆, 董春华, 马骏, 等. 大连樱桃根际寄生线虫种类的调查与鉴定[J]. 安徽农业科学, 2014, 42(9): 26002601.
[31]兰庆渝, 邓大林, 谢成伦, 等. 铁灭克等五种药剂防治果树线虫的研究[J]. 四川果树, 1995(2): 68.
[32]LI Yu, LU Qisen, WANG Shuo, et al. Discovery of a root-lesion nematode, Pratylenchus scribneri, infecting corn in Inner Mongolia, China [J]. Plant Disease, 2019, 103(7): 1792.
[33]王宏洪, 卓侃, 廖金铃. 桃树根围三种短体线虫的鉴定[C]∥郭泽建, 吴元华. 中国植物病理学会2014年学术年会论文集. 北京: 中国农业科学技术出版社, 2014: 471.
[34]趙文霞, 杨君宝. 中国植物线虫名录[M]. 北京: 中国农业出版社, 2006.
[35]方羽生, 尹淦. 植物病原线虫短体属种类的研究[J]. 华南师范大学学报(自然科学版), 1994, 26(4): 3241.
[36]李戌清, 郑经武. 4种短体线虫形态及rDNA-ITS的PCR-RFLP鉴定[J]. 植物病理学报, 2013, 43(4): 444448.
[37]高学彪, 程瑚瑞, 方中达. 斯克里布纳短体线虫在华北的寄主范围和克线磷防治作用的研究[J]. 南京农业大学学报, 1994, 17(1): 4346.
[38]阎爱华. 薯蓣红斑病病原线虫种类鉴定及其生物学特性研究[D]. 保定: 河北农业大学, 2006.
[39]黄金玲, 陆秀红, 高淋淋, 等. 广西淮山根腐线虫病病原鉴定[J]. 南方农业学报, 2015, 46(11): 19901993.
[40]贺哲, 黄婷, 李俊科, 等. 瑞昌山药根腐线虫病病原鉴定[J]. 江西农业大学学报, 2016, 38(5): 879883.
[41]张广民, 高士仁, 国庆合. 山药新病害: 山药根腐线虫病[J]. 植物保护, 1991, 17(3): 50.
[42]杨宝君, 赵来顺. 短体属线虫一新种(垫刃目: 短体科)[J]. 动物分类学报, 1992, 17(2): 160164.
(责任编辑:杨明丽)

