MAD2在文心兰‘柠檬绿’和拟南芥中的差异分析
付 帅,陈仕朋,叶 炜,林玉玲,徐 涵,3,赖钟雄*,叶开温,4*
(1.福建农林大学园艺植物生物工程研究所,福建福州350002;2.三明市农业科学研究院,福建三明365000;3.法国图卢兹综合科学研究所,法国图卢兹31000;4.台湾大学植物科学研究所,台湾台北10617)
MAD2(spindle check point protein MAD2)是一种纺锤体检查点蛋白,首先在玉米中鉴定,它与有丝分裂细胞以及减数分裂I和II期间的着丝粒—动粒复合体相关[1]。MAD2是纺锤体检查点的重要组成部分,在微管附着到动粒完成的过程中该基因能阻断分离酶的激活和姐妹染色单体的溶解[2]。对细胞分裂的过程进行观察,发现了在未与纺锤体连接的着丝点上MAD2蛋白的浓度较高,而在与纺锤丝连接的着丝点上则与之相反,这表明MAD2在未与纺锤体连接的着丝粒点上高浓度[3]。MAD2是维持染色体在分裂时向细胞两级移动的关键物质,在探讨染色体不分离问题的分子机制中,该基因的研究显得极为重要[4]。在nua突变体中发现NUA和MAD2可能在植物的分生细胞分裂中发挥作用[5]。已有的研究表明,在文心兰不可育品种‘柠檬绿’中,On MAD2的表达量低于可育品种‘巧克力’,因此推测MAD2是影响文心兰‘柠檬绿’花粉活力低的关键基因之一[6]。
该试验通过At MAD2基因的拟南芥突变体mad2(SALK_136419)的鉴定与表型分析,发现了当At MAD2基因在拟南芥花苞中表达量增高时会影响植物的生殖生长,如抽花梗时间提早、花粉活力和结果荚率下降。表明了MAD2在拟南芥中表达量高会导致育性下降,这与MAD2在文心兰中的表达结果相反。
1 材料与方法
1.1 材料
拟南芥(Arabidops is thaliana)mad2(S A L K_136419)突变体购自拟南芥突变体中(Ara Share),通过T AIR(https://www.arabidopsis.org/index.jsp)查询T-D N A插入位点的边缘序列(Flanking sequence),经三引物法筛选鉴定后用于本次试验。
1.2 方法
1.2.1 播种方法与种植环境。将种子从4℃冰箱取出,之后在超净台使用84消毒液∶水(1∶5)进行清洗2次,每次5 min,消毒后用高压灭菌水进行清洗5~6次,每次1 min。均匀播种在1/2 M S培养基平板上。4℃黑暗环境下存放2 d后,转入光照培养室,培养温度22℃,相对湿度60%~70%,14 h/10 h的光暗周期。大约7 d后,移栽到培养土中(土∶蛭石=2∶1)。放置在人工气候箱,光照条件和温度同上。
1.2.2 突变体鉴定。幼苗生长3周,剪取叶片采用C T AB法提取基因组总D N A,以总D N A为模板进行PC R扩增。PC R所用引物L P、R P的序列根据插入位点的位置自行设计,T-D N A通用引物B P通过http://signal.salk.edu/tdnaprimers.2.html设计,进行PC R扩增(表1),验证m y b106突变体是否为纯合体。反应体系共20μL:模板1μL,引物各1μL,10μL 2×Taq PCR Master Mix(上海生物工程有限公司),加ddH2O至20μL,充分混匀后进行PC R扩增。PC R反应程序为:94℃变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸2 min,共32个循环。PC R产物经1.5%琼脂糖凝胶电泳检测后于凝胶成像系统成像。
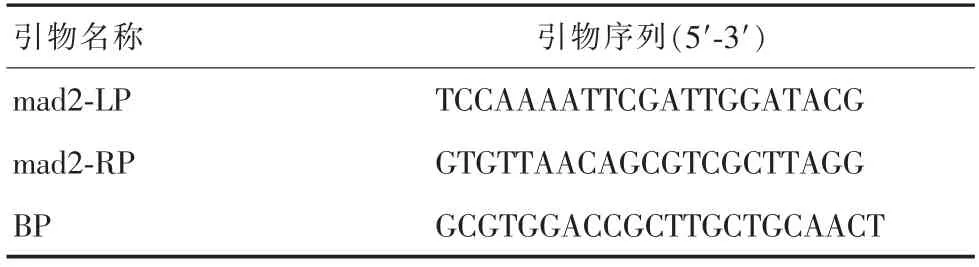
表1 PCR引物序列
1.2.3 拟南芥总R N A的提取。采用T ri z ol u p R N A试剂盒(全式金生物技术有限公司)提取拟南芥未开放时期花苞的总R N A,利用超微量分光光度计(Thermo Electron Corp)检测R N A样品浓度(O D260/O D280值介于1.8~2.1),并用1%琼脂糖凝胶电泳检测花器官总R N A的质量和纯度。cDNA经 SMART TM RACEA cDNA Amplification Kit试剂盒逆转录合成,用于后续目的基因AtMAD2表达量的检测。
具体操作方法参考试剂盒说明书。
1.2.4 植株的表型观测。使用手机拍摄记录播种30和60 d的生长情况。随机选取16株拟南芥野生型和mad2突变体的植株。
1.2.5 拟南芥花药和花粉粒的亚历山大染色。取拟南芥野生型和mad2突变体的盛开期的花朵,参考Alexander[7]的方法,将花粉置于载玻片上,滴少量亚历山大染色液,可育花粉呈深红色,花粉活力弱呈浅红色,败育花粉呈无色。置于普通光学显微镜(B X-50)下观察染色花粉粒的数量和形状。并统计3个最佳视野下花粉粒的总数和着色花粉粒数。
1.2.6 数据处理和分析方法。使用软件Excel 2010进行student t-test显著性分析,P<0.05为显著差异(*),P<0.01为极显著差异(**)。
2 结果分析
2.1 T-DNA插入位点与鉴定结果
从图1可见,mad2(At3g25980)由7个外显子和6个内含子组成,mad2(S A L K_136419)突变体的T-D N A插入位点位于5′U T R端前约2 100 b p左右。
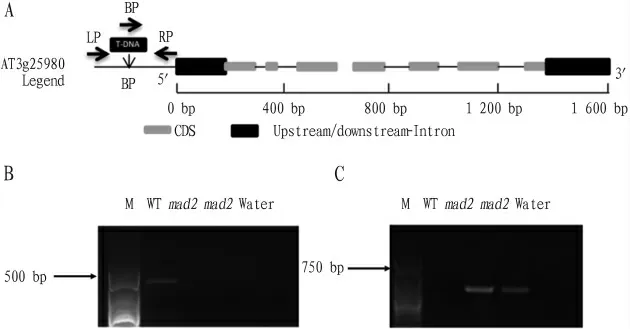
图1 mad2突变体的T-DNA插入位点分析及鉴定结果
用mad2基因的特异性引物L P与R P进行PC R扩增,野生型中扩增出1条带,条带位置与目的基因(1 059 bp)大小一致。而与此对应的mad2突变体中未扩增出条带,而用T-D N A特异性引物B P和R P进行扩增,mad2突变体中扩增出1条特异条带,条带大小为500~750 b p,与引物的预期扩增结果一致,而野生型中未能扩增出此条带,证明本试验所使用MAD2的T-D N A插入体是纯合的突变体。
2.2 AtMAD2的表达量分析
荧光定量PC R的结果表明在mad2突变体中,OnMAD2的表达量远高于野生型,大约是野生型的9倍(图2)。
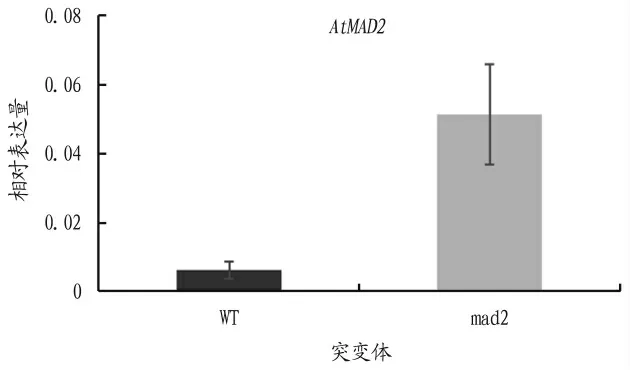
图2 AtMAD2在突变体中的表达量分析
2.3 突变体的表型分析
将野生型拟南芥和mad2突变体进行表型比较分析。结果如下:播种后30 d时mad2突变体已经抽梗,而野生型还未抽梗(图3A)。播种60 d后,可以看出mad2突变体植株的植株大小与野生型有明显差异,说明MAD2基因的T-D N A插入抑制了植株的营养生长,除此之外,野生型的果荚数量较多,而mad2突变体的结荚数量远远少于野生型株,并且可以看出野生型的茎相比于mad2更加粗壮(图3B)。

图3 拟南芥野生型和myb106突变体的表型分析
对野生型拟南芥和mad2突变体植株的结果荚情况进行分析可知,W T的果荚长度约为1.07 cm,单个果荚内种子数量约为19粒。与其同样环境下种植的mad2突变体的都小于W T的果荚长度和种子数量。其中mad2的果荚长度和单果荚种子数量均约为0.79 cm、7粒,与野生型植株呈现极显著差异。这表明T-D N A对MAD2基因高表达的影响,直观的影响到了植株的繁育能力,显著影响了果荚的发育和种子形成的过程(表2)。

表2 野生型拟南芥和mad2突变体植物的果荚分析
2.4 突变体花粉粒的亚历山大染色
对拟南芥花朵开放期成熟花粉粒的亚历山大染色,可以看出拟南芥野生型的单个花粉粒独立分散,并且花粉粒形态饱满,形状近乎圆形,仅有少数花粉粒未被着色(图4A-C)。对花粉粒的花粉活力进行数据统计分析,可以看出野生型的被染色的花粉粒高达94%(图5)。mad2突变体的花粉粒在染色后,有较多的花粉粒未着色,这表明mad2突变体有较多的花粉粒是没有活力的。从更细节的图片中可以看出,mad2的花粉粒形状异常。之后进行数据统计分析,得到mad2突变体的花粉活力染色率仅为69%(图5),与野生型呈现极显著差异(图4D-F)。

图4 拟南芥开放期花药和花粉粒的亚历山大染色
3 讨论
在已有的研究结果中,不乏有高表达导致植物不育的基因,如拟南芥中过表达miR167导致雄性不育[8];同样在拟南芥中过表达At1g74450的O R F后会让植物的株高和育性都下降[9];在拟南芥中过表达miR159能够延迟开花,因为miR159可以调节编码M Y B转录因子的基因与花药发育有着非常广泛的关联,在拟南芥中过表达mi R159的植株中,由于抑制了MYB103基因的合成,导致绒毡层提前降解,最终造成花粉败育[10]。就表型来看,AtMAD2就是属于这一类的基因。AtMAD2表达量增加提早了拟南芥抽花梗的时期,让其提早抽花梗大约4 d左右,对于后续发育时期的生殖生长,MAD2基因也起到了关键作用,mad2的突变体花粉活力严重下降,最后导致了单株果荚数、果荚长度和种子数量均严重降低。但关于AtMAD2表达量增高造成植物育性下降的内在机制还有待进一步研究。结合已有的研究可以得出,MAD2确实是影响花粉发育的关键基因,但在文心兰不可育品种‘柠檬绿’中表达量低于可育品种,而在拟南芥中则相反,其表达量在野生型中低于育性低的株系。

图5 花粉活力染色率

