载药脂质微泡推进智能化超声医学技术的研究进展
龙朦朦,刘东, ,杨芳,顾宁*
(1. 东南大学生物科学与医学工程学院,江苏 南京 210096;2. 皖西学院生物与制药工程学院,安徽 六安 237012)
超声医学技术是将医学与生物技术、电子科技以及光学等高科技技术相结合的一门技术,其几乎应用于临床医学的各个阶段,包括常规筛查、诊断测试、疾病分期、手术辅助和治疗后监测[1-2]。在超声医学中,超声波的应用最为广泛,特别在超声成像领域[3]。超声成像具有使用方便、无创、动态观察、实时检测、无放射性污染、生物安全性高等优点,是一种广泛应用于多种疾病诊断的工具[4]。微泡(microbubbles,MBs)由于在超声作用下具有独特的非线性效应和强声散射,有利于获得增强的超声造影图像[5]。Gramiak和Shah在对主动脉根部超声心动图的观察中首次提出气泡具有增强超声信号的作用[6],此后,微泡作为超声造影剂受到越来越多的重视,并逐步在临床上得到应用。
微泡一般由气核和稳定壳膜组成。气泡的包被材料一般是由脂质、聚合物或蛋白质组成,它们应具有良好的生物兼容性且静脉注射时比较安全。其中磷脂作为微气泡的壳膜比交联的聚合物硬壳更具柔韧性,超声作用下,更易收缩、破裂、弯曲或再铺展,从而增强微泡对声波的敏感性[7]。因此,与其他类型的微泡相比,脂质微泡具有更好的应用前景。市售的超声造影剂如Definity®、Lightity®、SonoVue®、Levovist®等都采用了脂质壳膜[8]。
随着脂质微泡的发展,其不仅作为超声造影剂对血栓、动脉粥样硬化斑块、炎症区域和肿瘤生长相关的血管生成进行分子成像,还可以作为超声靶向触发的药物和基因传递系统,成为一种治疗工具[9]。靶向配体通过脂质微泡表面所修饰的聚乙二醇(PEG)结合到微泡表面,药物负载在脂质外壳中,形成能够靶向特定区域的载药脂质微泡[10]。作为药物递送系统,载药脂质微泡具有降低药物使用剂量、靶向定位释药、减轻毒副作用、提高治疗效果等优点,实现诊断-治疗一体化[11]。近年来,脂质微泡引起众多研究者的关注,并被设计出各种各样用于多模式分子成像、肿瘤治疗、溶栓、心血管给药和跨血脑屏障(blood-brain barrier,BBB)给药等的载药脂质微泡[12-14]。本文首先对脂质微泡的结构进行分析,然后介绍脂质微泡常见载药方法,最后对其在超声医学技术上的应用进行阐述,并对未来的发展进行展望。
1 脂质微泡的结构
脂质微泡主要由脂质壳和气核组成。脂质外壳包括稳定的脂质层和乳化剂。组成脂质微泡的每个组件均可影响微泡的稳定性和功能性,例如使用氧气作为填充气体对于需要快速氧气输送的应用有其必要性[15],但对于需要更长循环时间的诊断应用效果较差。因此,可溶性较差的气体,如全氟碳化合物(PFC),通常被选择用于诊断应用[9]。针对不同的应用,可以通过调节表面连接的化学成分对微泡外壳进行设计和优化。例如,可以通过化学反应对PEG-脂质进行修饰,从而开发出具有靶向功能并能屏蔽配体介导的先天免疫反应的脂质微泡[10]。以下对载药脂质微泡的主要成分及其影响微泡稳定性的可能机制进行介绍。
1.1 气核
气核是微泡系统的关键功能元件,大多选择六氟化硫(SF6)、全氟乙烷(C2F6)或全氟丙烷(C3F8)等高相对分子质量、低溶解度气体作为气核成分,这类气体不易从微泡中溢出,能有效保持微泡的稳定性,延长微泡在血液中循环时间,表现出更高的回声[16]。对于氧气、硫化氢、氙气、一氧化氮等治疗性气体输送,气核仅仅是被输送的治疗“货物”[17],但在超声成像应用中,气核对声波具有高度响应性,在毫米级纵向超声波传播过程中,气核的非线性振动能产生很强的声散射信号,用于图像增强[18]。此外,气核在超声波的刺激下可能会塌陷(即惯性空化),产生剪应力,导致血管通透性增加[13],利于药物或基因输送[19]。
1.2 脂质壳
脂质壳通常由具有较长脂肪链的高度饱和、稳定性高的磷脂组成,例如二硬脂酰磷脂酰乙醇胺(DSPE)、二棕榈酰磷脂酰胆碱(DPPC)、二棕榈酰磷酯酰乙醇胺(DPPE)等。用于微泡设计的脂质由亲水性(盐)头基和疏水(油)烃尾部组成。头基通常是两性离子成分,如磷胆碱(PC)或磷乙醇胺(PE),其还可以通过化学方法来调节微泡特性,例如,带电的头基可以被取代,以允许DNA或带相反电荷的聚离子的沉积,以用于逐层组装[20]。与脂质体一样,脂质微泡的脂质壳层可以通过化学修饰来调整性能,为诊断和治疗应用提供了一个有用的平台。脂质分子的碳氢化合物尾部,通常选择溶解度低、堆积顺序高且可显著降低表面张力的饱和的双酰基链。对于饱和的双酰化链状脂类,亚甲基的加入增加了脂类分子之间的疏水性和范德华引力,从而增加了壳层的刚性[21-22]。与较短的脂链相比,这种刚性通常导致较低的气体渗透性、较大的剪切力和扩张黏弹性。因此,含有较长酰基链的脂质组成的微泡更加稳定,易于长期保存。
1.3 乳化剂
乳化剂在微泡制剂中无处不在,它们能增加微泡的产量和稳定性,其通常是磷脂锚定的PEG(如DSPE-PEG2000等)[23]。乳化剂的主要作用是促进产生微泡,并防止乳化液和气泡在形成过程中的聚结。PEG乳化剂可以通过分子间相互作用促进脂质外壳-微泡的相互融合,从而有助于脂质微泡的形成。此外,PEG乳化剂可能会扰乱脂质基质,使脂类更容易在微泡表面进行融合和铺展。一旦脂质单层形成,PEG就会形成一种立体刷,通过空间斥力来抑制微泡的融合,并且PEG立体刷可以防止血浆蛋白吸附在微泡表面,保护微泡免受调节和过早清除,还可以将配体从微泡外壳上延伸出去,以更好地将这些配体暴露于靶受体[24]。通过PEG进一步对微泡进行化学修饰,还可实现不同的生物医学应用。对于核酸输送,微泡中可以加入PEG化脂质,以克服阳离子脂质在组织中的堆积、颗粒聚集和毒性,同时延长微泡在体内的寿命[25];对于药物输送,PEG能导致细胞膜上的脂质有序性下降,从而增加膜流动性,使装载在微泡中的药物分子更易于转移到相邻的细胞膜,然而,该现象受各种其他配方和生理因素的影响,因此不能仅由PEG浓度进行控制[8,26]。
2 脂质微泡载药方法
脂质微泡作为药物递送系统,将药物负载到微泡中并确定微泡中的载药量至关重要,它直接影响到目标部位药物浓度。然而,由于影响药物和微泡的稳定性及性能的参数多种多样,该实现过程具有一定的复杂性[8]。到目前为止,已有不少研究报道了将药物负载到脂质微泡的不同技术,并研究了不同量化方法以及局限性,如图1所示[27]。
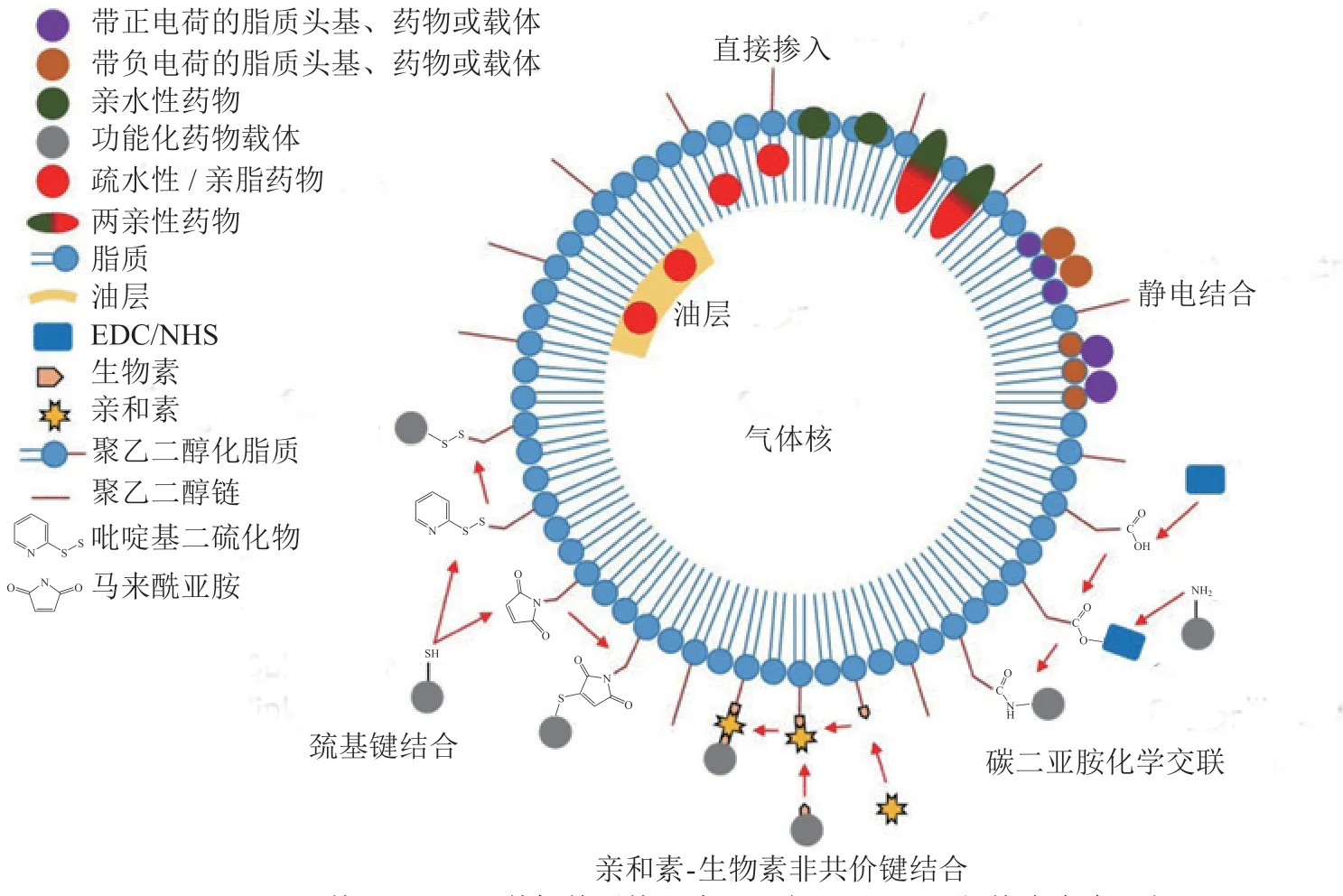
图 1 脂质微泡的不同负载技术示意图[27]Figure 1 The illustration of different loading techniques for lipid microbubbles[27]
2.1 直接掺入
脂质微泡最简单的负载方法是将药物直接结合到微泡的外壳中。其脂质壳具有两亲性结构,因此能够负载两亲性[28]、亲水性[29]或疏水性药物[30]。该方法操作简单,药物在超声启动后能够迅速释放,但药物可能会影响外壳的稳定性和微泡行为,且微泡释放可能发生在体内微泡易被捕获的区域,如肺[31]、脾脏[32]或肝脏[33]。微泡的载药量可用已知的载药面积、疏水性和溶解度等参数来估算,也可采用离心法测量,通过离心将微泡与游离药物分离,进而将载药脂质微泡进行破膜处理,释放出所负载药物后测定药物浓度[34]。
2.2 静电作用
通过静电相互作用可以实现亲水性药物或药物载体在微泡表面的直接结合[35]。一般通过设计具有与药物或药物载体相反电荷的微泡,经过静电吸引的作用将药物或药物载体结合在微泡表面。可以根据实验需要对微泡表面的电荷性质进行设计,例如,微泡使用羟基、磷酸基和羧基进行修饰则会产生负电荷,使用质子化的氮基团(胺、三甲胺)进行修饰则会带正电荷。
2.3 药物载体的偶联
药物载体通常需要连接到微泡外壳上实现载药,在这些情况下,药物通常被装载到第二药物载体,即聚合物纳米颗粒或脂质体中,并通过静电作用或化学结合的方式偶联到微泡上[36-37]。这种方式可以通过药物包埋降低药物的系统毒性;此外,与直接掺入壳体相比,药物载体与壳体的偶联可以潜在地提高微泡的载药量。Kheirolomoom等[38]计算出大约多达10 000个100 nm的脂质体通过亲和素-生物素连接装载到平均直径为1.7 μm的单个微泡上,与单个微泡相比,仅通过附着这些脂质体就可使表面积增加近35倍[39]。通常通过功能配体将载体与壳膜进行结合,常见的连接剂是PEG,原因是其毒性低、成本低、易于操作,且易得到不同形式的PEG及其偶联物[40]。对于脂质微泡,PEG可以在微泡制备前进行连接,以减少易碎微泡的处理步骤,或者将具有官能团的PEG-脂质结合物在微泡制备过程中直接掺入。未反应的PEG分子可以通过洗涤和尺寸排除色谱(SEC)从微泡中分离,并通过折射率检测进行定量[41]。
2.4 亲和素-生物素非共价键结合
亲和素-生物素是常用的非共价键之一,其使用简单,且易获得带有生物素或亲和素配体的PEG连接物或PEG-脂质结合物。亲和素-生物素对广泛的缓冲条件具有高度的耐受性,因此常用来制备脂质微泡用于药物、核酸或成像剂的递送[42]。一般通过广泛使用的荧光生物素或亲和素来定性确定掺入微泡外壳中的物质,也可通过使用2-(4'-羟基偶氮苯)苯甲酸(HABA)的比色和荧光测试快速测定样品中的生物素水平以定性测量结合在脂质微泡上的药物或其他物质[43]。然而,有些微泡制剂中使用的生物素化脂质的比例很低,通常物质的量比介于5% ~ 10%,因此以该种方式研究微泡,即使是荧光HABA分析也难以确定生物素的数量[27]。
2.5 碳二亚胺化学交联
在碳二亚胺化学交联反应中,羧基通常先使用N-羟基琥珀酰亚胺(NHS)或N-羟基磺基琥珀酰亚胺(sulfo-NHS)和1-乙基-3-(3-二甲氨基丙基)碳二酰亚胺(EDC)活化成能与氨基形成共价键的配体化合物,再与氨基反应生成碳二亚胺。具有羧基的脂质微泡外壳可被EDC/NHS活化以结合使用氨基官能化的药物或药物载体[44],也可以将含有羧基的药物或药物载体使用EDC/NHS活化后与具有氨基基团的脂质微泡进行反应,从而将药物或药物载体连接在脂质微泡表面[45]。脂质-PEG-NHS结合物可在脂质微泡制备过程中直接掺入,然而以这种方式形成的碳-氮键具有不可逆性。此外,由于反应试剂对温度、pH和时间的敏感性,导致该类反应的进行和优化具有挑战性。
2.6 巯基键结合
脂质微泡表面的PEG可使用马来酰亚胺或含吡啶基二硫化物修饰,使用巯基功能化的药物能与马来酰亚胺或含吡啶基二硫化物反应生成硫醚键和二硫键,从而将药物连接在脂质微泡上[46]。马来酰亚胺试剂比EDC/NHS更稳定,并能形成稳定的硫醚键。马来酰亚胺基团的存在可采用市售的荧光分析试剂盒或分光光度法[47]来检测;含吡啶基二硫化物与巯基形成的二硫键,可用340 nm处的吸光度检测[48]。
3 载药脂质微泡在超声医学技术上的应用
微泡早期在超声医学技术上主要应用于超声分子成像领域,随着微泡技术的发展,微泡除了作为超声造影剂增强超声信号外,还可以作为超声介导的药物递送系统,通过超声靶向微泡破坏(ultrasound-targeted microbubble destruction,UTMD)技术将药物靶向递送至病灶区域并释放出所负载药物,实现诊断-治疗一体化[49]。研究显示超声能够增加微血管壁的通透性,同时也能促进药物外渗和向靶组织的输送;临床前研究也表明,超声与微泡联合使用可增加细胞膜的通透性,从而增强分子、纳米颗粒和其他治疗剂的组织分布和细胞内药物传递[19]。通透性增强的机制是通过高强度超声波和微泡相结合产生的一种“声空化”效应,在低超声强度(0.3 ~ 3 W · cm-2)下,声空化可能是由微泡稳定运动引起的,也称为稳定空化;而在较高的超声强度(大于3 W · cm-2)下,声空化通常伴随着微泡的爆炸性增长和崩塌的惯性空化[50]。
利用微泡进行的超声治疗已被证明是一种通过微泡增强微血管通透性来提高药物摄取率的高效方法,而且微泡介导的药物输送可以潜在地克服对周围正常组织的不可逆热损,能减轻药物对正常组织的毒性作用[19]。与其他类型的微泡相比,脂质微泡柔性更好,对临床超声频率的刺激表现出更好的应答,并且脂质可以在所含气体和周围血液之间形成一致的单层屏障,以防止注射后血栓的形成,因此脂质微泡在超声医学领域被广泛使用[5]。现从超声分子成像、癌症治疗、超声溶栓、跨血脑屏障给药等方面阐述脂质微泡在超声医学技术上的应用。
3.1 超声分子成像
超声分子成像是微泡应用的最早领域,在过去几十年中,微泡超声造影剂的出现增强了超声作为一种医学成像手段的能力,其可对血栓、动脉粥样硬化斑块、炎症区域和肿瘤生长相关的血管[51]生成进行分子成像,并促进了癌症检测、治疗和治疗后监测的创新策略。近几年,随着微泡技术的发展,脂质微泡用于成像的策略越发新颖。Meng等[52]设计了一种将脂质微泡转化为纳米粒的超声(US)响应型光声成像(PA)探针(Au@lip MBs),用于活体“无背景”的光声成像。如图2所示,Au@lip MBs由负载金纳米颗粒(Au NPs)的脂质微泡组成。Au@lip MBs在近红外光(NIR)激发下具有较低的PA信号,但在超声脉冲作用下,其会发生破裂形成纳米尺度的Au@lip纳米粒子聚集体,由于红移的表面等离子体共振,这些纳米粒子表现出显著增强的近红外光声(NIR PA)信号。因此,通过从超声后捕获的PA图像减去超声前捕获的,可以扣除组织背景PA信号,以实现高灵敏度的无背景PA成像。该研究可以启发下一代US/PA双模显像剂的设计,有望精确检测具有强吸收背景的组织或具有复杂血管组织的器官。

图 2 微泡超声响应型光声成像探针用于活体“无背景”光声成像模式图[52]Figure 2 The illustration of microbubbles (MBs) ultrasound responsive photoacoustic imaging probe for"background-free" photoacoustic imaging pattern in vivo[52]
具有多模式成像功能的脂质微泡成为近期研究的热点。Huynh等[53]采用了一种使用低频超声(LFUS)将卟啉脂质微泡(PMBs)转化为纳米颗粒用作超声、光声和荧光成像的三模态造影剂进行多模式成像。当暴露在超声波下时,负载全氟碳气体的PMBs破裂并形成更小的具有与原始微泡相同光学特性的纳米颗粒。并且,这种转化在荷瘤小鼠中是可能的,可以用光声成像进行验证。超顺磁性氧化铁纳米颗粒(SPIONs)作为无机生物材料,因其独特的物理、化学和生物学特性而备受关注。SPIONs可被引入到微泡外壳中,由此产生的复合微泡结构已被应用于超声与核磁共振(MR)相结合的多模式成像和药物输送[54]。Yan等[55]采用层层自组装的方法将磁性Fe3O4纳米颗粒通过静电作用结合到脂质微泡的表面,制备具有超声和磁场双重响应特性的磁性脂质微泡;Park等[56]设计了可将不同类型的纳米颗粒(包括Fe3O4或Au)附着到表面的稳定脂质微泡,用于增强US成像、MR成像或PA成像对比度。此外,还可以锰螯合卟啉脂质为原料,包裹C3F8惰性气体,制备出集US成像和MR成像于一体的脂质微泡,并在US和MR成像中均表现出良好的对比度增强[57]。
总之,脂质微泡易于功能化,能够与其他成像技术相结合,以促进多模式成像,这也是脂质微泡在超声分子成像应用中的一个重要发展趋势。随着成像技术的发展,脂质微泡的优势也越来越明显,有望成为新一代成像剂,用于多模式成像,推动智能化医学成像技术的发展。
3.2 癌症治疗
在诸多应用中,超声微泡(USMB)介导的药物传递在癌症治疗方面显示出巨大的潜力,同时也是一种相对安全和低成本的方法。微泡可与抗癌药物或药物载体结合在一起,以允许同时给药或单独给药。超声波照射后,血管中的微泡在肿瘤组织经历空化和塌陷,这些机械效应将会破坏或打开肿瘤组织内皮细胞之间的紧密连接,导致血管通透性增加。因此,抗癌药物可以在肿瘤部位被特异性地摄取并发挥治疗作用。这种方法允许具有较高选择性的治疗药物进入肿瘤细胞,因此,超声引导的靶向给药可以减少全身毒性,同时确保治疗部位的高剂量局部给药。此外,由于脂质微泡脂质外壳具有两亲性结构且表面易于修饰,其可负载化疗药物[58]、小分子核酸[59]、抗体[35]、光敏剂[60]等不同类别的药物,故能针对癌症进行化疗、基因治疗、免疫治疗、光动力治疗(photodynamics therapy,PDT),或将几种疗法相结合进行协同治疗,从而提高疗效,同时减小对正常组织的毒副作用。例如,Li等[44]设计了一种负载化疗药物多西他赛(docetaxel,DTX)并使用PD-L1单克隆抗体(anti-PD-L1-mAb)修饰的多功能脂质微泡(PDMs),用于肺癌的化疗和免疫治疗。如图3所示,图3A总结了PD-L1介导的免疫化疗脂质微泡的合成过程,即DTX负载在脂质微泡的脂质外壳中,PD-L1单抗通过氨基(-NH2)和羧基(-COOH)形成的碳二亚胺连接在脂质微泡表面。如此形成的免疫化疗脂质微泡通过尾静脉注射到体内后,在肿瘤部位给予超声波照射(见图3B),通过UTMD技术破裂微泡释放所包载的抗癌药物DTX,使DTX在肿瘤部位得到蓄集,达到更高的药物浓度,微泡在超声作用下的空化和声孔效应,促使更多的药物进入肿瘤细胞,从而提高疗效。同时,PD-L1单抗在肿瘤部位可以阻断免疫抑制的PD1/PD-L1途径,使功能受抑制的免疫细胞恢复对肿瘤细胞的识别功能,从而达到通过自身免疫系统实施免疫治疗,有效抑制肿瘤生长的目的。如此设计的智能化免疫化疗脂质微泡,可使药物在肿瘤部位局部释放,有效减轻化疗药物以及PD-L1单抗对正常组织产生的潜在毒性。作者通过荧光显微镜和流式细胞仪检测显示,小鼠经PDMs处理后,肿瘤细胞对DTX摄取增加;通过体内荧光成像观察DTX和PD-L1在肿瘤组织中的分布,结果表明,PDMs不仅可以提高化疗效果,而且可以通过促进CD4+T细胞和CD8+T细胞的增殖,降低血管内皮生长因子(vascular endothelial growth factor,VEGF)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)和转化生长因子-β(transforming growth factor-beta,TGF-β)等细胞因子水平来增强抗肿瘤作用。以上结果都表明PDMs具有良好的抗肿瘤作用,并且超声联合免疫化疗微泡的协同治疗可能是治疗多种恶性肿瘤的一种有潜力的方法,有望为联合免疫治疗开辟一条新的途径。
PDT利用光启动光敏剂,将能量传递给组织氧,产生直接导致组织破坏的活性氧物质[61]。其因公认的选择性、安全性和可重复性已成为许多肿瘤的潜在替代疗法[62]。微泡是一种很好的辅助PDT用于癌症治疗的候选材料,原因在于微泡可以增强超声对比度,有助于更好地定位病变部位,并通过UTMD技术靶向输送光敏剂,这是提高PDT选择性的关键。You等[63]报道了一种由卟啉接枝脂质(PGL,由双碳链和卟啉组成)、二硬脂酰磷脂酰胆碱(DSPC)、DSPE-PEG2000、胆固醇和惰性氟碳气体混合制备而成的微泡(PGL-MBs)。PGLMBs是一种新颖的基于MBs、LFUS辅助的PDT策略,其具有较高的卟啉负载率,且可以通过US成像进行实时检测,应用UTMD技术可以有效地将PGL-MBs转化为卟啉接枝脂质纳米粒(PGLNPs),这种“由大到小”结构的转换能促进光敏剂在肿瘤组织中选择性积聚,对肿瘤部位进行激光照射后可以对肿瘤起到良好的光动力治疗效果(见图4)。此外,Sun等[64]设计了负载低氧诱导因子-1α小干扰RNA(HIF1α-siRNA)的阳离子PMBs;Zhao等[60]设计了负载乳腺癌分子分型的重要转录因子的小干扰RNA(FOXA1-siRNA)的PMBs用于乳腺癌的治疗,两项研究均表明,通过UTMD技术将PDT与基因疗法相结合,协同治疗癌症,均能增强治疗效果。

图 3 新型免疫化疗脂质微泡形成过程及协同治疗肿瘤方案[44]Figure 3 The formation process of novel immune chemotherapy lipid microbubbles and collaborative treatment of tumor[44]

图 4 基于微泡的超声辅助PDT策略示意图[63]Figure 4 Schematic diagram of ultrasound-assisted PDT strategy based on microbubbles
肿瘤缺氧被认为是限制癌症治疗成功的一个因素,利用负载氧气的脂质微泡向肿瘤部位输送氧气增强放射治疗和PDT等的疗效也是肿瘤治疗的一个策略[65]。由于微泡具有声学活性,可利用超声刺激载氧微泡在缺氧肿瘤部位进行氧气释放。Yang等[66]制备了一种负载混合气体(O2/C3F8)的载氧脂质涂层微泡(OLMs),该微泡可通过超声控制肿瘤特异性氧气的输送。研究表明,OLMs表现出较好的氧气输送能力,可用于肿瘤复氧的可控释氧。McEwan等[67]也研究了在低氧环境下将载氧微泡与增敏药物联合使用以增强声动力学效应的可能性,结果表明,这种将氧气和增敏药物递送至缺氧肿瘤的方法,可以显著提高声动力治疗效果。
微泡用于癌症的治疗主要依赖于UTMD,即利用低频中功率超声与微泡联合触发空化的超声治疗方法[49],其可以促进负载在微泡中的药物靶向集中在病灶部位,从而针对性地杀伤肿瘤细胞,同时减轻对正常组织的毒副作用。与其他类型的微泡相比,脂质微泡因其独特的负载药物能力以及易于修饰的特性而具有更大的发展潜力。近年来,越来越多新型多功能的载药脂质微泡被报道,显示出其在超声医学技术上正朝着智能化方向发展,有望利用其改善癌症治疗效果,为癌症治疗提供可行的新策略。
3.3 超声溶栓
血栓形成是指血液在血管内形成凝块,阻塞通过心血管系统的血液流动,是导致心、脑和外周血管事件的关键致病因素,也是导致死亡和残疾的直接原因。血栓形成的临床研究主要集中在常见的动脉血栓,如卒中或心肌梗死,或静脉血栓,如深静脉血栓形成(deep vein thrombosis,DVT);血栓形成也会影响微循环,对身体健康产生严重影响[68]。超声溶栓(ultrasound thrombolysis,STL)利用微泡与超声相结合来促进血栓溶解,是一种微创或非侵入性的物理方法。超声本身就具有增强溶栓作用,而微泡增强溶栓的机制通常归因于超声诱导的空化,其能导致声流效应、轴向流体加速和高速流动梯度,可以穿透和破坏血栓的基础结构[69]。
利用脂质微泡对血栓进行分子成像以快速定位血栓在STL的应用中至关重要,Wang等[70]报道了一种快速、可靠、高灵敏度的可实现活化血小板特异性CD62p靶向血栓超声分子成像的方法,首先合成并预先注射反式环辛烯(TCO)修饰的CD62p抗体(TCO-antiCD62p),CD62p抗体是血小板黏附受体(P-选择素)的重要靶向探针,当血小板被启动形成血栓时,外膜与血小板α颗粒的融合使P-选择素暴露在血小板表面[71-72]。因此,在TCOantiCD62p处理的第一步,血栓可与TCO-antiCD62p非共价结合并相互作用。随后加入精制的四嗪标记 的 微 泡(tetratrazin-tagged microbubbles,Tetra-MBs),其能与TCO-antiCD62p预处理的血栓或血小板聚集进行快速选择性反应,从而可以进行实时超声分子成像。由于微泡在空间和时间上的高度敏感性,这种预靶向策略在分子水平上为早期检测血栓提供了高精度。此外,Tetra-MBS在生理条件下表现出长期稳定性,能够保持实时监测血栓变化的能力。这种基于Tetra-MBs的生物正交靶向分子超声成像策略也被证明可以成为快速诊断急性血栓形成的一种简单而有力的工具。该研究为今后开发诊断、预防和治疗急性血栓的智能化创新策略打开了新思路。
最近,不少研究报道了脂质微泡负载溶栓药物,通过超声波局部启动,靶向释药抗击血栓,同时脂质微泡本身在超声波中产生的空化作用可以在微观尺度上机械地破碎凝块,从而取得不错的溶栓效果。例如,Wang等[73]采用超声微泡造影剂(SonoVue®)联合常见溶栓药物——尿激酶(urokinase,UK)治疗血栓形成,评价尿激酶联合超声、微泡在体内外溶栓治疗DVT的效果。在体外,使用形成时间分别为1、3、7、14和21 d的血栓用于溶栓;在体内,用45只成年杂种犬评价体内血栓形成情况。体内外实验分析表明,与UK单独使用和UK+US联合使用相比,UK+US+MBs的溶栓效果最佳,溶栓率显著提高,表明超声与微泡造影剂、尿激酶联合应用可能具有协同溶栓作用,同时超声和微泡的组合会减少尿激酶的剂量并降低药物的不良反应。
微泡增强的超声溶栓治疗是增加当前溶栓药物治疗的耐受性和疗效的有前途的方法,然而,在血栓部位保持足够治疗浓度的微泡和溶栓药物仍然是一个挑战。为此,De Saint Victor等[74]设计了一种新型的具有磁性靶向功能的脂质微泡,负载新型的血栓溶解剂——组织型纤溶酶原激活物(tissue type plasminogen activator,tPA)进行超声溶栓。该磁性靶向微泡是将粒径为10 nm的磁铁纳米粒和tPA负载在脂质微泡中形成。实验使用苏木素伊红(hematoxylin & eosin,H&E)染色研究了不同处理对血凝块结构的影响,结果显示血凝块给予有磁场的tPA+US的磁性微泡处理后,与tPA单独处理、tPA+US处理和无磁场的tPA+US的磁性微泡处理相比,其对血凝块有明显的溶解效果。该研究在体外阐明了磁性靶向可以显著加速超声时微泡增强的酶促超声溶栓作用,并有可能减少给药剂量,使血管再通更快实现。与无磁力的微泡相比,使用磁性靶向时,观察到的血栓的裂解速率增加了3倍以上。这些结果表明,在微泡介导的超声溶栓治疗闭塞性疾病的应用中,磁性靶向具有增强治疗功效和患者耐受性的潜力。
大多数超声溶栓研究都基于非阻塞性血栓,主要通过微通道或旁路输送微泡和溶栓剂。然而临床上大多数血栓是阻塞性的,微泡诱发的声空化只能发生在接触的血栓边缘,使其溶解血栓的效率降低。Gao等[75]报道了一种将导管定向疗法(catheterdirected therapy,CDT)与超声溶栓技术相结合的溶栓治疗方法。CDT也称为血管内疗法,可以机械去除大部分或部分血栓或直接将较高浓度的血栓溶解剂递送至血管内血凝块,其是血栓形成疾病的替代方法。CDT可增加血块中微泡的局部浓度,再进行超声处理,微泡产生足以击碎血栓的声空化。这种简单的技术可以加快血栓栓塞性血管的再通,并减少溶栓剂的施用,从而改善溶栓效果并降低溶栓相关副作用发生率。
3.4 跨血脑屏障给药
BBB限制了分子在人体与脑实质之间的运输,本质上,只有具有低相对分子质量和疏水性的药物才能跨过BBB到达脑实质[76]。针对帕金森病、阿尔茨海默病和脑瘤等脑部疾病,需通过特殊的药物输送系统将药物输送到脑实质中,因此,开发增强BBB通透性的方法意义重大。通常认为,MBs在声场中的膨胀和塌陷使细胞膜或微脉管系统发生通透性变化,从而有利于血管内的药物或基因向组织递送。近年来有文献报道,聚焦超声(focused ultrasound,FUS)结合静脉注射MBs可用于无创、局部和可逆地打开BBB,实现非侵入性、暂时性和局部性脑内给药[77]。这项技术通过增加局部BBB的通透性,允许部分大分子和小分子运输到所需的大脑区域,而不依赖于增强的渗透性和滞留(enhanced permeability and retention,EPR)效应[78]。脂质微泡由于脂质壳层亲脂的性质以及易于功能化和负载治疗药物,并具有良好的生物兼容性,常被用于与FUS相结合打开BBB进行药物或基因递送[79]。例如,Huang等[80]通过多聚L-赖氨酸(poly-L-lysine,PLL)的逐层组装技术将质粒连接到脂质微泡的表面,在核磁共振成像(magnetic resonance imaging,MRI)诱导下,使用FUS和装载DNA质粒的脂质微泡实现基因的脑内靶向输送;Fan等[81]开发了负载治疗剂[阿霉素(DOX)]并与SPIONs偶联的多功能脂质微泡(DOX-SPIONs-MBs),在充当MRI和US双重造影剂的同时,打开BBB并执行磁靶向的药物输送;此外,负载DNA(荧光素酶质粒)和偶联叶酸的阳离子脂质微泡传递系统也被构建并用于BBB开放和选择性基因传递[82]。
超声启动MBs可诱导其转化为纳米颗粒(NPs),这种“由大变小”的策略可以进一步增加药物对肿瘤和脑组织等多种组织的输送[83]。例如,Zhao等[84]制备了含磷脂酰丝氨酸(phosphatidylserine,PS)的脂质微泡(PS-MBs),通过UTMD暂时打开脑梗死晚期的BBB,此外,PS-MBs可在超声波作用下转化为更易于通过BBB的PS-NPs,然后被活化的小胶质细胞/巨噬细胞(microglia/macrophage,M/M)吸收,实现了针对炎症区域的递送(见图5)。研究表明,PS-MBs结合超声暴露可以安全地打开BBB,且所得的PS-NPs可进一步靶向神经炎症中活化的M/M,而这种靶向性主要归功于PS头基的磷酸化-L-丝氨酸。
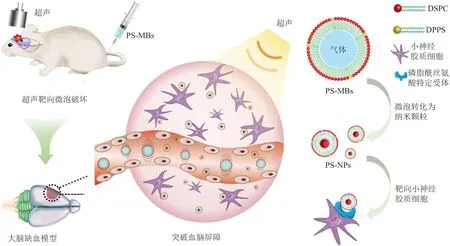
图 5 磷脂酰丝氨酸脂质微泡靶向活化的小胶质细胞/巨噬细胞治疗卒中炎症的示意图[84]Figure 5 The illustration of phosphatidylserine microbubbles targeting activated microglia/macrophages for stroke inflammation treatment [84]
FUS与MBs相结合打开BBB进行药物或基因的递送用于治疗脑相关疾病,其药物传递效率和机制已在中枢神经系统疾病动物模型中得到了广泛的研究。这项技术可用于在不发生脑损伤的情况下,在特定区域进行非侵入性和暂时性的药物输送,属于较为智能的药物输送方式。最近,相关临床试验也对FUS与MBs相结合打开BBB的治疗策略进行了评估,例如,使用低功率MR引导的经颅FUS和Definity®相结合进行BBB开放的临床试验[85],以及使用非聚焦超声与SonoVue®相结合打开BBB的临床试验[86]。这些临床试验招募了胶质母细胞瘤、多形性胶质母细胞瘤和阿尔茨海默病等患者,超声和微泡的组合被证明可以诱导其脑组织中的BBB开放,而对大脑无明显的损害。因此,利用超声和微泡打开BBB正被广泛应用到临床研究中。随着脂质微泡技术的发展,更加智能化的通过FUS打开BBB的药物输送系统有望被设计出来,并向临床转化,更进一步推进脂质微泡在超声医学技术上的发展。
4 总结与展望
微泡的外壳可由多种材料制成,包括蛋白质、表面活性剂、脂质、聚合物和聚电解质多层膜等[87],与其他类型的微泡相比,脂质微泡具有更多优势,原因在于脂质微泡具有以下特性:1)稳定性好。与表面活性剂气泡相比,脂质微泡具有稳定的脂质壳层,并能延长在血液中的循环时间,造影持续时间长。2)具有安全性。构成脂质层的磷脂膜具有良好的生物相容性且可以生物降解,对人体无害。3)药物负载方式多样性。脂质壳层的两亲性结构,决定了脂质微泡可以负载亲水、亲油或两亲性药物,且壳层表面易于修饰,从而可以通过静电作用、化学反应或配体结合的方式连接更多类型的药物或配体。4)靶向性。脂质壳层易于功能化,可以连接靶向特定部位的靶分子,增强靶向性。
脂质微泡与超声波的结合最早应用于超声分子成像领域,但随着微泡技术的发展,除了在诊断领域体现的靶向成像外,脂质微泡作为药物和基因的输送系统用于疾病的治疗也取得了一定的进展,特别是在跨越BBB的药物输送和癌症治疗方面。载药脂质微泡与超声相结合除了在分子成像、癌症治疗、超声溶栓和跨越BBB给药等方面的应用以外,还可以用于治疗泌尿系统感染[42]与结石[88]、黏膜疫苗接种[89]、经皮给药[90]、治疗性气体输送[17]等。因此,脂质微泡在超声医学领域表现出来的优势越来越明显,也逐渐成为一种备选的治疗方案,推动智能化超声医学技术的发展。
然而,载药脂质微泡仍然存在以下问题需要进一步研究:1)克服脂质微泡与超声相结合对机体带来的潜在毒副作用,例如超声与微泡相结合导致的空化效应对组织或血管带来的损伤;2)提高脂质微泡的载药率和包封率;3)提高载药脂质微泡的靶向性;4)明确载药脂质微泡在体内的代谢途径。随着国内外对载药脂质微泡研究的不断深入,相信这些问题都会在将来得到很好的解决。总而言之,载药脂质微泡和超声波的结合具有很大的应用潜力,不仅可以被设计成为多模式的成像系统,还可以作为药物递送系统用于重大疾病的治疗,例如癌症、神经性疾病、脑卒中和血栓等,使超声医学逐渐朝着更加智能化的方向发展。

