还原镀金研究进展
吴博,黄静梦,谭桂珍,郝志峰,胡光辉,崔子雅,罗继业,谭柏照,杨应喜,李小兵,黎小芳,刘彬云
(1.广东工业大学 轻工化工学院,广州 510006;2.广东东硕科技有限公司,广州 511400)
金具有优良的导电性、可焊性和耐腐蚀性,可作为功能性镀层广泛应用于电子产品中线路板的表面保护、金丝/铝丝键合和提高锡焊性能,也可应用于装饰性产品如首饰、高档艺术品的加工等[1-2]。金层的沉积可通过化学镀和电镀进行。电镀时,金离子的还原是依靠外部电源提供电子,因此必须保证待镀覆的图形线路与电源是互连的;而化学镀可以很好地克服这种缺陷,无需外电源驱动,设备简单,由于不存在电流分布不均的问题,因此还能在复杂的图形和不规则的样品形状上沉积均匀的金层。
根据电子供体的不同,化学镀金分为置换镀金和还原镀金。置换镀金是依靠基底金属提供电子,在化学镀镍/置换镀金(ENIG)工艺中,镍磷层中金属镍的电子转移到金离子上,自身氧化为镍离子溶入镀液[3]。随着沉积反应进行,溶液中的镍离子浓度逐渐升高,镀液需具备良好的镍离子耐受力才可长期使用,否则不利于镀液稳定性和金镀层的性能。ENIG工艺实际是金离子对镍磷层的可控腐蚀,如果镀液成分搭配不当或反应条件不合适,将会造成镍磷层被过度腐蚀,形成“黑盘”,黑盘将降低镀层的可焊性,镍层的腐蚀形貌如图1 所示[4-7]。ENIG 工艺反应的进行是依靠镍磷层与镀液的直接接触得以实现,一旦金层增长至一定厚度,将会对两者造成阻挡,反应随即停止,因此置换镀金沉积的金层厚度有限,一般为0.05~0.1 μm[8-10],这难以达到在航天航空或军工设备等高新技术领域中的应用要求。此外,镀层孔隙率较高也是置换镀金工艺的不足之处[4]。
还原镀金是依靠还原剂提供电子,对镍磷层的腐蚀较小,沉积厚度也可不受金层的限制,理论上只要镀液成分合理并能够及时得到补充,反应便能一直持续,因此可以沉积厚金。还原镀金的挑战在于镀速与镀液稳定性的兼顾,由于充当电子供体的还原剂分布于镀液各个区域,所以可能导致氧化还原反应发生在溶液本体,造成镀液分解,特别是在无氰镀金体系中,这种问题更为显著。

图1 镍层的腐蚀形貌[5-6]Fig.1 Corrosion morphologies of Ni layer[5-6]: a) surface;b) profile
还原镀金体系的主要成分为金盐、络合剂、还原剂、缓冲溶液、促进剂和其他添加剂,其中,络合剂的研究对镀金液的开发是非常重要的,但是还原剂和促进剂的研究也不可缺少,这些组分的改变都会显著影响镀液的反应速率和稳定性。国内外学者在氰化物体系和无氰化合物体系镀金领域做了很多工作[11-15],但是着重介绍的是络合剂的研究历史和研究现状,对还原剂或促进剂的研究较少。本文综述了化学镀金中还原剂和促进剂的研究现状,以期为相关领域的研究人员提供借鉴,促进无氰还原镀金的发展。
1 还原镀金的分类
根据金属对还原剂不同的催化活性,可将还原镀金分为基底催化镀金和自催化镀金,反应原理如图2所示。
基底催化镀金是由Iacovangelo 和Zarnoch[16]首先提出的。基本原理是,依靠基底金属对还原剂的催化作用,使其发生氧化反应,金离子得到电子,沉积在基材上。PCB 表面处理工艺常用于镍磷层和镍磷/钯层表面镀金,镍磷层和钯层为基底金属。当金层厚度增加到一定程度时,将基底完全覆盖,如果选用的还原剂在金表面无法发生氧化,则镀金反应停止,因此金层厚度仍然有限。
自催化镀金工艺有别于置换镀金和基底催化镀金,其特点是能够实现金层的持续增厚。自催化镀金是由沉积的金起催化作用,包括三个阶段[9]:在成核和生长的初始阶段,基底的催化活性起主导作用,对于不具有催化作用的基底,需采用活化工艺引导金层的沉积;在中间阶段,已经沉积了足够的金来催化反应,但仍然存在足够的孔隙,使还原剂能够与基底接触,基底的催化作用仍可能存在;在后期阶段,金层完全将还原剂与基底阻隔,反应依靠金层的自催化进行。

图2 还原镀金原理示意图Fig.2 Schematic diagram of electroless deposition processes: a) substrate catalysis; b) autocatalysis
2 还原剂的研究进展
络合剂和还原剂的开发是无氰镀金技术的主要研究内容。相比于还原剂,络合剂的研究成果较多,其发展历程也较清晰,从最初的硫化物无机盐到近几年的氮杂环有机分子的应用,说明络合剂的开发有较大的进展[15,17-19]。而还原剂的发展显得较为迟缓,所使用的还原剂普遍是常用的还原剂,各种报道也没有阐明哪一种还原剂可占主流地位,也未了解理想的还原剂应当具备哪些分子特征。随着无氰络合剂的开发日趋完善,为还原剂的研究提供了一种较为稳定的基础镀液,还原镀金可能紧跟着电镀金和置换镀金成为又一个值得深入研究的课题。还原剂的氧化机理大致包括以下步骤[20]。

在机理研究方面,由Wagner 和Traud[21]提出的混合电位理论,是研究化学镀电化学过程的常用方法。这个理论假定阴极和阳极半反应是独立进行的,为金属表面提供了混合电位,使两个半反应通过电荷守恒得到平衡。因此,可以独立地测量单个阴极和阳极半反应的极化行为,从而预测净化学反应速率和表面混合电位。值得注意的是,一些研究者[22-23]对甲醛化学镀铜和乙醛酸化学镀铜工艺进行研究,发现阴极和阳极反应是相互依赖的,这导致了更复杂的电化学反应途径,因此不能简单地用混合电位解释,在还原镀金体系的研究中也应当重视这个问题。2019 年,Zeszut 和Landau[24]通过监测外部电流和沉积金属量,确定了实际研究系统中正确的阳极和阴极极化曲线,并将其应用于混合电位理论。利用这种方法可以很好地描述乙醛酸化学还原铜的过程,虽然该研究工作以铜-乙醛酸体系为例,但有望可以推广到其他化学镀过程中。
本节涉及的部分有机试剂分子结构如图3 所示,所用绘图软件为Materials Studio,通过Clean 功能简单优化结构。灰色、白色、蓝色、红色、粉色和黄色小球分别代表C、H、N、O、B 和S 原子。
2.1 亚硫酸盐
亚硫酸盐最初应用于无氰镀金的目的是充当一种络合剂[3],目前常见的无氰亚金盐,亚硫酸金钠,便是选择亚硫酸盐作为配体,在后续的研究中才逐渐发现,亚硫酸盐不仅具有络合效果,在镀液中还发挥着还原剂的作用。

图3 分子结构示意图Fig.3 The molecular structures: a) dimethylamine borane; b) hydroxyl sulfate; c) hydrazine; d) tetraethylene pentaamine;e) ascorbic acid; f) dehydroascorbic acid; g) thiourea; h) L-cysteine
Krulik 等[25-26]在Ni-B 基底应用亚硫酸钠体系镀金时,即使不添加其他还原剂,金层也能以 1.0~1.5 μm/h 的速率发生沉积,这是其自催化反应的结果。Kato 等[27]对这一体系进行了详细的机理研究,发现沉积反应不能发生在金基底上,并非自催化反应。实际上,这一过程既包括基底催化反应,也包括置换反应,而基底催化起着主要作用。极化曲线测试表明,SO32–是基底催化金沉积反应的还原剂。
亚硫酸盐-硫代硫酸盐也是早期无氰镀金常用的配体,这种混合配体的开发主要是为了解决单独使用亚硫酸盐时其易分解的问题[28]。Li 等[29]发现Na2S2O3的加入还有提高镀速的作用,在亚硫酸钠体系的无氰镀金液中加入少量(小于0.01 mol/L)的Na2S2O3可显著提高镀速,最高可达0.1 μm/10 min,通过阴极和阳极极化曲线发现,这种加速作用是通过促进镍的氧化和金离子的还原来实现的。值得注意的是,作者认为亚硫酸钠体系是一种置换反应体系,这与前人的研究结果不符,同时Na2S2O3具有一定还原性,其加速作用实际上是否是通过还原性来实现的尚未可知,因此其加速机理还有待进一步分析。
亚硫酸盐和硫代硫酸盐的化学性质不稳定,容易发生分解,这是后来这种络合体系被研究得越来越少的原因。还原剂发挥作用可能也不利于镀液的稳定性[14,30-31]:


2.2 胺硼烷
胺硼烷类还原剂主要以二甲基胺硼烷(DMAB)的研究居多。一般认为,DMAB 在碱性溶液中的解离速度较快[33]:

中间体BH3OH-可能通过两种途径氧化[34-35]。一种是提供六个电子的反应:

另一种是提供三个电子的反应:

有报道称,DMAB 氧化时这两种途径可能同时存在[35-36]。BH3OH−也可发生分解反应[35]:

在pH 大于12 或在过渡金属表面,分解反应可得到抑制[37]。随着反应条件的变化,DMAB 的最终氧化产物也会产生变化,氧化硼、硼酸、硼酸盐、HB4和其他硼酸盐阴离子已经被检测或提出[9,33,38-41]。
Okinaka[42]首次报道了以碱金属硼氢化物和二甲基胺硼烷为还原剂,氰化金钾为金盐的化学镀金液。Ohtsuka 等[43]采用循环伏安法研究了DMAB 作为还原剂的化学镀金液,结果表明,氰化物离子对DMAB的氧化有较大的抑制作用。随着镀覆时间延长,金的厚度呈线性增加,说明该实验镀液具有自催化反应特性。在pH 为13 以上的条件下,自催化化学镀金效果较好,最佳镀液条件下的沉积速率约为2 μm/h,金的晶粒尺寸为1~5 μm。但该镀液不适合高温的反应环境,在80 ℃以上时,镀液变得不稳定,在85 ℃时,发生分解,因此70~75 ℃被认为是适合的反应温度区间,配方的组成如表1 所示,其中,镀液pH为13.1~13.4,反应温度为70~75 ℃。

表1 DMAB 体系镀液组成[43]Tab.1 Composition for gold plating bath containing DMAB[43]
Matsuoka 等[44]研究表明,在初始阶段,DMAB体系镀金液在铜基底上可以快速镀金,当铜完全被金覆盖后,沉积速率降低。发现铜基体镀金初期的析出过程是由置换镀和铜催化还原反应同时作用,经过一段时间后,金的自催化反应起到主要作用。lacovangelo[9]对其进行原理分析并对比不同金属对DMAB的催化能力,研究了DMAB 在Cu、Ni、Pd 和Au 表面的极化曲线,发现镍和铜得到的电流密度大约比钯和金得到的电流密度高一个数量级,说明DMAB 在镍基和铜基上的还原能力更强,由此解释了Matsuoka等人的实验现象。Gaudiello[45]在氰化物体系中以DMAB 作为还原剂,可在宽温度范围(50~70 ℃)和宽金离子浓度范围(1~3 g/L)操作,镀速为1.5~2.2 μm/h,镀层均匀,通过延长反应时间成功制备了厚度为50 μm 的镀层,证实这是一种自催化还原镀金体系。结合这三篇报道可知,DMAB 或许既有基底催化效应,又有自催化效应,并且基底催化效应更为显著。
Plana 和Dryfe[46]在金电极表面研究DMAB 的氧化过程,认为第一步反应,即DMAB 在碱性溶液中的解离与金属表面催化有关,硼氮键的断裂需要DMAB与金属表面的持续接触才较容易发生。Ellsworth 和Walker[47]也认为,金属的沉积速率有赖于胺硼烷中硼氮键的强度。
Sargent 和Sadik[33]利用电化学石英晶体微天平(EQCM)研究了DMAB 在金表面的电化学行为。研究发现,线性扫描下金电极的质量增加,直接体现了 DMAB 与金的相互作用,这种质量的增加是DMAB 氧化后活性中间体在金表面的吸附造成的,可见还原剂的吸附在沉积过程中起主要作用。
2.3 次磷酸盐
次磷酸盐的氧化反应需在具有催化效应的基底表面才能发生,钯和镍对其有催化活性,次磷酸钠体系的化学镀镍液正是利用这种原理来实现4~5 μm 厚的镍磷层的沉积,而纯金不催化次磷酸盐的氧化[48-50]。Yang 等[48]提出了次磷酸盐的氧化机理猜想,P—H 键的H 原子以共价键的形式与金原子成键,吸附在金活性表面,形成吸附态次磷酸根,再产生电子,给予金属离子。
Onabuta 等[51]提出次磷酸盐的可能反应途径如下:
首先,次磷酸根吸附到金属表面,成为吸附态次磷酸根。

吸附态次磷酸根可能出现两种反应。一种是先脱氢生成三配位中间体,再被氢氧根进攻。

另一种反应是先被氢氧根进攻生成五配位中间体,再脱氢。

Wu 等[52-53]采用柠檬酸金钾代替氰化亚金钾,选择次磷酸钠和硫酸羟胺作为混合还原剂,发现两者的混用不会对镀液的稳定性产生影响,这可能与次磷酸钠和硫酸羟胺只在表面催化氧化有关,该体系配方如表2 所示[54-55]。通过硫酸溶液和氨水调节镀液pH 为6.3~6.7,反应温度为86~90 ℃。开路电位测试进一步发现,高浓度次磷酸钠的加入可缩短到达平台电位的时间,但是对金层的总体厚度影响不大。说明次磷酸钠是一种基底催化还原剂,不受金层催化,主要在反应初始阶段起到还原作用。而硫酸羟胺的加入也使到达平台电位的时间缩短,但是其对金层厚度影响更加显著,加入0.03 mol/L 的硫酸羟胺后,反应10 min便可将厚度由0.07 μm 提升至接近0.1 μm。在褪去金层后,发现相对于未添加硫酸羟胺,添加硫酸羟胺的镍层腐蚀情况有明显改善,如图4 所示。两种还原剂的复配使用,使镀层耐腐蚀性能比未使用或仅使用一种还原剂有所提高。

表2 次磷酸钠-硫酸羟胺体系镀液组成[52]Tab.2 Composition for gold plating bath containing sodium hypophosphite and hydroxyl sulfate[52]

图4 不同还原剂下镀金层褪金后Ni-P 层表面及截面微观形貌(3000×)[52]Fig.4 Surface micro topography and cross-sectional micro topography of Ni-P surface after etching gold(3000×): a) no reducing agent; b) 0.05 mol/L sodium hypophosphite; c) 0.05 mol/L sodium hypophosphite and 0.03 mol/L hydroxyl sulfate[52]
肖忠良等[56]在含氰化亚金钾和次磷酸钠的基础镀液中添加乙二胺四乙酸二钠、乙二胺四亚甲基膦钠和柠檬酸三铵作为复合络合剂,虽然稳定性可达6 MTO,但是沉积速率较慢,仅为0.0066 μm/min。这可能与次磷酸盐的催化特性有关,随着镍层逐渐被金层覆盖,镍层的催化氧化效果随之下降,而金层不起到催化作用,反应速率也降低。
2.4 联氨
Harrison 等[57]认为联氨的反应过程是经过四次氢氧根配位-脱水-给电子过程,如图 5a 所示。Meerakker 等[20]则认为联氨可能首先脱去氢原子,接着与氢氧根配位并给出电子,如图5b 所示。

图5 联氨被氧化的两种可能反应过程[20,57]Fig.5 Two possible reaction paths for hydrazine oxidation[20,57]
Iacovangelo 和Zarnoc[16]在以联氨用作还原剂的报道中,首先提出基底催化还原。根据他们的研究,在该氰化物体系镀液中,联氨只在镍表面起还原作用,而在金表面不反应。通过这种体系获得金层的厚度是有限的,但镀液对镍离子的存在不敏感,在金属镍表面和碱性pH 值的状态下,联氨也显现出一种强的还原性,提供金离子沉积所需的电子,抑制了置换反应的发生,从而保护镍基体不受腐蚀。尽管有这样的优点,但强碱环境与绘制线路所用的光刻胶不相容,容易导致光刻胶溶解或开裂。一方面镀液受到污染,另一方面使原先被光刻胶保护的金属线路暴露在镀液中,这部分线路也可能会沉积金层,改变图形电路的形状[58-59]。Nakazawa[60]对联氨体系还原镀金进行改进,通过添加具有直链烷基结构的胺类(四乙烯五胺),使镀液可在中性条件下操作。Shaigan 等[4]通过极化曲线进一步分析四乙烯五胺的作用原理,结果表明,四乙烯五胺可提高镍层的催化活性,即使在中性条件下,联氨也能保持高的还原性。通过将镀液中过量游离氰化物的浓度提高到0.035 mol/L 来提高金层厚度,虽然提升有限,但已能达到0.66 μm,基本满足表面处理的一般要求,该配方如表3 所示。通过柠檬酸和氨水调节镀液pH 为6.5~7.0,反应温度为85 ℃,反应过程伴随着轻微的机械搅拌。

表3 联氨体系镀液组成[4]Tab.3 Composition for gold plating bath containing hydrazine[4]
Vrublevskaya 等[61]在铁氰化钾-氯金酸钾镀金液中添加联氨作为还原剂,在Ni-P、Ni-B、Ni-Pd 和Cu 四种基底沉积了0.23~0.38 μm 厚的耐腐蚀性好、附着力好、结构致密的金层,并且发现,沉积速率与基底的选择有关,沉积速率由快到慢依次为Ni-P>Ni-B>Ni-Pd>Cu,这种差异可能与基底对联氨的不同催化能力有关。
然而联氨是一种极毒的化合物,基于无氰化学镀金开发的趋势来讲,在环保方面,联氨最终应该被淘汰,目前也没有研究证明联氨在化学镀金中的不可替代性,因此研究者可适当将研究重点转移到其他更为绿色的还原剂上。
2.5 抗坏血酸
抗坏血酸是一种有机酸,有两个可离去的氢原子,解离平衡常数pKa1=4.4 和pKa2=11.34[62]。抗坏血酸的氧化步骤大体上分为两个反应,首先是一级解离的化学反应,然后是给电子的电荷传递步骤,产物为脱氢抗坏血酸,如下式所示。其中,A 表示与环相连的两个羟基以外的结构,DA 表示脱氧抗坏血酸[63]。

抗坏血酸在镀液中不仅与金离子反应,还会与氧气反应生成脱氧抗坏血酸和过氧化氢,这是抗坏血酸还原能力过强所致。抗坏血酸与水中的溶解氧发生副反应,如下式所示[62,64]。

pH 值升高,副反应的反应速率会加快,并且由于氧气的迅速溶解,水中溶解氧的浓度基本恒定,副反应速率也基本恒定[65-66]。产物脱氧抗坏血酸在水中会迅速水解为2,3-二酮古洛糖酸,然后氧化为草酸[67]。
抗坏血酸体系镀金液是由日本关东化学公司开发的。KATO 等[68]配制了一种以NaAuCl4为金盐,Na2SO3和Na2S2O3为络合剂,抗坏血酸为还原剂的无氰镀金液,在60 ℃、弱酸性条件下,金沉积速率为1.2~1.5 μm/h,但是镀液寿命小于8 h。该研发团队[69]后来通过添加2-巯基苯并噻唑(MBT)改善了稳定性问题,配方如表4 所示,镀液pH 为7.0,反应温度为60 ℃。相比之下,添加了MBT 的镀液表现出较强的稳定性,含有1 mg/L MBT 的镀液直到第28 d才观察到包括沉淀形成在内的变化,使用放置14 d的镀液可以与新鲜配制的镀液以相当的沉积速率进行镀金。在沉积速率方面,加入1 mg/L 或更低浓度时,镀液表现出与无添加时相同的镀速,但添加2.5 mg/L 或更高浓度时,镀速则略有下降。

表4 抗坏血酸体系镀液组成[69]Tab.4 Composition for gold plating bath containing ascorbic acid[69]
Sullivan 和Kohl[70]以Na3Au(S2O3)2为金盐,抗坏血酸作为还原剂,在pH=6.4、30 ℃条件下进行自催化沉积。初始沉积速率可达0.89 μm/h,但随着反应进行,Na2S2O3的还原和累积导致其与金离子的配位发生复杂的变化,金配合物与抗坏血酸的电势差降低,反应速率减慢。通过在化学镀液中加入过氧化氢,将过量的分解为和,可以一定程度恢复镀液的活性和沉积速率。这种镀液只有很短的使用寿命,大约为2 h,需要再进行改进以提高稳定性。
谭谦[71]在构建的亚硫酸钠-硫代硫酸钠镀金体系基础上,添加了抗坏血酸作为还原剂,发现镀液体系稳定性较差。抗坏血酸极易变质,需储存在棕色瓶中,这种活泼的化学性质不利于保证镀液稳定性[72]。
2.6 硼氢化钠
NaBH4的还原作用是由水解的中间体BH3OH-发挥的,但是BH3OH–也会继续发生水解,极谱仪分析发现,其水解速率很快,因此NaBH4的利用率很低,一般不超过2~3%。NaBH4的反应方程式如下[73]:

Matsuoka 等[44]以NaBH4作为KAu(CN)4的还原剂,报道的配方组成如表5 所示,通过氢氧化钾溶液调节镀液pH 为11.2,反应温度为70 ℃。极谱分析发现,BH4–可将Au(CN)4-还原为Au(CN)2–,生成了游离CN–,因此这种体系不需特意添加KCN 也能保持稳定。当添加1.5 mg/L PbCl2时,镀速可提升7 倍,达到1 μm/h 左右。这可能是由于Pb2+首先还原生成吸附态的Pb 原子,Pb 原子起到催化作用,促进晶核的形成,TlCl 也具有类似的加速作用,但是这类促进剂的加入会造成Pb 或Tl 共析在镀层中,对镀层的结合力产生不良影响。Angstetra 和 Jeffrey[74]在以Na3Au(SO3)2为金盐,抗坏血酸为还原剂的镀液中添加Pb2+,却发现Pb2+对金的还原或抗坏血酸的氧化均无显著影响,可能这类促进剂的使用体系有一定限制。

表5 硼氢化钠体系镀液组成[44]Tab.5 Composition for gold plating bath containing sodium borohydride[44]
2.7 硫脲
镍层对硫脲具有催化活性,而金层不起催化作用,因此以硫脲为还原剂的体系,氧化还原反应仅发生在镍基底上,不发生在沉积的金层上,这是一种基底催化还原反应[27,75-76]。
硫脲体系是由日立公司的研究人员开发和改进的[76-78]。利用高效液相色谱、核磁共振波谱、质谱和激光拉曼光谱分析了反应产物,尿素是主要产物,还包含部分双氰胺。该镀液寿命只有12 h,通过添加产物到镀液中发现,稳定性并无明显变化,然而通入氧气后,镀液寿命降低至8 h,分析可能是硫脲氧化过程形成的自由基中间体(NH)(NH2)CS 与溶解氧反应,生成的(NH2)2CSO2对镀液不利。添加对苯二酚(HQ)后,自由基可恢复为原来的硫脲分子,节约了硫脲的使用量,也大大提高了镀液稳定性。改进后的镀液使用寿命可达两个月以上,镀速也未降低,为0.9 μm/h左右。改进后的镀液组成如表6 所示,镀液pH 为7.5~8.0,反应温度为60~90 ℃。
蔡积庆[79]指出,碱性条件下硫脲会氧化为氨基氰中间体,最终生成氨基氰聚合物,以凝胶状附着于基材表面,造成漏镀,需要添加胺类、羧酸类、氨基羧酸类或多元羧酸类等聚合抑制剂。
刘海萍等[80]在亚硫酸钠-硫代硫酸钠体系中添加2 g/L 的硫脲作为还原剂,镀速为0.3 μm/15 min。与无添加还原剂的置换镀金层相比,还原镀金层有更高的覆盖率和更好的耐腐蚀性,但是该体系的反应温度高达80 ℃,镀液稳定性有待进一步研究。
2.8 其他还原剂
2.8.1 甲酸
近年来,乙内酰脲衍生物作为金离子的络合剂逐渐受到关注,其中以5,5-二甲基乙内酰脲(DMH)的研究居多,主要应用在无氰电镀金液,DMH 与Au+和Au3+的配位结构如图6 所示[17,81-82]。2018 年,付文超[83]开发了DMH 体系还原镀金液,选择可被钯催化氧化的甲酸作为还原剂,以镍钯层为基底,尽管钯对甲酸有强烈的催化氧化作用,但镀速仅达到置换镀金的水平,为0.0418 μm/20 min。这可能是由于金层覆盖钯层后,钯层的催化作用便体现不出,而金对甲酸的催化氧化能力较弱,甲酸本身又是一种还原性较弱的还原剂,因此在反应后期,甲酸的还原作用微弱。
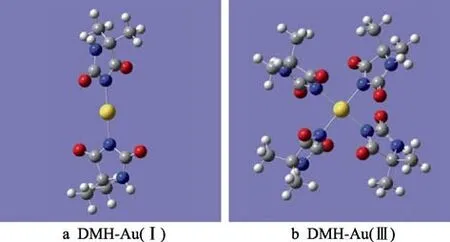
图6 DMH 与金离子配位结构Fig.6 The coordination structures of DMH with gold ion
2.8.2 Co(II)-胺络合物
许多氧化态较低的多价金属离子是足够强的还原剂,可以将其他金属离子还原为金属态,但大多数金属对这些还原过程的催化作用很小。在 Co(II)-Co(III)体系中,发现金属离子氧化还原具有较高的效率,已有铜、银和金沉积的报道[84-86]。Co(II)-Co(III)氧化还原电位变化范围较大,从水合钴离子的1.86 V到含有胺作为配体体系的负还原电位,根据不同研究体系可以通过选择不同的配体构建合适的还原剂。Vaškelis 等[86]选择HAuCl4和Co(II)-(1,3-丙二胺)为无氰镀金研究体系,沉积速率为1 μm/h。以Co(II)-胺络合物为还原剂的优点还在于,可利用化学法或电化学法将氧化产物再生,这是传统的还原剂如次磷酸钠或硼氢化钠等无法实现的,有利于降低原料成本。
2.8.3 L-半胱氨酸
Takeuchi 等[87]报道了以巯基琥珀酸(MSA)为络合剂、L-半胱氨酸为还原剂的自催化无氰化学镀金液,沉积速率为0.66 μm/h,配方组成如表7 所示。通过氢氧化钾溶液调节镀液pH 为7.0,反应温度为80 ℃。通过比色法、直流极谱法和电位扫描法的研究,发现在金沉积反应过程中,L-半胱氨酸的还原机理如下式所示:
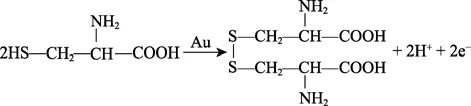

表7 L-半胱氨酸体系镀液组成[87]Tab.7 Composition for gold plating bath containing L-cysteine[87]
当无L-半胱氨酸存在时,该体系沉积反应无法发生,这可能与MSA 中巯基的强配位能力有关,造成配合物在热力学上过于稳定。有报道称,MSA 甚至能够取代部分CN-与金离子配位,其配位能力也显著强于部分含N 和O 的配位原子化合物[88-89]。
2.8.4 多酚类化合物
Ohtani 等[72]研究了多酚类化合物作为无氰化学镀金的还原剂,结果表明,添加邻苯二酚、邻苯三酚和没食子酸,均可制备外观良好、可焊性好的金层。在所选择的三种测试还原剂中,邻苯二酚是最适合用来配制稳定的长使用周期的镀液,16 d 内的沉积速率基本不变,镀液也无分解现象。虽然它的还原能力中等,但在65 ℃条件下,沉积速率仍能达到0.2 μm/h。作者也发现,邻苯二酚镀液的稳定性与还原能力与HOMO 的能级有关,量子化学计算结果与实验结果相符。
2.8.5 异抗坏血酸
异抗坏血酸是抗坏血酸的一种立体异构体。Kurashina 等[90]在亚硫酸钠-硫代硫酸钠无氰镀金体系中添加异抗坏血酸作为还原剂,沉积速率为0.718 μm/h,自催化反应和置换反应的沉积速率随异抗坏血酸浓度的增加而上升。并发现,添加苯并三唑(BTA)、乙二胺四乙酸二钠(EDTA)和乙二胺(en),可抑制置换反应的沉积速率,制备的镀层具有良好的焊接性能。
2.8.6 过氧化氢
以上对还原镀金的研究都是将化学镀金液作为研究对象,主要是镀液组成和反应条件的探索。一些研究者另辟蹊径,将研究重点专注于基材的活性改进,为广大研究人员提供了另一种研究思路。过氧化氢既有氧化性,又有还原性。Hu 等[91]研制了一种简单、环保的HAuCl4/H2O2体系无氰化学镀金液,在反应前,将金纳米颗粒粘附在基材上作为金还原的催化位点,加速了Au3+在基材表面的还原,并有效地防止了镀液本体金颗粒的析出,制备了连续均匀、择优生长方向为Au(111)面的金层。Horiuchi 和Nakao[92]也用类似的思路,利用静电作用将Pt 胶体纳米颗粒固定在基材上,纳米尺寸的Pt 颗粒具有优异的催化性能,在室温下即可使用由HAuCl4/H2O2组成的简单无氰金化学镀液制备金层,5 min 内厚度可达0.1 μm。这种方法也被作者证实有望用于取代甲醛为还原剂的化学镀铜液。
3 促进剂的研究进展
基于镀液配方实用性的目的和生产需求,科研人员对促进剂的认识暂时停留在工艺研究阶段,很少对加速机理进行探讨,使促进剂可发挥作用的适用体系并不清楚。
Krulik 等[26]通过添加2~100 g/L 的氨基酸作为促进剂,如甘氨酸、丙氨酸、赖氨酸、亮氨酸、谷氨酰胺、缬氨酸等,可将一般亚硫酸盐体系还原镀金的速率从(0.25~0.5) μm/15 min 提升至(0.4~1.0) μm/10 min,并且镀液仍能保持稳定。
黎松强等[93]在KAu(CN)2为金盐的体系中添加15 g/L的NiCl2后,发现镀速有显著提升,由1.25 mg/(cm2·h)提升至2.8 mg/(cm2·h),但是未进行镀层元素分析。前文提到,低浓度的重金属离子的添加也会造成共沉积,如此高浓度的Ni2+的加入很可能使金层夹带一定Ni 元素,该报道对镀层的性能也未进行表征。
卢银东等[94]发现乙二胺具有加速作用,镀速随着乙二胺质量浓度的增加而增大,当乙二胺的质量浓度为320 mg/L 时,镀速达到最快,为1.73 μm/h,继续增大浓度速度,基本无变化。虽然乙二胺可提高速度,但是镀液稳定性却变差。吴赣红等[95]对无氰亚硫酸钠镀金的研究也得出乙二胺可作促进剂的结论。
赵林南等[96]在压电陶瓷表面采用 Na2SO3为络合剂的无氰镀金液沉积金层,当添加1.5 g/L 聚乙二醇或2.0 g/L 聚丙烯酰胺时,镀速由无添加剂的0.010 g/(dm2·10 min)分别增加至0.015 g/(dm2·10 min)和0.013 g/(dm2·10 min),聚乙二醇的加速效果更显著,两者对镀层的耐腐蚀性也有提高,聚丙烯酰胺在这方面效果更好。
4 总结与展望
无氰化学镀金技术发展尚未十分成熟,镀液稳定性仍无法与氰化物体系相比,添加还原剂对其稳定性是一种负担,因此化学镀金常在中等温度下操作。为了保证在中等温度仍能够有较高的沉积速率又不致镀液发生分解,金属对还原剂的催化氧化显得尤为重要。同一种还原剂往往只受镍或金其中一种催化,两种或多种还原剂的复配是实现沉积初始阶段和后期阶段的反应速率都保持较高水平的一种可行方案,基底催化和自催化还原的结合是今后无氰还原镀金的重要研究方向之一。
尽管国内外学者为无氰还原镀金的开发提供了众多重要的研究成果,但是这一领域还有许多问题值得留意:
1)新型的氮杂环有机分子络合体系在电镀领域显现出较好的稳定性,其是否能应用于还原镀金体系仍值得探讨。
2)研究者局限于对传统还原剂的研究,具有还原性物质的数量众多,基于其他领域的研究尝试新型的还原剂是一个前景广阔的研究课题,对绿色环保无氰镀金液的开发具有重要意义。
3)化学镀的氧化还原反应是在同一区域进行的,而电镀时,阴阳极分别进行不同的反应,化学镀这种复杂的反应过程提高了电化学研究反应特性的难度。混合电位理论广泛应用于化学镀的研究,其基本假设原理是阴阳极反应相互独立。当实际反应不满足这个假设时,如何构建恰当的电化学研究方法才能正确体现研究体系的特点?这个难题的解决无论对化学镀金,还是其他化学镀的研究,都具有非常高的研究价值。

