复制因子C4在胰腺导管腺癌中的表达及其与预后相关性研究
刘宾 刘辉 李宝玉
天津医科大学第二医院胃肠外科300211
0 引言
胰腺癌是全球第七大癌症致死原因,在美国的恶性肿瘤中,其死亡率高居第三位[1]。根据美国癌症协会的估计,2020年美国有576 00例新发胰腺癌病例,导致近47 050例死亡[2]。据预测,胰腺癌将在2030年左右成为美国癌症相关死亡的第二大原因[3]。胰腺导管腺癌是最常见、最致命的胰腺癌亚型,占总诊断病例的90%以上[3]。由于缺乏显著的早期症状,大多数胰腺导管腺癌在确诊时往往处于晚期(Ⅲ或Ⅳ期),此时治疗效果较差。此外,胰腺导管腺癌是一种侵袭性极高的恶性肿瘤,手术后易复发。并由于化疗耐药性的存在,现有疗法对于提高患者预后,效果甚微[4]。靶向治疗与免疫治疗尽管效果初现端倪,但仍需发现更多更有效的治疗靶点。胰腺癌的早期诊断至关重要,目前的主要标记物包括癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原199(carbohydrate antigen199,CA199)、CA242等,一定程度上起到了预测胰腺癌的作用,但其特异性仍有待提高[5]。为了提高胰腺癌的早期诊断率,仍需发现更多且更加特异的胰腺癌生物标记物。
复制因子C(replication factor C,RFC)家族是由RFC1、RFC2、RFC3、RFC4、RFC5亚基组成的复合物,是DNA聚合酶的引物识别因子[6-11]。RFC在多种恶性肿瘤中具有生物活性,可能在癌细胞的增殖、进展、侵袭和转移中发挥重要作用[12-13]。根据肿瘤的细胞和组织学特征,其可以作为癌基因或抑癌基因。RFC4是一个主要存在于细胞核中,相对分子质量为37 000的调控蛋白[7,14-15]。RFC4主要存在于DNA的RFC复合体中,能够参与DNA复制复合体的形成,起始DNA的复制过程[7,16-17]。另外,RFC4还参与多种重要的细胞过程,包括DNA链延伸、DNA修复、磷酸肌醇相关信号通路等[6,12,18]。
RFC4在肿瘤中的作用已被多项研究证实[12-13]。在此前一项研究中,研究者通过全基因组RNAi筛选,发现RFC4可通过促进非同源端连接修复介导结直肠癌放疗耐受[19]。也有研究结果证实,RFC4的表达水平与结直肠癌进展相关,可用于结直肠癌的预后预测[13]。研究者通过生物信息分析,证实RFC4是肝癌的潜在治疗靶点[12]。然而,RFC4对于胰腺癌这种高恶性程度肿瘤的潜在影响仍然未知。
本研究中,旨在探讨RFC4在胰腺导管腺癌组织及相应正常组织中的相对表达及其与临床预后的关系,有助于更好地认识RFC4在胰腺导管腺癌发展中的作用机制,从而对研究胰腺导管腺癌的治疗与预后预测方法有重要意义。
1 资料与方法
1.1 临床资料
选择2015年6月至2017年9月,天津医科大学第二医院收治的经手术治疗的胰腺导管腺癌患者76例。其中,男性44例,女性32例,年龄57.5岁±3.25岁。全部病例均经过病理证实,术前未经化疗或放疗,且具有完整的病例资料。收集患者的一般临床资料,包括年龄、性别、肿瘤分级和肿瘤大小等;收集患者的肿瘤组织及癌旁组织标本。在76例病例中,肿瘤分级低级别者35例,高级别者41例;肿瘤大小<4 cm者28例,≥3.5 cm者48例。所有患者均签署知情同意书,本研究已通过天津医科大学第二医院伦理委员会的审核。
1.2 主要材料与仪器
RFC4兔抗人单克隆抗体(a b156780,英国Abcam公司),二抗免疫组化试剂盒(北京中衫金桥生物技术有限公司),二氨联苯胺(diamiobenzidine,DAB)显色试剂盒(美国Cell Signaling Technology公司)。
RM2235型石蜡切片机(德国Leica公司),BX51型显微镜(日本奥林巴斯公司)。
1.3 免疫组织化学检测方法
对76例胰腺导管腺癌肿瘤组织及癌旁正常组织行福尔马林固定,石蜡包埋,包埋后蜡块标本进行3μm切片,然后行RCF4免疫组化染色。将切片在75℃环境中孵育30 min,随后用二甲苯脱蜡,并用梯度乙醇溶液(100%,100%,95%,85%,75%)水合。水合完毕后使用柠檬酸缓冲液孵育20 min修复抗原,并阻断内源性过氧化物酶5 min。随后用质量浓度为50 g/L的牛血清白蛋白(b ovine serum albumin,BS A)封闭液封闭30 min。封闭后使用RFC4抗体孵育2 h。然后,切片用生物素化的二抗孵育1.5 h,通过DAB法显色,苏木素染色细胞核。免疫组化切片于显微镜下观察,观察倍率为100和200倍,期间拍照并采集图像。根据肿瘤细胞阳性染色百分率和染色强度综合评价免疫组化结果。
染色结果表明,RCF4蛋白呈显著的核定位。每例患者的肿瘤组织及癌旁组织切片选取6个视野进行检测,结果采用双盲法判断,依照阳性细胞在总细胞数中的比例进行评定。阳性细胞比例评分标准:肿瘤细胞阳性百分数<10%时,记0分;10%~30%时,记1分;30%~60%时,记2分;>60%时,记3分。阳性染色强度评分标准:阴性染色记0分;弱阳性染色记1分;中阳性染色记2分;强阳性染色记3分。以阳性细胞百分比评分和染色强度评分的和判断表达情况,总分为0~2分为RFC4低表达,3~6分为RFC4高表达。
1.4 统计学方法
采用Graphpad 6.0统计学软件处理数据。通过基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)数据库分析RCF4的mRNA在胰腺导管腺癌组织中的表达。通过ProteinAtlas数 据 库(https://www.proteinatlas.org/ENSG00000104738-RCF4/tissue)分析不同肿瘤组织中RCF4的表达与患者预后的相关性,并通过GEPIA数据库比较RCF4不同表达组胰腺导管腺癌患者的总生存及无病生存率差异(http://gepia.cancer-pku.cn/detail.php?gene=RCF4)。符合正态分布的计量资料采用均值±标准差(Mean±SD)表示,通过卡方检验比较临床病理特征与患者胰腺导管腺癌组织RFC4表达之间的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 RFC4的生物信息学分析结果
通过ProteinAtlas数据库分析了RCF4的mRNA水平在不同肿瘤中与患者生存率间的相关性。结果表明,RCF4的mRNA水平与多种肿瘤患者的生存期之间具有相关性,包括肾癌、肝癌、胰腺癌及宫颈癌,提示RCF4可作为多种肿瘤预后的预测因子(图1)。

图1 复制因子C4(RCF4)在不同肿瘤组织中与患者预后间的关联
通过GPEIA数据库分析了RCF4的mRNA水平在179例人胰腺导管腺癌组织及171例对应的正常组织中的差异,发现在肿瘤组织中RCF4的mRNA呈显著高表达(图2,P<0.05)。此外,通过GPEIA数据库分析探讨了RCF4的表达与胰腺导管腺癌患者预后的潜在关联。结果表明,RCF4的表达与胰腺导管腺癌患者的总生存率(P=0.046)及无病生存率(P=0.042)均具有显著的相关性(图3)。该结果提示,RCF4的表达与患者的预后显著相关。
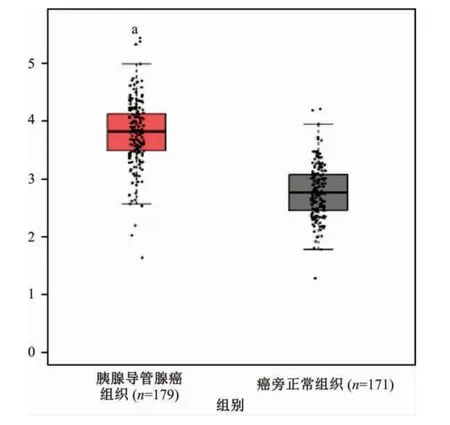
图2 胰腺导管腺癌中复制因子C4(RCF4)的mRNA表达

图3 复制因子C4(RCF4)表达与胰腺导管腺癌患者生存率的相关性
2.2 RFC4在胰腺导管腺癌组织中的表达
通过免疫组织化学染色方法检测了RFC4在76例行手术切除的胰腺导管腺癌患者的肿瘤组织及对应癌旁正常组织中RFC4蛋白表达情况。结果显示,RFC4呈显著核定位,且与癌旁组织相比,RFC4蛋白在胰腺导管腺癌组织中呈显著高表达(图4)。

图4 胰腺导管腺癌组织和癌旁正常组织中复制因子C4(RCF4)的免疫组化结果
2.3 RFC4蛋白表达与胰腺导管腺癌患者的临床病理特征相关性
为了进一步明确RFC4在胰腺导管腺癌患者中的临床意义,分析比较了RFC4与胰腺导管腺癌患者的临床病理特征之间的相关性。比较了RFC4低表达组与高表达组胰腺导管腺癌患者的临床病理特征差异,包括年龄、性别、肿瘤分级及肿瘤大小。结果表明,RFC4的表达水平与胰腺导管腺癌患者的肿瘤大小(P=0.038)显著相关,而与年龄(P=0.642)、性别(P=0.804)、肿瘤分级(P=0.902)的相关性无统计学意义(表1)。

表1 复制因子C4(RFC4)蛋白表达与胰腺导管腺癌患者临床病理特征的相关性分析
3 讨论与结论
胰腺癌的发病率及死亡率均居高不下,主要原因是其缺乏显著的早期症状,进展迅速,且缺乏有效的治疗手段[20]。因此,胰腺癌的早期诊断至关重要。近年来发现的一系列胰腺癌靶点,如CA199、CA242等,在一定程度上提高了胰腺癌的早期诊断率,但这些生物标记物均仍有一定的局限性[21]。部分胰腺癌患者的CA199水平并未升高,主要由于少数人群不表达CA199,并且在部分情况下CA199会与体液中的某些抗体形成免疫复合物,导致CA199无法检测[19]。CA242的敏感性较CA199略低。这两种指标虽然可作为胰腺癌的预测依据,但仍需结合影像学检查加以确诊[22]。为了提高胰腺癌的早期诊断率,仍需发现更有效、更敏感的胰腺癌生物标记物。在本研究中,发现RFC4在人胰腺导管腺癌组织中显著高表达,并与患者的预后及肿瘤大小显著相关,提示RFC4可作为胰腺导管腺癌的预后预测因子和生物标记物。
通过对76例人胰腺导管腺癌组织和癌旁正常组织RFC4染色强度的免疫组化分析,发现相较于癌旁正常组织,RFC4在肿瘤组织中高表达。临床病理分析显示,RFC4表达与肿瘤大小密切相关,提示RFC4在胰腺导管腺癌的增殖及进展中发挥重要作用。RFC4除了在胰腺导管腺癌组织中异常表达外,其高表达也发生在一些实体瘤中,如结直肠癌及肝癌等,并与不良预后密切相关[13]。RFC4通过促进DNA非同源末端连接修复,降低结直肠癌患者的放疗敏感性[2]。而到目前为止,RFC4对肿瘤发生发展的作用尚未被广泛揭示,它是否在大多数肿瘤中具有功能,及其对预后的影响尚不明晰。在本研究中,初步分析了RFC4在胰腺导管腺癌中的表达,并分析了其与胰腺导管腺癌患者临床特征的关系及其对预后的影响,提示RFC4可能是胰腺导管腺癌的独立预后因子和潜在的治疗靶点。但是,上述结论需要利用体外细胞实验加以验证,分析RFC4对胰腺导管腺癌相关细胞功能的影响。
研究结果表明,RFC4对于细胞内的DNA双链断裂(double strand break,DS B)有重要影响[7,23-24]。细胞内存在两种主要的DSB修复方式:非同源末端链接(non-homologous end joining,NHE J)和同源重组(homologous recombination,HR)[25]。而在针对结直肠癌的体外细胞实验中,研究者发现敲低RFC4显著降低了NHEJ的活性[13]。在本项研究中,证实了RFC4在胰腺导管腺癌组织中存在高表达,并提示不良预后,其极有可能参与肿瘤进展。因此,需要进一步开展机制研究,研究RFC4是否可通过对DSB的修复,影响胰腺导管腺癌的进展。
RFC4对于DNA复制具有重要的调控作用,而这进一步会影响细胞的周期及增殖进程[8]。RFC4的异常表达会导致DNA复制的异常,进一步导致细胞的异常增殖并引发肿瘤[26]。因此,在未来的研究中需要阐明在胰腺导管腺癌中,RFC4的下调是否会导致DNA复制及细胞增殖的异常,从而阐明RFC4对于肿瘤发展及患者预后影响的调控机制。已有多项研究结果证实了RFC4作为肿瘤治疗靶点的可能性,结合本研究成果,进一步提示了RFC4可作为多种肿瘤的潜在治疗靶点。
本研究的结果表明,RFC4的mRNA在胰腺导管腺癌组织中显著高表达,且其表达与患者的总生存率与无病生存率相关;RFC4蛋白在胰腺导管腺癌组织中高表达,并与患者的肿瘤大小显著相关。本研究结果提示,RFC4可作为胰腺导管腺癌的预后预测因子和潜在的生物标记物。
利益冲突所有作者均声明不存在利益冲突

