孤立性轻中度侧脑室扩张胎儿脑弥散的区域特异性变化
王学玲 盛辉 张国伟 王爱杰 盖丽萍 王春业 严倩 姜淑燕烟台市烟台山医院影像科,山东 6400;烟台市烟台山医院产科,山东 6400;烟台市烟台山医院超声科,山东 6400
胎儿脑室扩张(ventriculomegaly,VM)是胎儿产前筛查最常见的结构异常之一,发病率可达千分之二,多合并其他器官或中枢神经系统的畸形[1]。单纯脑室扩张的原因不明,因此被定义为孤立性脑室扩张(isolated ventriculomegaly,IVM)。有研究认为VM和许多神经系统疾病相关[2],但至今尚未达成一致意见。弥散加权成像(diffusion weighted imaging,DWI)能够评估组织内水分子的扩散运动,表观扩散系数(apparent diffusion coefficient,ADC)值能够对其进行量化评价,目前主要应用于定量评价胎儿脑发育,但是应用ADC值评估胎儿孤立性轻中度侧脑室扩张的报道较少。本研究的目的是评估孤立性轻中度对称/不对称性侧脑室扩张胎儿不同脑区ADC值的变化。
1 资料与方法
1.1 一般资料 收集本院2015年3月至2019年6月期间经胎儿颅脑核磁共振成像(MRI)扫描诊断为孤立性轻中度侧脑室扩张的病历共54例,其中非对称性脑室扩张(asymmetrical ventriculomegaly,AVM)组6例,母亲年龄范围为28~36岁,年龄(30.5±3.1)岁,孕周范围为28~38周,孕周(32.5±3.7)周;对 称 性 脑 室 扩 张(symmetrical ventriculomegaly,SVM)组10例,母亲年龄范围为25~35岁,年龄(30.5±3.1)岁,孕周范围为25~36周,孕周(30.8±3.7)周;单侧脑室扩张(asymmetrical ventriculomegaly with one normal-sized ventricle,AV1norm)组38例,母亲年龄范围为26~38岁,年龄(31.2±3.5)岁,孕周范围为23~39周,孕周(31.3±4.2)周。
入选标准:由两名专门从事胎儿磁共振诊断的医师共同阅片,图像清晰无伪影,胎儿单侧或双侧侧脑室宽度为10~15 mm,胎儿无其他影像学异常,未发现染色体畸变、宫内感染等。
对照组40例,母亲年龄范围为27~42岁,年龄(32.3±3.4)岁,孕周范围为24~39周,孕周(32.3±3.8)周。对照组胎儿双侧脑室均未见明显扩张。
1.2 MRI检查方法 采用美国GE Signa 1.5T超导型MR扫描仪,梯度场强度40 mT·m-1·s-1,8通道相控阵体部线圈为接收线圈。患者采取仰卧位脚先进,膀胱中等程度充盈。对每个胎儿的颅脑进行冠状位、矢状位和水平位扫描。扫描序列及参数:(1)单次激发快速自旋回波序列(single shot fast spin-echo,SSFSE):层厚5.0 mm,层间距0.0 mm,FOV 400.0 mm×400.0 mm,激励次数(NEX)1次,TR 3 000 ms,TE 80 ms,翻转角90°,扫描时间15~21 s。(2)DWI序列:层厚5.0 mm,层间距0.0 mm,FOV 420.0 mm×420.0 mm,NEX 4次,TR 2 000 ms,TE 67 ms,b值为0、600 s/mm2,扫描时间25~35 s。
1.3 MRI图像分析 使用AD-HD工作站(GEMedical Systems)的Functool软件计算ADC值。ADC值测量:每个病例测量15个感兴趣区(ROIs):白质(双侧额叶、双侧顶叶、双侧颞叶、双侧枕叶和双侧小脑半球),灰质(双侧基底节和双侧丘脑),在脑桥测量1个ROI。双侧对称的结构求平均值,共得出7个数值。所有的ADC值的单位为10-6mm2/s。ROIs由同一个的研究者(Gy)系统地放置(图1)。侧脑室测量:在SSFSE序列冠状位及水平位上测量脑室宽度,选取可以见到脉络丛的层面(图1)。
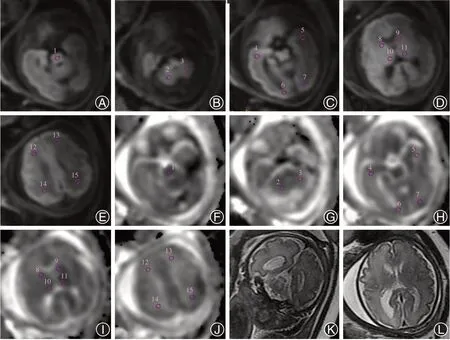
图1 孕32周,孤立性单侧侧脑室增宽胎儿颅脑MR成像(A~E为轴位DWI图像,F~J为对应的ADC图像,图中所示1~15为不同区域ROI放置的位置,分别为脑干、双侧小脑半球、颞叶、枕叶、基底节区、丘脑、额叶和顶叶。K~L为SSFSE序列,K为冠状位,L为轴位,可见右侧侧脑室宽约11.4 mm,左侧侧脑室宽约7.4 mm)
1.4 统计学分析 分别测量各组双侧额顶颞枕叶脑白质、基底节、丘脑、小脑和脑干的ADC值,与正常对照组对比。采用IBM SPSS Statistics 23统计软件处理,符合正态分布的计量资料以均数±标准差的形式表示。孤立性轻中度侧脑室扩张组各脑区与对照组相应脑区ADC值比较采用独立样本t检验,各组胎儿颅脑左右侧各区ADC值的比较采用配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 基本特征 各研究组的基本特征见表1;各研究组胎儿的孕周分布见表2,研究组孕周为(31.3±4.0)周,对照组为(32.3±3.8)周,研究组和对照组的孕周分布差异无统计学意义。研究组ROI直径为(39.0±3.0)mm2,对照组为(39.6±2.0)mm2,研究组和对照组的ROI直径差异无统计学意义(P>0.05)。

表1 各研究组的基本特征

表2 各研究组胎儿孕周分布情况(例)
2.2 ADC值 各组不同脑区的ADC值见表3。基底节区:对照组ADC值 为(1.28±0.15)×10-6mm2/s,SVM组 为(1.39±0.13)×10-6mm2/s,AV1norm组扩张侧为(1.35±0.16)×10-6mm2/s,SVM组和AV1norm组的扩张侧基底节区ADC值均较对照组显著升高(均P<0.05)。AV1norm组中脑室扩张侧基底节ADC值较脑室正常侧显著升高(P<0.05),但是对照组、AVM组和SVM组双侧基底节区ADC值差异均无统计学意义。额叶:正常对照组ADC值为(1.53±0.17)×10-6mm2/s,SVM组 为(1.39±0.18)×10-6mm2/s,AVM组 为(1.36±0.17)×10-6mm2/s,AVM组和SVM组额叶ADC值均较正常对照组显著降低(均P<0.05)。
表3 各研究组胎儿不同脑区ADC值分布表(×10-6 mm2/s,±s)

表3 各研究组胎儿不同脑区ADC值分布表(×10-6 mm2/s,±s)
注:ADC为表观扩散系数;对照组为胎儿双侧脑室均未见明显扩张,AVM为非对称性脑室扩张,SVM为对称性脑室扩张,AV1norm为单侧脑室扩张
组别 例数对照组 40 AVM组 6 SVM组 10 AV1norm组 38小脑1.29±0.22 1.36±0.14 1.33±0.24 1.33±0.22脑干1.18±0.16 1.14±0.06 1.14±0.16 1.20±0.15基底节1.28±0.15 1.33±0.15 1.39±0.13 1.35±0.16丘脑1.19±0.12 1.22±0.17 1.16±0.21 1.22±0.13颞叶1.48±0.22 1.46±0.33 1.39±0.28 1.50±0.25枕叶1.52±0.21 1.57±0.26 1.45±0.33 1.52±0.23额叶1.53±0.17 1.36±0.28 1.39±0.18 1.51±0.16顶叶1.60±0.17 1.46±0.47 1.47±0.23 1.60±0.31
3 讨 论
VM的诊断依据是1988年Cardoza等提出的,即无论任何孕周的胎儿脑室宽度超过10.0 mm和超出相应孕周平均值3~4个标准差即为脑室扩张,以侧脑室扩张常见,10.0~12.0 mm为轻度扩张,12.0~15.0 mm为中度扩张,超过15.0 mm为重度扩张[3]。双侧侧脑室宽度差≥2.0~2.4 mm即双侧侧脑室不对称。VM可以是某种病变的影像表现之一,也可能是某种生理性的正常变异[4]。胎儿IVM即排除了其他原因导致的侧脑室扩张。既往有研究认为其与轻微的神经发育障碍有关,如注意力缺陷、行为问题、学习障碍和知觉障碍等,但是对于其临床意义目前仍然没有统一的共识[5-8]。
本研究中,我们以孤立性轻中度脑室扩张的胎儿(脑室宽度10.0~15.0 mm)为研究对象。对该人群的预后研究显示结果差异很大[2],其出现神经发育落后的风险0%~40%[9]。有研究认为其93.3%预后良好[10],轻中度IVM者脑发育迟缓的发生率为7.9%[9];亦有研究证实其明显增加神经系统后遗症的风险[11-12]。另外,产前VM有进展者出生后异常的发生率(66.7%)明显高于无进展者(15.6%)[13]。母胎医学会也认为中度脑室扩张有出现神经后遗症的风险[14],脑室容积与脑实质体积比越高则预后越差[15]。这种神经后遗症的不确定性导致研究者和临床医生寻求额外的成像方式,以帮助临床医生准确评估胎儿预后。
既往对于胎儿IVM的诊断主要依赖于超声,但由于超声的种种局限性导致图像不理想,MR越来越成为有效的辅助诊断方法[16],对于其成像方法的研究越来越多[17]。随着研究的深入,常规MR序列越来越不能满足临床的需要,而功能磁共振成像越来越得到重视[18-19]。DWI是临床广泛应用的功能磁共振成像方法,ADC值表示水分子在选定区域中的随机运动,具有量化成像变化的优点,在胎儿领域应用越来越广[20]。最近有研究证明在胎儿脑的大部分区域具有高度可重复性[21]。ADC值越来越被公认为是评估胎儿和儿童期脑成熟度和病变的有用工具[21-22]。有研究显示,在胎脑成熟过程中ADC值在不同脑区降低[23]或保持恒定[24]。此外,在病理条件下也会出现改变,如先天性心脏病、感染性疾病、脑积水、宫内卒中或辅助生殖技术获得的新生儿[22-27]。IVM的病理生理学尚未阐明,其微结构损伤可能不同于脑积水。与Yaniv等[28]相似,我们发现IVM胎儿额叶白质的ADC值显著降低,基底节的ADC值也升高,但是Yaniv等观察到枕叶白质中ADC值的降低,我们并没有发现。
研究结果显示,当双侧侧脑室宽度大于10.0 mm时,额叶白质的ADC值低于对照组。ADC值降低通常表明细胞毒性组织损伤,由于细胞内水分子聚集导致细胞内体积增加和细胞外体积减少。这些变化导致水分子布朗运动受限。在1项对于生长发育受限胎儿的研究中发现,多发脑区ADC值明显降低,提示存在发育异常[29]。ADC值降低的另一个原因是细胞的增加,如脑肿瘤。在IVM情况下,脑实质并没有可见的病理改变,故额叶脑白质ADC值降低可能是由于大脑半球的细胞过度增殖所致。既往有学者发现伴有IVM的胎儿脑皮层容积增加[30],认为这是由于控制细胞增殖和凋亡的调控系统发生了破坏,进而导致了脑连接改变,使得这些儿童后期出现了神经发育迟缓。
SVM和AV1norm组基底节区可见明显的弥散改变,这两组测得脑室扩张侧基底节区的ADC值升高。ADC值升高是由于水分子的布朗运动增加。我们将基底节区的ROI放置在尾状核头部和壳核之间,包括内囊的前肢,虽然包括部分脑白质,但主要是大脑半球深部灰质。因此,额叶脑白质和基底节区ADC值的不同改变可能是由于脑白质和灰质的脑组织成分不同所致。既往针对胎儿脑的研究发现不同的脑区有其各自相对特异的发育特点,基底节区的灰质核团通常细胞较密集,含水量相对较少,所以正常情况下基底节区ADC值要小于白质区,并随着胎儿脑的成熟ADC值下降[23]。本研究中SVM和AV1norm组基底节区ADC值的升高,可能与该区正常的成熟过程受阻有关。先天性心脏病胎儿脑ADC值的升高,可能是由于宫内缺氧损伤和递质传递障碍,导致了脑微结构和代谢异常致脑发育受损[27]。基底节区是距离侧脑室最近的解剖结构,理论上更容易受脑室内压力变化的影响,使得其微观结构和代谢异常,继而影响到该区脑组织的正常成熟进程。然而,该理论不能解释为何AVM组基底节区的ADC值不受影响。因此,有可能是除了脑室内压以外的其他机制导致了基底节区ADC值的升高,还有待于进一步的研究。
3个研究组的ADC值改变特点各不相同,说明每个研究组有各自独特的微观结构扩散模式。既往研究显示,神经系统疾病的发生率AV1norm组为5.88%,SVM组为11.76%,AVM组为54.55%[31]。AV1norm组是该研究中病例数最多的一组,除了基底节区之外,其他感兴趣区均没有出现弥散改变。对于该亚组的临床研究较多,虽然短期随访显示该亚组神经发育预后最好,但是对于其是否会导致学前儿童发育落后仍然存在争议[5,8,32]。此外,只有AV1norm组脑室扩大侧的ADC值显著高于对侧。目前我们不能断定ADC值的变化是AV1norm组病理生理改变的一部分还是其病理学改变的结果。关于这组的临床意义仍有很多争议,尚需不断深入研究。
我们的研究有几个局限性,首先是本研究缺乏临床相关性;其次,研究组例数相对较少(AVM组6例和SVM组10例)。
总之,不同的IVM模式,不同脑区的ADC值改变与其各自的病理生理变化有关。在不同IVM组,基底节区ADC值升高和额叶ADC值降低,ADC值可能有助于评估与不同IVM模式相关的微结构损伤。
利益冲突:作者已申明文章无相关利益冲突。

