环境类型和代谢表型对中华倒刺鲃群体行为的影响
杨 亚,凌 鸿,付世建,曾令清
重庆师范大学进化生理与行为学实验室,动物生物学重庆市重点实验室, 重庆 401331
鱼类个体因社会原因而聚集成群现象被称为鱼类群体行为[1- 2],是其在长期进化过程中形成的行为策略之一[3]。与独居生活相比,群体生活不仅为鱼类个体提供多种多样的生态收益,还伴随着各类的风险代价[3-4]。例如,群体生活有助于提高个体的觅食效率、繁殖成功率及防御能力[5-7]。然而,群体生活会提高个体对食物资源竞争和能量消耗强度[8-10]以及寄生虫传染率[11-12]。为降低不同个体间对环境资源需求的竞争强度,鱼类个体在群体中的空间占位可能是按一定规律分布的,例如勇敢性和有氧运动能力较强的个体更频繁地出现于鱼群的前部空间,可领导整体鱼群四处游动[13]。自然界超过50%的鱼类在全部生活史或特定生活史阶段存在群体行为现象[14-16]。
栖息环境条件的持续变化是鱼类表型进化的重要驱动力之一[17],例如水温、溶氧水平等环境因子均表现出巨大的时空变动,影响鱼类的生理状态和行为表现甚至适合度[18-20]。然而,自然环境的选择压力迫使鱼类进化出相应的各种生存策略[18,21-22],例如躲藏于隐蔽场所的行为策略明显降低了鱼类个体的日常能量消耗[23-25]。此外,在不同栖息生境之间群体水平的行为差异及其稳定性可能会对群体结构、功能作用和生态表现产生一定影响,例如食物发现或敌害逃避的能力导致鱼群个体的生理状况及适合度出现明显个体差异[26-27]。研究发现,在有隐蔽场所的测试环境中三刺鱼(Gasterosteusaculeatus)群体的个体间距离和游泳速度同步性明显高于无隐蔽场所的测试环境,并且该种鱼的群体凝聚力和协调性显著增强[28]。关于鱼类群体行为的过往研究主要关注单一环境类型下的群体行为表现[29- 32],而鱼类群体行为在不同环境类型之间的变化规律的相关研究相对较少[33-34]。因此,本研究第一个目标是考察环境类型对鲤科鱼类群体行为的影响。
鱼类群体领导者的产生可能与个体的能量代谢水平有关,如高标准代谢率(Standard metabolic rate, SMR)个体更易受到食物匮乏的影响,这是因为相比较于低SMR个体,高SMR个体的日常能量消耗较大,需要从环境中获取更多的食物资源[13,35]。因此,高SMR个体在鱼群中的个体空间位置可能偏好群体的前部空间,因为此处可增加个体的食物捕获成功率[12,36]。然而,鱼群前部空间会使个体面临高的被捕食风险[37],即群体空间位置存在收益与风险之间的权衡。有关鳟(Salmotrutta)的研究发现,在低食物丰度条件下,高SMR/低AS表型的生长率明显高于低SMR/高AS表型,但两种代谢表型在中等或高食物丰度条件下的生长率无差异[21],表明个体适合度(如生长)受到代谢表型的影响具有食物丰度依赖性,但代谢表型对鱼类群体行为的相关研究尚未见报道。为此,本研究第二个目标是考察代谢表型对鲤科鱼类群体行为的影响。
鱼类群体行为的研究对象主要集中于三刺鱼等数种模式动物[10, 17, 26, 28],而鲤科鱼类群体行为的相关研究相对较少[29-31]。本研究以栖息于我国长江水域的中华倒刺鲃(Spinibarbussinensis)幼鱼为研究对象,考察环境类型(空白环境,无食物隐蔽场所;食物环境;食物隐蔽场所环境)和代谢表型对该种鱼群体中个体空间位置和群体行为的影响。中华倒刺鲃多栖息于流水环境中,喜成群且具有较强的游泳运动能力[38]。本研究探讨不同环境类型下中华倒刺鲃的代谢表型与群体行为的关系,有助于揭示鲤科鱼类群体行为的环境响应特征,具有重要的行为生态学研究意义。
1 材料与方法
1.1 实验鱼及其驯化
中华倒刺鲃购自于重庆市合川区当地鱼类水产繁殖基地,运回后将实验鱼养在3个循环控温水槽(约250 L)中驯化2个月以上。为提高驯化水槽环境的富集度,在每个水槽底部放置一定数量的绿色塑料水草和砾石。驯化期间,用商业鲤科鱼类颗粒饲料(成都,中国通威集团有限公司)分别于每天早上10:00和晚上22:00对鱼饱足投喂1次。正式实验开始之前一个月,为提高中华倒刺鲃对红线虫的适口性,每天采用不同饵料进行先后投喂,即先用红线虫后用商业饵料投喂,在后两星期中未发现鱼具有饵料偏好。在每次饵料投喂前5 min,关闭循环水槽的充氧泵以去除充氧泵的工作噪声对鱼自由摄食的影响,在30 min后采用塑料虹吸管清理养殖水槽中的剩饵、残渣及鱼的粪便,以较好地维持驯化水槽的水体环境。由于每天的水质维持工作导致驯化水体的部分丢失(约驯养水体总量的10%),因此需向驯化水槽补充曝气 3 d后的自来水至标准水位。用控温装置将驯化水温控制在(26.1±0.1)℃,溶氧水平维持大于7 mg/L以上,实验室的光周期控制为12 L: 12 D。
1.2 实验设计
本研究选取大小相近[体重(11.41±0.11)g、体长(1.84±0.03)cm,n=200] 的中华倒刺鲃作为实验对象,随机分为5批,每批40尾。实验前每批鱼都禁食24 h,第1 d在鱼类呼吸代谢仪的呼吸室中过夜适应12 h,以减少食物消化活动对SMR测定的影响[39]。第2 d和第3 d分别测定实验鱼的SMR和最大代谢率(Maximum metabolic rate, MMR),计算代谢空间(Aerobic scope, AS=MMR-SMR),随后将实验鱼装回各自对应的呼吸室中。通过对能量代谢数据的计算获取4种代谢表型并随机组合,每批鱼可组合6—7个鱼群,共有32个鱼群。每个鱼群由4尾鱼组成,包括4种代谢表型,即每种代谢表型1尾鱼;在鱼的背鳍前部进行不同颜色的体外标记(Visible Implant Elastomer Tags, 美国西北科技公司)以区别不同代谢表型。每个鱼群在标记后装入单元网格中(长 × 宽 × 高=45 cm × 30 cm × 50 cm)并投喂1次红线虫。第5 d对每个鱼群进行群体行为拍摄(方法见后)。本研究设定3种环境类型:无食物隐蔽场所的开放水域环境(空白对照),有食物、无隐蔽场所的食物环境,有食物隐蔽场所(水草)环境。每批鱼的所有实验均严格执行上述的实验步骤。所有实验环境的溶氧、水温及光周期与驯化期间相同。本研究将4尾鱼组成一个鱼群是因为前期研究发现一个由4尾鱼组成的鲤科鱼群可表现出明显的群体行为[29-30]。
1.3 实验方法
1.3.1能量代谢测定
本研究采用实验室研制的4台流水式鱼类呼吸代谢仪和1台间歇式呼吸代谢仪分别测定中华倒刺鲃的SMR和MMR[40-41]。每台鱼类呼吸代谢仪包括11个呼吸室,选取其中一个空白呼吸室作为对照呼吸室(未装鱼),另外的十个呼吸室作为实验呼吸室(装鱼)。第1 d将禁食24 h的鱼装入呼吸室中过夜驯化12 h,第2 d采用溶氧测定仪(HQ30d,美国哈希公司)在15个时间点(10:00—24:00)每小时测定1次4个空白呼吸室和40个实验呼吸室出水口的溶氧水平。在计算单尾鱼的耗氧率后,选取单尾鱼在15个时间点中的3个最低耗氧率的平均值作为单尾鱼的SMR[41]。第3 d通过人工力竭运动方法诱导实验鱼的MMR,采用1台间歇式呼吸代谢仪测定运动力竭后单尾鱼的5 min恢复代谢并计算获得实验鱼的MMR,实验方法参照文献资料[41],最后测定鱼的体重和体长。SMR和MMR的计算公式如下所示:
SMR=v×ΔΟ2
(1)
式中,SMR为中华倒刺鲃的标准代谢率(mg O2/h);v为装鱼呼吸室单位时间的水体流量(L/h),此水体流量的测定方法:对装鱼呼吸室出水口的流水充满50 mL容量瓶准确计时,再根据计算公式得到呼吸室的水体流量;ΔO2为空白呼吸室(无鱼)与实验呼吸室(有鱼)出水口流水的溶氧水平差值(mg/L)[41]。
MMR=3600×Sslope×V
(2)
式中,MMR为中华倒刺鲃的最大代谢率(mg O2/h),3600是时间换算系数,Sslope为密闭呼吸室水体的溶氧水平在5 min的理论下降斜率(mg O2L-1s-1),V为扣除实验鱼体积后密闭呼吸室的实际水体体积(L),本研究假定中华倒刺鲃的密度为1 g/cm3。本研究中华倒刺鲃的SMR、MMR和AS分别为(1.84±0.03)、(7.60±0.09)和(5.76±0.09)mg O2/h。
1.3.2代谢表型分类
每一批鱼均执行下述的代谢表型分型方法:首先把鱼的体重(body mass, BM)、SMR和AS转换成以10为底的对数值,然后用统计软件SPSS或Statistics分别线性拟合对数BM与SMR、AS的回归方程,并获取对数SMR和AS的残差(rSMR和rAS)。以rSMR为横坐标,以rAS为纵坐标作图(图1),可组合得到四种代谢表型,即高SMR/高AS(+/+)、高SMR/低AS(+/-)、低SMR/高AS(-/+)、低SMR/低AS(-/-)。组合鱼群时,以数量最少的表型个体为基础,每个鱼群的平均体重保持相近。
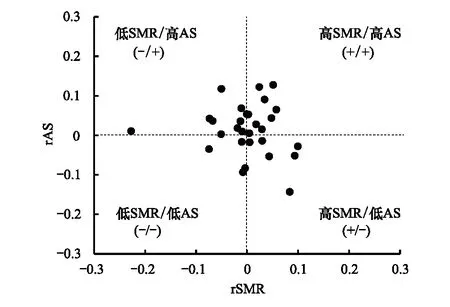
图1 中华倒刺鲃的代谢表型Fig.1 The metabolic phenotype of qingbo S. sinensis
1.3.3群体行为拍摄
本研究采用自行研制的白色圆形水槽(直径100 cm,水深12 cm)拍摄鱼的群体行为。在圆形水槽的四周安装1.5 m高的纯绿色布帘,为实验鱼的群体行为的真实表现提供稳定统一的环境背景并消除外部潜在影响。在圆形水槽的正上方安置一个连接电脑的广角高清摄像头(Webcam Pro9000,中国罗技公司,15帧/s)。将单个鱼群放入圆形水槽(开放水域环境)中适应30 min,之后对该鱼群连续拍摄20 min;随后在圆形水槽均匀分布的3个食物盘中共放置12个红线虫(觅食环境),每个食物盘放4个红线虫,待水面平静后再拍摄20 min;由于在觅食环境中部分或全部红线虫被鱼群摄取,需对每个食物盘补充红线虫数量至4个,同时在圆形水槽正中央添加一个由4颗绿色塑料水草组成的隐蔽场所(即食物隐蔽场所环境),随后再拍摄20 min。每一批的每个鱼群均严格按上述步骤进行实验操作。视频拍摄完后,清除圆形水槽的全部水体,更换充分曝气后的备用水,为下一个鱼群的群体行为拍摄做好准备。在所有实验过程中,实验环境保持安静以降低声音对鱼群群体行为的潜在影响。
1.3.4视频分析及实验参数计算
本研究仅对鱼群处于游泳运动状态时进行个体空间位置的排序,按鱼群游泳前进方向从前到后依次排序,任意两尾鱼的前进方向全部小于90度的情况才排序,大于90度的情况则不排序。对鱼群中4尾鱼从前到后(以鱼吻部的垂直线为界)依次对编号1、2、3、4;若单尾鱼的序号越小,则该尾鱼在鱼群中的个体空间位置越靠前。若两尾鱼的吻部处于同一直线上,则二者个体空间位置的序号相同。
本研究采用狸窝视频格式转换器(v5.1.0.0)将所有拍摄视频WMV格式转码成AVI格式,然后再采用软件ImageJ(https://imagej.nih.gov/ij/)对转码后的视频进行分析,获取单尾鱼每一秒的二维坐标数据(x,y轴像素值)。为消除红线虫投放或水草放置对鱼群扰动的影响,本研究仅分析每个视频第10—20 min的共10 min视频数据。根据像素将坐标数据与行为装置的实际大小(本研究实际物体大小与像素的转换率为8.14像素/cm)换算成单尾鱼个体空间位置的实际坐标数据(cm)。通过人工分析视频获取个体空间位置和领头鱼出现次数百分比,通过坐标数据计算单尾鱼的个体特征如个体游泳速度(Velocity,V)、个体游泳速度同步性(Synchronization of speed,Sv)、个体间距离(Inter-individual distance,IID)、最近邻距离(Nearest neighbor distance,NND)、运动时间百分比(Percentage time on moving, PTM),群体特征包括群体移动速度(Group movement speed,Gv)、群体移动总距离(Total group movement distance,D)、群体极性(Group polarization,P)等群体行为参数。上述实验参数的计算公式如下所示:
(1)个体游泳速度(V,cm/s)
(3)
式中,V为个体游泳速度(cm/s),x(t)和x(t-1)分别为单尾鱼在t、t-1时刻的横坐标值;y(t)和y(t-1)分别为单尾鱼在t、t-1时刻的纵坐标值;dt为两个坐标点的时间间隔(本研究设定为1 s)。个体移动总距离(TD,cm)是10 min内个体的游泳运动总距离。
(2)个体游泳速度同步性(Sv)
Sv评价个体游泳速度的同步性,介于0—1之间。若该数值越大,个体游泳速度的同步性则越高[25]。
(4)
式中,Sv为个体游泳速度同步性(无单位),vi和vj为鱼群中第i、j鱼的瞬时个体游泳速度。
(3)个体间距离(IID, cm)
IID表示鱼群中所有个体之间的平均距离(cm),评价群体凝聚力[26]。若该数值越小,鱼群的群体凝聚力则越强。
(5)
式中,IID为个体间距离(cm),xi和xj为鱼群中第i、j鱼在t时刻的横坐标值,yi和yj为鱼群中第i、j鱼在t时刻的纵坐标值。
(4)最近邻距离(NND, cm)
NND表示鱼群中某一个体与其它所有个体距离中的最小距离(cm),衡量群体凝聚力[26]。
(6)
式中,NND为最近邻距离(cm),xi和xj为鱼群中第i、j鱼在t时刻的横坐标值,yi和yj为鱼群中第i、j鱼在t时刻的纵坐标值。
(5)运动时间百分比(PTM,%)
(7)
当单尾鱼的游泳运动速度超过1.75 cm/s时被定为运动状态,若游泳运动速度小于1.75 cm/s被定为静止状态[31]。式中,T1表示鱼进行游泳运动(游泳速度超过1.75 cm/s)的总时间,T2表示视频观察分析总时间(本研究的为600 s)。
(6)群体中心(Gx,Gy)
(8)
式中,Gx为群体中心的横坐标值,x1(t)、x2(t)、x3(t)、x4(t)分别为4尾鱼在t时刻的横坐标值;Gy为群体中心的纵坐标值,y1(t)、y2(t)、y3(t)、y4(t)分别为4尾鱼在t时刻的纵坐标值。
(7)群体移动速度(Gv,cm/s)
(9)
式中,Gx(t)和Gy(t)为群体中心在t时刻的横、纵坐标值,Gx(t-1)和Gy(t-1)为群体中心在t-1时刻的横、纵坐标值,其中dt为群体中心两个坐标的间隔时间(本研究设定为1 s)。群体移动总距离(Total group movement distance, cm)是指10 min内群体游泳运动的总距离。
(8)与群体中心距离(D, cm)
(10)
式中,x(t)和Gx(t)为单尾鱼和群体中心在t时刻的横坐标值,y(t)和Gy(t)为单尾鱼和群体中心在t时刻的纵坐标值。
(9)极性(P)
极性评价鱼群个体排列的整齐程度,介于0—1之间。当鱼群中所有个体以朝向绝对一致方向排列时,P值为1;当鱼群中所有个体以方向相反且完全抵消的方式而排列时,P值为0[26]。若极性的数值越高,鱼群的协调能力则越强。
(11)
式中,vi(t)为单尾鱼i的单位时间内的运动向量,运动方向是从t-1时刻的坐标点指向t时刻的位置坐标点。n表示群体成员数量,本实验中n等于4。
1.4 数据统计与分析
所有数据先用Excel(2007)进行平均值计算并制图,然后再采用统计软件SPSS(19.0)进行统计分析。本研究采用双因素方差分析(Two-ways analysis of variance)的线性模型考察代谢表型和环境类型对中华倒刺鲃群体的个体空间位置参数、个体特征和群体特征的影响。若该线性模型发现组间存在显著差异,则再采用Duncan多重比较分析组间差异,或采用单因素方差分析(One-way analysis of variance)比较组内差异。最后,采用单因素方差分析考察环境类型对群体特征参数的影响。本文中所有数据均以“平均值±标准误(Mean±SE)”表示,显著性水平定为P<0.05。
2 结果
2.1 和环境类型和代谢表型对中华倒刺鲃个体空间位置的影响
中华倒刺鲃群体中的个体空间位置不受代谢表型和环境类型的影响,但仅代谢表型对个体空间位置的变异系数具有影响(图2,表1),高SMR/高AS表型个体空间位置的变异系数显著高于低SMR/高AS和低SMR/低AS两种表型(图2,表1,P<0.05)。相比较于环境类型,代谢表型对中华倒刺鲃的领头鱼出现次数百分比产生影响,低SMR/低AS表型在鱼群中当领头鱼的百分比显著低于高SMR/高AS和高SMR/低AS两种表型(图2,表1,P<0.05)。
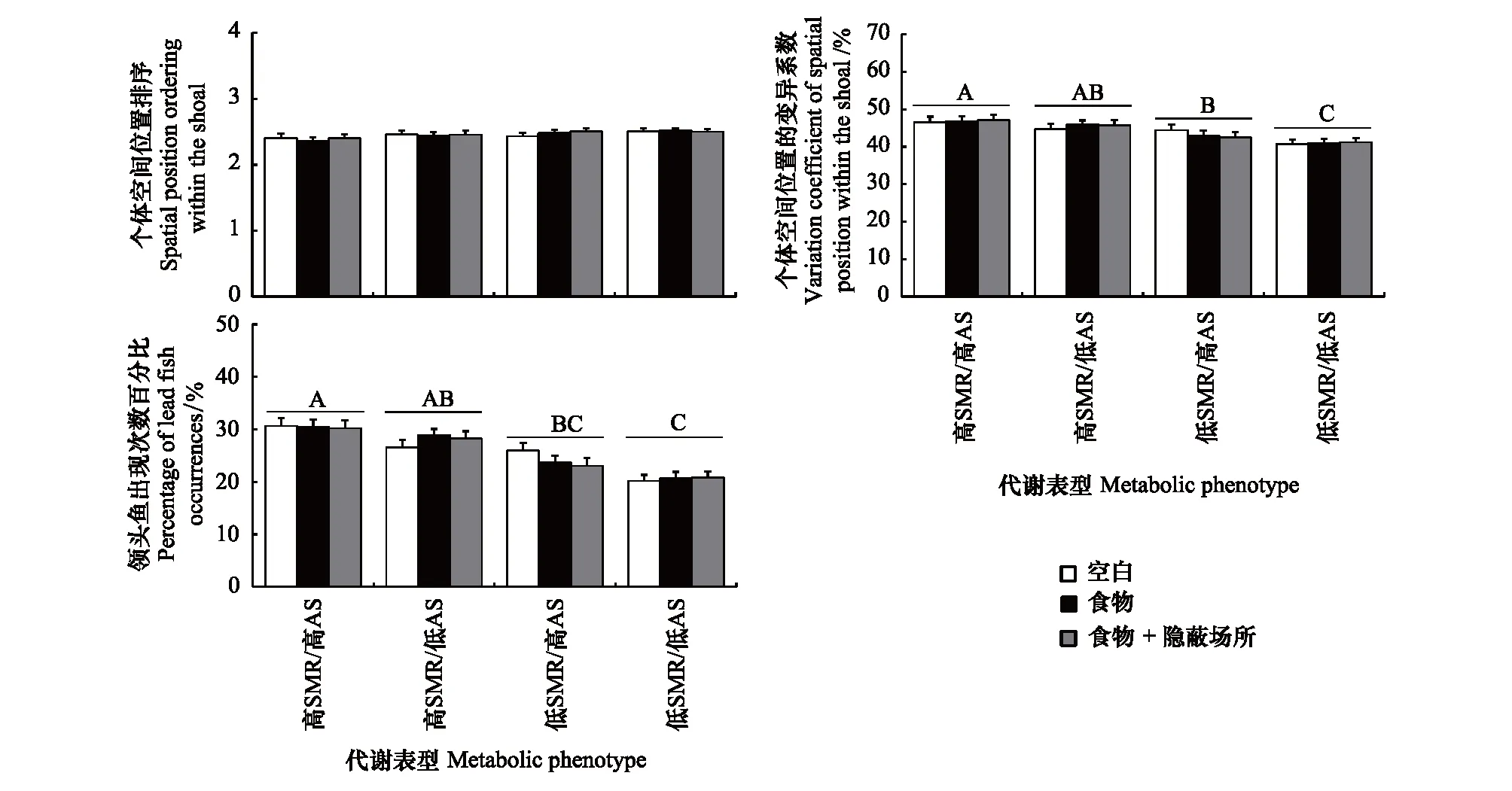
图2 环境类型和代谢表型对中华倒刺鲃群体中个体空间位置的影响Fig.2 Effects of ecological context and metabolic phenotype on spatial position parameters of S. sinensis within shoals不同表型无共同大写字母表示表型间数据存在显著差异(P<0.05)

表1 环境类型和代谢表型对中华倒刺鲃集群空间位置参数影响的双因素方差统计结果
2.2 代谢表型和环境类型对中华倒刺鲃个体特征的影响
除高SMR/低AS表型外,中华倒刺鲃三种代谢表型(高SMR/高AS、低SMR/高AS和低SMR/低AS)在空白环境和食物环境中的个体游泳速度均显著小于食物隐蔽场所环境(图3,表2,P<0.001)。四种代谢表型在空白环境和食物环境中的个体移动总距离均小于食物隐蔽场所环境(图3,表2,P<0.001)。四种代谢表型在空白环境和食物环境中的个体游泳速度同步性均明显高于食物隐蔽场所环境(图4,表2,P<0.001)。低SMR/高AS和低SMR/低AS表型在空白环境和食物环境中的个体间距离小于食物隐蔽场所环境,但高SMR/高AS和高SMR/低AS表型在三种环境中的个体间距离均无差异(图4,表2,P<0.001)。

图3 环境类型和代谢表型对中华倒刺鲃个体游泳速度和个体移动总距离的影响Fig.3 Effects of ecological context and metabolic phenotype on individual swimming speed and total individual locomotion distance in S. sinensis小写字母a和b表示同一代谢表型在不同环境中的数据具有显著差异(P<0.05)
低SMR/高AS和低SMR/低AS两种表型的NND小于高SMR/高AS表型(图4,表2,P<0.01),高SMR/低AS表型的NND介于上述三种表型中间;此外,四种表型在三种环境中的NND均无差异(图4,表2)。低SMR/高AS和低SMR/低AS两种表型的与群体中心距离小于高SMR/高AS表型(图5,表2,P<0.05)。低SMR/高AS和低SMR/低AS表型在空白环境和食物环境中的与群体中心距离小于食物隐蔽场所环境(图5,表2,P<0.001),而高SMR/高AS和高SMR/低AS表型的与群体中心距离在三种环境间无差异(图5,表2)。环境类型和代谢表型对实验鱼的运动时间比均无影响(图5,表2,P> 0.05)。

图4 环境类型和代谢表型对中华倒刺鲃个体游泳速度同步性、个体间距离及最近邻距离的影响Fig.4 Effects of ecological context and metabolic phenotype on synchronization of speed, inter-individual distance and nearest neighbor distance in S. sinensis小写字母a和b表示同一代谢表型在不同环境中的数据具有显著差异(P<0.05);不同表型无共同大写字母表示表型间数据存在显著差异(P<0.05)
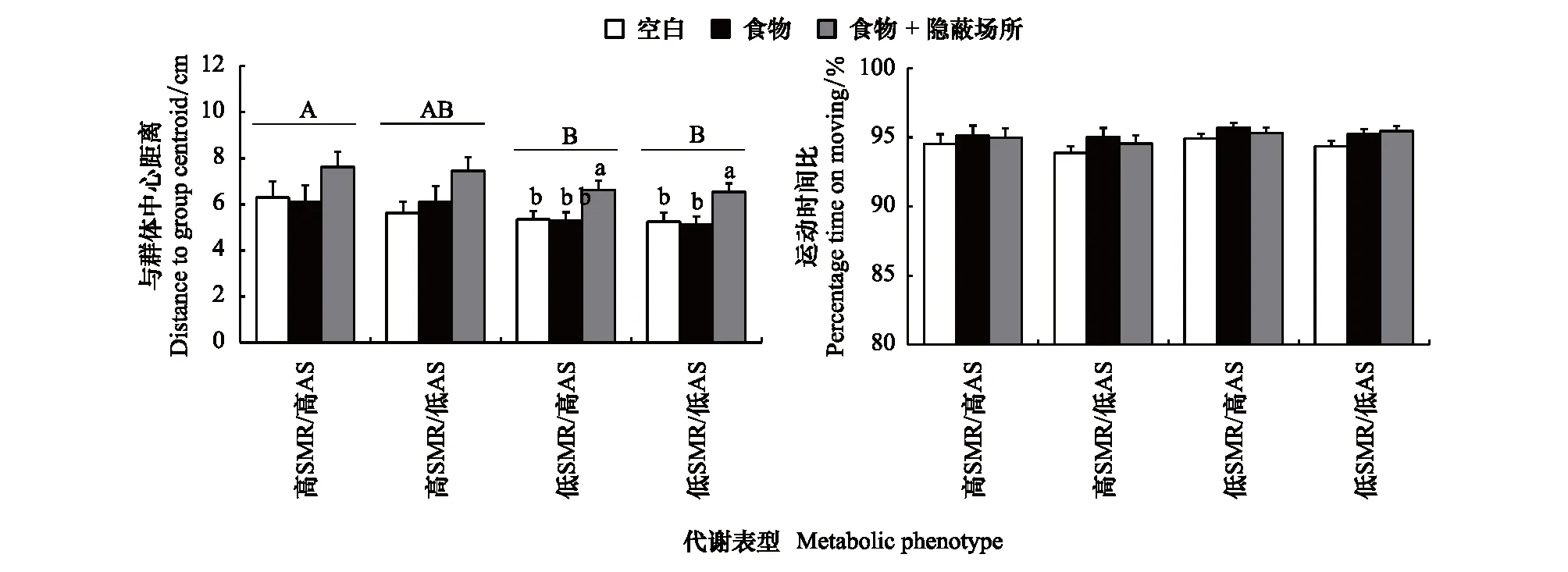
图5 环境类型和代谢表型对中华倒刺鲃个体与群体中心距离和个体运动时间比的影响Fig.5 Effects of ecological context and metabolic phenotype on distance to group centroid and percentage time on moving in S. sinensis小写字母a和b表示同一代谢表型在不同环境中的数据具有显著差异(P<0.05);不同表型无共同大写字母表示表型间数据存在显著差异(P<0.05)
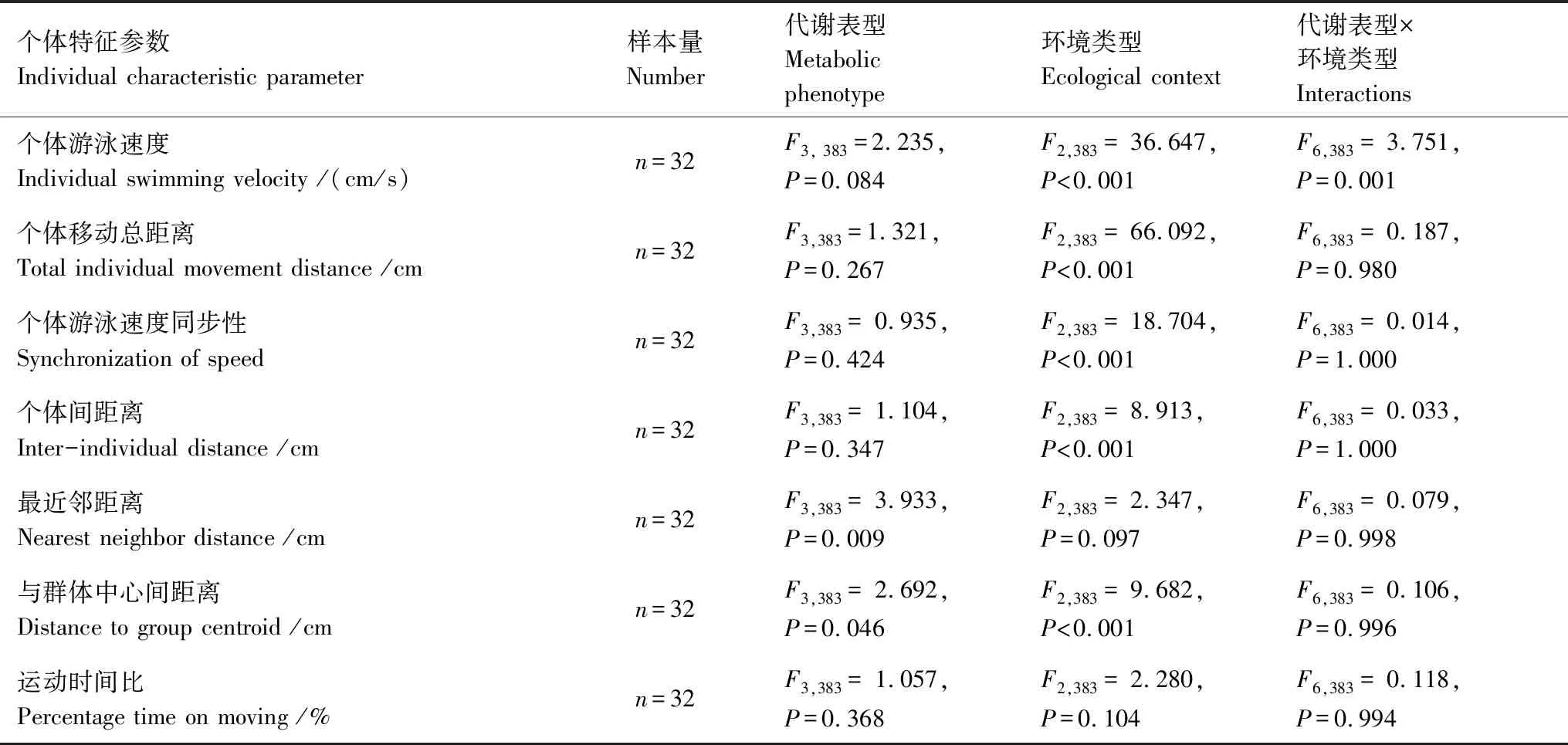
表2 环境类型和代谢表型对中华倒刺鲃个体特征影响的双因素方差统计结果
2.3 环境类型对中华倒刺鲃群体特征的影响
虽然中华倒刺鲃在三种环境间的群体极性并无差异(图6,F2,95= 2.649,P=0.076),但其在空白环境和食物环境中的群体移动速度及群体移动总距离均小于食物隐蔽场所环境(图6,群体移动速度:F2,95= 15.701,P<0.01;群体移动总距离:F2,95= 17.231,P<0.01)。

图6 环境类型对中华倒刺鲃群体特征的影响 Fig.6 Effect of ecological context on group-level characteristics in S. sinensis字母a和b表示在不同环境中的实验参数具有差异(P<0.05)
3 讨论
3.1 代谢表型和环境类型对个体空间位置的影响
自然界鱼类通过调整形态、生理和行为表型等策略以适应多种多样且不稳定的生存环境[42]。前期研究发现较高有氧代谢能力[13,43]、较强勇敢性的鱼类个体在群体前部空间的出现概率更高[44],而那些较弱表型的鱼类个体更偏好位于群体的后部空间,可能与在群体后部空间具有节约能量消耗的优势相关[45]。然而,另有研究报道中华倒刺鲃的有氧代谢能力并不决定群体中的个体空间位置[35];此外,灰鲻鱼(Mugilcephalus)的标准代谢率也不影响群体中的个体空间位置[46]。上述研究表明,不同鱼类在群体中的个体空间位置与个体表型(如能量代谢)的关系不尽相同。本研究发现环境类型和代谢表型对中华倒刺鲃群体中的个体空间位置均无影响,与本实验室的过往研究相似[35]。理论认为,群体前部空间位置的益处是鱼类个体的摄食成功率和反捕食能力的增强,而相应的成本是被捕食概率的增加、游泳能量效率的下降等[36]。尽管前期相关研究的实验结果存在较大差异,但鱼类个体在群体空间位置的变动可能与水体流速及有氧运动能力等多种因素有关。栖息环境中食物资源的时空变动及不可预测性影响鱼类个体的生理状态和功能表现。因此,鱼群前部空间的占据与更替可能与个体在群体前部空间收益和风险之间的权衡与妥协相关,即取决于个体的有氧运动能力、生理负荷和行为策略等,而个体的代谢表型的相对作用程度较低。此外,个体的社群等级或营养状况等因素也可能影响鱼类群体空间位置的占据与更替[35, 46],如某些社群等级较高或饥饿个体在群体前部空间的出现频率明显增加。虽然鱼群的前部空间虽然有助于个体在此处获得较多的食物,但随后食物消化吸收造成的巨大生理负荷挤压个体的代谢空间,这些大量摄食的个体因代谢空间的减少而出现游泳能力的下降,无法继续维持自身在鱼群前部空间,而后退至鱼群的后部空间,表明个体在群体空间位置并非稳定不变的,而是存在具有规律性的更换与交替过程[47]。
本研究发现,环境中食物的出现或隐蔽场所的增加并不影响实验鱼群体中的个体空间位置,可能是因为中华倒刺鲃不同的代谢表型个体在实验室驯化期间的投喂制度(如每天两次的饱足投喂)和单次摄食量较为统一,致使不同的代谢表型个体间的营养水平和食欲强度无明显差异,在群体运动过程中并未表现出明显的个体空间位置偏好的现象。值得注意的是,高SMR/高AS表型个体的领头鱼出现次数百分比明显高于低SMR/高AS、低SMR/低AS表型个体,这种行为变化却与个体空间位置(平均值)的数据特征不相统一,表明那些具有较高SMR且较大AS的个体更倾向出于现鱼群前部,可能与其机体较高的能量代谢需求及较强的个性有关。
3.2 代谢表型和环境类型对群体行为的影响
鱼群是由不同的鱼类个体成员所组成的群体,个体行为表现常存在一定的异质性,影响鱼类的群体行为特征。前期研究报道,三刺鱼的群体游泳运动速度随着个体游泳运动速度的提高而呈现相应增加的现象[26]。本研究发现,中华倒刺鲃在不同环境类型下的个体水平特征及群体行为特征产生显著变化。例如,在空白对照环境和觅食环境中个体(或群体)游泳运动速度和移动总距离均小于食物隐蔽场所环境,该结果与相关研究的实验结果类似[26]。该现象的可能原因是当环境同时具有食物和隐蔽场所时,实验鱼开始利用隐蔽场所提供的风险降低的保护优势,但红线虫的空间分布于测试环境的四周,远离中间的隐蔽场所,在搜寻食物过程中鱼表现出时常出入隐蔽场所的现象;鱼既希望能迅速获得红线虫以补充能量,又渴望通过增加个体游泳运动速度的行为策略,以减少在外周水域中各类风险的遭遇概率。本研究发现,在空白对照环境和觅食环境中个体运动速度同步性明显大于食物隐蔽场所环境,这种现象可能是因为实验鱼提高了个体的游泳运动速度,并且增加隐蔽场所的利用时间,潜在减少了鱼群中个体成员间的社会信息传递与互作,导致整个群体结构的有效维持变差;个体成员间游泳运动的动机迥异(如有的个体游出隐蔽场所搜寻红线虫,而有的个体游入隐蔽场所以消化食物或躲避外界风险),降低了个体游泳速度的同步性。虽然中华倒刺鲃在食物环境类型中的群体极性具有下降的趋势,但三种环境中群体极性并无差异,这与环境具有的隐蔽场所降低了三刺鱼的鱼群极性的研究结果不同[28],表明测试环境的隐蔽场所可能并不改变中华倒刺鲃鱼群中个体成员间游泳运动速度的相对协调程度。
研究显示,鱼群的能量消耗随着个体成员之间距离的增加而明显增强[48]。本研究发现低SMR/高AS和低SMR/低AS表型在空白对照环境和觅食环境中的个体间距离小于食物隐蔽场所环境,表明当环境具有隐蔽场所时低SMR个体的风险承担能力低于其它两种代谢表型(高SMR/高AS和高SMR/低AS),这可能是因为低SMR个体更加偏好利用环境中的隐蔽场所,其它个体成员游出隐蔽场所进行觅食的活动增加了个体间距离,导致在此环境中群体的凝聚力下降。本研究还发现实验鱼的最近邻距离介于0—8 cm范围,与青鱼(Mylopharyngodonpiceus)[30]和高体鳑鲏(Rhodeusocellatus)[49]的实验结果类似。虽然本研究中华倒刺鲃每一种表型在不同环境类型中的最近邻距离并无明显差异,但低SMR/低AS和低SMR/高AS两种表型的最近邻距离小于高SMR/高AS表型,表明高SMR/高AS表型个体的凝聚力(或社会性)较低,这种凝聚力的个体表型间差异可能是因为高SMR/高AS表型个体具有较强的有氧代谢能力和较高的基础能量消耗,而表现出较为活跃且较强活动强度的行为特征,对群中其它个体成员的追随意愿相对较低,潜在增加了高SMR/高AS表型个体与其它三种表型个体的最近邻距离。
研究发现,三刺鱼群体凝聚力的改变与个体游泳运动速度的差异程度有关[26];在同时具有食物和化学预警物质的测试环境中,秀体底鳉(Fundulusdiaphanus)的群体大小大于空白对照环境,却小于仅具有化学预警物质的测试环境[50];大颚细锯脂鲤(Pristellamaxillaris)在食物环境下的游泳运动速度更快,鱼群结构更为松散[51];在同时具有食物和隐蔽场所的环境中,虽然三刺鱼的群体移动速度维持稳定,但群体凝聚力和协调性下降[28]。本研究发现,中华倒刺鲃的群体行为调节与环境类型密切相关。例如,在空白对照环境条件下,中华倒刺鲃群体倾向于以中等速度进行群体移动,呈现出较强的群体行为协调性和凝聚力。然而,当测试环境具有食物及隐蔽场所时,中华倒刺鲃的群体移动速度明显增加,个性游泳速度同步性和群体的凝聚力降低,这些研究发现与过往研究类似[26,28,50]。
综上所述,本研究发现环境类型和代谢表型对中华倒刺鲃群体中的个体空间位置均无影响,不同代谢表型之间的相互凝聚力(如最近邻距离)存在明显差异,并在不同生态环境之间稳定维持,暗示个体间的相互吸引力具有代谢表型依赖性;个性游泳速度同步性和群体极性受环境类型的影响并不统一,环境复杂性的增加可能不影响中华倒刺鲃的群体协调性。中华倒刺鲃部分的个体特征与代谢表型无关。全球气候变化及人类干扰活动对鱼类及其生境的负面影响日益严重,鱼类面临多种多样的自然环境选择压力与挑战。未来研究不仅需要关注鱼类群体行为的常规模式,还要增强对个体表型异质性(如种内个体差异)与鱼类的群体行为及其功能表现和生态过程之间关联的深入探索,具有重要的理论研究价值及进化生物学和生态学意义。

