新政策环境下创新药物临床试验风险识别及评估
安晓玲 黄文强 苏雨楠 罗臻


中圖分类号 R969.4;R95 文献标志码 A 文章编号 1001-0408(2021)10-1153-05
DOI 10.6039/j.issn.1001-0408.2021.10.01
摘 要 目的:识别并评估创新药物临床试验的风险因素,为制定其风险管控策略提供参考。方法:运用文献研究法,获取创新药物临床试验阶段的风险因素,进行分类整理,初步形成风险评价指标,并在此基础上设计调查问卷;通过采用面谈访问、问卷调查等方式,邀请4家三甲医院及1家合同研究组织的54位专家进行评分;运用SPSS 24.0软件对风险事件状态数据进行主成分分析。结果与结论:形成的风险评估体系包括政策法律风险、临床试验机构风险、试验方案设计风险等9项一级指标,行业政策和法律法规变化、知识产权风险等31项二级指标。经分析,创新药物临床试验风险因素主要为药品及生物样本管理风险、试验方案设计风险、临床试验机构风险、安全性报告管理风险、伦理审查风险、政策法律风险和受试者管理风险等。临床试验相关方需要重点监测各风险因素,建立动态化的监控管控机制和实施保障机制,有效预防和管控风险,促进临床试验顺利实施。
关键词 创新药物临床试验;新政策环境;主成分分析法;风险识别;风险评估
Risk Identification and Evaluation of Clinical Trials of Innovative Drugs under New Policy Environment
AN Xiaoling,HUANG Wenqiang,SU Yunan,LUO Zhen(School of Pharmacy, Lanzhou University, Lanzhou 730030, China)
ABSTRACT OBJECTIVE: To identify and evaluate the risk factors of innovative drug clinical trials, and to provide references for the development of risk management and control strategies. METHODS: Using the method of literature research, the risk factors of innovative drug clinical trials were obtained, classified and sorted out, and the risk evaluation indicators were initially formed. On this basis, the questionnaire was designed. By means of interview and questionnaire survey, 54 experts were invited from 4 tertiary hospitals and 1 contract research organization to score. SPSS 24.0 software was used to perform principal component analysis on risk event status data. RESULTS & CONCLUSIONS: The risk evaluation system included 9 first-class indicators such as policy and legal risk, clinical trial institution risk and trial scheme design risk, and 31 second-class indicators such as industrial policy, law and regulation changes, intellectual property risk. According to the analysis, the risk factors of innovative drug clinical trials mainly included drug and biological sample management risk, trial scheme design risk, clinical trial institution risk, safety report management risk, ethical review risk, policy and legal risk, and subject management risk. Relevant parties in clinical trials need to focus on monitoring various risk factors, establish dynamic monitoring and control mechanism and implementation guarantee mechanism, and effectively prevent and control risk, to promote the smooth implementation of clinical trials.
KEYWORDS Clinical trials of innovative drugs; New policy environment; Principal component analysis; Risk identification; Risk evaluation
临床试验是评价创新药物有效性和安全性的关键环节,是创新药物能否上市的重要评判依据。由于临床试验耗时长、投资大、风险高,成为药物研发注册过程中的“限速步骤”,很大程度影响着创新药物的研发进程[1]。因此,在创新药物临床试验中引入风险管理非常必要。通过风险识别、评估及管控可以有效降低试验失败风险并减少经济损失。随着《药品管理法》[2]、《药品注册管理办法》[3] 、《药物临床试验质量管理规范》[4] 、《国家药品监督管理局关于调整药物临床试验审评审批程序的公告》[5]等一系列药品管理法律文件的相继出台,创新药物临床试验法律政策环境发生了较大的变化,初步形成了以“临床价值”为导向的创新药物研发环境,临床试验机构认定由原来的资格认定制改为备案管理制,临床试验申请由审批制改为默认许可制,境外临床试验数据也可在特定条件下被接受等,在解决我国临床资源相对不足、药品审评审批程序繁杂、药品审评积压等问题上发挥了积极作用[6]。根据2015-2019年度药品审评报告,我国2015-2019年创新药物临床试验共获批3 931件,创新药物上市申请共获批633件,年平均增长率分别为16.42%、10.75%,创新药物的上市进程逐渐加快。同时,国家药品审评中心等对临床试验的质量提出了更高、更严的要求,更加注重创新药物临床试验过程的规范性以及数据和结果的科学性、真实性、可靠性,创新药物临床试验面临重要的发展机遇与挑战[7]。随之而来的是,创新药物临床试验的主要风险因素及影响程度也发生了较大的变化,以往的风险管理模式已难以满足当前新政策环境下临床试验的实际需要,亟需结合新政策环境的特点,提出更具针对性、适应性的创新药物临床试验风险管理模式。目前,我国创新药物临床试验风险管理相关研究成果集中在受试者风险管理、藥品风险管理、临床试验机构风险管理等方面,而关于全过程、动态化的风险识别、评估、管控等的研究较少。基于此,本课题组拟运用文献研究法、专家评价法和主成分分析法,对新政策环境下创新药物临床试验风险进行识别评估,确定主要风险因素,为下一步制定临床试验风险管控策略提供参考。
1 创新药物临床试验风险概述
根据《药物临床试验质量管理规范》规定,临床试验系指以人体(患者或健康受试者)为对象的试验,意在发现或验证某种试验药物的临床医学、药理学以及其他药效学作用、不良反应,或者试验药物的吸收、分布、代谢和排泄,以确定药物的疗效和安全性的系统性试验[4]。对于创新药物的临床试验,由于该类药物尚未被普遍应用于临床,相关研究者对其使用剂量、使用方法、有效性和安全性等信息的了解有限,故风险较大[8]。运用工作分解结构(Work breakdown structure,WBS)可对创新药物临床试验实施过程进行归类和层次划分[9],其具体内容见图1。由图1可见,在临床试验的前、中、后期均涉及多项环节,包括临床试验机构、申办方、研究者、试验方案、试验药物等多个方面,风险因素种类多、涉及面广。因此,有必要开展临床试验风险管理,采取各种措施识别、评估、控制和监控各环节中的风险,以实现“利益最大化、风险最小化”的动态管控目标[10]。
2 创新药物临床试验风险识别
为准确、全面地识别创新药物临床试验中的风险因素,本研究首先采用文献研究法,以“创新药物临床试验/新药临床试验/临床试验”“风险”等为关键词,在中国知网中检索2010年1月-2019年12月公开发表的有关创新药物临床试验风险管理方面的研究成果;同时,对《药品管理法》[2]、《药物临床试验质量管理规范》[4]等相关法律法规进行梳理,收集创新药物临床试验中可能存在的风险因素并进行分类整理,初步形成包含行业环境风险、临床试验机构风险、试验方案设计风险等9项一级指标,政策风险、知识产权风险、法律纠纷风险等31项二级指标的风险指标体系。在此基础上,设计《创新药物临床试验风险因素调查问卷》,邀请4家三级甲等医院临床试验中心的5名具有高级职称、从事药物临床试验研究多年的专家对调查问卷进行分析、讨论和评价,就风险指标设置及其发生概率和影响程度等细节提出进一步的修改意见。经修改完善后,最终确定形成了包含9个一级指标、31个二级指标的风险因素表,详见表1。
3 创新药物临床试验的风险评估
3.1 风险评估方法
采用专家评价法对创新药物临床试验风险进行评估。通过与专家进行探讨,设计出正式调研的《创新药物临床试验风险因素问卷调查表》,以填写数值的方式对31项风险因素进行逐项量化估算,评估其风险发生概率和风险影响程度。其中,风险发生概率(P)分为极低(0 3.2 问卷数据采集及处理方法 通过面谈、问卷调查等方式,邀请4家三级甲等医院及1家合同研究组织的54位具有高级职称、从事药物临床试验研究多年的专家进行打分评估。最终,共收回问卷54份,问卷回收率为100%;其中,3份填写不规范(未填写完整或出现涂改痕迹),故有效问卷51份,有效率为94.44%。 从风险发生概率和风险影响程度两个方面对问卷进行汇总,并计算其风险事件状态(即风险发生概率和风险影响程度的乘积)。运用SPSS 24.0软件对风险事件状态数据进行主成分分析。首先,进行主成分适合性检验,对数据进行KMO检验和Bartlett球形检验。其中,KMO检验的取值在0~1之间,0.9以上表示非常适合、0.8表示适合、0.7表示一般、0.6表示不太适合、0.5以下表示极不适合;Bartlett球形检验的显著性若小于0.05(即P<0.05),说明各变量间具有相关性,因子分析有效[12]。其次,对数据进行标准化处理,得到标准化矩阵,进而得到相应的相关系数矩阵。再次,对相关系数矩阵的方程进行求解,得到特征值、特征向量、主成分载荷、累计贡献率;从中选择特征值>1或累计贡献率>85%的统计量,确定主成分,并结合碎石图进行验证。最后,根据主成分载荷、特征值等成分系数矩阵和主成分表达式(系数为因素对每个主成分的方差贡献率),找出创新药物临床试验的主要风险因素[13]。
3.3 风险评估结果
3.3.1 问卷信度分析结果 采用SPSS 24.0软件Cronbachs α模型对回收的问卷进行信度分析,结果见表2。由表2可见,创新药物临床试验的风险发生概率和风险影响程度的Cronbachs α分别为0.940和0.958,均大于0.9,可见问卷中的31个问题具有较高的一致性,信度较佳,具有较好的分析价值[13]。
3.3.2 主成分适合性检验 经检验,KMO检验值为0.712,大于0.7,近似 χ2为1 867.991,自由度为465,且Barlett球形检验的显著性P<0.001,说明各因素具有相关性,适合进行主成分分析[12]。
3.3.3 主成分提取 对问卷调查的数据进行标准化处理,对其进行总方差解释,发现前7个成分的特征值均大于1,且累积贡献率达82.752%(表3)。因此,提取前7个主成分。从碎石图(图2)可以看出,成分1~7的曲线较为陡峭,包含了大量的信息;而从成分8开始,曲线逐渐进入平台期。因此,本研究提取前7个主成分进行分析。
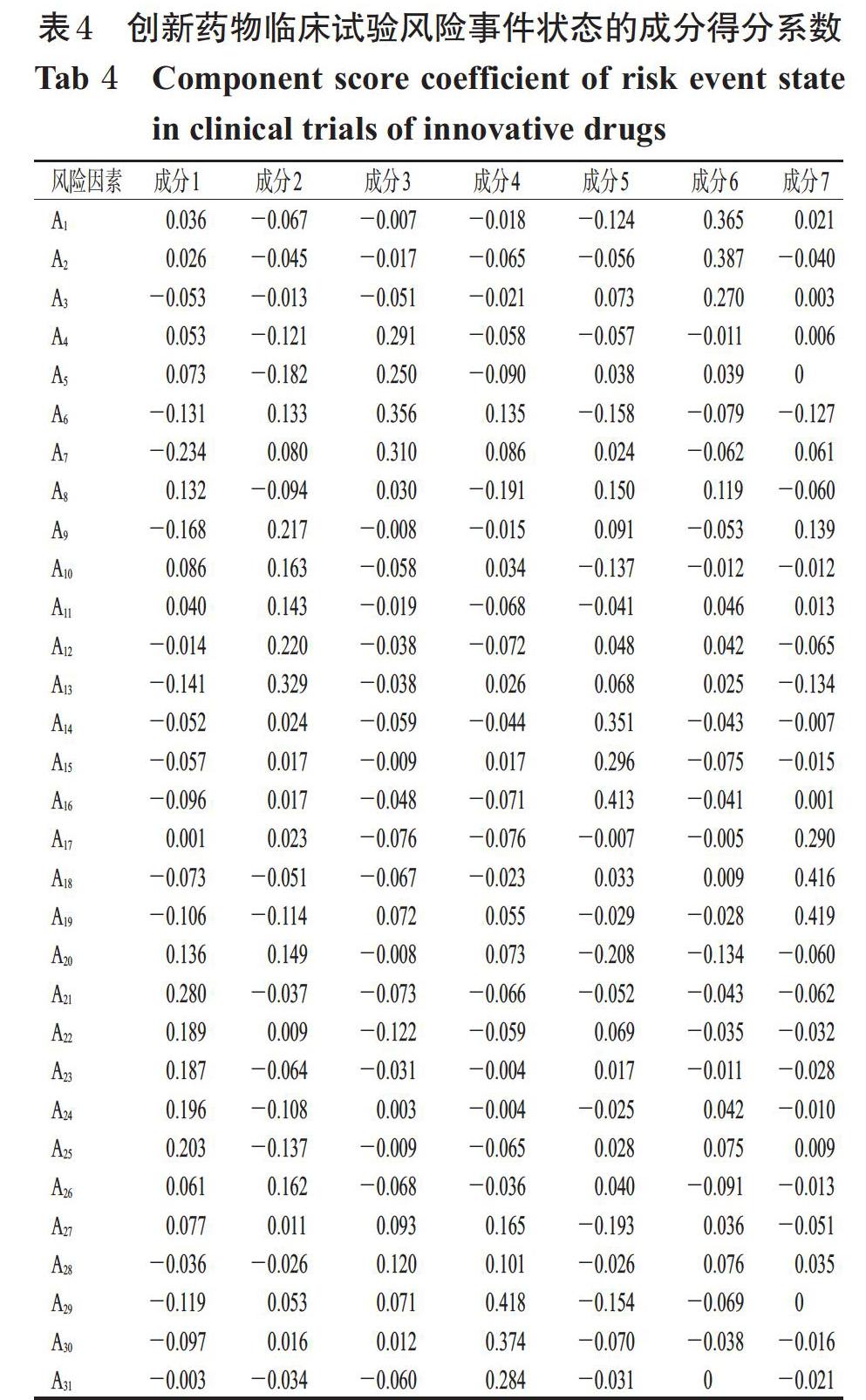
3.3.4 主成分分析 根据主成分载荷及相应特征值,计算出7个主成分的得分系数,结果见表4。
式中,F指主成分的线性组合。从中可以看出,在第1主成分中,A21试验用药物接收与保存风险和A25生物样本储存和运输风险的系数较大(0.280、0.203),均为保存、运输环节的相关风险因素,因此可将该主成分综合为药品及生物样本管理风险;在第2主成分中,A9临床前研究及提供资料不足、A12疗效评价指标选择与制定不合理和A13统计设计不合理的系数较大(0.217、0.220、0.329),可将该主成分综合为试验方案设计风险;在第3主成分中,A4环境及设施条件未完备、A5信息管理系统不健全、A6标准操作规程不合理和A7质量保证及控制体系不完善的系数较大(0.291、0.250、0.356、0.310),可将该主成分综合为临床试验机构风险;在第4主成分中,A29安全性数据采集风险、A30安全事件记录与处理风险和A31安全性数据报告风险的系数较大(0.418、0.374、0.284),可将该主成分综合为安全性报告管理风险;在第5主成分中,A14伦理审查组织架构不合理、A15审查标准不够科学合理和A16试验过程跟踪审查不严格的系数较大(0.351、0.296、0.413),可将第5主成分综合为伦理审查风险;在第6主成分中,A1医药行业政策变化、A2药品注册法律法规变化和A3知识产权风险的系数较大(0.365、0.387、0.270),可将该主成分综合为政策法律风险;在第7主成分中,A17受试者招募不达预期、A18受试者发生脱落和A19受试者依从性较差的系数较大(0.290、0.416、0.419),可将该主成分综合为受试者管理风险。综上所述,创新药物临床试验风险主要集中在药品及生物样本管理、试验方案设计、临床试验机构、安全性报告管理、伦理审查、政策法律和受试者管理等方面,需要重点监测并做好管控方案。
4 讨论
创新药物临床试验风险是广泛存在且不可避免的,通过风险识别、评估,制定实施风险管理方案,建立健全动态风险监控体系,能够有效预防和管控风险[14]。本研究通过对创新药物临床试验进行風险识别、评估研究,探索并确定了药品及生物样本管理、试验方案设计、临床试验机构、安全性报告管理、伦理审查、政策法律和受试者管理等7项主要风险。另外,专家讨论时也普遍认为,试验用药物风险和数据管理风险也是重要的风险因素,但在评估时未能被提取出。分析其原因,可能是因为参与问卷调查的专家大部分为医师,对于临床试验用药物本身和数据管理的关注较少,因此该类风险未被识别、评估出来。此外,本研究还存在一定的局限性,在正式调研前,虽进行了测试并对调查问卷进行了修改完善,但样本量较小,可能会对调研方案可行性及问卷信效度产生影响。
本研究经过分析得出,创新药物临床试验风险主要在药品及生物样本管理、试验方案设计、临床试验机构、安全性报告管理、伦理审查、政策法律和受试者管理等方面。其中,生物样本检测是创新药物临床试验的主要终点事件之一,临床试验相关方可从生物样本采集管理、生物样本处理阶段管理以及生物样本储存与转运阶段管理等方面加强风险管控,保证样本检测全过程规范,确保其数据真实、可靠[15]。临床试验方案是临床试验实施执行的标准,制定操作性强、科学合理的试验方案对临床试验的实施非常关键,需要申办方、研究者和合同研究组织等共同讨论制定,建议可从加强临床前研究及立项调研、重视起始剂量的选择和提高相关指标标准的合理性等方面制定科学、系统、完善的试验方案[16]。临床试验机构为临床试验实施的主要场所,应重点改善硬件设施、完善信息管理系统、制定科学合理的标准操作规程、健全完善质量管理体系和加强研究团队建设等,保障临床试验的顺利实施[17-18]。受试者安全性监测是创新药物研发过程中的重要组成部分,高质量的安全性报告有助于临床试验期间药物警戒管理的实施,今后应继续完善安全性数据快速报告管理指南及制度、建立完善药物临床试验数据警戒体系和加强药物警戒人才队伍建设,以确保受试者的合法权益[19]。临床试验的伦理审查是保护受试者权益的重要环节,相关方需建立完善的伦理委员会监管机制、建立区域伦理委员会、提高伦理委员会成员的业务水平和职业道德素养等[20]。政策法律风险可能会导致创新药物临床试验时间延长甚至试验失败,其防控重点在于加强对药物研发注册法律、法规、规章及相关文件的学习以及与药品审评中心专家的及时沟通交流,确保信息畅通,确保政策、法律精神全面领会,保证临床试验合法合规。保护受试者安全是创新药物临床试验实施的基本原则,应进一步制定合适的招募策略、提高受试者服药依从性并完善受试者补偿机制,最大限度保护受试者的安全和合法权益[21-22]。此外,申办方、临床试验机构等也应高度关注试验用药物和数据管理风险,可通过加强对试验用药物生产、运输、储存、分发等各环节的监管来预防或降低上述风险[23]。
综上所述,创新药物临床试验风险主要存在于药品及生物样本管理、试验方案设计、临床试验机构等多方面,需要申办方、临床试验机构、合同研究组织等多方共同努力,针对风险发生概率及影响程度较高的环节,建立动态化、系统化的监控管控机制以预防或减少风险事件的发生;同时,建议建立风险管控组织协调机制以及风险管控评估等保障机制,提高风险管控的操作性和可行性,确保风险管控措施落实到位。
参考文献
[ 1 ] 刘妤,陆明莹,张田香,等.药物临床试验各环节的风险管理[J].药物评价研究,2018,41(11):2113-2116.
[ 2 ] 全国人民代表大会.中华人民共和国药品管理法[S].2019- 08-26.
[ 3 ] 国家药品监督管理局.药品注册管理办法[S].2020-01-22.
[ 4 ] 国家药品监督管理局,国家卫生健康委.国家药监局、国家卫生健康委关于发布药物临床试验质量管理规范的公告:2020年第57号[EB/OL]. (2020-04-27)[2020-12-21]. http://www.nhc.gov.cn/yzygj/s7659/202004/1d5d7ea301f-
04adba4c4e47d2e92eb96.shtml.
[ 5 ] 国家药品监督管理局.国家药品监督管理局关于调整药物临床试验审评审批程序的公告:2018年50號[EB/OL]. (2018-07-24)[2020-12-21]. http://www.cde.org.cn/policy.do?method=view&id=178be2ecb5e3780c.
[ 6 ] 任佳伟,张若明,张象麟.药物临床试验机构备案制对药物Ⅰ期临床试验质量影响的风险管理研究[J].中国新药杂志,2019,28(3):319-324.
[ 7 ] 邵蓉,赵丹,蒋蓉.中国创新药物研发政策与趋势[J].中国食品药品监管,2018(1):15-19.
[ 8 ] 范华莹,谢振伟,王瓅珏,等.创新性药物临床试验的风险管理[J].中国临床药理学杂志,2017,33(23):2471-2473.
[ 9 ] 李蔷薇. CK所新药研发项目的风险与进度管理[D].成都:电子科技大学,2013.
[10] 汶柯,王瑾,白楠,等.药物临床试验中受试者风险最小化管理探讨[J].中国新药杂志,2015,24(16):1862-1866.
[11] 张靖.抗肝癌新药研发的风险管理研究[D].天津:天津大学,2014.
[12] 俞立平,刘骏.主成分分析与因子分析法适合科技评价吗:以学术期刊评价为例[J].现代情报,2018,38(6):73-79、137.
[13] 朱红兵.问卷调查及统计分析方法:基于SPSS[M].北京:电子工业出版,2019:37-49.
[14] 李晓玲.生物制品研发项目中临床试验阶段的风险管理研究[D].北京:中国科学院大学,2016.
[15] 胡盈盈,张菁,郁继诚,等.Ⅰ期临床试验中生物样本管理的风险管控[J].中国临床药理学杂志,2020,36(11):1598-1600.
[16] 钟皎,王丽萍.创新药物临床试验风险与受试者保护[J].中国新药杂志,2016,25(24):2804-2806.
[17] 吴建龙,陈斌,佘定平,等.影响我院药物临床试验质量的关键环节分析与干预[J].中国药房,2017,28(22):3033- 3036.
[18] 胡菲菲,张若明,张象麟.药物Ⅰ期临床试验实施阶段质量风险管理研究[J].中国药事,2019,33(11):1235-1245.
[19] 苏设镇,董凌云,武志昂.我国药物临床试验期间安全性数据快速报告的质量影响因素研究[J].中国新药杂志,2020,29(1):73-80.
[20] 任茜,马忠英,翟小虎,等.从保护受试者权益的角度探讨药物临床试验的伦理审查[J].中国药事,2018,32(12):1603-1607.
[21] 李轩,洪亮,邵蓉.完善我国药物临床试验受试者管理分析:从风险管理的角度[J].现代商贸工业,2013,25(6):140-142.
[22] 王瑾,汶柯,曹江,等.从我院药物临床试验投保情况浅谈我国临床试验风险管理现状[J].中国新药与临床杂志,2013,32(12):946-949.
[23] 沈霞,王增,吴佳萍.国内外药物临床试验中药品管理现状分析[J].中医药管理杂志,2019,27(24):78-80.
(收稿日期:2021-01-30 修回日期:2021-03-18)
(编辑:孙 冰)

