沉默miR-31-5p抑制口腔鳞状细胞癌的增殖及凋亡
王恩程,索 南,张 蕾,张婷婷,钱 军
(1.辽阳市中心医院口腔科,辽宁 辽阳 111000;2.北京大学口腔医院第二门诊部,北京 100081)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔癌的主要形式,约占口腔癌的90%[1]。据报道,OSCC的发病率不断增加,截至2017年底,全球新增OSCC 1 688 780例,死亡600 920例[2-3]。OSCC的高发病率主要归因于吸烟和饮酒[4]。此外,OSCC还与长期营养不良、病毒感染和不良口腔卫生有关[5]。对于OSCC的治疗,尽管目前外科手术、化学疗法和放射疗法均取得了长足的进步,但患者5年生存率一直偏低[6]。因此,揭示OSCC细胞增殖、转移及凋亡等病程生理过程的内部机制并寻找新的治疗策略至关重要。近年来,microRNAs被认为是多种癌症诊断和治疗的新的生物标志物。miR-31-5p是口腔癌的潜在循环生物标志物和治疗靶标[7]。Kao等[8]研究发现microRNA miR-31可作用于口腔癌的线粒体,影响其活性,而线粒体损伤与细胞新陈代谢和凋亡有关。但是关于miR-31-5p表达与OSCC细胞生物学活性的关系,及其与线粒体损伤之间关系的研究还未见报道。故本研究就miR-31-5p对OSCC细胞增殖和凋亡的影响及与线粒体损伤之间的关系展开探讨,现报告如下。
1 材料与方法
1.1 主要试剂及仪器
RPMI-1640培养基购自上海慧颖生物科技有限公司,青霉素、链霉素和胎牛血清购自上海素尔生物科技有限公司,miR-NC、miR-31-5p mimic、miR-31-5p inhibitor及各种引物由河南省生物工程技术研究中心设计并合成,Lipofectamine 2000转染试剂购自上海伟进生物科技有限公司,cDNA逆转录试剂盒购自北京百奥莱博科技有限公司,SYBR-Green PCR试剂盒购自上海天筛科技有限公司,BCA试剂盒购自上海碧云天生物技术有限公司,辣根过氧化物酶标记的山羊抗兔二抗、E2F3兔来源的单克隆抗体购自上海艾博抗生物科技有限公司。CytoFLEX流式细胞仪购自美国贝克曼库尔特公司,Gel Doc XR+凝胶成像系统购自美国伯乐公司。
1.2 组织来源及细胞培养
收集2018年5月至2020年5月在辽阳市中心医院口腔科进行手术治疗的OSCC患者的癌组织及癌旁组织,所有患者均同意参加本研究并签署知情同意书。本研究根据《赫尔辛基宣言》的道德准则进行,并经辽阳市中心医院伦理委员会批准。
正常口腔细胞系(HOK)和OSCC细胞系(SCC-4、SCC-9、SCC-25、CAL-27、NH-6、TCA8113)均购自美国典型培养物保藏中心。所有细胞于37 ℃、5% CO2下在10%胎牛血清、100 μg/mL的链霉素和100 U/mL青霉素的RPMI-1640培养基中培养。
1.3 RT-qPCR检测miR-31-5p mRNA的表达
将收集的癌组织及癌旁组织剪碎并研磨,用QIAzol裂解试剂提取总RNA,用cDNA逆转录试剂盒合成cDNA。将正常细胞系HOK和OSCC细胞系SCC-4、SCC-9、SCC-25、CAL-27、NH-6、TCA8113分别接种于6孔板中,当细胞达到近85%融合时,用QIAzol裂解试剂提取总RNA,再通过cDNA逆转录试剂盒合成cDNA,并按照SYBR-Green PCR试剂盒说明书进行RT-qPCR测定。miR-31-5p的表达水平通过RT-qPCR分析评估。所有步骤均使用All-in-OneTMmiRNA RT-qPCR检测试剂盒(GeneCopoeia)完成。以U6为内参,以2-ΔΔCT方法计算mRNA表达量。
1.4 细胞转染
取对数生长期细胞并按照约1×105/孔接种于6孔板,于37 ℃、5% CO2下培养。当细胞达到85%融合,根据Lipofectamine 2000说明书将100 nmol/L miR-NC、miR-31-5p mimic、miR-31-5p inhibitor质粒分别转染SCC-25和CAL-27细胞,并分为Control组(未转染任何质粒)、miR-NC组(转染miR-NC质粒)、miR-31-5p mimic组(转染miR-31-5p mimic质粒)和miR-31-5p inhibitor组(转染miR-31-5p inhibitor质粒)。
1.5 克隆形成实验
将各组细胞按约1×105/孔接种于6孔板,于37 ℃、5% CO2培养。直到长出肉眼可见的菌落,弃去培养液,100%甲醇固定菌落,0.25%结晶紫染色30 min,清水清洗。将6孔板倒置并叠加一张带网格的透明胶片,直接计数细胞克隆数。
1.6 微管形成实验
各组细胞培养48 h后,将基质胶与4 ℃预冷的无血清RPMI-1640培养基以1∶1的比例混合,置于24孔板底部,每孔300 μL,并于5% CO2、37 ℃的培养箱中固化30 min。在无血清RPMI-1640培养基中将细胞浓度调整为1.0×105/mL。每4 h观察微管结构。在100倍显微镜下随机取5个视野并计数每5个视野的微管状结构。使用Microvision Saisam软件分析图像。
1.7 流式细胞术
将各细胞培养48 h后,用胰酶消化,3 500 r/min离心5 min,再按1.0×105/mL重悬细胞。细胞悬液中加入5 μL FITC标记的Annexin-V和5 μL碘化丙啶,暗处理15 min后用CytoFLEX流式细胞仪分析细胞凋亡情况。细胞凋亡率(%)=早期细胞凋亡率(%)+晚期细胞凋亡率(%)。
1.8 ELISA检测超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量
取各组对数生长期SCC-25和CAL-27细胞,制备细胞悬液并于4 ℃、3 000 r/min离心10 min,取上清液,反应孔加入样品液,37 ℃孵育40 min,用洗涤液洗涤3次,每次2 min,然后加入生物素标记的抗体于37 ℃避光孵育30 min,洗涤3次后加入链霉亲和素混匀,37 ℃避光孵育30 min,最后加入显色剂避光显色10~15 min,滴加终止液终止反应,终止反应后5 min内置酶标仪中,于450 nm波长处测吸光值。
1.9 JC-1染色检测线粒体损伤
SCC-25和CAL-27细胞的JC-1染色方法参考文献[9]。加入DAPI使最终浓度为10 mg/L以显示细胞核。选取对数生长期的SCC-25和CAL-27细胞,加入0.25%胰酶消化后,吹打成单细胞悬液,并调整细胞密度为3×105/mL,接种于6孔板中,每孔加入3 mL细胞培养液,放入培养箱中培养。细胞贴壁后,各组细胞经过相应处理后,吸去细胞培养基,加入PBS冲洗1次,然后加入1 mL细胞培养基。每孔加入1 mL 1× JC-1染色液,轻轻晃动使其充分混匀,重新置入培养箱中培养20 min。按照比例,将5× JC-1染色缓冲液配制成1× JC-1染色缓冲液,置于冰上备用。染色结束后,弃上清液,用1×JC-1缓冲液清洗细胞2次。加入2 mL全培养基,置于荧光显微镜或激光共聚焦显微镜下观察结果并采集图片。以荧光显微镜及荧光分光光度计观察及检测荧光值。
1.10 蛋白印迹法检测相关蛋白表达水平
各组细胞用含蛋白酶抑制剂的RIPA细胞裂解液在冰上裂解,16 440 r/min离心10 min,收集上清。采用BCA试剂盒检测上清中蛋白浓度,并添加蛋白上样的缓冲液以制备蛋白样品。每孔上样量为30 μg,12% SDS-PAGE分离后转膜,5%脱脂牛奶室温封闭1 h,加入兔来源的单克隆一抗VEGF(ab32152,1∶250)、Ki67(ab92742,1∶5 000)、survivin(ab134170,1∶1 000)、Bcl-2(ab182858,1∶2 000)、Bax(ab32503,1∶1 000)、c-Myc(ab32072,1∶1 000)、GAPDH(ab8245,1∶1 000),4 ℃ 孵育12 h,缓冲液洗膜3次;加入山羊抗兔多克隆二抗(1∶2 000),室温孵育1 h后加显影液,于Gel Doc XR+凝胶成像系统中曝光,使用ImagePro plus 6.0软件分析蛋白条带,蛋白的相对表达水平为目标蛋白积分吸光度值与内参蛋白GAPDH积分吸光度值比值。
1.11 统计学分析

2 结果
2.1 miR-31-5p在OSCC中的表达情况
与OSCC癌旁组织相比,癌组织中miR-31-5p表达升高(图1a,P<0.05);与正常细胞HOK相比,OSCC细胞系SCC-4、SCC-9、SCC-25、CAL-27、NH-6和TCA8113中miR-31-5p表达升高(图1b,P<0.01);选择SCC-25和CAL-27细胞进行后续实验。分别将miR-31-5p mimic和miR-31-5p inhibitor转染至SCC-25和CAL-27细胞中,结果显示,与Control组比较,转染miR-31-5p mimic的细胞中miR-31-5p表达水平显著上升,而转染miR-31-5p inhibitor的细胞中miR-31-5p表达水平显著下调(图1c、d,P<0.05),表明转染成功,可进行后续试验。

a:OSCC组织中miR-31-5p mRNA的表达水平;b:正常细胞和OSCC细胞系中miR-31-5p mRNA的表达水平;c、d:转染后SCC-25和CAL-27细胞中miR-31-5p mRNA的表达水平 *:与癌旁组织比较,P<0.05;#:与HOK细胞比较,P<0.01;△:与Control组比较,P<0.05
2.2 沉默miR-31-5p抑制SCC-25和CAL-27细胞增殖
克隆形成实验结果显示,与Control组比较,miR-NC组SCC-25和CAL-27克隆细胞数无明显变化(P>0.05),miR-31-5p inhibitor组SCC-25和CAL-27克隆细胞数显著减少(P<0.01),miR-31-5p mimic组SCC-25和CAL-27克隆细胞数显著增加(P<0.01)。蛋白印迹实验结果亦显示,与Control组比较,miR-NC组SCC-25和CAL-27细胞中Ki67和survivin蛋白水平无显著变化(P>0.05),miR-31-5p inhibitor组SCC-25和CAL-27细胞中Ki67和survivin蛋白水平显著降低(P<0.01),miR-31-5p mimic组SCC-25和CAL-27细胞中Ki67和survivin蛋白水平显著升高(P<0.01),见图2。以上结果表明,沉默miR-31-5p抑制SCC-25和CAL-27细胞增殖。

a、b:克隆形成实验检测CAL-27、SCC-25细胞克细胞数;c、d:克隆形成实验和蛋白印迹实验检测CAL-27、SCC-25细胞中增殖相关蛋白Ki67和survivin表达水平 *:与Control相比,P<0.01
2.3 沉默miR-31-5p抑制SCC-25和CAL-27细胞微管形成
与Control组比较,miR-NC组SCC-25和CAL-27细胞微管形成数无显著变化(P>0.05),miR-31-5p inhibitor组SCC-25和CAL-27细胞微管形成数显著减少(P<0.01),miR-31-5p mimic组SCC-25和CAL-27细胞微管形成数显著增加(P<0.01)。蛋白印迹实验结果亦显示,与Control组比较,miR-NC组SCC-25和CAL-27细胞中VEGF蛋白水平无显著变化(P>0.05),miR-31-5p inhibitor组SCC-25和CAL-27细胞中VEGF蛋白水平显著降低(P<0.01),miR-31-5p mimic组SCC-25和CAL-27细胞中VEGF蛋白水平显著升高(P<0.01),见图3。以上结果表明,沉默miR-31-5p抑制SCC-25和CAL-27细胞微管形成。
2.4 沉默miR-31-5p促进SCC-25和CAL-27细胞凋亡
流式细胞术检测结果显示,与Control组比较,miR-NC组SCC-25和CAL-27细胞凋亡率无显著变化(P>0.05),miR-31-5p inhibitor组SCC-25和CAL-27细胞凋亡率显著提高(P<0.01),miR-31-5p mimic组SCC-25和CAL-27细胞凋亡率显著下降(P<0.01)。蛋白印迹实验结果亦显示,与Control组比较,miR-NC组SCC-25和CAL-27细胞中Bcl-2/Bax比率和c-Myc水平无显著变化(P>0.05),miR-31-5p inhibitor组SCC-25和CAL-27细胞中Bcl-2/Bax比率和c-Myc水平显著下降,miR-31-5p mimic组SCC-25和CAL-27细胞中Bcl-2/Bax比率和c-Myc水平显著上升(P<0.01),见图4。以上结果表明,沉默miR-31-5p可促进SCC-25和CAL-27细胞凋亡。
2.5 沉默miR-31-5p促进SCC-25和CAL-27细胞线粒体损伤
与Control组比较,miR-NC组SCC-25和CAL-27细胞JC-1线粒体活性无变化(P>0.05),miR-31-5p inhibitor组SCC-25和CAL-27细胞中JC-1线粒体活性显著降低(P<0.01),miR-31-5p mimic组SCC-25和CAL-27细胞中JC-1线粒体活性显著升高(图5a、b,P<0.01)。与Control组比较,miR-NC组SCC-25和CAL-27细胞中SOD活性和MDA含量无显著变化(P>0.05),miR-31-5p inhibitor组SCC-25和CAL-27细胞中SOD活性显著降低而MDA含量显著上升(P<0.01);miR-31-5p mimic组SCC-25和CAL-27细胞中SOD活性显著上升而MDA含量显著降低(图5c、d,P<0.01)。以上结果表明,沉默miR-31-5p促进SCC-25和CAL-27细胞线粒体损伤。

a、b:微管形成实验检测CAL-27、SCC-25细胞微管形成;c、d:蛋白印迹实验检测CAL-27、SCC-25细胞中VEGF蛋白水平 *:与Control组比较,P<0.01
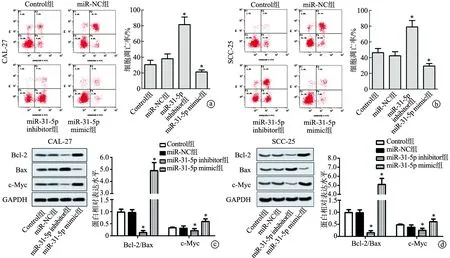
a、b:流式细胞术检测CAL-27、SCC-25细胞凋亡;c:蛋白印迹实验检测CAL-2、SCC-25细胞中Bax、Bcl-2和c-Myc蛋白水平 *:与Control组相比,P<0.01
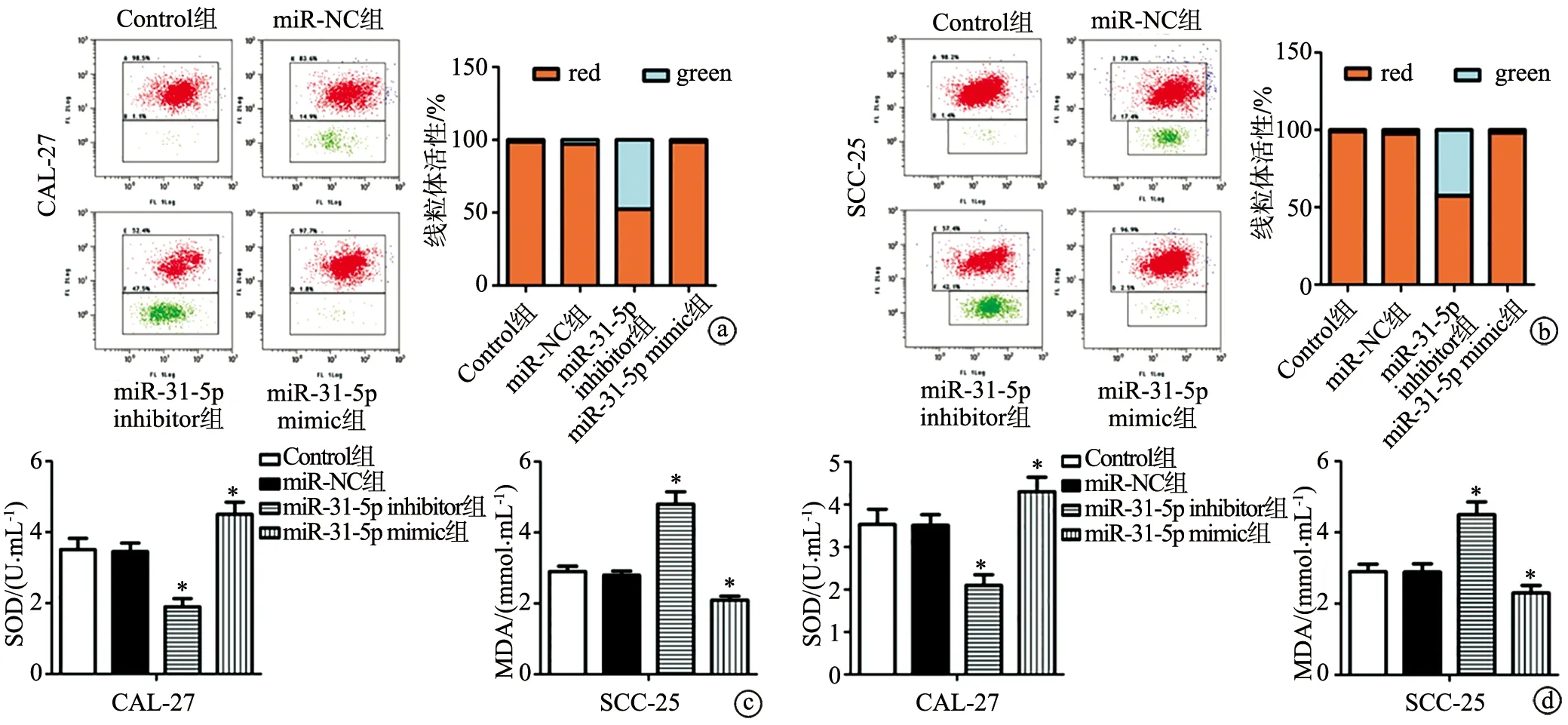
a、b:JC-1染色检测CAL-27、SCC-25细胞线粒体活性;c、d:CAL-27、SCC-25细胞中SOD活性和MDA含量 *:与Control组比较,P<0.01
3 讨论
OSCC由于复发率高且缺乏有效的早期治疗策略,其治疗仍然是临床面临的难题[10]。OSCC的发病机制与口腔鳞状细胞的无限制生长和增殖密切相关[11-12]。近年来,随着生物医学的发展,分子生物学标志物的针对性治疗成为了医学研究的热点。miRNA是用于癌症的分子诊断和靶向治疗的靶标[13]。miRNA具有调节细胞增殖、分化、转移、侵袭和凋亡等多种生物学功能,其表达情况与人类多种癌症的发生、发展、诊断和预后相关。研究发现,miRNA-137 mimic可显著降低OSCC HSC-2的细胞活力、侵袭和增殖能力[14];环状miRNA-1290可作为晚期OSCC患者放化疗及预后判断的潜在生物标志物[15];miR-31-5p是口腔癌的潜在生物标志物[7]。研究表明,miR-31-5p在结直肠癌中高表达[16]。为了研究miR-31-5p在OSCC中的表达情况,本研究检测了癌旁组织和癌组织、正常细胞和癌细胞中miR-31-5p表达水平,结果发现,miR-31-5p在OSCC细胞和组织中均高表达。
正常情况下,在复杂的生物体内,各种细胞通过动态增殖和凋亡以使细胞数目达到平衡,但是在癌症机体内,细胞的过度增殖和异常凋亡破坏了这种平衡[17]。因此,调控肿瘤细胞增殖和凋亡平衡对于癌症治疗至关重要。研究显示,miR-31-5p通过PI3K/AKT/Bcl-2信号通路调控14-3-3ɛ抑制前列腺癌22RV1细胞存活和增殖[18]。过表达miR-31-5p可抑制肾上皮肾细胞癌细胞增殖、迁移、侵袭和细胞周期,而下调miR-31-5p可促进细胞增殖、迁移和侵袭[19]。为了探讨沉默miR-31-5p对OSCC中SCC-25和CAL-27细胞增殖和凋亡的影响,本研究运用克隆细胞形成实验和流式细胞术检测细胞的凋亡水平,结果显示,沉默miR-31-5p可显著抑制SCC-25和CAL-27细胞克隆形成和微管形成,并诱导SCC-25和CAL-27细胞凋亡,表明沉默miR-31-5p可显著诱导SCC-25和CAL-27细胞凋亡,并抑制SCC-25和CAL-27细胞增殖。Ki67也称为Ki67抗原,已经成为预测多种类型癌症患者临床预后的成熟标记物,同时也是癌细胞增殖的标记物[20]。survivin是OSCC的有效诊断和预后标志物,同时也是OSCC细胞增殖的标记物[21]。本研究蛋白印迹实验结果显示,沉默miR-31-5p可降低Ki67和survivin的表达,说明沉默miR-31-5p可抑制SCC-25和CAL-27细胞增殖。
线粒体是细胞中最重要的动态细胞器之一,参与运输、融合和裂变等多种活动,并在氧化磷酸化和能量代谢中起关键作用。线粒体活性障碍被认为是全身异质性、表型异常和遗传变异的主要原因[22-23]。线粒体膜电位变化可用于评估线粒体活性变化和细胞早期凋亡现象[24]。有研究发现,Neferine通过诱导线粒体功能障碍对视网膜母细胞瘤发挥抑制增殖和侵袭的作用[25]。JC-1是一种特殊的线粒体染料,通常被用作膜电位的报告分子。JC-1在与线粒体结合后可显示荧光变化,该变化是驱动染料聚集的膜电位的函数。通常将2种荧光强度的比率测量值作为相对膜电位的测量值。2种染料均非常适合实时成像,并根据实验程序报告膜电位的变化,可进一步反映线粒体功能的状态[26]。为了探究沉默miR-31-5p对SCC-25和CAL-27细胞线粒体损伤的影响,本研究运用ELISA检测SOD活性、MDA含量和JC-1染色检测细胞线粒体功能障碍,结果显示,沉默miR-31-5p可显著增强线粒体膜电位变化,增强JC-1线粒体活性,提示沉默miR-31-5p可导致线粒体活性破坏并诱导SCC-25和CAL-27细胞凋亡;流式细胞术检测结果表明,沉默miR-31-5p可诱导细胞凋亡率上升。Bcl-2/Bax比率可作为预测OSCC预后的有效指标[27]。c-Myc诱导的长链非编码RNA SNHG16的上调促进了OSCC的进展和癌变[28]。本研究蛋白印迹实验结果表明,沉默miR-31-5p可降低Bcl-2/Bax比率和c-Myc水平,表明沉默miR-31-5p可促进SCC-25和CAL-27细胞凋亡。
综上所述,沉默miR-31-5p可显著抑制SCC-25和CAL-27细胞增殖并诱导其凋亡,并且可破坏线粒体活性。因此,我们推测,沉默miR-31-5p通过破坏线粒体活性抑制OSCC增殖并诱导其凋亡。但本实验仅为体外细胞实验,结果具有局限性,有待通过动物体内实验进一步验证。
——水芹主要害虫识别与为害症状

