基于高通量测序技术研究靛玉红对溃疡性结肠炎小鼠肠道菌群的影响
梁艳妮,程 雯,吴柯楠,于金高,张东博,张 珍,王 征
• 药理与临床 •
基于高通量测序技术研究靛玉红对溃疡性结肠炎小鼠肠道菌群的影响
梁艳妮,程 雯,吴柯楠,于金高,张东博,张 珍,王 征*
陕西中医药大学 陕西中药资源产业化省部共建协同创新中心,秦药特色资源研究开发国家重点实验室(培育),陕西省创新药物研究中心,陕西 咸阳 712083
研究靛玉红对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的溃疡性结肠炎(ulcerative colitis,UC)模型小鼠肠道菌群的影响及其作用机制。雄性昆明种小鼠随机分为对照组、模型组、柳氮磺胺吡啶(125 mg/kg)组和靛玉红低、中、高剂量(7.5、15.0、30.0 mg/kg)组,采用3% DSS自由饮用7 d诱导小鼠UC模型,第8天ig药物,连续干预7 d后,观察小鼠体征进行疾病活动指数(disease activity index,DAI)评分;采用苏木素-伊红(HE)染色观察小鼠结肠组织病理变化;采用ELISA法检测小鼠血清中白细胞介素-6(interleukin-6,IL-6)、IL-8、IL-10、IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;各组收集5份小鼠肠道内容物样本,采用细菌16S rRNA基因V4~V5区高通量测序,分析小鼠肠道内容物的菌群变化。与模型组比较,靛玉红组小鼠DAI评分显著降低(<0.05),结肠组织损伤减轻,炎性细胞浸润减少,血清中促炎细胞因子IL-6、IL-8、IL-1β和TNF-α水平显著降低(<0.05),抗炎细胞因子IL-10水平呈升高趋势。16S rRNA基因测序结果显示,模型组小鼠肠道菌群多样性降低,靛玉红组小鼠肠道菌群多样性升高,在门水平主要表现为拟杆菌门与厚壁菌门比例回升,属水平7个菌属Lachnospiraceae_FCS020_group、_9、_brachy_group、别样棒菌属、链球菌属、Erysipelotrichaceae_ UCG_003和可能与靛玉红对UC的治疗作用相关。靛玉红能够通过调节UC小鼠肠道菌群、抑制肠道炎性反应,从而治疗UC。
靛玉红;溃疡性结肠炎;16S rRNA基因测序;肠道菌群;多样性分析
溃疡性结肠炎(ulcerative colitis,UC)是一种累及直肠、结肠黏膜和黏膜下层的慢性非特异性结肠炎性反应,以腹痛、腹泻、黏液脓血便、里急后重为主要临床表现,是结直肠癌的高相关性疾病[1]。随着人们生活方式的改变,我国UC患者比例不断升高[2-4]。UC的发病机制普遍认为与免疫异常、遗传易感、环境因素、肠道菌群失衡等相关[5],临床治疗药物主要有氨基水杨酸类、糖皮质激素、免疫抑制剂等,长期服用易出现严重的不良反应[6]。中医认为UC病理因素主要为湿热、瘀热、热毒、痰浊、气滞、血瘀等,清热燥湿为其主要治法[7]。青黛为爵床科植物马蓝(Nees) Bremek.、蓼科植物蓼蓝Ait.或十字花科植物松蓝Fort.的叶或茎叶经加工制得的干燥粉末、团块或颗粒,具有清热解毒、凉血消斑、泻火定惊的功效,符合中医治疗UC“清热利湿、凉血止血”的用药策略,临床常使用含青黛的方剂如青黛散、复方青黛颗粒、清肠温中方、锡类散、溃结方等治疗UC[8-10]。靛玉红为天然双吲哚类化合物,是青黛中的主要成分之一,也是大青叶、板蓝根中的有效成分,临床用于治疗慢性粒细胞白血病、炎性疾病和肿瘤等[11-12]。研究发现,靛玉红能够干预UC的发生和发展[13-15]。
肠道菌群在人体健康中发挥着关键作用,肠道菌群与宿主互利共生,参与重要的代谢、免疫和肠道保护作用。正常菌群的种类、数量和比例异常时,免疫系统失衡、代谢紊乱,导致肠道黏膜损伤。肠道菌群紊乱可能是UC发生和迁延难愈的主要原因之一[16-18],因此微生态制剂调节肠道菌群已成为临床治疗炎症性肠病(inflammatory bowel disease,IBD)的常用手段。本课题组前期研究结果表明,青黛可以调节葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的UC小鼠肠道菌群失衡,可能与厌氧的革兰阳性菌曲霉菌属、消化球菌属密切相关[19]。本研究采用高通量测序技术对小鼠肠道菌群进行16S RNA基因测序,对菌群结构和多样性变化进行深入分析,探究靛玉红对DSS诱导UC小鼠肠道菌群的影响。
1 材料
1.1 动物
SPF级雄性昆明种小鼠60只,6~8周龄,体质量(20±2)g,购自成都达硕实验动物有限公司,动物许可证号SCXK(川)2015-030。动物饲养于陕西中药资源产业化省部共建协同创新中心SPF级实验动物中心,室内保持12 h明暗交替。动物实验遵循陕西中医药大学实验动物管理和使用的规定,符合3R原则。
1.2 药品与试剂
靛玉红(批号18121203,质量分数为98%)购自成都普菲德生物科技有限公司;DSS(批号S3045)购自美国MP Biomedicals公司;柳氮磺胺吡啶(批号22200301)购自上海福达制药有限公司;小鼠白细胞介素-6(interleukin-6,IL-6)、IL-8、IL-10 ELISA试剂盒(批号分别为M190322-004a、M190322-104a、M190322-003a)购自欣博盛生物科技有限公司;IL-1β、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号分别为201908、201908)购自南京森贝伽生物科技有限公司;Stool DNA Kit试剂盒(批号00D4015040000L10T002)购自美国Omega公司;FastPure Gel DNA Extraction Mini Kit(批号7E470L0)、VAHTS Universal DNA Library Prep Kit for Illumina V3(批号7E401J0)购自南京诺唯赞生物科技股份有限公司;Prime Star GXL DNA Polymerase(批号AJ62481A)购自日本Takara公司;Agencourt AMPure XP(批号17900700)购自美国Beckman Coulter公司。
1.3 仪器
5424R型高速台式冷冻离心机(德国Eppendorf公司);超低温冰箱、NanoDrop 2000超微量分光光度计(美国Thermo Fisher Scientific公司);DYY-6C型电泳仪(北京市六一仪器厂);GeneAmp 9700型PCR扩增仪(美国ABI公司);高通量测序仪(美国Illumina公司)。
2 方法
2.1 造模、分组与给药
雄性小鼠适应性饲养3 d后随机分成对照组、模型组、柳氮磺胺吡啶(125 mg/kg)组和靛玉红低、中、高剂量(7.5、15.0、30.0 mg/kg)[15]组,每组10只。对照组饮用纯净水,其余各组自由饮用3% DSS 7 d诱导UC模型。柳氮磺胺吡啶肠溶片研磨后,溶于超纯水配制成质量浓度为6.25 mg/mL的混悬液;靛玉红溶于超纯水分别配制成质量浓度为0.375、0.750、1.500 mg/mL的溶液。造模后第8天,各给药组ig相应药物(20 mL/kg),对照组和模型组ig等体积纯净水,1次/d,连续7 d。自造模第1天起记录小鼠体质量、大便性状、便血特征,进行疾病活动指数(disease activity index,DAI)评分,评分标准见表1。
DAI=(体质量下降评分+大便性状评分+大便隐血情况评分)/3

表1 DAI评分标准
2.2 靛玉红对UC小鼠血清中IL-6、IL-8、IL-10、IL-1β和TNF-α水平的影响
末次给药后,小鼠禁食不禁水12 h,吸入乙醚麻醉,摘眼球取血,3000 r/min离心10 min,吸取血清,按试剂盒说明书检测血清中IL-6、IL-8、IL-10、IL-1β和TNF-α水平。
2.3 靛玉红对UC小鼠结肠组织病理变化的影响
小鼠脱颈椎处死,无菌条件下解剖,距离肛门5 cm处取结肠段1 cm,于4%多聚甲醛溶液中固定,常规包埋、切片后进行苏木素-伊红(HE)染色,于显微镜下观察结肠组织病理变化。
2.4 肠道菌群测序
各组小鼠收集5份肠道内容物,采用Stool DNA Kit试剂盒抽提总DNA,利用1%琼脂糖凝胶电泳和超微量分光光度计检测DNA提取质量,以16S rRNA基因V4~5可变区进行PCR扩增,引物序列:上游引物5’-GTGCCAGCMGCCGCGGTA-3’、下游引物5’-CCCCGYCAATTCMTTTRAG-3’。使用FastPure DNA凝胶回收试剂盒切胶回收PCR产物,利用FastPure Gel DNA Extraction Mini Kit纯化后采用QuantiFluorTM-ST定量,根据每个样本测序量要求进行相应比例混合;根据VAHTS Universal DNA Library Prep Kit for Illumina V3试剂盒进行文库构建,采用Illumina MiSeq平台测序得到Pair-End(PE)双端序列,扩增子建库后使用Trimmomatic v0.36和Pear v0.9.6软件对原始数据质控;利用FLASH v1.2.0和Pear v0.9.6软件进行拼接,利用UCHIME方法去除序列中的嵌合体,采用QIIME v1.8.0软件中UPARSE聚类法按97%相似度进行操作分类单元(operational taxonomic unit,OTU)聚类。
2.5 生物信息学分析
将OTU代表序列对比16S rRNA数据库,采用RDP分类算法进行物种比对注释,置信度阈值为0.7,获得OTU代表序列的分类学信息,并在各分类水平上分析样本群落组成。基于OTU聚类结果采用mothur软件进行α多样性分析和主坐标分析(principal co-ordinates analysis,PCoA)。根据线性判别分析(liner discriminant analysis,LDA)进行LEfSe多级物种差异判别分析,找出组间在丰度上有显著差异的物种。
2.6 宏基因组预测与分析
PICRUSt软件可以基于16S rRNA基因测序得到的OTUs预测群落的基因类型与数量,结合京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)、直系同源蛋白簇(clusters of orthologous groups of proteins,COG)和Pfam数据库进行注释作功能分析。采用PICRUSt软件将对照组、模型组和靛玉红高剂量组样品测序的OTU映射到GreenGene数据库,进行菌群功能和代谢途径预测分析。
2.7 统计学分析
3 结果
3.1 靛玉红对UC小鼠DAI评分的影响
对照组小鼠活动敏捷、摄食正常、体质量正常增加、无便血、腹泻情况;如图1所示,其余各组小鼠造模后逐渐出现懒动、翻毛、扎堆、体质量下降、排稀便甚至便血、死亡,造模7 d后小鼠DAI评分上升到3分,提示UC模型制备成功。各给药组小鼠精神状态、体质量减轻、腹泻便血等均有不同程度地改善,DAI评分显著降低(<0.05),表明靛玉红对UC具有治疗作用。
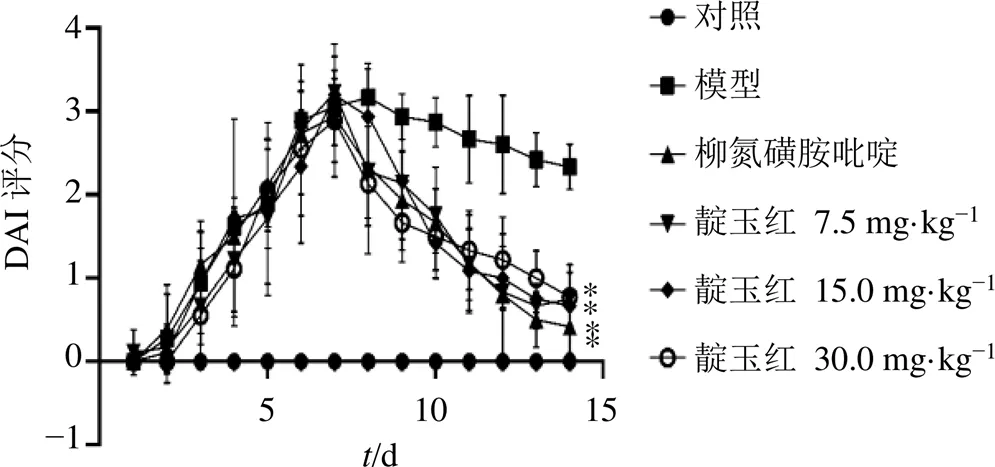
与模型组比较:*P<0.05
3.2 靛玉红对UC小鼠血清中IL-6、IL-8、IL-10、IL-1β和TNF-α水平的影响
如图2所示,与对照组比较,模型组小鼠血清中促炎因子IL-6、IL-8、IL-1β和TNF-α水平均显著升高(<0.05),抗炎因子IL-10水平显著降低(<0.05);与模型组比较,各给药组小鼠血清中IL-8和IL-1β水平显著降低(<0.05),柳氮磺胺吡啶组和靛玉红中、高剂量组小鼠血清中IL-6水平显著降低(<0.05),柳氮磺胺吡啶组和靛玉红低、中剂量组小鼠血清中TNF-α水平显著降低(<0.05),表明靛玉红能够调节UC小鼠体内促炎因子和抑炎因子的平衡。
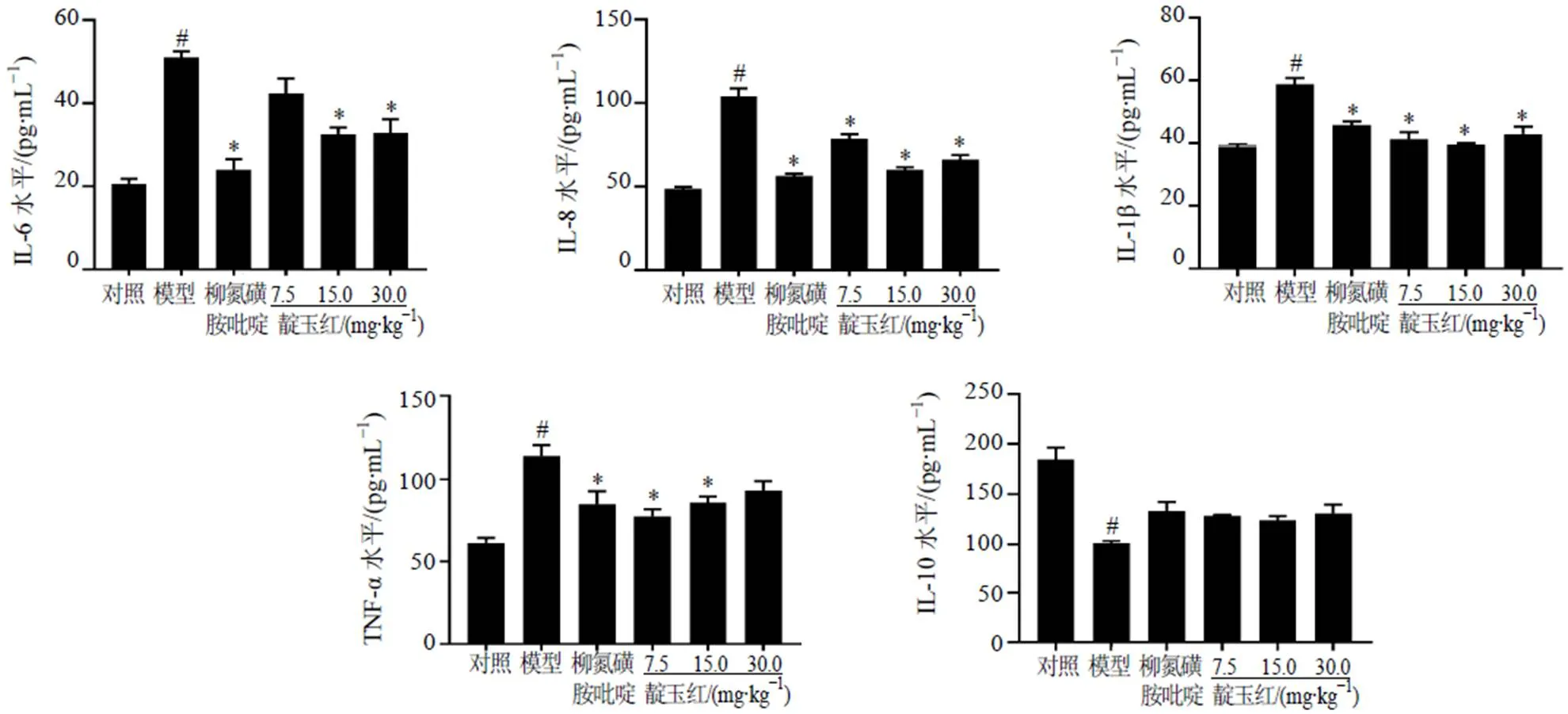
与对照组比较:#P<0.05;与模型组比较:*P<0.05
3.3 靛玉红对UC小鼠结肠组织病理变化的影响
如图3所示,结肠肠壁由内至外依次为黏膜层、黏膜肌层、黏膜下层、肌层和浆膜层。对照组结肠组织结构完整,可见明显的隐窝和大量杯状细胞,隐窝边缘规则,无炎性细胞异常浸润。模型组结肠黏膜层可见隐窝萎缩和上移,隐窝边缘不规则,杯状细胞大量减少,中性粒细胞浸入黏膜层和隐窝。柳氮磺胺吡啶组结肠结构完整,虽然仍有少量炎性细胞浸润,但隐窝和杯状细胞已大量可见。靛玉红组出现大量杯状细胞,隐窝结构有所恢复,炎性细胞减少。表明靛玉红能够缓解DSS诱导的UC小鼠结肠组织损伤。
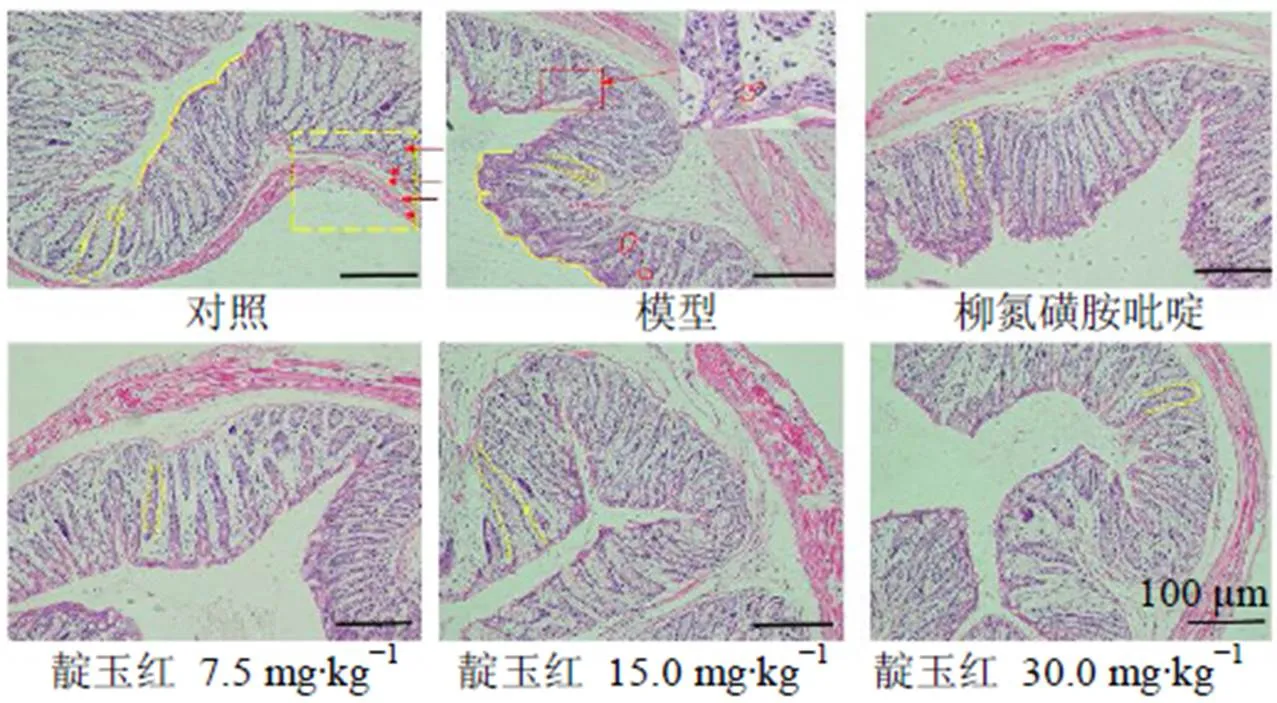
U型虚线表示隐窝;圆形虚线表示杯状细胞;矩形实线表示中性粒细胞浸润
3.4 靛玉红对UC小鼠肠道菌群的影响
3.4.1 肠道菌群的物种注释 如图4-A所示,经Illumina高通量测序共得到1396个OTUs,样本间共有OTUs 267个。Venn图可以直观表现样本的OTU数目及各组重叠情况,如图4-B所示,1056个OTUs为3组间共有,占比为75.6%,对照组和模型组共有1211个OTUs,模型组和靛玉红高剂量组共有1145个OTUs,经鉴定分别属于15个门和208个属。
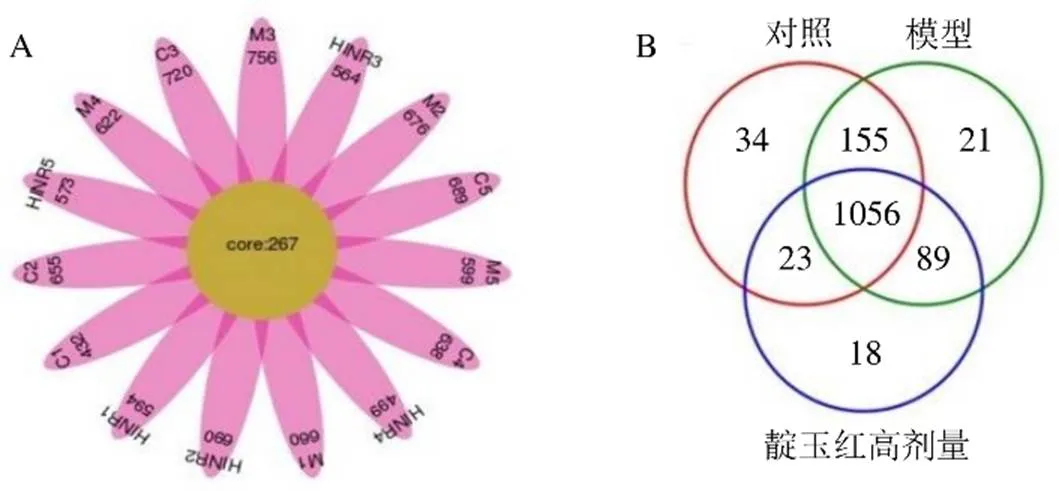
C-对照组 M-模型组 HINR-靛玉红高剂量组
如图5-A所示,在门水平上,各组样品主要包括拟杆菌门、厚壁菌门、变形菌门、放线菌门、蓝藻菌门、软壁菌门、脱铁杆菌门等,其中拟杆菌门和厚壁菌门的相对丰度占95%以上,变形菌门次之。经Wilcoxon分析,模型组厚壁菌门相对丰度显著上调,拟杆菌门相对丰度显著下调;与模型组比较,靛玉红高剂量组厚壁菌门相对丰度降低,拟杆菌门相对丰度升高,但无显著差异。
如图5-B所示,在属水平上,各组样品相对丰度较高的菌属分别为Prevotellaceae_UCG-001、乳酸杆菌属、另枝菌属、别样棒菌属、Prevotellaceae_UCG-003、拟杆菌属、Lachnospiraceae_NK4A136_ group、Ruminococcaceae_UCG-014、Rikenellaceae_ RC9_gut_group、、拟普雷沃氏菌属、_1。与对照组比较,模型组Prevotellaceae_UCG-001相对丰度降低,别样棒菌属、乳酸杆菌属、拟杆菌属、拟普雷沃氏菌属、_1、等相对丰度升高;与模型组比较,靛玉红高剂量组PrevotellaceaeUCG-001、_1、别样棒菌属和等相对丰度回调,表明普雷沃氏菌属、瘤胃球菌属、别样棒菌属和等与靛玉红对UC的治疗作用相关。
3.4.2 α多样性分析 Rank-abundance曲线可以分析物种丰度和物种均匀度,水平方向曲线的宽度反映物种丰度,曲线在横轴上范围越大则物种的丰度越高;曲线平滑程度反映物种均度,曲线越平缓则物种分布越均匀。Specaccum物种累积曲线描述随着样本量增大物种增加的情况,反映了持续抽样下新物种出现的速率,可用于判断样本量是否充分并估计物种丰富度。如图6-A、B所示,随着测序深度和样本量的增加,绝大多数微生物都能被测序,且物种丰富度不再随样本量增加而增加,表明本研究中测序深度和样本量能够满足分析需求。α多样性指数可以反映微生物群落的丰度和多样性,经过最低序列数的样本数抽平分析,得到反映群落丰富度的指数observed_species和反映群落多样性的指数Shannon。如图6-C、D所示,模型组和靛玉红高剂量组对肠道菌群物种数量无显著影响,但是能够调节不同菌群丰度的消长,使菌群物种多样性水平产生变化;模型组Shannon指数降低,靛玉红高剂量组Shannon指数升高,表明靛玉红能够改善肠道菌群结构,优化其物种多样性指数。
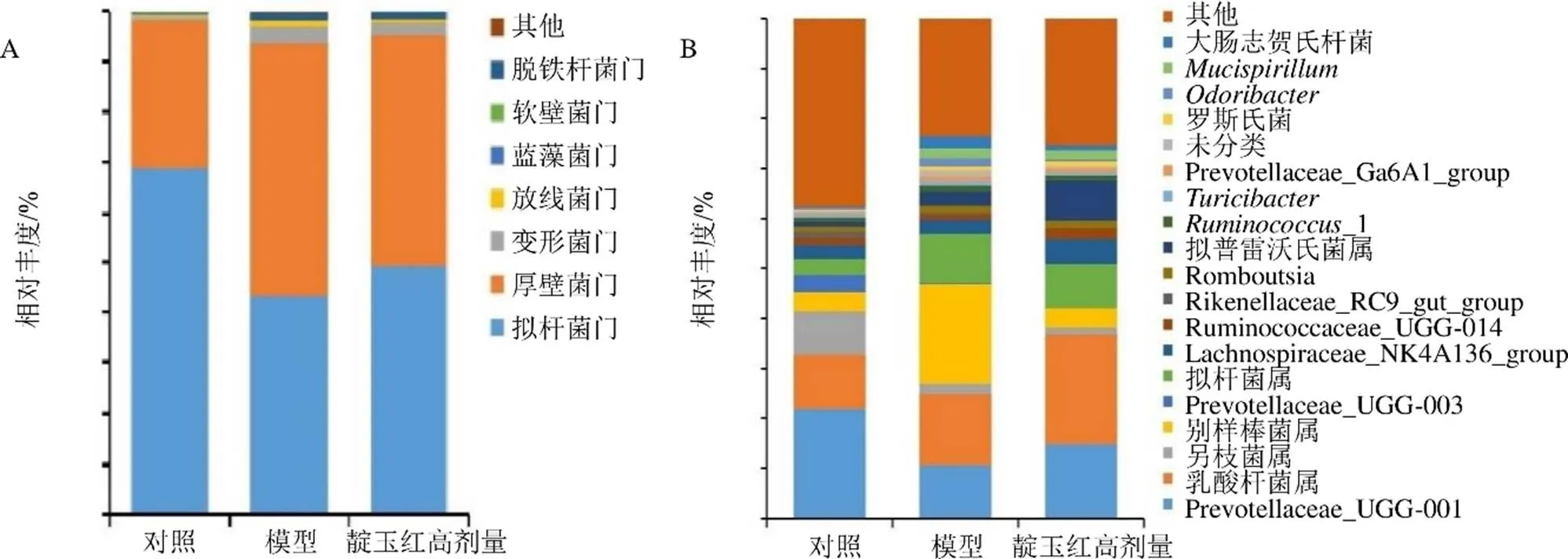
图5 门水平(A) 和属水平(B) 的样本物种组成分析
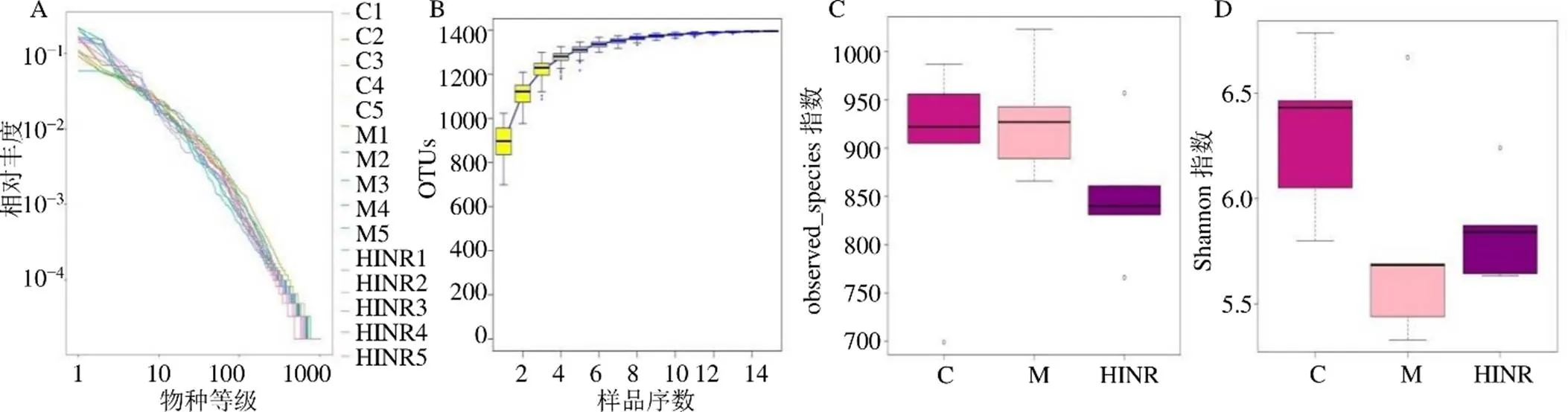
C-对照组 M-模型组 HINR-靛玉红高剂量组
3.4.3 β多样性分析 β多样性分析利用各样本序列间的进化关系及丰度信息计算样本间距离,反映样本间是否具有显著的微生物群落差异。PCoA分析通过对一系列的特征值和特征向量进行排序,选择排在前几位的最主要特征值表现在坐标系里,没有改变样本点之间的相互位置而只改变坐标系统。基于bray-curtis的PCoA二维图见图7,对照组、模型组和靛玉红高剂量组样品的菌群结构具有明显差异,模型组和靛玉红高剂量组较为接近,对照组相对差距较远;模型组和靛玉红高剂量组菌群轮廓一定程度上分开,表明UC小鼠肠道菌群结构发生变化,靛玉红能够恢复肠道菌群结构从而治疗UC。
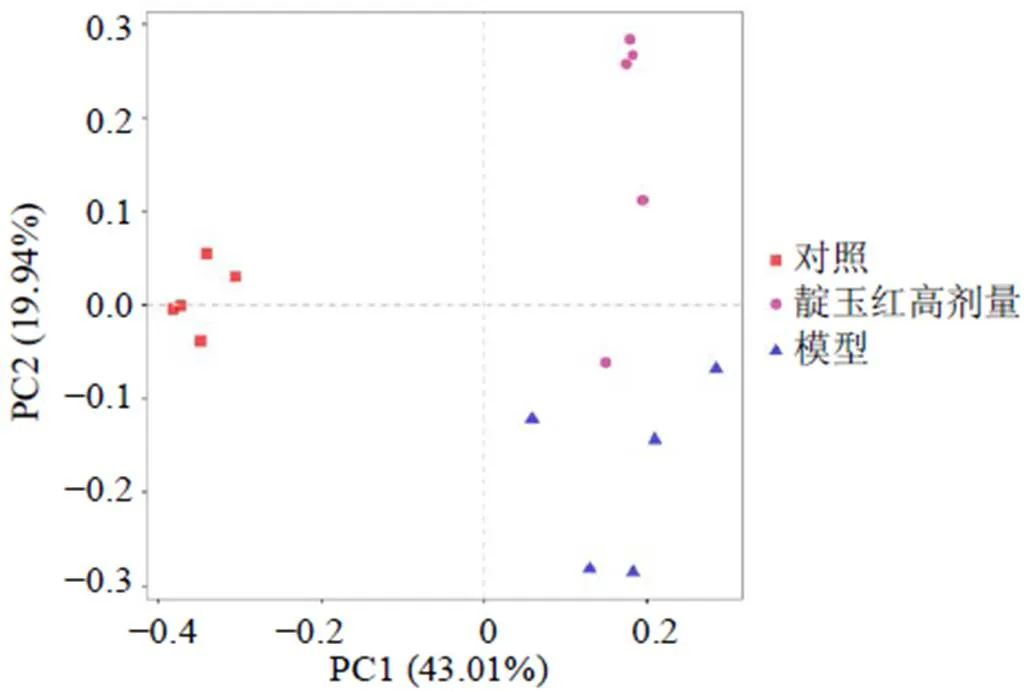
图7 基于bray-curtis的PCoA分析
3.4.4 LEfSe分析 LEfSe分析可以实现多组间比较,找到组间在丰度上有显著差异的物种。如图8所示,与对照组比较,模型组别样棒菌属、拟杆菌属、大肠志贺氏杆菌,拟普雷沃菌属、考拉杆菌属等17种菌属相对丰度显著上调,Prevotellaceae_UCG_001、别样杆菌属、Rikenellaceae_RC9_gut_group、_coprostanoligenes_group、副拟杆菌属等22种菌属相对丰度显著下调;与模型组比较,靛玉红高剂量组拟普雷沃菌属Family_XIII_UCG_001、、Lachnospiraceae_ FCS020_group、_brachy_group、_9、_5、、螺杆菌属、_group、厌氧棍状菌属11种菌属相对丰度显著上调,别样棒菌属、Prevotellaceae_NK3B31_group、Prevotellaceae_ UCG_003、、_fissicatena_ group、_coprostanoligenes_group、链球菌属、和Erysipelotrichaceae_ UCG_003 9种菌属相对丰度显著下调;其中靛玉红能够显著上调模型组中下调的、Lachnospiraceae_FCS020_group、_9、_brachy_group[16]等菌属,显著下调模型组中上调的别样棒菌属、链球菌属、Erysipelotrichaceae_UCG_003等菌属,表明靛玉红对UC的治疗作用与这些菌属相对丰度的回调有关。
3.4.5 PICRUSt基因预测分析 如图9所示,与对照组比较,模型组转运蛋白、ABC转运蛋白、转录因子、细菌趋药性、孢子形成等功能上调,核糖体、DNA修复和重组蛋白质、嘧啶代谢、蛋白酶、DNA复制蛋白、能量代谢、嘌呤代谢、氧化磷酸化以及丙氨酸、天冬氨酸和谷氨酸代谢等功能下调;与模型组比较,靛玉红高剂量组脂类代谢、细胞骨架蛋白、氯烷烃和氯烯烃的降解、脂质代谢功能上调,氮代谢、叶酸生物合成、β-丙氨酸代谢、癌症通路以及二苯乙烯、二庚烷和姜辣素的生物合成等功能下调。
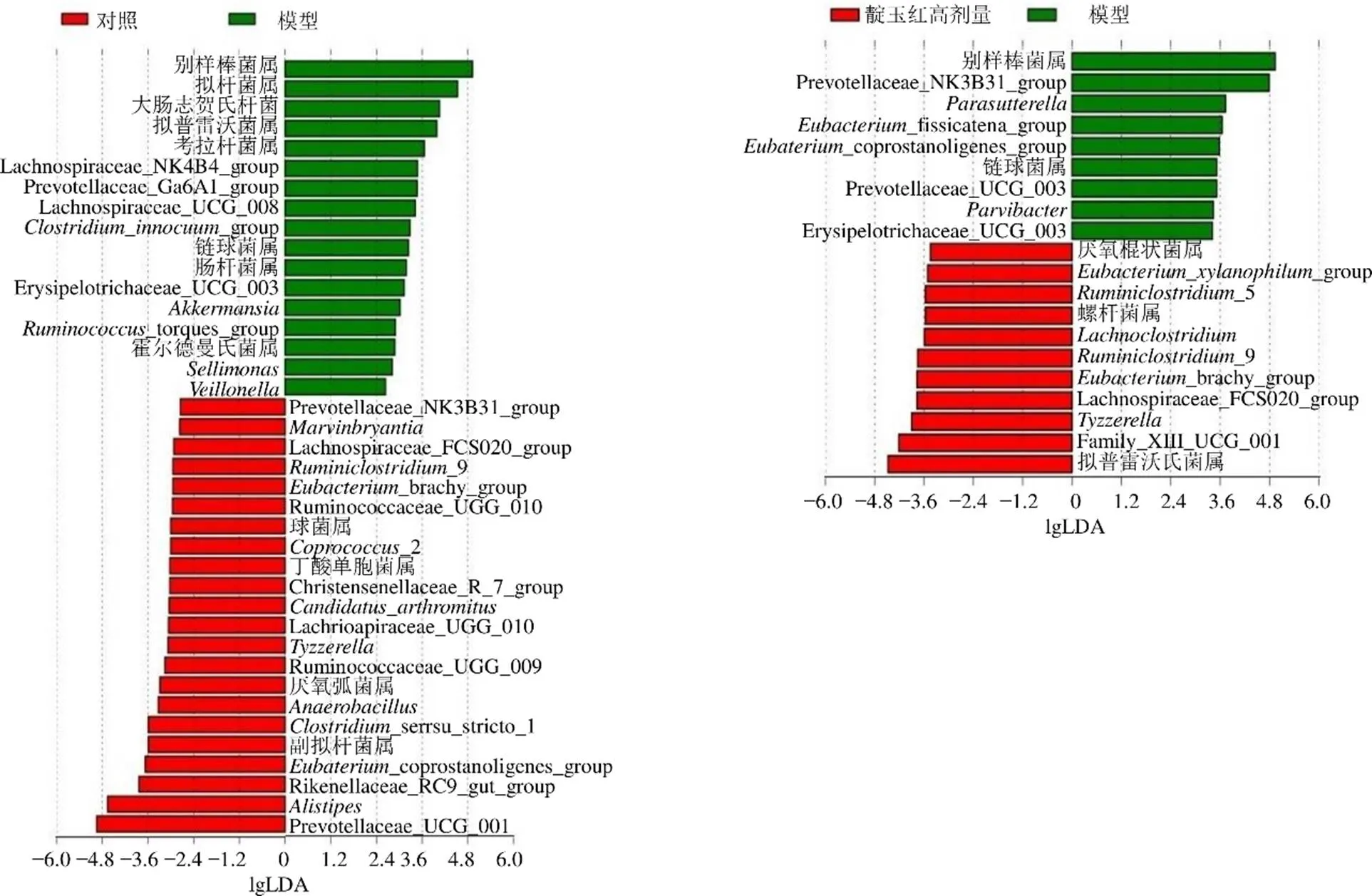
图8 各组样品肠道菌群的LEfSe分析
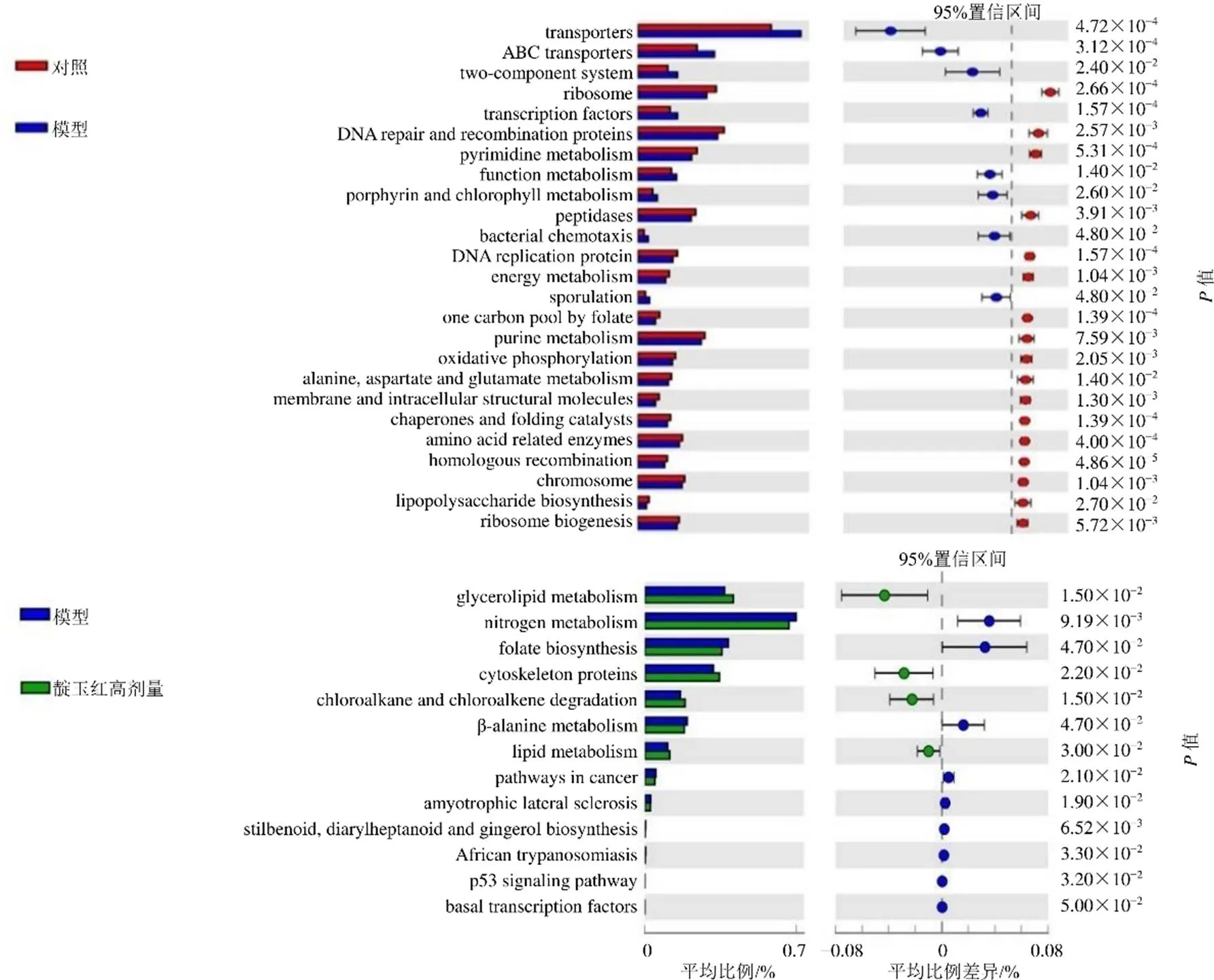
图9 PICRUSt功能预测分析
4 讨论
肠道微生态与消化系统疾病[16,20]、心脑血管疾病、呼吸系统疾病、代谢综合征[21]、肿瘤[22]等关系密切,肠道菌群在维持肠道稳态及宿主免疫系统的发育和激活中起重要作用。IBD患者体内肠道菌群严重失调,菌群多样性及丰度下降,出现不稳定的菌群,肠道共生菌减少,双歧杆菌、乳杆菌等益生菌显著减少,肠道致病菌及条件致病菌数量增加,导致肠黏膜损伤[21]。IBD不同发病时期肠黏膜菌群结构存在差异[23]。活动期UC患者肠道中的有益菌如乳酸杆菌、双歧杆菌、真杆菌、消化球菌等菌群数量明显少于缓解期和健康者,致病菌如大肠杆菌、肠球菌和小梭菌菌群数量显著高于缓解期和健康者;缓解期UC患者肠道拟杆菌群数量明显低于健康者[24]。肠道菌群可以促进免疫系统的成熟,肠道菌群产生的信号分子参与调控肠道上皮细胞的凋亡、增殖和分化,肠道菌群失衡导致IBD患者T细胞分化异常。目前较多研究使用益生菌、益生元、粪菌移植等恢复肠道微生物稳态,治疗炎性肠病[5]。中医根据UC泄泻、腹痛的病因病机,以运脾化湿、通利气机为治疗原则,临床上常用健脾渗湿、清热燥湿、活血化瘀等中药复方或有效组分,通过增强有益菌且减弱致病菌及条件致病菌扶正祛邪,调节宿主肠道菌群平衡及免疫反应,从而治疗UC[25-26]。
青黛咸寒,具有清热解毒、清肠胃邪热的功效。《本经逢原》中记载“青黛,泻肝胆,散郁火,治温毒发斑及产后热痢下重”。靛玉红能够通过下调UC大鼠结肠组织转化生长因子-β1(transforming growth factor-β1,TGF-β1)、髓过氧化物酶(myeloperoxidase,MPO)表达水平,上调碱性成纤维细胞生长因子(basic fibroblast growth factor,)、肠三叶因子(intestinal trefoil factor,)mRNA表达水平,激活丝裂原活化蛋白激酶(mitogen-activated extracellular signal-regulated kinase,MEK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路、磷脂酰肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路,进而抑制肠道细胞凋亡和肠道炎性反应,促进肠黏膜修复[15]。靛玉红能够降低DSS诱导的UC小鼠血清中促炎因子水平,升高抗炎因子水平,上调CD4+T细胞叉状头样转录因子P3(Forkhead box P3,Foxp3)表达,抑制氧化应激反应和肠上皮细胞凋亡[14];靛玉红能够抑制UC小鼠核因子-κB(nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的活化。本课题组前期研究表明,青黛和色胺酮对DSS诱导的UC小鼠肠道微生态具有调节作用,青黛对UC治疗作用可能与曲霉菌属和消化球菌属密切相关,色胺酮对UC的治疗作用可能与Erysipelotrichaceae_UCG_003、Rikenellaceae_ RC9_gut_group和密切相关[19]。本研究从DAI评分、结肠组织形态及血清中细胞因子水平证实靛玉红对UC小鼠具有治疗作用,能够调节失衡的炎性因子水平;并通过16S RNA基因测序探究了靛玉红对UC小鼠肠道菌群的影响,发现靛玉红能够恢复UC小鼠厚壁菌门与拟杆菌门比例,调节不同菌群相对丰度,加快肠道菌群结构向正常水平恢复,Lachnospiraceae_FCS020_group、_9、_brachy_group、别样棒菌属、链球菌属、Erysipelotrichaceae_UCG_003和可能与靛玉红对UC的治疗作用密切相关。
肠道菌群失调介导的免疫损伤是IBD的重要发病机制,但肠道微生态与IBD的关系尚未完全明确。本研究从肠道微生物角度探讨靛玉红对UC小鼠肠道菌群结构的影响,发现靛玉红对UC小鼠肠道菌群结构与多样性的调节作用与其对UC的治疗作用具有相关性。后续将进一步结合宏基因组测序、蛋白质组学、代谢组学等技术从肠道菌群角度深入研究靛玉红治疗UC的作用机制。
利益冲突 所有作者均声明不存在利益冲突
[1] Ungaro R, Mehandru S, Allen P B,. Ulcerative colitis [J]., 2017, 389(10080): 1756-1770.
[2] Prideaux L, Kamm M A, de Cruz P P,. Inflammatory bowel disease in Asia: A systematic review [J]., 2012, 27(8): 1266-1280.
[3] 刘笃佳, 王媛媛, 马旭. 溃疡性结肠炎的流行病学研究进展 [J]. 中国烧伤创疡杂志, 2017, 29(3): 214-217.
[4] 吕兰婷, 王丽娟. 中国溃疡性结肠炎干预的卫生经济学评价研究进展 [J]. 中国药物经济学, 2019, 14(1): 114-121.
[5] 周林妍, 李岩. 炎症性肠病与肠道微生态的研究进展 [J]. 微生物学通报, 2020, 47(5): 1600-1606.
[6] 孙中美, 胡立明, 毛堂友, 等. 溃疡性结肠炎中西医治疗进展 [J]. 辽宁中医药大学学报, 2018, 20(11): 171-175.
[7] 张声生, 沈洪, 郑凯, 等. 溃疡性结肠炎中医诊疗专家共识意见(2017)[J]. 中华中医药杂志, 2017, 32(8): 3585-3589.
[8] 姜慧, 李军祥, 胡立明, 等. 青黛及其复方治疗溃疡性结肠炎的研究进展 [J]. 中国中医急症, 2019, 28(4): 740-742.
[9] Naganuma M, Sugimoto S, Mitsuyama K,. Efficacy of indigo naturalis in a multicenter randomized controlled trial of patients with ulcerative colitis [J]., 2018, 154(4): 935-947.
[10] Naganuma M. Treatment with indigo naturalis for inflammatory bowel disease and other immune diseases [J]., 2019, 42(1): 16-21.
[11] 赖金伦, 刘玉辉, 刘畅, 等. 中药靛玉红作用机理及其临床应用研究进展 [J]. 中兽医医药杂志, 2017, 36(1): 76-79.
[12] Sugimoto S, Naganuma M, Kanai T. Indole compounds may be promising medicines for ulcerative colitis [J]., 2016, 51(9): 853-861.
[13] Tokuyasu N, Shomori K, Amano K,. Indirubin, a constituent of the Chinese herbal medicine qing-dai, attenuates dextran sulfate sodium-induced murine colitis [J]., 2018, 61(2): 128-136.
[14] Gao W Y, Zhang L D, Wang X Q,. The combination of indirubin and isatin attenuates dextran sodium sulfate induced ulcerative colitis in mice [J]., 2018, 96(5): 636-645.
[15] 李楠, 柳越冬, 王长洪, 等. 靛玉红缓解三硝基苯磺酸致大鼠溃疡性结肠炎及其机制研究 [J]. 中国药理学通报, 2018, 34(12): 1689-1692.
[16] Zhang S L, Wang S N, Miao C Y. Influence of microbiota on intestinal immune system in ulcerative colitis and its intervention [J]., 2017, 8: 1674.
[17] Prosberg M, Bendtsen F, Vind I,. The association between the gut microbiota and the inflammatory bowel disease activity: A systematic review and meta-analysis [J]., 2016, 51(12): 1407-1415.
[18] 杜珊, 周月, 陈斌. 中医药与肠道微生态相关性研究进展 [J]. 中国实验方剂学杂志, 2019, 25(18): 182-188.
[19] Liang Y N, Yu J G, Zhang D B,. Indigo naturalis ameliorates dextran sulfate sodium-induced colitis in mice by modulating the intestinal microbiota community [J]., 2019, 24(22): E4086.
[20] 岳宏宇, 丛春莉, 李艳梅. 肠道微生态与肠道疾病关系的研究进展 [J]. 中国真菌学杂志, 2020, 15(4): 240-243.
[21] 王萍, 王颖, 万红, 等. 肠道菌群在代谢综合征发病机制中的作用 [J]. 中国糖尿病杂志, 2020, 28(2): 147-149.
[22] 滕俊, 赵艳芬, 姜云宁, 等. 肠道菌群与肺癌的相关性 [J]. 中国肺癌杂志, 2020, 23(10): 909-915.
[23] 刘阳, 徐缨龙. 不同发病时期溃疡性结肠炎患者肠道菌群差异及对血清TLRs/NF-κB和SOCS-3及Cingulin蛋白水平的影响 [J]. 中国微生态学杂志, 2020, 32(11): 1285-1288.
[24] 梁淑文, 王晓英, 屈昌民, 等. 溃疡性结肠炎患者肠道菌群变化的临床研究 [J]. 医学研究杂志, 2015, 44(9): 60-62.
[25] 刘素萍, 蒋青青, 金晶, 等. 中医药调节溃疡性结肠炎肠道菌群研究概况[J]. 中华中医药学刊, 2021, 39(3): 208-212.
[26] 曹晖, 吴东升, 张彧, 等. 基于高通量测序技术研究芍药汤对溃疡性结肠炎大鼠肠道菌群的影响 [J]. 中国中医药信息杂志, 2021, 28(1): 61-66.
Effect of indirubin on intestinal flora in mice with ulcerative colitis based on high-throughput sequencing technology
LIANG Yan-ni, CHENG Wen, WU Ke-nan, YU Jin-gao, ZHANG Dong-bo, ZHANG Zhen, WANG Zheng
Co-construction Collaborative Innovation Center for Chinese Medicine Resources Industrialization by Shaanxi & Education Ministry, State Key Laboratory of Research & Development of Characteristic Qin Medicine Resources (Cultivation), Shaanxi Innovative Drug Research Center, Shaanxi University of Chinese Medicine,Xianyang 712083, China
To investigate the effect and mechanism of indirubin on intestinal flora of mice with ulcerative colitis (UC) induced by dextran sulfate sodium (DSS).Male kunming mice were randomly divided into control group, model group, salazosulfapyridine (125 mg/kg) group, and low-, medium-, high-dose (7.5, 15.0, 30.0 mg/kg) indirubin groups, UC model was induced by free drinking 3% DSS for 7 d. On 8th day, mice were ig drugs, after continuous intervention for 7 d, signs of mice were observed for disease activity index (DAI) score; Hematoxylin-eosin (HE) staining was used to observe the pathological changes of colon tissue; ELISA method was used to detect levels of interleukin-6 (IL-6), IL-8, IL-10, IL-1β and tumor necrosis factor-α (TNF-α) in serum of mice. Five samples of intestinal contents in each group were collected, and bacterial 16S rRNA gene V4—V5 regions high-throughput sequencing were used to analyze the flora of intestinal contents variety.Compared with model group, DAI score in indirubin group was significantly reduced (< 0.05), colon tissue damage was reduced, inflammatory cell infiltration was decreased, levels of pro-inflammatory cytokines such as IL-6, IL-8, IL-1β and TNF-α in serum were significantly decreased (< 0.05), level of anti-inflammatory cytokine IL-10 showed an increasing trend. 16S rRNA gene sequencing results showed intestinal flora diversity of mice in model group was decreased, and intestinal flora diversity in indirubin group was increased; Ratio of Bacteroides/Firmicutes was increased at phylum level, seven genus such as Lachnospiraceae_FCS020_group,_9,_brachy_group,,, Erysipelotrichaceae_UCG_003 andmay be related to the therapeutic effect of indirubin on UC.Indirubin can treat UC by regulating intestinal flora of UC mice and inhibiting intestinal inflammation.
indirubin; ulcerative colitis; 16S rRNA gene sequencing; intestinal flora; diversity analysis
R285.5
A
0253 - 2670(2021)13 - 3896 - 09
10.7501/j.issn.0253-2670.2021.13.013
2020-12-18
国家自然科学基金资助项目(81803951);国家自然科学基金资助项目(81973687);陕西省教育厅重点科研项目(20JY012);陕西高校青年创新团队(陕教[2019]90号);陕西高校第三批“青年杰出人才支持计划”项目(陕教工[2019]95号);陕西省首批中医药优秀中青年科技骨干人才支持计划
梁艳妮(1986—),女,博士,副教授,从事药物活性评价研究。E-mail: aiziji_2005@126.com
王 征,男,副教授,硕士生导师,从事中药活性成分发现与评价研究。E-mail: wazh0405@126.com
[责任编辑 李亚楠]