无血清悬浮MDCK细胞库的建立及检定
邹钰莹,张健,姚为民,王笑天,张兰婷,姜皓淼,宋昊,赵大鹏,吴业红
长春生物制品研究所有限责任公司,吉林长春130012
流行性感冒(简称流感)是由流感病毒引起的一种季节性、急性病毒感染疾病。每年全球有300万~500万严重病例,导致29万 ~65万人因呼吸系统疾病并发症死亡[1]。预防流感最有效的方法是接种流感疫苗,我国CDC推荐60岁及以上的老年人、6月龄~5岁儿童、慢性病患者、6月龄以下婴儿的家庭成员和看护人员、孕妇或准备在流感季节怀孕的女性接种流感疫苗[2]。目前已上市的流感疫苗根据其生产方式可分为3种:鸡胚基质流感疫苗、细胞基质流感疫苗(如Flucelvax®Quadrivalent)和重组流感疫苗(如FluBlok®Quadrivalent)[3],国内现已上市的大多是鸡胚基质流感疫苗。在研流感疫苗还包括通用疫苗、DNA疫苗、mRNA疫苗、病毒样颗粒(viruslike particles,VLPs)疫苗等。
使用鸡胚生产流感疫苗需要大量鸡胚供应,且生产周期较长;大规模流感暴发时,会因鸡胚供应不足等问题无法扩大生产规模。而细胞基质流感疫苗的生产规模取决于生物反应器体积,且使用细胞基质进行培养的流感病毒与流行株更为相似,可提供更好的保护效果[3-5]。
MDCK(Madin-Darby canine kidney)细胞是1958年由Madin和Darby从雌性成年可卡犬(Coc ker Spaniel)肾分离得到的,对流感病毒敏感性高且不易发生突变[6],目前已广泛应用于流感病毒相关的培养、检测。MDCK细胞适应于贴壁培养,但因贴壁生长的过程中会使用胰蛋白酶、血清等,增加了引入动物源性病毒因子污染的风险,也对疫苗的纯化造成很大压力。使用无血清悬浮培养MDCK细胞进行流感疫苗的生产,可简化生产流程,降低成本。本文旨在建立无血清悬浮MDCK细胞库,为细胞基质流感疫苗的进一步研究奠定基础。
1 材料与方法
1.1 细胞及毒株 无血清悬浮MDCK细胞[MDCKProtein Free(ECACC 02050101]购自欧洲细胞株 /微生物保藏中心(European Collection of Authenticated Cell Cultures,ECACC)[7],贴壁MDCK细胞MDCK(NBL-2)(ATCC®CCL-34TM)购自ATCC,于37℃,5%CO2条件下培养,2 d传代1次;2BS、Vero、HeLa细胞由长春生物制品研究所有限责任公司疫苗六室保存;A/Michigan/45/2015、A/Hong Kong/4801/2014及B/Brisbane/60/2008毒株均购自英国国家生物制品检定研究所(The National In-stitute for Biological Standards and Con trol,NIBSC),在SPF级鸡胚中传代建立种子库后,经贴壁MDCK细胞连续适应性传代,并建立主代毒种库与工作代毒种库,由长春生物制品研究所有限责任公司疫苗六室制备并保存。
1.2 实验动物及鸡胚 SPF级昆明乳鼠(雌性,24 h内)、SPF级昆明成鼠(雌性,体重15~20 g)和清洁级豚鼠(雌性,体重350~500 g)均由长春生物制品研究所有限责任公司实验动物室提供,动物生产许可证号:SCXK(吉)-2017-0005;SPF级Nu/nu裸鼠(雌性,体重10~15 g,5周龄)和SPF级鸡胚(5~7、9~11日龄)均购自北京梅里亚公司维通实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006。
1.3 主要试剂及仪器 VirusPro®MDCK-S细胞无血清培养基购自上海源培生物科技有限公司;恒温振荡培养器(ZWTR-2102C)购自上海智城分析仪器制造有限公司;IC100型自动细胞计数仪购自艾力特生命科学有限公司。
1.4 悬浮MD C K细胞库的建立
1.4.1 主代细胞库 取1支悬浮MDCK细胞(编号:02050101),于37℃注射用水中快速复融;取15 mL 37℃预热的无血清培养基,置于50 mL离心管中,将上述细胞加入离心管中,混匀后184×g离心5 min,弃上清,在细胞沉淀中加入15 mL无血清培养基,将细胞悬液移入摇瓶中培养2 d。将培养的细胞命名为MDCK-SFM-2(简称S-2)。培养至第12代时,按107个 /(mL·支)的细胞密度冻存,于-196℃液氮中保存,作为主代细胞库,命名为S-2-M。
1.4.2 工作代细胞库 取S-2-M细胞3支,于37℃注射用水中快速复融,每支细胞取15 mL 37℃预热的无血清培养基,分别置于3支50 mL离心管中,将上述细胞加入离心管中,混匀后184×g离心5 min,弃上清,在每支离心管细胞沉淀中加入15 mL无血清培养基,并将细胞悬液移入摇瓶中培养2 d。将上述细胞继续培养至第17代时,按107个 /(mL·支)的细胞密度冻存,于-196℃液氮中保存,作为工作代细胞库,命名为S-2-W。
1.5 S-2细胞的活力检测 分别取5株复苏的S-2-M和S-2-W细胞采用台盼兰染色法检测细胞活力。
1.6 S-2细胞的检定 按照《中国药典》三部(2015版)生物制品生产检定用动物细胞基质制备及检定规程以及通则中的方法和规定,对建立的S-2-M和S-2-W细胞进行检定,包括细胞鉴别试验(以ECACC悬浮MDCK细胞02050101及文献[8]中的悬浮MDCK细胞作为对照)、细菌及真菌检查[9]、支原体检查[10][分别采用检查法与指示细胞培养法(DNA染色法)两种方法进行检测]、内源病毒及外源病毒污染检查[分别采用形态观察及血吸附试验、体外不同指示细胞培养法(以贴壁MDCK细胞、Vero细胞和2BS细胞作为指示细胞)及动物和鸡胚体内接种法]、成瘤性检查(将裸鼠分为3组,每组10只,分别经皮下注射107个S-2-W细胞、106个阳性对照HeLa细胞和阴性对照PBS,0~6周每周观察2次,7~17周每周观察1次,观察同时测量每只裸鼠结节最长径及最短径,持续观察4个月,并进行病理检查)。
1.7 不同细胞对流感病毒敏感性的比较 按相同细胞数接种S-2-W和贴壁MDCK细胞,再分别接种3个毒株,MOI均为0.01,培养条件:胰酶浓度均为2.5μg/mL,培养温度分别为A/Michigan/45/2015和A/Hong Kong/4801/2014毒株34.5℃、B/Bri sbane/60/2008毒株33.5℃。分别于培养24、48、72、96 h取培养上清,测定血凝效价,试验重复3次。1.8统计学分析 应用SPSS 20.0统计学软件进行统计分析,采用配对样本t检验对血凝效价进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 S-2细胞的活力S-2-M细胞的活力最低为94.3%,平均为95.6%;S-2-W细胞的活力最低为94.8%,平均为96.4%。
2.2 S-2细胞的检定
2.2.1 细胞鉴别试验 ECACC悬浮MDCK细胞呈多细胞聚团状悬浮,经VirusPro®MDCK-S细胞无血清培养基多次适应性传代培养后,呈单细胞分散状悬浮生长,S-2-M和S-2-W细胞形态与对照细胞一致,见图1。乳酸脱氢同工酶电泳条带与来自ECACC和ATCC的贴壁MDCK细胞一致,见图2。

图1 S-2细胞库的显微镜观察Fig.1 Microscopy of S-2 cell bank

图2 S-2细胞库与贴壁MDCK细胞乳酸脱氢同工酶条带电泳图Fig.2 Electrophoretic profile of lactate dehydrogenation isozyme bands of S-2 cell bank and adherent MDCK cells
2.2.2 细菌及真菌检查 结果显示,阳性对照中出现明显细菌生长,阴性对照及S-2-M和S-2-W细胞库均未出现细菌及真菌污染。
2.2.3 支原体检查 结果表明,检查法第21天所有培养基均未显示支原体生长;指示细胞培养法(DNA染色法)未显示支原体污染,见图3。
图3 指示细胞培养法(DNA染色法)支原体检测结果(×40)Fig.3 Mycoplasma test by indicator cell culture(DNA staining,×40)
2.2.4 细胞内、外源病毒因子检查
2.2.4.1 形态观察及血吸附试验 结果呈阴性,培养14 d后,细胞表面未出现血细胞吸附现象。
2.2.4.2 体外不同指示细胞培养法 判定结果表明,细胞形态未出现病变、无红细胞吸附现象,且血细胞凝集结果为阴性。
2.2.4.3 动物和鸡胚体内接种法 外源病毒因子检测结果表明,各组动物存活率均大于80%,且鸡胚尿囊液血凝检测为阴性,符合相关检定要求。见表1。

表1 动物和鸡胚体内接种法检测外源病毒因子结果Tab.1 Test for exogenous viral agents by in vivo inoculation in animals and chick embryos
2.2.5 成瘤性 阳性对照组中,有9只裸鼠出现了明显结节,1只几乎未出现结节,阳性对照组成立;S-2-W组有2只裸鼠未出现明显结节,8只裸鼠出现明显结节,其中4只结节在试验结束时未见明显生长,其余4只结节呈进行性生长;阴性对照组裸鼠未见结节生长。见表2。病理结果显示,S-2-W组中所有结节均为肿瘤组织,其中1只裸鼠肺组织中含有肿瘤细胞,有肺转移,见图4。

图4 阳性对照和S-2-W组裸鼠结节及肺组织病理结果(HE染色)Fig.4 Pathological examination of tubercle and lung tissues of nude mice in positive control and S-2-Wgroups(HEstaining)
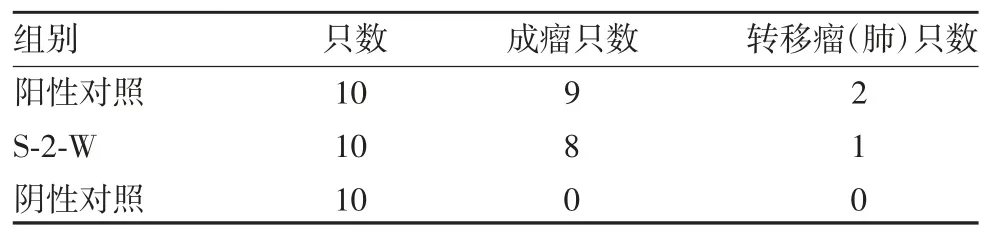
表2 S-2-W细胞的成瘤性Tab.2 Tumorigenicity of S-2-W cells
2.3 不同细胞对流感病毒的敏感性
2.3.1 A/Michigan/45/2015毒株 接种A/Michigan/45/2015后各时间点,S-2-W细胞血凝效价均高于贴壁MDCK细胞,其中24 h差异有统计学意义(t=-5.196,P=0.035),见图5。
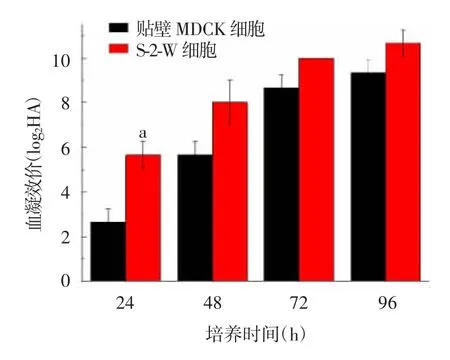
图5 不同细胞接种A/Michigan/45/2015病毒血凝效价的比较Fig.5 Hemagglutination titers of influenza A/Michigan/45/2015 virus in various cells
2.3.2 A/Hong Kong/4801/2014毒株 接种A/Hong Kong/4801/2014后,S-2-W细胞血凝效价提升较快,与贴壁MDCK细胞各时间点比较,差异均有统计学意义(24和48 h的t分别为-10.000和-8.000,24、48、72、96 h的P分别为0.010、0.015、0.000和0.000),见图6。
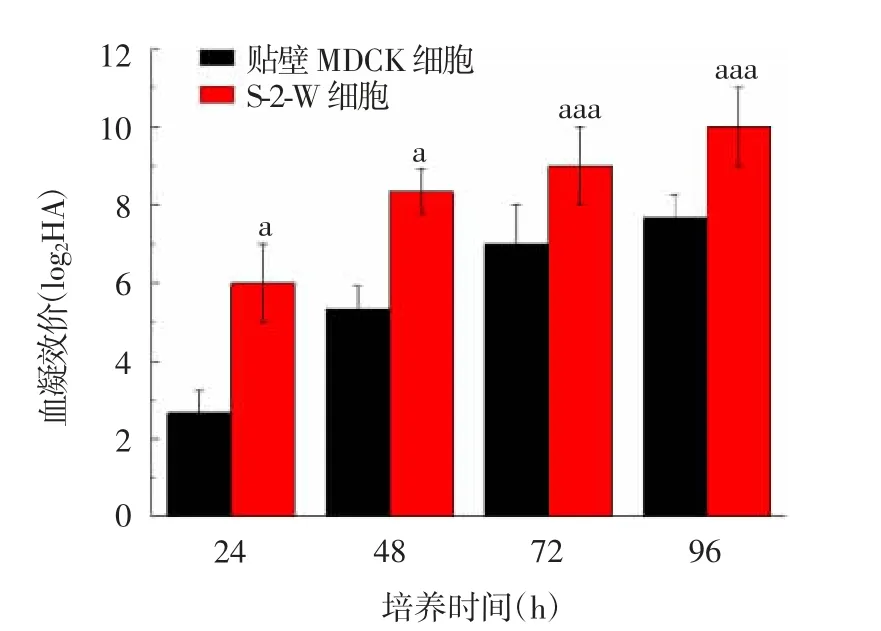
图6 不同细胞接种A/Hong Kong/4801/2014病毒血凝效价的比较Fig.6 Hemagglutination titers of influenza A/Hong Kong/4801/2014 virus in various cells
2.3.3 B/Brisbane/60/2008毒株 接种B/Brisbane/60/2008后,S-2-W细胞血凝效价提升较快,与贴壁MDCK细胞各时间点比较,差异均有统计学意义(24、48、72 h的t分别为-7.000、-8.000和-5.000,24、48、72、96 h的P分别为0.020、0.015、0.038和0.000),见图7。

图7 不同细胞接种B/Brisbane/60/2008病毒血凝效价的比较Fig.7 Hemagglutination titers of influenza B/Brisbane/60/2008 virus in various cells
3 讨论
本文按照《中国药典》三部(2015版)通则、生物制品生产检定用动物细胞基质制备及检定规程中的规定,对S-2细胞的主代细胞库和工作代细胞库进行了检定。S-2细胞形态与文献中记录的悬浮MDCK细胞形态一致,主代、工作代细胞乳酸脱氢同工酶电泳条带与来自ATCC、ECACC的MDCK细胞一致,可判断建立的细胞库与来自ATCC、ECACC的细胞为同种细胞,即MDCK细胞,无其他细胞污染;未发现细菌、真菌、支原体污染;体外及体内法外源病毒因子检查结果为阴性。
在观察期内,S-2细胞可致裸鼠出现结节,经病理分析确定为肿瘤,这与文献中报道的一致,贴壁MDCK细胞本身具有成瘤性[11],而驯化后的细胞的成瘤性与细胞来源、所用培养基及驯化方式均相关。但MDCK细胞对人类是异种的,很可能被排斥,即细胞只在裸鼠中产生肿瘤,而在成年动物,甚至免疫系统不发达的日龄动物中,也不存在肿瘤。此外,关于致瘤性的监管关注点是活疫苗,而不是灭活、高度纯化、不含活细胞的疫苗,前提是残留DNA的限度及每剂量的风险是可接受的[12]。与贴壁MDCK细胞相比,S-2细胞也可很好地支持流感病毒在细胞内的增殖,在对流感病毒的敏感性方面其优势在于能够在短期内迅速大量地获得病毒,可更好地满足快速生产疫苗时对于大量扩增流感病毒的需求。
综上所述,本文建立了基本符合要求的悬浮MDCK细胞库。与贴壁培养的MDCK细胞相比,无血清的细胞培养体系可降低由血清和胰蛋白酶带来动物来源外源因子的潜在污染风险,且悬浮生长的MDCK细胞并未损失其对于流感病毒的敏感性,为细胞基质流感疫苗的研究奠定了基础。

