β-乳香酸对海马神经元细胞氧糖剥夺损伤的改善作用
王明明 王磊 窦芳 李韦韦 文爱东 王婧雯

摘 要 目的:研究β-乳香酸对大鼠海马神经元细胞氧糖剥夺损伤的改善作用。方法:将大鼠海马神经元细胞分为正常对照组、模型组和β-乳香酸低、中、高浓度组(1、10、100 μmol/L),除正常對照组外,其余各组细胞加入相应含药培养基,并进行氧糖剥夺培养以复制氧糖剥夺损伤模型。采用MTT法检测细胞的存活率,采用化学比色法检测细胞上清液中乳糖脱氢酶(LDH)活性,采用Hoechst-PI染色法观察细胞形态的变化,采用流式细胞仪检测细胞早期凋亡率,采用Western blot法检测细胞中凋亡相关蛋白[B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)、激活型胱天蛋白酶3(cleaved caspase-3)]的表达。结果:与模型组比较,β-乳香酸中、高浓度组细胞存活率、Bcl-2蛋白表达水平均显著升高(P<0.01),细胞上清液中LDH活性、细胞早期凋亡率和细胞中cleaved caspase-3、Bax蛋白表达水平均显著降低 (P<0.05或P<0.01);细胞核致密浓染、碎片状现象明显减少。结论:β-乳香酸可改善大鼠海马神经元细胞氧糖剥夺损伤,其作用机制可能与下调cleaved caspase-3、Bax蛋白表达,上调Bcl-2蛋白表达有关。
关键词 β-乳香酸;海马神经元细胞;氧糖剥夺;细胞凋亡
ABSTRACT OBJECTIVE: To study the improvement effects of β-boswellic acid on hippocampal neurons cells injury of rats induced by oxygen-glucose deprivation. METHODS: The hippocampal neurons cell of rats were divided into normal control group, model group and β-boswellic acid low-concentration, medium-concentration and high-concentration groups (1, 10, 100 μmol/L). Except for normal control group, other groups were cultured with relevant medium and given oxygen glucose deprivation to induce oxygen-glucose deprivation induced injury model. MTT assay was adopted to detect cell viability. Chemical colorimetry was used to detect LDH activity in cell culture supernatant. Hoechst-PI staining was used to detect the morphology change of cells. Flow cytometry was used to detect early apoptosis rate of cells. The expression of apoptosis-related protein (Bcl-2, Bax and cleaved caspase-3) were detected by Western blot. RESULTS: Compared with model group, the survival rate of cells and protein expression of Bcl-2 were increased significantly in β-boswellic acid medium-concentration and high-concentration groups (P<0.01), while LDH activity, early apoptosis rate, protein expression of cleaved caspase-3 and Bax were all decreased significantly (P<0.05 or P<0.01). The densely stained nuclei and fragmentation decreased significantly. CONCLUSIONS: β-boswellic acid can relieve oxygen-glucose deprivation induced injury of hippocampal neurons cells, the mechanism of which may be associated with down-regulating the protein expression of cleaved caspase-3 and Bax and up-regulating the protein expression of Bcl-2.
KEYWORDS β-boswellic acid; Hippocampal neurons cells; Oxygen-glucose deprivation; Cell apoptosis
脑卒中是引起人类死亡和残疾的第二大病因,具有高发病率、高病死率、高致残率、高复发率及经济负担重的特点,严重影响国民健康;其中,80%的患者为缺血性卒中[1]。缺血性脑卒中是因大脑动脉血流短暂或持久性的闭塞导致脑供血不足或中断,进而诱发一系列级联反应,造成缺血区脑组织不可逆的损伤,导致神经功能缺陷[2]。海马组织是中枢神经系统的重要组成部分,是脑组织中对缺血缺氧最敏感的部位之一[3-4],因此,抑制海马神经元细胞凋亡可有效减轻缺血性脑损伤的程度,进而防治缺血性脑卒中[5]。
乳香为橄榄科植物乳香树 Boswellia carterii Birdw.及同属B. bhaur dajiana Birdw.树皮渗出的树脂,目前已被欧洲药品管理局列为治疗脑癌水肿的潜在治疗药物[6],其中β-乳香酸是其重要的药效物质[7]。相关研究发现,β-乳香酸可促进海马神经元的生长和分支;另外,其在大鼠脑组织中的浓度明显高于乳香的其他药效成分,具有较高的血脑屏障渗透率[8-9]。但β-乳香酸是否对缺血性脑卒中具有治疗作用,尚不明确。
基于此,本研究以大鼠海马神经元细胞为研究对象,建立氧糖剥夺损伤模型,通过检测细胞凋亡情况和凋亡相关蛋白[B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)、激活型胱天蛋白酶3(cleaved caspase-3)]的表达,探讨β-乳香酸对海马神经元细胞氧糖剥夺损伤的改善作用,以期为β-乳香酸防治缺血性脑血管疾病提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:HF-90型CO2培养箱(上海力申科学仪器有限公司),IX53型倒置相差显微镜(日本Olympus公司),ELX-800型酶标仪(美国Bio-Tek公司),H-2050R型超速冷冻离心机(湖南湘仪实验室仪器开发有限公司),SW-CJ-2FD型超净工作台(苏州净化设备有限公司),NW10LVF型超纯水系统(力康生物医疗科技控股有限公司),DYY-7C型电泳仪、WD-9413B型凝胶成像系统(北京六一生物科技有限公司),NovoCyte型流式细胞仪(艾森生物有限公司),DH36001B型电热恒温培养箱(天津泰斯特仪器有限公司)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有:β-乳香酸(上海纯优生物科技有限公司,批号P1513,纯度不低于95%),胰蛋白酶(上海中乔新舟生物科技有限公司,批号0103),DMEM培养基(美国Hyclone公司,批号SH30027),胎牛血清(以色列BI公司,批号04-011-1A),Neurobasal培养基、L-谷氨酰胺、细胞培养添加剂B27(美国Gibco公司,批号分别为12348-017、25030-149、17504-044),阿糖胞苷(日本TCI公司,批号C2035),磷酸盐缓冲液(PBS)、二甲基亚砜(DMSO)、蛋白上样缓冲液、碘化丙啶(PI)、细胞裂解液、ECL发光液(上海碧云天生物技术研究所,批号分別为ST476、ST038、P0015、ST511、P0013、P0018),MTT试剂、乳酸脱氢酶(LDH)测定试剂盒、BCA蛋白浓度测定试剂盒、细胞凋亡检测试剂盒、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗、兔抗大鼠cleaved caspase-3单克隆抗体、兔抗大鼠Bcl-2 单克隆抗体、兔抗大鼠Bax单克隆抗体、兔抗大鼠β-actin单克隆抗体(沈阳万类生物科技有限公司,批号分别为WLA021、WLA072、WLA004、WLA001、WLA023、WL02117、WL01556、WL01637、WL01372)。
1.3 动物
本研究所用动物为SPF级SD新生大鼠(出生2天),雄性,购自第四军医大学实验动物中心,实验动物生产许可证号为SCXK(陕)2019-001。大鼠的饲养环境温度为(22±1) ℃、湿度为45%~55%,饲养过程中大鼠自由进食饮水。
2 方法
2.1 原代海马神经元细胞的分离与培养
参考文献[10]并对方法改良后进行细胞分离培养。取新生大鼠,置于 75%乙醇中浸泡5 min,于无菌条件下取出其脑组织,分离海马组织,以PBS洗净残血后剪碎,放入无菌离心管中,加入0.125%胰蛋白酶,于37 ℃条件下水浴5 min进行消化;将消化后的混悬液反复吹打溶液,静置,待自然沉淀后弃去上清液;沉淀中加入0.125%胰蛋白酶继续消化,待自然沉淀后收集上清液;然后向上清液中加入含10%胎牛血清和青/链霉素的DMEM培养基以中和消化酶,然后以70 μm孔径的一次性细胞滤网过滤,取上清液,以1 000 r/min离心7 min,弃上清液;将沉淀接种至多聚赖氨酸包被的6孔板中,于37 ℃、5%CO2恒温箱中培养8 h后,换成含2%B27和0.5 mmol/L L-谷氨酰胺及100 U/mL青/链霉素的Neurobasal培养基中培养48 h,然后加入10 μmol/L阿糖胞苷抑制胶质细胞生长,每隔3 天换液1次,培养7~10天后进行后续试验。
2.2 海马神经元细胞分组、造模与给药
取海马神经元细胞分为正常对照组、模型组和β-乳香酸不同浓度组(1、10、100 μmol/L,浓度根据文献[11-12]设置)。正常对照组和模型组加入含2%B27和0.5 mmol/L谷氨酰胺的Neurobasal培养基1 mL;β-乳香酸各浓度组加入含相应药物以及含2%B27和0.5 mmol/L L-谷氨酰胺的Neurobasal培养基1 mL。各组细胞于37 ℃、5%CO2恒温箱中培养24 h后,将β-乳香酸各浓度组和模型组的培养基更换为无糖DMEM培养基,并将细胞置于缺氧造模盒内,通入混合气体(含有95%N2、5%CO2),于37 ℃培养箱中培养2 h以诱导建立氧糖剥夺模型[13-14];正常对照组继续用含2%B27和0.5 mmol/L谷氨酰胺的Neurobasal培养基培养,不作缺氧缺糖处理。造模结束将各组培养基更换为含2%B27和0.5 mmol/L L-谷氨酰胺的Neurobasal培养基(β-乳香酸各浓度组继续加入相应药物)。
2.3 海马神经元细胞存活率的测定
采用MTT法进行检测。取“2.1”项下海马神经元细胞,以5×103个/孔接种于96孔板中,然后按“2.2”项下方法分组、造模与给药,每组设3个复孔。细胞于37 ℃、5%CO2恒温箱中培养24 h后,加入MTT染色液20 μL,继续培养4 h;弃去上清液,加入DMSO 150 μL以溶解细胞,避光静置10 min后,采用酶标仪于570 nm波长下测定各孔吸光度值(OD),并计算细胞存活率[细胞存活率(%)=(OD实验组/OD正常对照组)×100%]。实验重复3次。
2.4 海马神经元细胞上清液中LDH活性的测定
采用化学比色法进行检测。取“2.1”项下海马神经元细胞,以5×103个/孔接种于96孔板中,然后按“2.2”项下方法分组、造模与给药,每组设3个复孔。细胞于37 ℃、5%CO2恒温箱中培养24 h后,取培养液上清液,根据LDH测定试剂盒说明书方法操作,采用酶标仪于440 nm波长处测定各孔OD,并计算LDH 活性。
2.5 海马神经元细胞形态的观察
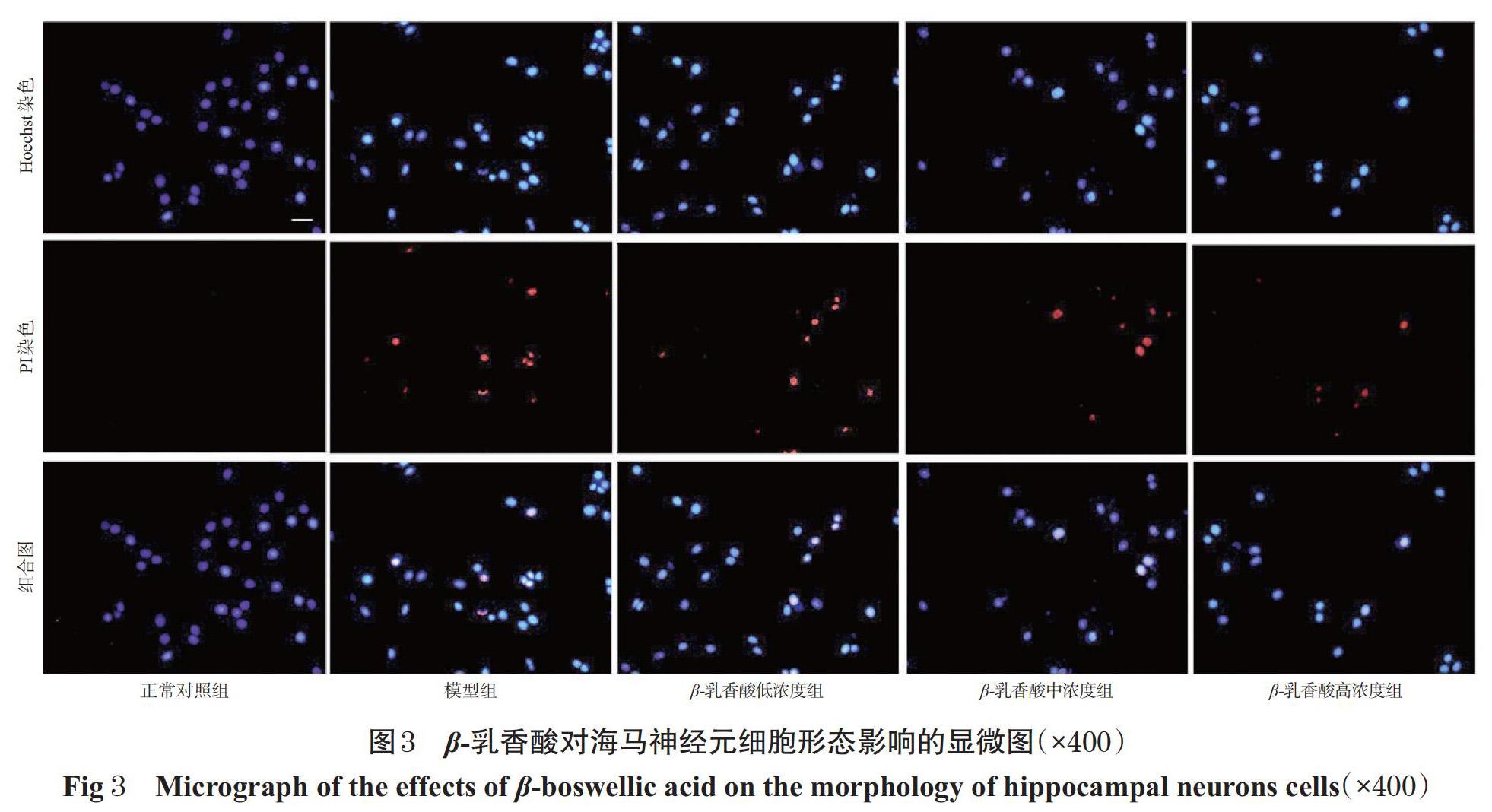
采用Hoechst-PI染色法进行观察。取“2.1”项下海马神经元细胞,以5×103个/孔接种于置有盖玻片的12孔培养板中,按“2.2”项下方法分组、造模与给药。细胞于37 ℃、5%CO2恒温箱中培养24 h后,滴加Hoechst荧光染料(10 μg/mL),于37 ℃条件下孵育10 min;以PBS清洗3次,加入1 μg/mL PI,于4 ℃条件下孵育20 min;滴加预冷的4%多聚甲醛固定15 min;以 PBS清洗3次,然后采用荧光倒置显微镜观察(正常细胞的细胞核经Hoechst染色后呈淡蓝色圆形状,凋亡细胞的细胞核经Hoechst染色后呈亮蓝色分叶、碎片状;死细胞或晚期凋亡细胞因细胞膜被破坏,可被PI染成亮红色[15])。
2.6 海马神经元细胞早期凋亡率的检测
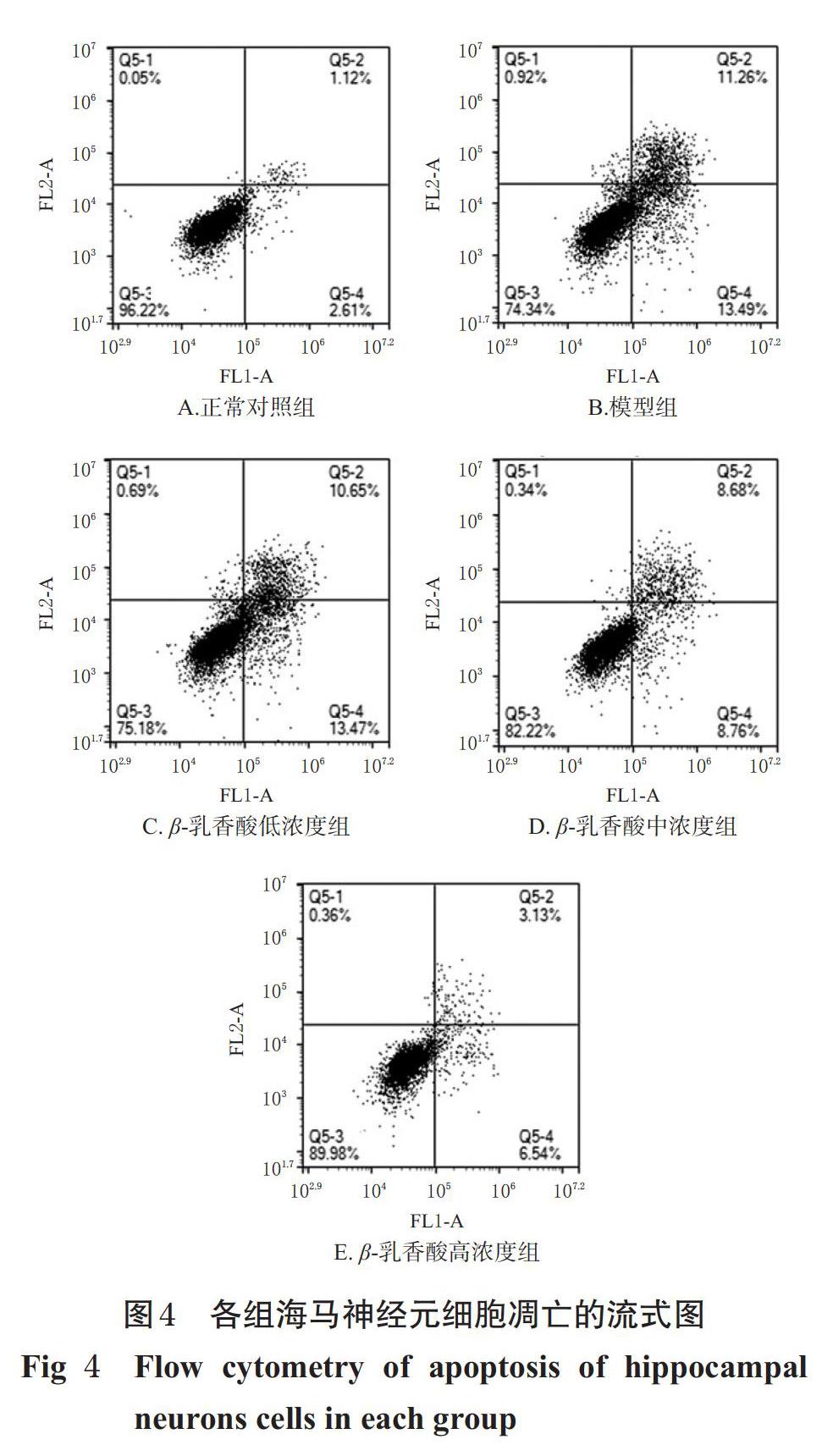
取“2.1”项下海马神经元细胞,以5×103个/孔接种于具有盖玻片的6孔培养板中,按“2.2”项下方法分组、造模与给药,每组设3个复孔。细胞于37 ℃、5%CO2恒温箱中培养24 h后,以1 000 r/min离心5 min,收集细胞,以PBS清洗2次,弃上清液;加入Binding buffer 500 μL轻轻重悬细胞;加入Annexin V-FITC 5 μL混匀后,再加入PI 10 μL,室温避光孵育15 min,然后采用流式细胞仪检测各组细胞早期凋亡率。
2.7 海马神经元细胞中cleaved caspase-3、Bcl-2、Bax蛋白表达水平的检测
采用Western blot法进行检测。取“2.1”项下海马神经元细胞,以5×103个/孔接种于6孔培养板中,按“2.2”项下方法分组、造模与给药,每组设3个复孔。细胞于37 ℃、5%CO2恒温箱中培养24 h后,弃上清液,以PBS沖洗3次,加入适量裂解液,于冰上裂解30 min;以10 000 r/min离心5 min,取上清液,采用BCA蛋白浓度测定试剂盒测定蛋白浓度。蛋白经变性后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜;以TBST清洗5 min,以5%脱脂奶粉溶液封闭1 h;加入cleaved caspase-3、Bcl-2、Bax、β-actin一抗、(稀释度分别为1 ∶ 400、 1 ∶ 500、1 ∶ 500、1 ∶ 500),于4 ℃条件下孵育过夜;以TBST清洗5 min×4次,加入二抗(稀释度为1 ∶ 5 000),室温振荡孵育1 h;以TBST 清洗5 min×6次,加入 ECL发光液,经凝胶成像系统扫描。采用Image J v1.44软件分析,以目的蛋白与内参β-actin的灰度值的比值来表示目的蛋白的表达水平。
2.8 统计学方法
采用SPSS 19.0软件对数据进行统计分析。数据以x±s表示,组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 β-乳香酸对海马神经元细胞存活率的影响
与正常对照组比较,模型组海马神经元细胞存活率显著降低(P<0.01);与模型组比较,β-乳香酸中、高浓度组海马神经元细胞存活率均显著升高(P<0.01),详见图1。
3.2 β-乳香酸对海马神经元细胞上清液中LDH活性的影响
与正常对照组比较,模型组海马神经元细胞上清液中LDH活性显著升高( P<0.01);与模型组比较,β-乳香酸中、高浓度组海马神经元细胞上清液中LDH活性均显著降低( P<0.01),详见图2。
3.3 β-乳香酸对海马神经元细胞形态的影响
正常对照组海马神经元细胞染色均匀,细胞核形态完整;模型组海马神经元细胞的细胞核呈致密浓染,可见核固缩和核碎片现象;β-乳香酸中、高浓度组海马神经元细胞染色均匀,细胞核致密浓染、核碎片状现象明显减少;β-乳香酸低剂量组海马神经元细胞的细胞核仍存在致密浓染,核固缩和碎片仍显著,详见图3。
3.4 β-乳香酸对海马神经元细胞早期凋亡率的影响
与正常对照组比较,模型组海马神经元细胞早期凋亡率显著升高(P<0.01);与模型组比较,β-乳香酸中、高浓度组海马神经元细胞早期凋亡率均显著降低(P<0.05 或 P<0.01),详见图4、图5。
3.5 β-乳香酸对海马神经元细胞中凋亡相关蛋白表达的影响
与正常对照组比较,模型组海马神经元细胞中Bax、cleaved caspase-3蛋白的表达水平均显著升高( P<0.01),Bcl-2蛋白的表达水平显著降低( P<0.01);与模型组比较,β-乳香酸中、高浓度组海马神经元细胞中Bax、cleaved caspase-3蛋白的表达水平均显著降低(P<0.05或 P<0.01),Bcl-2蛋白的表达水平均显著升高 ( P<0.05或 P<0.01),详见图6、图7。
4 讨论
缺血性脑卒中是危害人类健康的主要疾病之一。发生缺血性脑卒中后,由于缺氧缺糖导致脑细胞,尤其是神经元细胞损伤,是造成神经功能缺陷的主要原因,因此减少神经元细胞损伤是减轻缺血性脑卒中病情的策略之一[16]。海马组织是中枢神经系统的重要组成部分,与多种中枢神经系统功能活动有关,是中枢神经系统中对缺氧耐受相对较差的部位[15]。因此,本研究选择海马神经元细胞来建立氧糖剥夺损伤模型。
乳香由树脂、树胶和挥发油等组成,其中含量较高的是树脂(约60%~70%),其主要成分有游离的α-乳香酸、β-乳香酸、11-酮基-β-乳香酸等[17]。相关研究发现,β-乳香酸在神经可塑性中发挥着核心作用,具有促进海马神经元生长和分支的作用[18]。本研究结果显示,10、100 μmol/L的β-乳香酸可显著升高氧糖剥夺损伤模型海马神经元细胞的存活率,表明β-乳香酸可通过提高海马神经元细胞的存活率,减轻其氧糖剥夺损伤。
LDH广泛存在于人体各组织内,正常细胞中LDH漏出量很少,而当其受损时,细胞膜的完整性和通透性被破坏,使得LDH漏出[19]。因此,检测海马神经元细胞上清液中 LDH的活性,即可间接反映细胞的受损程度。本研究结果显示,10、100 μmol/L的β-乳香酸可降低氧糖剥夺损伤海马神经元细胞上清液中 LDH的活性;进一步研究发现,海马神经元细胞的细胞核致密浓染、碎片状现象较模型组明显减少,细胞早期凋亡率也显著降低,说明β-乳香酸可通过减少细胞凋亡,减轻海马神经元的氧糖剥夺损伤。
相关研究发现,caspase家族、Bcl-2家族等相关蛋白可参与细胞凋亡的过程;其中,caspase家族相关蛋白可参与细胞凋亡的各个时期[20-21]。该家族由14个成员组成,在正常细胞中均以无活性的酶原形式存在;其中caspase-3在细胞凋亡的级联反应途徑中位于核心位置,是凋亡信号转导下游的执行者,主要分布于细胞质中,初始无活性,当收到凋亡信号刺激被激活后,活化为cleaved caspase-3[20]。Bcl-2分布于线粒体外膜、核膜和内质网膜上,位于线粒体上游,可通过调节线粒体膜间隙蛋白的释放来调控细胞凋亡;Bax定位于细胞质,是Bcl-2家族重要的促凋亡因子[21]。本研究结果显示,10、100 μmol/L的β-乳香酸可显著降低氧糖剥夺损伤模型海马神经元细胞中Bax、cleaved caspase-3蛋白表达水平,升高Bcl-2蛋白表达水平,表明β-乳香酸可通过下调cleaved caspase-3、Bax蛋白表达以及上调Bcl-2蛋白表达来抑制细胞凋亡,从而改善海马神经元细胞氧糖剥夺损伤。
综上所述,β-乳香酸可改善大鼠海马神经元细胞氧糖剥夺损伤,其作用机制可能与下调cleaved caspase-3、Bax蛋白表达,上调Bcl-2蛋白表达有关。
参考文献
[ 1 ] WANG H D,MOHSEN N,CHRISTINE A,et al. Global,regional,and national life expectancy,all-cause mortality,and cause-specific mortality for 249 causes of death,1980-2015:a systematic analysis for the Global Burden of Disease Study 2015[J]. Lancet,2016,388 (10053):1459- 1544.
[ 2 ] 刘天龙,柳敏娜,王文军,等. Z-没药甾酮对缺血性脑卒中大鼠氧化应激损伤的保护作用及分子机制[J].解放军医药杂志,2020,32(1):6-27.
[ 3 ] 杜成昊,万海同,周惠芬,等.谷红注射液对新生乳鼠海马神经元缺氧缺糖损伤的保护作用[J].中华中医药杂志,2017,32(1):289-293.
[ 4 ] 张晓璇,马征,于宁,等.丁苯酞对缺血性脑卒中大鼠海马神经元凋亡的抑制作用及其对p38 MAPK信号通路的影响[J].吉林大学学报(医学版),2019,45(5):1086- 1091.
[ 5 ] LU X ,LING D,YUAN Q S,et al. Neuroprotective effects of curcumin against rats with focal cerebral ischemia- reperfusion injury[J]. Int J Mol Med,2019,43(4):1879- 1887.
[ 6 ] CARSTEN S,KARINA K,LARS T,et al. Increased bioavailability of 11-keto-beta-boswellic acid following single oral dose frankincense extract administration after a standardized meal in healthy male volunteers:modeling and simulation considerations for evaluating drug exposures[J]. J Clin Pharmacol,2012,52(10):1592-1600.
[ 7 ] BHAHWAL A S,GHULAM N Q,SUBHASH C T. Boswellic acids:a group of medicinally important compounds[J]. Nat Prod Rep,2009,26(1):72-89.
[ 8 ] KARIMA O,RIAZI G,KHODADADI S,et al. An in vitro study of the role of β-boswellic acid in the microtubule assembly dynamics[J]. FEBS Lett,2012,586(23):4132- 4138.
[ 9 ] KATHLEEN G,H?SCH J,FRICKER G,et al. In vitro metabolism,permeation,and brain availability of six major boswellic acids from Boswellia serrata gum resins[J]. Fitoterapia,2013,84(2013):99-106.
[10] 董永喜,董莉,付思红,等.辛芍组方对氧糖剥夺损伤的神经PC12细胞凋亡的影响及其机制研究[J].中国药房,2016,27(28):3907-3910.
[11] KONG C C,MIAO F F,WU Y,et al. Oxycodone suppresses the apoptosis of hippocampal neurons induced by oxygen-glucose deprivation/recovery through caspase-dependent and caspase-independent pathways via κ- and δ-opioid receptors in rats[J/OL]. Brain Res,2019[2020-12- 23]. https://pubmed.ncbi.nlm.nih.gov/31276638/.DOI:10. 1016/j.brainres.2019.146319.
[12] GUPTA S,AHSAN A U I,WANI A,et al. The amino analogue of beta-boswellic acid efficiently attenuates the release of pro-inflammatory mediators than its parent compound through the suppression of NF-κB/IκBα signalling axis[J]. Cytokine,2017,107:93-104.
[13] JEBELLI A,KHALAJ-KONDORI M,RAHMATI-YAMCHI M. The effect of beta-boswellic acid on the expression of Camk4 and Camk2α genes in the PC12 cell line[J]. Adv Pharm Bul,2020,10(3):437-443.
[14] ZHOU L,ZHANG J,WANG C,et al. Tanshinone inhibits neuronal cell apoptosis and inflammatory response in cerebral infarction rat model[J]. Int J Immunopathol Pharmacol,2017,30(2):123-129.
[15] 楊辉,鲁利香,肖政华,等.缺氧缺糖海马神经元模型最佳造模时间的选择[J].贵州医科大学学报,2017,42(7):778-782.
[16] 张黎黎,黄家贵,沈长波,等.白藜芦醇预处理对缺糖缺氧再灌注大鼠原代皮质神经元的保护作用[J].中成药,2014,36(5):897-903.
[17] 王峰,华会明,王淑美,等. 乳香的化学成分研究[J].中草药,2011,42(7): 1293-1296.
[18] KARIMA O,RIAZI G,YOUSEFI R,et al. The enhancement effect of beta-boswellic acid on hippocampal neurites outgrowth and branching (an in vitro study)[J]. Neurol Sci,2010,31(3):315-320.
[19] 周惠芬,万海同,何昱,等.丹参-川芎有效成分配伍对氧糖剥夺海马神经元细胞保护作用研究[J].中草药,2019,50(6):1372-1381.
[20] 刘春华,刘捷.神经元凋亡与Caspase家族及细胞周期研究进展[J].人民军医,2018,61(7):641-644.
[21] 冯健愉,朱玉山,陈佺,等. Bcl-2家族蛋白的生理功能及结构基础[J].中国细胞生物学学报,2019,41(8):1477- 1489.
(收稿日期:2021-01-11 修回日期:2021-03-28)
(编辑:唐晓莲)

