桑枝多糖基于YAP/TAZ 信号通路调控db/db 小鼠肾纤维化作用的研究
余文胜 黄 飞 郑 妮
糖尿病肾病(DN)是糖尿病常见的、严重的微血管并发症,且超过三分之一的糖尿病患者伴发DN,并最终发展为终末期肾脏疾病(ESRD),成为糖尿病致死、致残的主要因素[1]。DN 临床治疗较为棘手,且尚缺乏特异性、针对性的治疗药物,目前主要以血糖控制为基础,联合抗氧化、血管紧张素转化酶抑制剂和钙拮抗剂等药物进行综合治疗,但从临床疗效上看,目前的治疗方案只是减缓肾功能减退及肾纤维化的发展,仍难以阻止其病程进展[2-3]。
桑枝Mori Ramulus 是桑科植物桑Morus alba L.的干燥树枝,具有祛风活络、通利关节、燥湿利水、降血糖降血脂以及提高机体免疫功能等多种药效[4-5]。桑枝多糖为桑枝的主要成分之一,课题组前期研究结果表明,桑枝多糖具有良好降血糖,增强糖尿病小鼠肾脏抗氧化能力,改善氧化应激对肾组织损伤的作用[6],但其对DN 的作用机制并未完全阐明。本研究以自发型2 型糖尿病db/db 小鼠为DN 模型,探究桑枝多糖对DN 的作用机制。
1 实验材料
1.1 动 物 24 周龄db/db 小鼠40 只,db/m 小鼠10 只,SPF 级,雌雄各半,体质量(47.27±1.62)g,购自江苏集萃药康生物科技股份有限公司,实验动物使用许可证:SYXK(苏)2018-0027,实验动物生产许可证:SYXK(苏)2018-0008。小鼠饲养于通风良好的环境,室温18~25℃,相对湿度40~70%,12h 光照昼夜循环。
1.2 药 物 本研究应用的桑枝经广西中医药研究所鉴定。桑枝多糖制备[7]:干燥桑枝1kg,粉碎成粗粉,使用6000mL 80%的乙醇溶液,85℃下回流提取4次,每次2h,过滤,滤液减压至无醇味,加2000mL 双蒸水,煮3 次,每次2h,过滤,合并滤液,10000pr/min离心10min,用微波真空干燥器浓缩,得浓缩液250mL,经氯仿-正丁醇(5∶1)多次萃取后除去蛋白质。提取液4℃过夜,10000pr/min 离心10min,过滤,加入5 倍量95%乙醇,使乙醇终浓度为70%,醇沉24h,抽滤,收集药渣,滤渣依次用乙醚、无水乙醇、丙酮洗涤3 次,所得药渣定性测定含粗多糖。将多糖粗品溶于水,加样到经PBS 缓冲液(pH=7.8)处理的树脂层析柱中,静止12h,用双蒸水以2mL/min 流速进行洗脱,合并洗脱液,真空干燥得桑枝多糖。经紫外-可见分光计测定样品中的桑枝多糖纯度达85.6%;缬沙坦,海南皇隆制药股份有限公司,批号191205。
1.3 试 剂 肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、转化生长因子-β1(TGF-β1)、纤维连接蛋白(FN)、胶原Ⅰ型(CollagenⅠ)ELISA 试剂盒,上海酶联生物科技有限公司,批号200720、200811、200705、200716、200818;单核细胞趋化蛋白-1(MCP-1)、结缔组织生长因子(CTGF)ELISA 试剂盒,圣克鲁斯生物技术(上海)有限公司,批号Sc-52734、Sc- 102086;兔抗人Yes 相关蛋白(YAP)、TEAD 多克隆抗体,美国Cell Signaling Technology 公司,批号20271、20397。
1.4 主要仪器 9602A-酶标仪(北京艾普生设备有限公司);全自动生化分析仪(日立公司,7100);Gel doc200 低温高速离心机(上海安亭科学仪器厂);垂直电泳仪(BIO-RAD 公司);转膜及显影设备(BIORAD 公司);罗氏卓越型血糖仪(ACCU-CHEK Performa)。
2 实验方法
2.1 动物分组及给药 自发型2 型糖尿病24 周龄db/db 小鼠40 只,24 周龄db/m 小鼠10 只,均雌雄各半。使用随机数字表法将db/db 小鼠分为模型组、缬沙坦组(20mg/kg)、桑枝多糖低剂量组(600mg/kg)、桑枝多糖高剂量组(1200mg/kg),每组10 只,日常进行高脂饮食喂养,连续灌胃相应药物60 天,每天1 次。db/m 小鼠为空白组,日常进行普通饲料喂养,模型组与空白组小鼠灌胃等体积生理盐水60 天。
2.2 HE 染色方法 将制作好的肾脏蜡块切片,切片厚度4μm,切片用二甲苯脱蜡,置于二甲苯与纯乙醇混合液中,乙醇逐级脱水,苏木精染液染色,水洗及0.5%盐酸乙醇分色,蒸馏流水冲洗,伊红染液染色,乙醇逐级脱水后二甲苯透明,封片。观察小鼠肾组织病理学变化。
2.3 生化指标检测 于第60 天采集小鼠尿液,测量尿量,采用终点法测24h 尿白蛋白(UP)含量;末次给药后,小鼠禁食不禁水12h,使用血糖仪检测小鼠空腹血糖(FBG);眼眶静脉取血,高速冷冻离心分离血清,使用全自动生化分析仪测定小鼠血清肌酐(Scr)、尿素氮(BUN)含量。
2.4 ELISA 法检测小鼠肾组织纤维化指标 剥离小鼠肾组织,低温条件下将其制成约10%的匀浆液,按ELISA 试剂盒说明书操作,检测小鼠肾组织TGFβ1、FN、CTGF、CollagenⅠ表达及炎症因子TNF-α、IL-6、MCP-1 表达量。
2.5 蛋白免疫印迹法检测小鼠肾组织YAP、TAZ 表达量 剥离小鼠肾组织,低温条件下将其制成约10%的匀浆液,冰浴静置30min,高速冷冻离心机中离心5min,分离上清液,提取肾组织总蛋白。在SDSPAGE 胶上加入Marker 及检测蛋白,转移至PVDF膜后加5%脱脂奶粉,洗膜,加入一抗(1∶500),4℃低温环境下孵育过夜,洗膜,加入稀释的二抗(1∶2000),低温静置孵育60min,洗膜,暗室中曝光显影。电泳成像分析系统扫描、分析蛋白条带。
3 实验结果
3.1 桑枝多糖对db/db 小鼠FBG 的影响 与空白组比较,给药前各组小鼠FBG 均明显上升,给药后,桑枝多糖低、高剂量组小鼠FBG 有所下降,但仍高于空白组(P<0.05)。与模型组给药后比较,缬沙坦组小鼠FBG 无明显改变(P>0.05),桑枝多糖低、高剂量组小鼠给FBG 均明显降低(P 均<0.05)。见表1。
表1 桑枝多糖对db/db 小鼠FBG 的影响(mmol/L,)
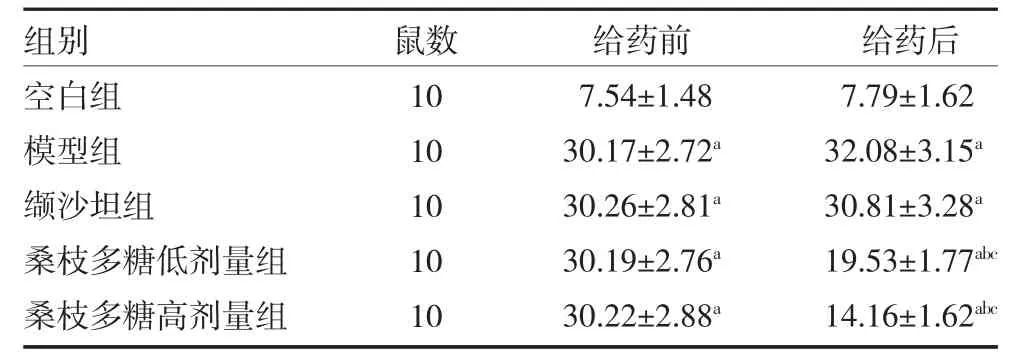
表1 桑枝多糖对db/db 小鼠FBG 的影响(mmol/L,)
注:空白组为db/m 小鼠,予生理盐水;模型组为自发型2 型糖尿病db/db 小鼠,予生理盐水;缬沙坦组为自发型2 型糖尿病db/db 小鼠予20mg/kg 缬沙坦混悬液;桑枝多糖低剂量组为自发型2 型糖尿病db/db 小鼠予600mg/kg 桑枝多糖混悬液;桑枝多糖高剂量组为自发型2型糖尿病db/db 小鼠予1200mg/kg 桑枝多糖混悬液;FBG 为空腹血糖;与空白组同期比较,aP<0.05;与本组给药前比较,bP<0.05;与模型组给药后比较,cP<0.05
3.2 桑枝多糖对db/db 小鼠24h 尿量、UP 及血清Scr、BUN 的影响 与空白组比较,模型组小鼠24h尿量、UP 含量及血清Scr、BUN 含量明显升高(P 均<0.05)。与模型组比较,缬沙坦组及桑枝多糖低、高剂量组小鼠24h 尿量、UP 含量及血清Scr、BUN 含量均明显降低(P 均<0.05)。见表2。
表2 桑枝多糖对db/db 小鼠24h 尿量、UP 及血清Scr、BUN 的影响()
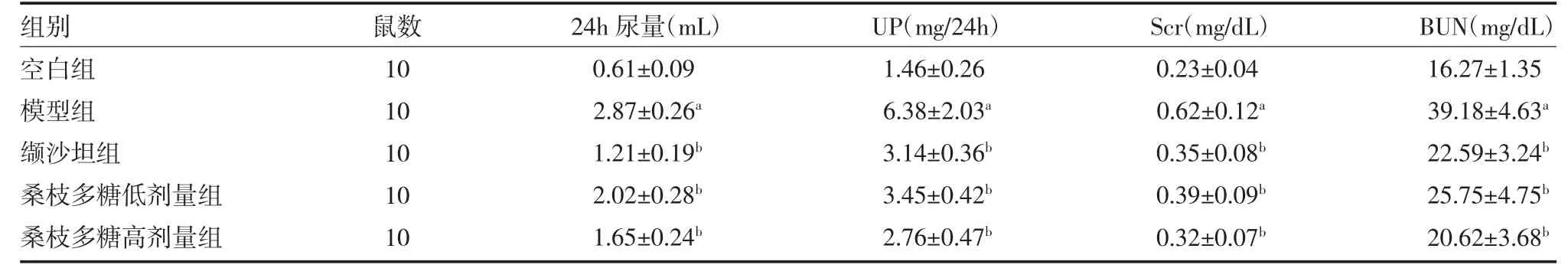
表2 桑枝多糖对db/db 小鼠24h 尿量、UP 及血清Scr、BUN 的影响()
注:空白组为db/m 小鼠,予生理盐水;模型组为自发型2 型糖尿病db/db 小鼠,予生理盐水;缬沙坦组为自发型2 型糖尿病db/db 小鼠予20mg/kg缬沙坦混悬液;桑枝多糖低剂量组为自发型2 型糖尿病db/db 小鼠予600mg/kg 桑枝多糖混悬液;桑枝多糖高剂量组为自发型2 型糖尿病db/db 小鼠予1200mg/kg 桑枝多糖混悬液;UP 为尿白蛋白;Scr 为血清肌酐;BUN 为尿素氮;与空白组比较,aP<0.05;与模型组比较,bP<0.05
3.3 桑枝多糖对db/db 小鼠肾组织病理学变化 肾脏病理切片结果显示,空白组小鼠肾小球数量多,分布广泛,其结构饱满完整。模型组小鼠肾小球囊腔内皱缩严重,肾小球基底膜均质性增厚且出现大量空泡及细胞核固缩现象,数量较少。缬沙坦及桑枝多糖低、高剂量组小鼠肾小球囊腔皱缩程度减少,仍有空泡出现,肾小球数量较模型组多。见图1。
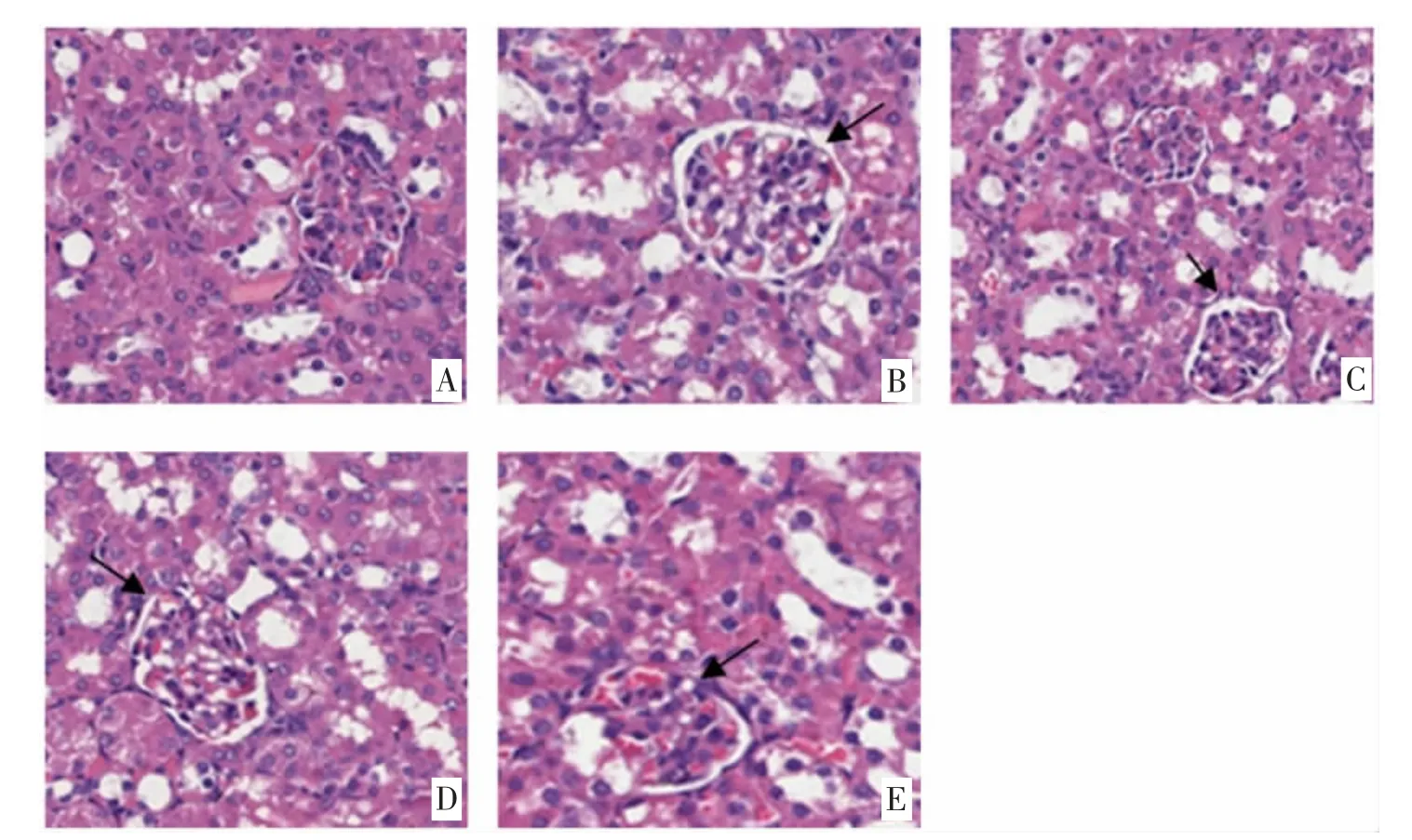
图1 桑枝多糖对db/db 小鼠肾组织病理学变化(HE 染色×400)
3.4 桑枝多糖对db/db 小鼠肾组织炎症因子、趋化因子的影响 与空白组比较,模型组小鼠肾组织炎症因子TNF-α、IL-6、MCP-1 含量显著升高(P 均<0.05)。与模型组比较,缬沙坦组及桑枝多糖低、高剂量组小鼠肾脏TNF-α、IL-6、MCP-1 含量明显降低(P 均<0.05)。见表3。
表3 桑枝多糖对db/db 小鼠肾组织炎症因子、趋化因子的影响(ng/L,)
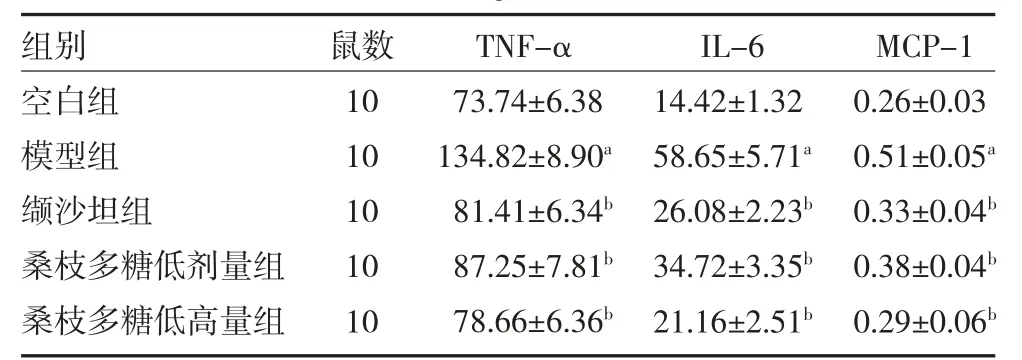
表3 桑枝多糖对db/db 小鼠肾组织炎症因子、趋化因子的影响(ng/L,)
注:空白组为db/m 小鼠,予生理盐水;模型组为自发型2 型糖尿病db/db 小鼠,予生理盐水;缬沙坦组为自发型2 型糖尿病db/db 小鼠予20mg/kg 缬沙坦混悬液;桑枝多糖低剂量组为自发型2 型糖尿病db/db 小鼠予600mg/kg 桑枝多糖混悬液;桑枝多糖高剂量组为自发型2型糖尿病db/db 小鼠予1200mg/kg 桑枝多糖混悬液;TNF-α 为肿瘤坏死因子-α;IL-6 为白介素-6;MCP-1 为单核细胞趋化蛋白-1;与空白组比较,aP<0.05;与模型组比较,bP<0.05
3.5 桑枝多糖对db/db 小鼠肾组织纤维指标的影响与空白组比较,模型组小鼠肾组织TGF-β1、FN、CTGF、CollagenⅠ含量显著升高(P 均<0.05)。与模型组比较,缬沙坦组及桑枝多糖低、高剂量小鼠肾脏TGF-β1、FN、CTGF、CollagenⅠ含量明显降低(P 均<0.05)。见表4。
表4 桑枝多糖对db/db 小鼠肾组织纤维指标的影响(ng/mL,)
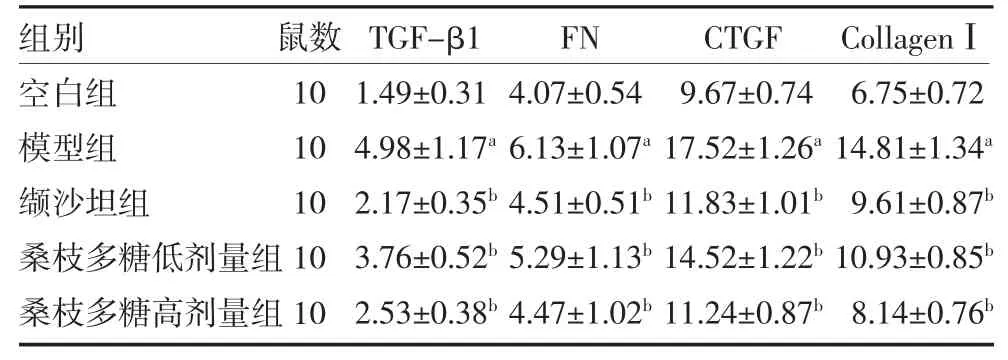
表4 桑枝多糖对db/db 小鼠肾组织纤维指标的影响(ng/mL,)
3.6 桑枝多糖对db/db 小鼠肾组织YAP、TAZ 表达的影响 与空白组比较,模型组小鼠肾组织YAP、TAZ 蛋白表达显著增加(P 均<0.05)。与模型组比较,缬沙坦组及桑枝多糖低、高剂量小鼠肾组织YAP、TAZ 蛋白表达降低(P<0.05)。见表5、图2。
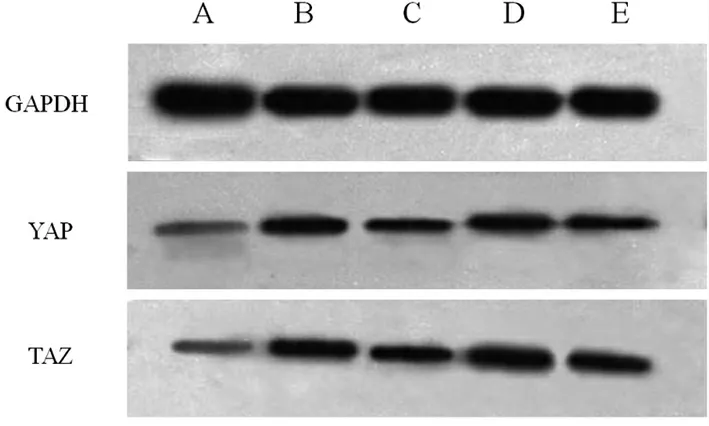
图2 桑枝多糖对db/db 小鼠肾组织YAP、TAZ 表达的影响
表5 桑枝多糖对db/db 小鼠肾组织YAP、TAZ 表达的影响()

表5 桑枝多糖对db/db 小鼠肾组织YAP、TAZ 表达的影响()
4 讨论
DN 发病机制复杂,主要由于长期的高血糖影响,造成肾小球血流动力学的改变、引起肾小球高压,肾脏系膜细胞受刺激后增殖、肥大,使基质增生[8]。同时肾素-血管紧张素-醛固酮系统(RAAS)的过度活跃和大量活性氧、炎症因子的生成,导致肾小球足细胞损伤、提高肾脏细胞外基质(ECM)的增殖水平,促使肾脏的炎症及纤维化的发生[9]。肾脏纤维化是DN 进入终末期的病理过程,其病程一般分为五期,主要以肾小球滤过率、肾小球毛细血管基底膜的厚度及宽度、蛋白尿、肾小管间质纤维化、肾小球硬化等指标判断病程的发展。
肾小球和肾小管的巨噬细胞炎性浸润及其大量聚集,是糖尿病肾损伤的主要病理特征[10]。在高糖环境下,单核细胞在黏附分子ICAM-1、VCAM-1 及趋化蛋白MCP-1 的作用下迁移到肾脏微环境,分化为巨噬细胞及进一步活化,释放炎症因子TNF-α、IL-6及纤维化因子TGF-β1 等细胞因子,加重肾组织的炎症反应,诱导肾脏局部慢性亚临床肾炎,促使肾小球系膜细胞对ECM 的分泌增加,进而引起成纤维细胞的增殖,系膜细胞外基质沉淀肾小球硬化及间质纤维化,促进糖尿病肾纤维化的发展[11-12]。
YAP/TAZ 复合物是对进化上有着高度保守的Hippo 信号通路的核心元件,其对器官大小的调控,肾脏成纤维细胞增生,肌成纤维细胞生成、分化、凋亡等重要的生物学过程均发挥着重要的作用。其中YAP 是调节细胞的增殖、分化及介导上皮间质转化的关键因子。肾脏正常状态下,磷酸化的YAP 与14-3-3 调控蛋白结合,调控CTGF、FN、CollagenⅠ等下游靶因子的表达,维持细胞生存平衡[13]。肾脏高糖内环境下,去磷酸化的YAP 会从细胞质向细胞核迁移且活化,与组织TEAD 相互作用,激活重要的纤维因子CTGF,促进细胞增殖和细胞外基质合成,以肾纤维化的方式修复慢性肾脏疾病的肾脏损伤[14]。TAZ 是YAP 的同源蛋白,在DN 的进展中发挥重要作用。研究表明,TAZ 在肾脏足细胞和肾小管上皮细胞的高表达,可激活纤维蛋白CTGF 的表达,进一步加重DN 的肾纤维化[15]。另外,由于YAP 诱导肾小管TGFβ1 表达,进而刺激HK-2 细胞,导致TAZ 蛋白表达增加,引发HK-2 细胞的增殖缺陷,介导细胞增殖和细胞外基质合成及肾纤维化的形成[16]。
实验结果表明,桑枝多糖能有效改善DN 小鼠肾功能及肾组织的病理变化,减低肾脏间质纤维化指标TGF-β1、FN、CTGF、CollagenⅠ、炎症因子TNFα、IL-6 及趋化蛋白MCP-1 含量,以减缓肾脏间质纤维的形成;同时降低肾组织YAP、TAZ 表达。提示,桑枝多糖可能通过调节肾组织YAP、TAZ 的蛋白表达,及抑制YAP/TAZ 信号通路下游的趋化蛋白MCP-1、纤维化指标TGF-β1、FN、CTGF、CollagenⅠ及炎症因子TNF-α、IL-6 生成,减缓肾脏间质纤维的形成及炎症因子对肾组织的攻击损害,降低细胞外基质合成,达到抗纤维化的作用。

