生物硝化抑制剂的研究进展及其农业应用前景*
陆玉芳,施卫明
(土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
大量施用氮肥为作物增产做出了巨大贡献,维持了全世界 70 多亿人口的粮食供应[1]。在目前产量水平下,我国三大粮食作物水稻、小麦、玉米每季推荐施氮量范围大致为150~250 kg·hm-2(以N计,下同)[2-4],但我国很多田块的氮肥施用量达到了250~350 kg·hm-2[5]。由于过量施肥和不合理的管理措施[6],我国目前主要粮食作物的当季氮肥利用率仅为 30%~40%[4,7-8],明显低于一些发达国家和地区 40%~60% 的水平[9]。根据联合国粮食及农业组织(FAO)的统计资料[10],我国氮肥年用量为3 000万t,持续高量的氮肥投入造成农业氮素损失严重,引发水体富营养化、温室气体排放和土壤酸化等一系列生态环境问题[11-12]。因此,如何在现有施肥和生产模式下,达到提高作物氮素利用率和降低氮素环境污染的目的[8,13],成为新形势下我国农业发展的重要需求。
这种氮素利用率低和氮污染的困境与氮高度活跃及其转化过程多样有关。在农田生态系统中,有机氮会通过矿化作用转化为铵态氮铵态氮会通过硝化作用转化为硝态氮无机态的容易被植物吸收利用会通过反硝化作用转化成N2O和N2,也会通过厌氧氨氧化(anaerobic ammonium oxidation,anammox)和硝酸盐异化还原为铵(dissimilatory nitrate reduction to ammonium,DNRA)过程转化为N2和,N2再通过生物固氮作用进入土壤转化为氨。然而,随着氮肥大量施用,土壤中未被农作物吸收的和会损失至环境中,如硝化作用产生的会随淋溶途径进入水体造成富营养化,硝化和反硝化作用产生的N2O 气体会加剧温室效应,此外还会有氨挥发损失[14]。在现代农业氮循环中,硝化作用与氮素损失和利用密切相关,成为提高氮素利用率和减少氮污染的关键过程[15-16]。合理抑制硝化作用是高投入条件下走出氮素管理困境的有效途径之一。
利用化学合成硝化抑制剂(synthetic nitrification inhibitors,SNIs)是减少氮流失风险和提高氮肥利用率的一项重要措施,在生产实践中得到了较普遍的应用。目前在农业上广泛应用的 SNIs 有 3 种:(1)双氰胺(dicyandiamide,DCD),(2)3,4-二甲基吡唑磷酸盐(3,4-dimethylpyrazole phosphate,DMPP),(3)2-氯-6-三氯甲基吡啶(2-chloro-6-trichloromethyl pyridine,nitrapyrin)。通过 Meta 数据分析发现,SNIs 和尿素同时使用能显著减少 48% 的淋溶,44% 的 N2O 排放[17-18],同时增加 7.5% 的作物产量和 12.9% 的氮素利用率(nitrogen use efficiency,NUE)[19]。SNIs 的有益效果受环境因子(如土壤pH、质地、温度)和农艺管理措施(如灌溉和氮肥用量)的影响[19]。由于能在农业生产中规模应用的SNIs 品种非常有限,且多为化工产品,其应用不仅会增加农业生产成本,还可能对环境和食品安全造成潜在威胁[20-21]。因此,在我国现代农业绿色发展的要求下,有必要寻求控制硝化作用的环境友好替代方案。本文针对生物硝化抑制剂在提高氮素利用率和减少氮环境污染方面的研究进展及其重要作用进行了系统总结。
1 生物硝化抑制剂在生态系统中的意义
2006年,日本国际农林水产业研究中心Subbarao高级研究员正式提出了“生物硝化抑制作用(biological nitrification inhibition,BNI)”的概念,它是指植物根系产生和分泌能抑制土壤硝化作用物质的能力;植物根系产生和分泌的抑制硝化作用的物质,则称为生物硝化抑制剂(biological nitrification inhibitors,BNIs)[22]。事实上,早在20世纪六七十年代,研究人员就发现在森林和草地生态系统中,包括树木、灌木、草、草药和苔藓等植物组织中有BNI活性[23-24],从而推测根系分泌的BNIs是驱动生态系统演替的关键机制。
研究普遍发现,在氮营养缺乏的环境中生长的植物通常具有BNI活性。短梗苞茅(Hyparrhenia diplandra)和非洲湿身臂形草(Brachiaria humidicola)这两种热带草受到的关注较多,田间试验表明它们生长的土壤硝化潜势和硝酸盐含量低[25-28]。Subbarao等[29]随后通过生物化学发光法发现Brachiariahumidicola的根系具有最强的BNI活性。Janke等[30]指出澳大利亚当地物种木槿(Hibiscus splendens)和刺茄(Solanum echinatum)的根系分泌物具有BNI活性,而它们正是生长在氮素养分缺乏的贫瘠土壤中。最近,研究人员在硝化速率低的温带森林树木欧洲云杉(Picea abies)和高加索冷杉(Abies nordmanniana)组织中也发现了BNI功能[31]。可见,BNIs可能是植物适应低氮环境的一种保氮生存机制[25,29]。
与自然生态系统以及传统农业耕作体系相比,现代高投入农业生产体系土壤的硝化作用迅速,硝化速率增加了数倍[32],BNIs 对于农田土壤硝化过程的调控值得关注。一些早期研究表明,适应高氮环境的植物BNI能力通常较弱。在牧草中,黍属(Panicumspp.)相对于臂形草属(Brachiariaspp.)更适应高氮环境,其根系BNI活性较弱[29];在大田作物中,适应低氮投入的高粱(Sorghum bicolor)根系分泌物有显著的BNI能力,而在高氮环境生长的水稻(Oryza sativaL.)、小麦(Triticum aestivum)和玉米(Zea maysL.)却无硝化抑制活性[29]。但是相关的研究涉及的作物品种并不多,仅关注了粮食作物的单个品种,这很有可能忽视了BNI在三大粮食作物中的重要作用。最近O'Sullivan 等[33]对98种基因型小麦的调查研究,推翻了基于单一品种小麦几乎不具有BNI或无BNI的观点。该研究表明,目前使用的几种地方品种和两个商业品种的根系分泌物均具有显著的BNI活性。此外,BNI在硝化作用弱的水作植物中不重要的观点也很快被扭转。Pariasca Tanaka 等[34]在一项对36种水稻基因型根系分泌物的研究中发现约有半数品种具有明显的BNI作用。施卫明研究员课题组通过19种水稻基因型的筛选实验表明,籼稻和粳稻的根系分泌物均具有较强的BNI活性,进一步通过根系分泌物精细分离和气相色谱-质谱联用(GC-MS)鉴定技术,首次明确了水稻分泌的BNIs 物质是1,9-癸二醇[35]。尽管目前尚未有证据表明玉米具有BNI功能,然而在玉米广阔的遗传资源背景下过早地排除其BNI功能还为时尚早[14]。鉴于水稻、小麦和玉米等粮食作物的氮肥投入强度和经济价值,对作物BNI的研究将对氮肥减施增效具有重要意义。可见,BNIs 在高量氮投入的农业中同样能发挥一定作用,具有减少农田氮素流失和提高作物氮素利用的潜能[14,36](图1)。
2 根系分泌生物硝化抑制剂的种类与功能
2.1 生物硝化抑制剂的种类
尽管目前已明确了草类、树木和作物等根系分泌物的BNI活性,但对具体起作用的关键BNIs 物质了解甚少,而只有真正揭开它们的面纱,才能有的放矢地服务于农业生产。早期对于BNI化学物质的识别局限于植物组织或土壤提取物[37-39],而不是根系分泌物,其中原因之一可能是根系分泌物含量低、易分解、干扰物质多,收集和分离难度较大。然而相对于植物组织提取物,根系主动分泌的BNIs更可能具有BNI作用[33],挖掘根系分泌物中的BNIs物质将更有意义。近十年来,随着根系分泌物收集、分离和鉴定技术的快速发展,已从高粱、湿身臂形草和水稻的根系分泌物中发现了5 种BNIs(表1)。

表1 根系分泌生物硝化抑制剂的种类和效果Table 1 Types and effects of biological nitrification inhibitors exuded from roots
2008年,从高粱一个高BNI活性品种Sorghum bicolor根系分泌物中发现了第一种BNIs——对羟基苯丙酸甲酯(methyl 3-(4-hydroxyphenyl)propionate,MHPP),该苯丙酸类物质具有中等的BNI活性[39]。随后,Subbarao 等[40]又从高粱中发现了2 种BNIs,分别是亲水性组分中发现的黄酮类化合物樱花素(sakuranetin),以及从疏水性组分中发现的苯醌类化合物高粱酮(sorgoleone),该物质对高粱根系分泌物BNI活性具有主导作用。该团队2009年还从Brachiaria humidicola根系分泌物中发现了一种环状二萜物质,命名为臂形草内酯(brachialactone)[41],它是湿身臂形草根系分泌物中的BNI主导物质,贡献率达60%~90%。最新的一种根系分泌BNIs 来自国内施卫明研究员团队,他们从水稻中发现了脂肪醇类化合物1,9-癸二醇(1,9-Decanediol),这是三大粮食作物中发现的首个BNIs,相比于已知的BNIs物质抑制活性处于中等水平,但效果显著优于已在农牧业生产中普遍应用的DCD[35]。
然而,上述BNIs物质的功能验证是在单个欧洲亚硝化单胞菌(Nitrosomonas europaea)的纯培养体系中进行的,在复杂土壤体系中的效果尚有待考证[32]。研究发现,臂形草[36]、水稻[33]和小麦多个品种[34]根系分泌物总组分BNI活性在纯菌培养和土壤体系下的效果一致,这为后期从作物遗传群体中筛选高BNI活性品种提供了重要依据。对于具体BNIs化学物质,来自臂形草的臂形草内酯由于化学标准品难获得,尚无证据证明其在土壤中的效果[41]。高粱BNIs MHPP和高粱酮在中性土壤中表现出显著的抑制效应[40,42,44],而亲水性物质樱花素添加至土壤后却失去了活性[40]。最新研究还证实,水稻源1,9-癸二醇对我国三种典型农田土壤(碱性潮土、中性水稻土和酸性红壤)硝化活性均有显著抑制作用[44]。未来单个BNIs物质的功能验证建议考察其在不同土壤类型下的效果。
高粱根系分泌物中具有疏水性BNIs和亲水性BNIs共存的现象,表明 BNIs 在作用方式上可能是空间分离的,疏水性、迁移能力弱的BNIs 在根际占主导,而亲水性的物质能扩散至根系较远的距离起作用[40]。此外,在土壤环境中具有独特生化活性的不同BNIs 共存时,可能会发生叠加和协同作用[44-45],这通常是纯菌株体系下的生物活性研究忽略的。这一定程度上能解释根系分泌物总组分在土壤中有BNI活性,而单个BNIs 无显著效果的现象,可能与不同BNIs之间的时空协同效应有关,值得进一步关注。
2.2 生物硝化抑制剂的功能
植物产生BNIs是对硝化环境的特定响应,还是它们具有多种的生化功能,抑制硝化作用仅是巧合的副作用?事实上,植物产生和分泌的BNIs 具有很多氮代谢以外的功能,例如,湿身臂形草叶中的关键BNIs物质α-亚麻酸是植物细胞膜的主要成分[46],高粱根系分泌的高粱酮是一种常见的化感物质和除草剂[47]。然而,O'Sullivan 等[33]认为如果化合物从根部主动分泌,而不是通过随机过程(如凋落物分解和膜渗漏)释放,更可能具有特定的BNI作用。他们发现在小麦不同品种组织与根系分泌物中BNIs的活性无显著相关性,表明不同BNIs具有功能特异性和独立性。Pariasca Tanaka等[34]也提出水稻分泌BNIs 是一个膜调节的过程而不是被动的非特异性组织渗漏过程。
根系BNIs的分泌通常受根际环境因子的特异诱导。研究发现,根系在接触时有一个快速和明显的BNIs分泌,而接触后却无响应。这个现象在湿身臂形草[41],高粱[39]、小麦野生近缘物种大赖草[46]和水稻[48]中均加以了证实,增强了人们对BNIs具有特定功能的信心。而且,在高粱中发现这种诱导与根细胞中质膜(PM)H+-ATPases的活性及NH3同化有关[49-50]。此外,在水稻中发现根际良好的通气情况有利于水稻分泌更多1,9-癸二醇(图2),研究人员猜想根系分泌BNIs和根系泌氧这两个对硝化作用一正一反的生物学过程可能共同调控根际硝化强度[48],维持合理铵硝比,从而有利于水稻的氮素吸收和生长[51]。更有趣的是,在水稻中还发现根际亚硝化细菌的存在能特异刺激1,9-癸二醇的分泌(图2),而反硝化细菌却无此诱导效应[48]。而硝化细菌对1,9-癸二醇的特异诱导可能与微生物分泌的群体感应(QS)信号分子有关(陆玉芳等,未发表数据),进一步表明BNIs可能是植物-微生物根际互作中的特定化学信号物质。而且,19个水稻品种根系分泌物的BNI活性、1,9-癸二醇含量与铵态氮利用和偏好正相关[35]。上述研究均说明了植物根系感应到有利于硝化环境的因子后,能主动分泌BNIs的特定信号物质,调控根际硝化强度至适宜范围内。
BNIs受环境特异诱导产生后,还存在着功能分配的特点,即BNIs在根际除了抑制微生物硝化过程外,还可能在土壤-植物-微生物互作系统起其他信号作用。以高粱分泌的BNIs 物质MHPP为例,中国科学院西双版纳热带植物园徐进研究员团队发现了MHPP对根构型塑造的信号调控功能[52]。MHPP主要通过干扰一氧化氮/活性氧(NO/ROS)的生长素信号途径,从而抑制Arabidopsis thaliana根尖分生区细胞分裂及主根伸长[52]。值得注意的是,的调控。如上文提到的,根际氮形态对BNIs的分泌具有重要影响,供能显著促进植物分泌BNIs,而在环境中的植株几乎不分泌BNIs[39,41,46,48]。此外,BNIs的分泌还受根际浓度的影响。在0~1 mmol·L-1时,高粱BNIs分泌量随浓度增加而显著增强,但当 NH+4大于1 mmol·L-1时,BNIs的分泌不再提高[50],在水稻中也发现了类似的结果[48]。而且,最新的研究还发现,根际良好的通气情况和硝化细菌能促进水稻分泌更多1,9-癸二醇,而反硝化细菌却无此诱导效应[48],这表明水稻根系BNIs 与硝化细菌之间存在着化学信号交流,但具体的信号互作机制尚缺乏研究。总体而言,BNIs似乎受到有利于硝化环境的影响因子诱导。
3 生物硝化抑制剂的分泌与作用机制
3.1 生物硝化抑制剂的分泌机制
在更微观水平上,目前在BNIs从根系分泌的分子转运机制方面也取得了一定进展。由于化学性质的差异,亲水性BNIs和疏水性BNIs的相关分子机制有所不同。亲水性BNIs 属于阴离子物质,很可能通过阴离子通道释放[49]。质膜H+-ATP酶对高粱亲水性BNIs(MHPP)的分泌起了重要作用,且与根系细胞中吸收和同化密切相关[49-50]。最近通过对三种基因型高粱的分析,进一步证实根际(≤1.0 mmol·L-1)和低pH促进了根系质膜H+-ATP酶活性,并通过电压依赖性的阴离子通道将带负电荷的亲水性BNIs转运出质膜[55]。该研究同时也指出,高粱疏水性BNIs的分泌与根际pH关系不明显,与高粱的基因型有关。Hybridsorgo基因型中疏水性BNIs的分泌不随pH变化,但在PVK801和296B基因型中却随pH升高而增强,这表明高粱疏水性BNIs的分泌可能依赖于其他膜转运过程。在水稻中,Zhang等[48]却发现疏水性1,9-癸二醇的分泌同样受根际低pH的诱导。这也是水作植物水稻相比旱作植物高粱的另一个分泌机制差异。
作为一种中性不带电的脂肪醇类化合物,1,9-癸二醇在细胞中不易受到离子极化作用,可能会通过腺苷三磷酸结合盒(ABC)转运蛋白或多药和有毒化合物排出家族(MATE)转运蛋白进行转运。值得注意的是,ABC转运蛋白已被证明可介导根系分泌物的释放,如脂肪酸和黄酮类物质[56],而1,9-癸二醇属于脂肪酸衍生物,樱花素与黄酮属于同一化学物质类别。Badri等[57]利用拟南芥突变体材料直接证明脂肪酸类化合物3-羟基-顺-4,6,8,10-四烯酸受ABC转运蛋白转运。这项研究同时也指出同一种化合物可由不同的转运蛋白转运,如反向转运蛋白MATE转运蛋白,而一些BNIs可能正是通过该蛋白家族成员释放的,如黄酮类物质[58]。这两类转运蛋白是否真正参与了BNIs的分泌尚有待进一步证明,但已知的根系分泌物从植物细胞膜的转运与释放途径能为BNIs的分泌机制提供理论参考。自由扩散和囊泡运输是另外两种常见的根系分泌物转运途径[56]。BNIs 物质分子量较大,具有电荷或极性,且很多BNIs(如高粱酮)具有潜在的细胞毒性,通过自由扩散转运的可能性不大[8]。根系分泌的高分子量物质通常涉及囊泡运输途径,如高粱酮,通过超微结构分析在高粱根毛中发现细胞富含囊泡[59]。然而,高粱酮分泌的具体分子机制目前尚不清楚,是否还有其他BNIs如臂形草内酯,通过类似过程释放也有待进一步研究。根据以上结果,本文提出了根系分泌BNIs由植物细胞膜释放的机制假说(图3)。
3.2 生物硝化抑制剂的作用机制
氨氧化是氨(NH3)氧化为亚硝酸盐(NO2-)的生物学过程,被认为是硝化作用的限速步骤,由氨氧化细菌(ammonia-oxidizing bacteria,AOB)、氨氧化古菌(ammonia-oxidizing archaea,AOA)和近年来新发现的全程硝化菌(complete ammonia oxidizer,comammox)主导。AOB 是高氮投入下的中性和碱性土壤环境中硝化作用的主要驱动者[60],而AOA 由于对底物 NH3的亲和力更高,在低氮和强酸性土壤环境中占主导[61]。基于基因组序列,comammox 似乎具有广泛的代谢通用性,因此可能在多种环境中具有竞争力[62]。三者生态位的分化可能是由于它们在氨氧化途径中的进化差异导致的[63]。氨单加氧酶(ammonia monooxygenase,AMO)和羟胺氧化还原酶(hydroxylamine oxidoreductase,HAO)是AOB、AOA和 Comammox 进行氨氧化的关键酶。AOB 的 AMO 三聚体膜结合蛋白由 amoA、amoB 和 amoC 3个亚基组成,其中 amoA 是 AMO的活性多肽位点。相对于AOB,AOA的氨氧化途径尚不清晰,但基因组分析表明 AOA 具有编码 3个亚基的独特同源基因,且体内包含ORF38或amoX基因,可能会编码第四个AMO亚基[64];此外,AOA 的amoB 活性位点不保守,且缺少编码 HAO基因。与AOB 相似,comammox 含有编码 AMO 和 HAO 的amo和hao基因,但与AOB 不同的是,comammox仅有一个amoCAB启动子区域,有 2 个其他的amoC基因,但总体上与 AOB 关系最密切。
目前在农业上广泛使用的SNIs(DCD,nitrapyrin和DMPP),主要作为竞争性底物或金属螯合剂结合amoB亚基的活性位点Cu起抑制作用[65]。Nitrapyrin还能作为amoB的替代底物,其产物将对氨氧化产生不可逆的影响[66]。但BNIs在生化层面的作用方式尚缺乏研究。在菌株纯培养体系下,DCD和nitrapyrin仅能作用于AMO,却对HAO无效果[39,41],而大多数根系分泌的BNIs(臂形草内酯、高粱酮和樱花素)却能同时抑制Nitrosomonas europaeaAMO和HAO的活性[14,41](表 2),包括Brachiaria humidicola地上部组织中发现的亚麻酸和亚油酸[38]。而且,臂形草、小麦近缘种和高粱的根系分泌物总组分也能同时抑制AMO和HAO的活性[39,41,45]。由此可见,BNIs可能较SNIs调控更多的硝化酶位点。
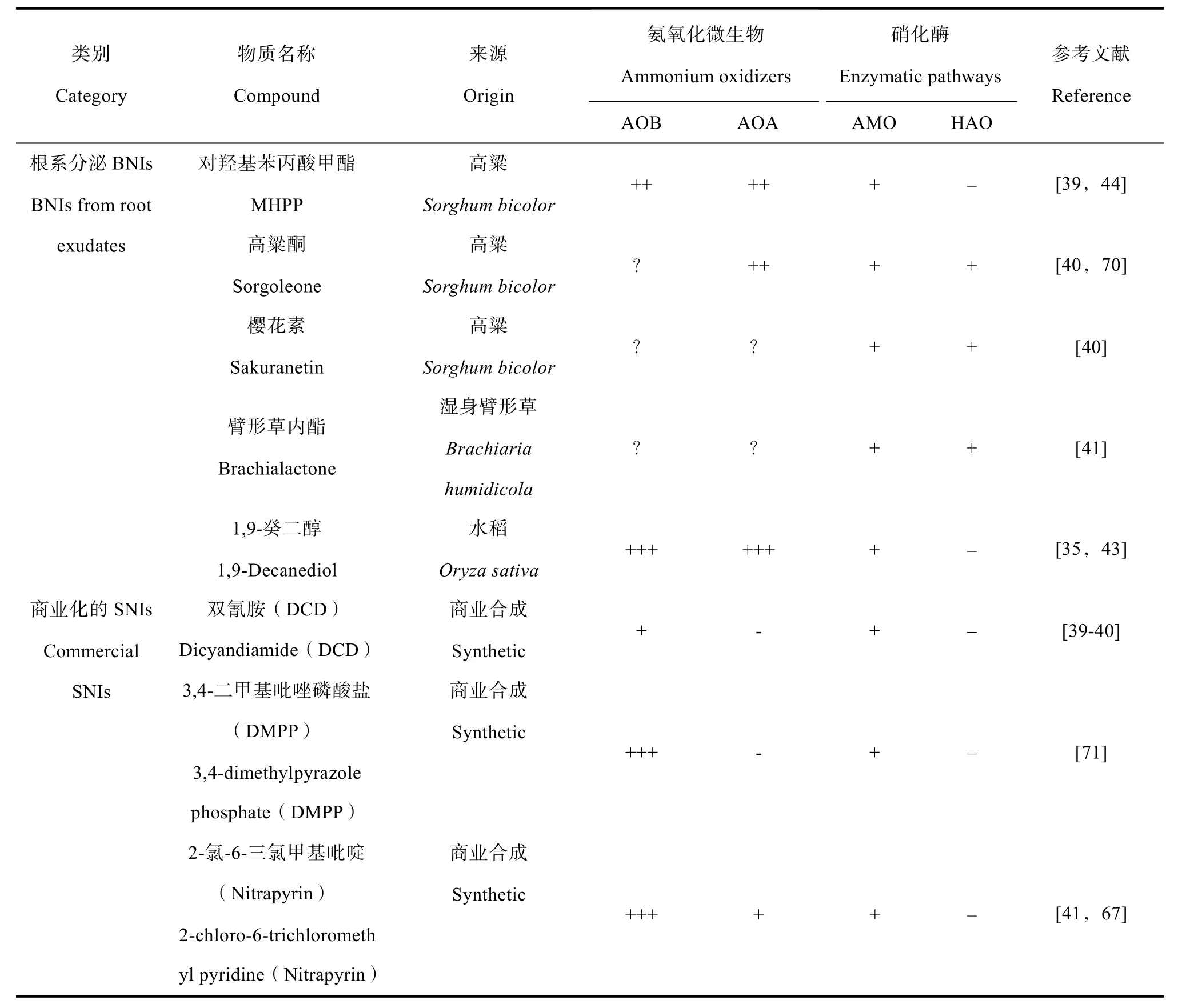
表2 主要生物硝化抑制剂和化学合成硝化抑制剂的作用机制Table 2 Mechanism of the main biological nitrification inhibitors and chemical nitrification inhibitors
在调控硝化微生物种类方面,化学合成硝化抑制剂DCD、 nitrapyrin 和DMPP大多数情况下仅对AOB有显著抑制,对AOA基本无抑制作用[67],这可能与AOA中amoB 亚基空间结构与AOB不同有关。大量研究表明,植物分泌BNIs 似乎能作用于更多的氨氧化微生物种类。例如,Subbarao 等[41]通过田间实验发现,种植高BNI活性的臂形草能同时抑制AOA和AOB丰度。Byrnes等[68]和Nuñez等[69]也陆续证明臂形草根系分泌物能作用于AOA。在BNIs 化学物质单独添加的研究中,Nardi 等[44]证明BNIs 物质MHPP能同时抑制土壤AOB和AOA丰度。Lu 等[43]利用土壤培养实验发现1,9-癸二醇添加能显著抑制三种农田土壤潮土、水稻土和红壤的AOA和AOBamoA基因丰度。Sarr 等[70]利用盆栽实验发现高粱酮对土壤AOA丰度有显著抑制。可见,BNIs具有同时抑制AOB和AOA的潜力。最新研究还明确了森林杉树凋落物对硝化细菌(NOB)硝化杆菌属(Nitrobacter)的调控作用[31]。除了AOB和AOA,后续研究建议同时关注comammox和NOB对BNIs的响应。
氨氧化微生物对不同类型硝化抑制剂敏感性的变化可能是由于AMO酶或氨氧化途径的差异,以及细胞差异引起的[67]。鉴于AOA和comammox对硝化作用的重要贡献,目前仅对AOB有效果的SNIs有待升级。大多数情况下DCD和DMPP 等SNIs仅在AOB占主导的中性和碱性土壤中发挥作用,而能同时调控AOA和AOB的BNIs潜在应用范围将更广泛,特别是在AOA占主导的酸性土壤上[43],这是BNIs相比于SNIs的优势之一。事实上,除了能抑制AOB,能更广谱地调控AOA和comammox的BNIs在土壤中的效果可能会更加持久[16]。而且,BNIs(或BNIs混合物)能作用于不同的氨氧化途径或氨氧化微生物种类,降低环境中硝化微生物对硝化抑制剂的抗性[16]。此外,BNIs在实际土壤-植物系统中还具有时空持续、精准释放的特点,这是其优于SNIs的另一大优势,而SNIs在土壤中有效期普遍较短。
4 生物硝化抑制剂在农业生产上的应用前景
BNIs环境友好,在农业上具有温室气体减排、氮素增效和作物丰产的潜力[14,72],但目前尚缺乏BNIs的田间实际应用研究。研究人员多年来一直在探寻高效利用BNI功能的方法,其中种植高BNI活性的植物或直接覆盖牧草组织是减少农业环境中N2O排放和提高氮素利用率的有效途径之一。最经典的例子来自Subbarao等[41]哥伦比亚热带国际农业中心的3年田间实验,与大豆或对照试验小区相比,种植高BNI活性的臂形草试验小区抑制了90%的N2O排放。Byrnes 等[68]将高 BNI 活性热带牧草B. humidicola(CIAT 679)组织覆盖至土壤牛尿斑块后,发现N2O排放较低BNI活性的牧草B. hybrid‘Mulato' 减少了60%。BNI的田间应用也逐渐拓展至蔬菜和粮食作物上。Zhang等[73]通过2年的蔬菜田间试验,发现与BNI效应强的高粱轮作后,菜地N2O排放量降低了18.1%,高于Nitrapyrin处理下的16.5%,而且蔬菜的氮素利用率提高了6.7%,产量增加了10.3 t·hm-2·a-1。Karwat等[74]在牧草-玉米轮作田间实验中发现种植高BNI活性牧草后显著提高了后茬玉米的氮素利用率和产量。因此,这种高BNI活性植物(如牧草)与其他作物轮作的农艺措施有望向农民推广应用。
此外,BNIs 物质作为新型的氮肥增效剂具有一定的产业化前景,然而这方面的研究正处于初级阶段。在一项MHPP对秸秆和牛粪堆肥减排的野外研究中,人们发现0.6% MHPP 能减少N2O排放达62.39%[75]。Lu等[43]通过室内培养实验提供了BNIs 1,9-癸二醇减少农田土壤N2O排放量的证据,明确1,9-癸二醇对三种农田土壤N2O平均减排为48%,特别是在酸性红壤上高达90%,效果显著优于DCD,这可能与1,9-癸二醇对AOA丰度和群落结构的有效抑制有关。Sun 等[35]结合19个水稻品种室内水培和15N同位素示踪实验,发现水稻BNI活性、1,9-癸二醇含量与水稻铵态氮吸收正相关,表明1,9-癸二醇有提高作物氮素利用的潜力。目前迫切需要研究1,9-癸二醇等BNIs物质的田间增效减排效果。
利用BNI性状进行作物遗传改良是提高作物氮素利用率的一条新途径。近年来研究人员一直尝试解析调控BNI活性和BNIs 分泌的关键基因。不同品种热带牧草、高粱、小麦和水稻的根系分泌物BNI活性存在显著变异[33-34,42,45]。在高粱中,其分泌的BNIs物质高粱酮含量具有显著的品种差异性[42]。在水稻中也发现19个水稻品种根系分泌的1,9-癸二醇与BNI活性呈显著正相关[35]。这些结果为进一步通过遗传学方法克隆控制BNI活性或BNIs 分泌的关键基因位点提供了理论依据。在粮食作物中,Subbarao等[45]在前期发现小麦的一个野生近缘物种L. racemosus具有较高的BNI能力基础上,利用QTL技术将控制BNI活性的遗传位点定位于Lr#n染色体,并通过远缘杂交技术成功导入小麦栽培品种中。澳大利亚O'Sullivan团队[33]在大量小麦地方品种中发现了BNI活性,增加了将BNI功能引入现代小麦品种的潜力。而且,该团队还进一步发现在澳大利亚西南部广泛生长的现代小麦品种Wyalkatchem具有中等的BNI活性,表明有必要将现代作物品种的测试范围扩大,进一步简化育种过程。在水稻中,研究人员也明确了现代水稻品种根系分泌物的BNI活性存在遗传变异,并采用全基因组关联分析(Genome wide association study,GWAS)确定了调控水稻BNI活性的遗传位点(施卫明等,未发表数据)。
5 研究展望
尽管BNIs 的研究目前处于起步阶段,但在过去的十年中已取得了相当多的进展:从臂形草、高粱和水稻根系分泌物中BNIs 物质的鉴定,到从现代小麦和水稻品种中发现了BNI活性,并揭示了BNI与氮素利用率的密切关系[35]。然而,为了更好地应对当今高投入条件下农业的氮素困境,满足农业氮素管理的需求,有必要进一步开发BNIs在根内-根际-土壤系统中的重要功能,诸多关于BNIs 的基础和应用研究值得深入:(1)继续探索重要农作物的BNI功能和BNIs物质类型,并兼顾BNIs 物质之间的互作关系;(2)进一步探索已知BNIs 物质抑制硝化的作用机理,除了氨氧化微生物AOA与AOB,还应关注新发现的Comammox对BNIs的响应,包括其他氮转化过程如反硝化,而BNIs引起的氨挥发潜在损失也有待评估;(3)随着分子生物学GWAS等先进技术的应用,结合国内外广泛的现代作物种质资源,未来将有望在调控BNI和BNIs分泌的关键基因及其分子遗传机制方面取得突破,为作物遗传育种提供新的思路与理论依据;(4)在农业生产上,应尽快开展BNIs的田间实验,探究BNIs在不同土壤条件下和不同作物中的增效减排效果,同时尝试开发基于BNIs的新型稳定性肥料产品,并在田间进行效果评估。
基于BNIs的新型肥料属于环境友好型产品,未来有望部分替代化学合成硝化抑制剂,特别在有机农业中有较广阔的应用前景,将对提升农产品品质安全,增强我国农产品的国际竞争力具有重大意义。同时,开发BNIs 技术和产品也将有利于提升农产品的经济附加值,推动现代农业绿色、高效和可持续发展。

