真空微波干燥中微波强度对胡萝卜和南瓜中类胡萝卜素生物利用率的影响
聂梅梅,肖亚冬,张钟元,李大婧,宋江峰,刘春泉,刘春菊,王晓燕,江 宁,冯 蕾
(江苏省农业科学院农产品加工研究所,江苏南京 210014)
类胡萝卜素是一种天然色素,研究表明其具有降低心血管疾病、抗氧化与保护视力等多种功能[1−2]。新鲜水果和蔬菜富含多种类胡萝卜素,是人们日常膳食中类胡萝卜素的主要来源,但研究发现新鲜水果蔬菜中类胡萝卜素在人体中的生物利用度不足5%[3−4]。植物中的类胡萝卜素主要以结合蛋白的形式存在于叶绿体或色素母细胞等有色体结构中[5],进一步经过细胞壁释放至消化系统中,被人体吸收利用。大量研究表明热加工过程对植物组织和细胞结构的破坏作用可能改变基质的渗透性,进而影响类胡萝卜素生物利用[6]。Bengtsson等[7]研究表明蒸煮前均质处理,有利于甘薯细胞壁破裂和有色体的聚集,从而显著提高β-胡萝卜素生物利用度。Zhang等[8]研究表明热风干燥增加胡萝卜和黄椒中类胡萝卜素释放量,原因是热风干燥导致细胞壁破裂;而西兰花中由于细胞体积小、细胞壁紧密结合,热加工中所受破坏小,因此其类胡萝卜素释放量较低。Palmero等[9]研究表明热处理导致番茄的细胞壁解聚产生的细胞壁组分形成了屏障,从而降低其番茄红素的生物利用度。由此可见,加工过程中食物类胡萝卜素基质环境的变化,是影响类胡萝卜素的生物利用率重要因素。
真空微波干燥能较好地保留被干燥物料原有的色香味、维生素等热敏性营养成分或生物活性成分,显著提高和改善干燥产品品质,已在食品加工行业广泛应用[10−11]。研究发现,当压强、微波功率适当时,会使细胞壁破裂,营养素大量释放[11−12]。汪小娉等[13]研究发现增大真空度有利于提高类胡萝卜素保留率。此外,真空微波干燥可改变细胞壁多糖的亲水性,使细胞壁皱缩变形[14],微波处理对果蔬细胞壁微观结构的影响正是类胡萝卜素生物释放所需条件,但与类胡萝卜素生物利用率的关系尚不明确。为了明确微波干燥过程中,不同微波强度条件下蔬菜中类胡萝卜素生物利用率的变化规律,本实验以富含类胡萝卜素的胡萝卜和南瓜为原料,基于细胞壁结构的变化,采用体外模拟消化法,探究不同微波强度对南瓜和胡萝卜类胡萝卜素保留率、生物利用率的影响,探讨食物加工方式对类胡萝卜素基质环境的作用进而对其生物利用的影响,以期为类胡萝卜素高效生物利用提供理论基础。
1 材料与方法
1.1 材料与仪器
胡萝卜品种‘心黑田五寸’、南瓜品种‘蜜本南瓜’
南京市孝陵卫集贸中心;β-胡萝卜素、叶黄素标准品 美国Sigma公司;丙酮、无水乙醇、盐酸、硫酸、氢氧化钠、氯仿、磷酸氢二钠、磷酸二氢钠、碳酸氢钠 分析纯,国药集团化学试剂有限公司;甲醇、甲基叔丁基醚(MTBE)色谱纯,美国天地有限公司。
VDM-1 型真空微波干燥设备 南京孝马机电设备厂;HZQ-F100 全温度振荡培养箱 太仓市华美生化仪器厂;CPA-125 电子天平 德国Sartorius公司;RE52CS旋转蒸发仪、B-226 恒温水浴锅 上海亚荣生化仪器厂;D10 氮气吹扫仪 杭州奥盛仪器有限公司;1200 高效液相色谱仪 美国安捷伦科技有限公司;E200MV生物显微镜 南京尼康江南光学仪器有限公司;日立H-7650 透射电子显微镜 日立高新技术公司。
1.2 实验方法
1.2.1 样品处理 新鲜胡萝卜和南瓜经清洗、去皮(南瓜需去除瓜籽及瓜瓢)后切成厚度约为(7±2) mm的薄片,置于95 度水中烫漂40 s灭酶后,取出沥干。
采用以微波间歇比为1 的间歇加热方式,分别称取沥干后的胡萝卜和南瓜各100 g,置于真空微波干燥设备中,真空度为−90 kPa,分别设置四个不同微波强度为:6、9、12、15 W/g,将胡萝卜和南瓜干燥至干燥终点(水分含量约为5%,以干基计算),装入不透光自封袋,置于干燥器中备用。
1.2.2 体外消化模型 本研究中使用的静态体外消化模型,根据文献稍微修改[15−16]。将胡萝卜和南瓜鲜样及不同微波强度处理后的样品,剪碎置于组织研磨机适配器中,置于组织研磨机中研磨45 s(60 Hz)。首先配制人工胃液成分为:CaCl2·2H2O、KH2PO4、MgCl2·6H2O、NaCl、KCl,浓度分别为10、3.5、3.6、50、14 mmol/L。准确称取1 g样品研磨物于50 mL试管中,加入15 mL胃液,用1 mol/L的HCl调节pH至 2.00±0.05 后加入胃蛋白酶(21 mg/mL,914 U/mg),样品通入氮气覆盖封口后,置于摇床(37 ℃,120 r/min)消化1 h。再用1 mol/L的NaHCO3调节溶液pH至6.9±0.05,随后加入3 mL的肠液(猪胰酶、猪胆盐浓度分别为4.5 mg/mL、28 mg/mL、猪胰酶250 U/mg),样品用氮气覆盖封口后置于摇床(37 ℃,120 r/min)消化2 h。整个过程在暗处进行。
1.2.3 微观结构观察
1.2.3.1 光学显微镜观察 鲜样、真空微波处理后样品及经体外模拟消化后消化液的观察方法参考文献[17]的方法。
1.2.3.2 细胞壁过碘酸雪夫(PAS)染色 鲜样及真空微波处理后样品细胞壁PAS染色观察方法参考文献[17]的方法。
1.2.3.3 透射电镜测定 鲜样及真空微波处理后样品经体外模拟消化后消化液的透射电镜观察方法参考文献[17]的方法。
1.2.4 类胡萝卜素的生物利用率的测定 经模拟消化后得到消化液,经离心(4 ℃,10000×g,20 min)后得到上层胶束。将胶束转入250 mL分液漏斗中,加入等体积混合提取液混匀静待分层,重复提取至下层无颜色。将提取液减压浓缩、氮气吹干,用1 mL正己烷复溶,经0.45 μm滤膜过滤后置于−80 ℃冰箱,待液相分析。样品中类胡萝卜素经消化后的生物利用率按下式计算。
生物利用率(%)=C上层胶束×m消化液/m总×100
式中:C上层胶束为离心后上层胶束中提取的类胡萝卜素含量(μg/g);m消化液为总消化液的质量(g);m总为消化样品所测得的类胡萝卜素总质量(μg)。
1.2.5 类胡萝卜素保留率的测定 类胡萝卜素保留率测定参考文献[13]方法。
1.2.6 类胡萝卜素的提取与测定
1.2.6.1 类胡萝卜素的提取 准确称取适量的原料鲜样(对照组,CK)及真空微波干燥后样品,剪碎后置于磨口锥形瓶中,加入40 mL混合提取液(V(乙醇):V(正己烷):V(丙酮)=1:2:1)混匀,置于37 ℃恒温培养箱中静置过夜,将提取液转移到圆底烧瓶中,待提取液分层,收集上层提取液,经减压浓缩、氮气吹干后,用1 mL正己烷复溶,重复两次,经0.45 μm有机滤膜过滤后置于−80 ℃冰箱备用,待分析。
1.2.6.2 类胡萝卜素的HPLC条件 采用1200 高效液相色谱仪(DAD检测器)配备YMC-C30 色谱柱(4.6 mm×250 mm,5 μm)检测样品中类胡萝卜素的含量;设置进样量为20 μL、柱温为25 ℃、流速为0.6 mL/min;流动相A为V(甲醇):V(MTBE):V(水)=70:25:5、流动相B为V(MTBE):V(甲醇):V(水)=85:10:5。
1.2.7 消化液黏度的测定 消化液黏度的测定方法参考文献[17−18]方法,在室温的条件下采用MCR 302 奥地利安东帕高级旋转流变仪测定消化液的黏度。
1.3 数据统计与分析
以上所有试验重复三次,各试验结果均以“平均值(means)±标准差(SD)”表示。本试验采用Origin9.0 软件绘制曲线,采用SAS软件进行单因素方差分析及组间差异的Duncan’s多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 真空微波干燥对胡萝卜和南瓜细胞形态的影响
胡萝卜和南瓜鲜样的光镜图和PAS染色图如图1 所示,可以看出胡萝卜和南瓜的细胞形态差异显著。胡萝卜细胞大小、形状不一,排列紧密,有色体结构为红色梭状的结晶状态,分布范围广;南瓜细胞呈椭圆形,体积较大,有色体结构为球状,分布于细胞壁内侧。PAS染色后的多糖类物质被染成紫红色,呈阳性。光学显微镜下可见胡萝卜和南瓜鲜样细胞完整,排列紧密。与胡萝卜相比,南瓜细胞壁多糖层较薄。Zdunek等[19]研究表明,较大植物细胞破坏所需的机械力较小。本研究南瓜细胞较大,因此在加工过程中更易被破坏。
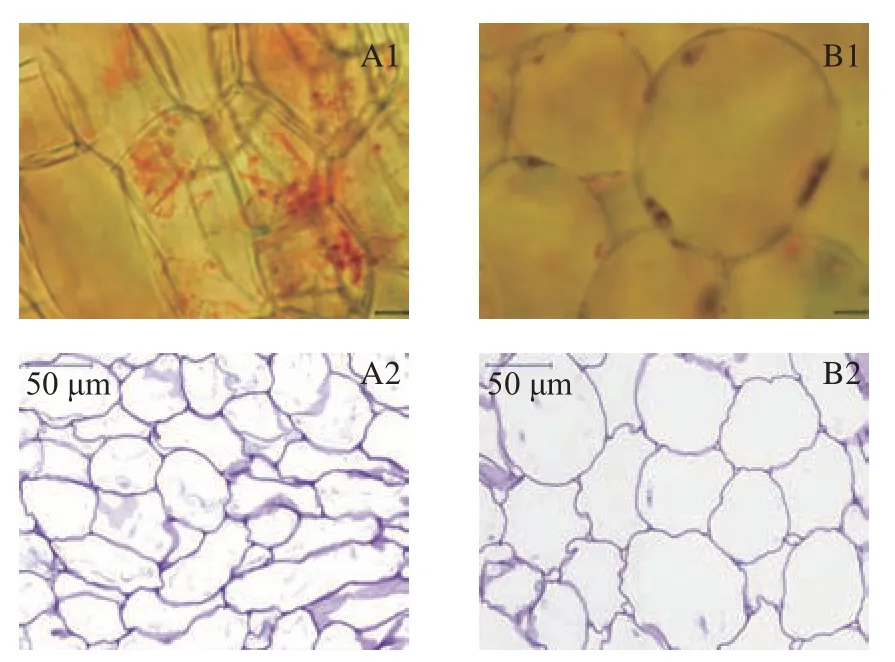
图1 胡萝卜和南瓜鲜样的细胞形态(光学显微镜,40×)Fig.1 Cell morphology of carrot and pumpkin(Optical microscope,40×)
细胞壁是影响细胞内生物活性物质释放到胞外最重要的物理屏障[20],因此本试验对真空微波干燥处理后胡萝卜和南瓜进行染色处理,观察其细胞壁变化。对比鲜样(图1)可知,经真空微波中强度(9 W/g)干燥后的胡萝卜细胞皱缩严重(图2),出现细胞壁断裂现象,细胞排列更紧密。通过观察PAS染色图可知,胡萝卜细胞壁染色变浅,结构疏松,细胞壁断裂严重,视野中有大块空缺存在。真空微波干燥南瓜细胞形态变化与胡萝卜类似,但细胞皱缩更显著。此外,真空微波干燥后的胡萝卜和南瓜有色体结构破坏严重。图2A1 中可见少量有色体结构,分布于细胞壁内侧;图2B1 中未观察到完整的有色体结构。
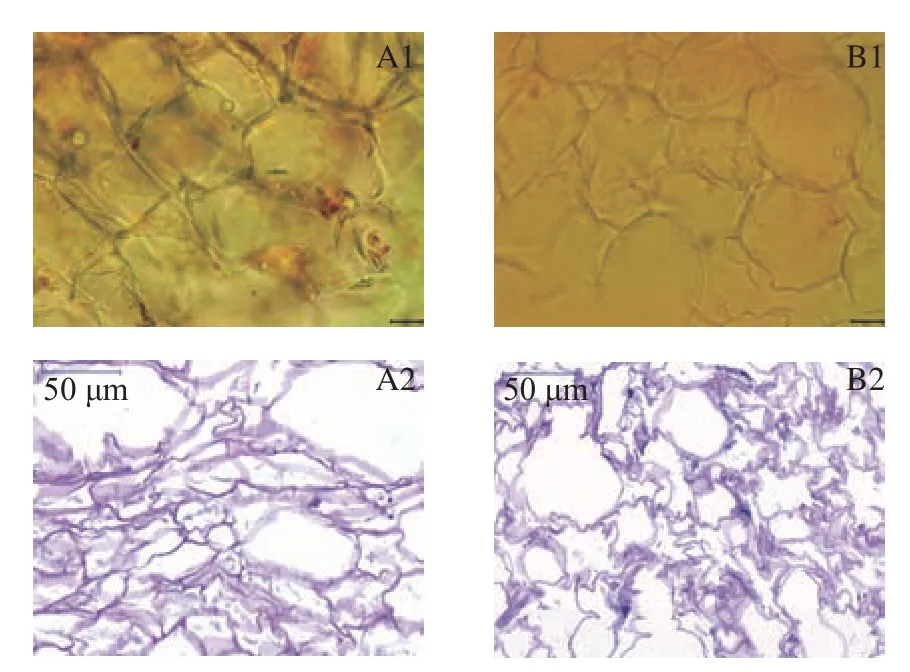
图2 真空微波干燥后胡萝卜和南瓜的细胞形态(光学显微镜,40×)Fig.2 Cell morphology of carrot and pumpkin after vacuum microwave drying(Optical microscope,40×)
2.2 微波强度对胡萝卜和南瓜消化微观结构的影响
2.2.1 消化液光学显微镜图 不同微波强度处理条件下的胡萝卜与南瓜消化液的光镜图如图3 所示。观察胡萝卜鲜样消化液光镜图3A1 可以发现,鲜样的消化液光镜图中仍可以看到完整的细胞结构,胡萝卜细胞内部晶状有色体结构破裂,类胡萝卜素位于细胞壁内侧,从细胞内释放到消化液中的含量较少,大部分仍存留于细胞中。由图3A2、A3 可知,真空微波干燥后的胡萝卜经体外消化后,细胞壁破裂严重,很难找到完整的细胞结构,类胡萝卜素从细胞内部释放到消化液中的含量明显高于鲜样。观察南瓜鲜样消化液光镜图3B1 可以发现,南瓜细胞内球状有色体结构破坏严重,类胡萝卜素在细胞内部呈不规则分布,散落在南瓜细胞中,与胡萝卜类似,大部分类胡萝卜素仍保留于细胞中。由图3B2、B3 可知,干燥后的南瓜变化与胡萝卜类似,细胞壁破坏严重,释放到消化液中的类胡萝卜素含量升高。与鲜样相似,释放到消化液中的类胡萝卜素并不是单独存在,而是在其周围形成了新的结构网络,这可能会影响类胡萝卜素的吸收利用。
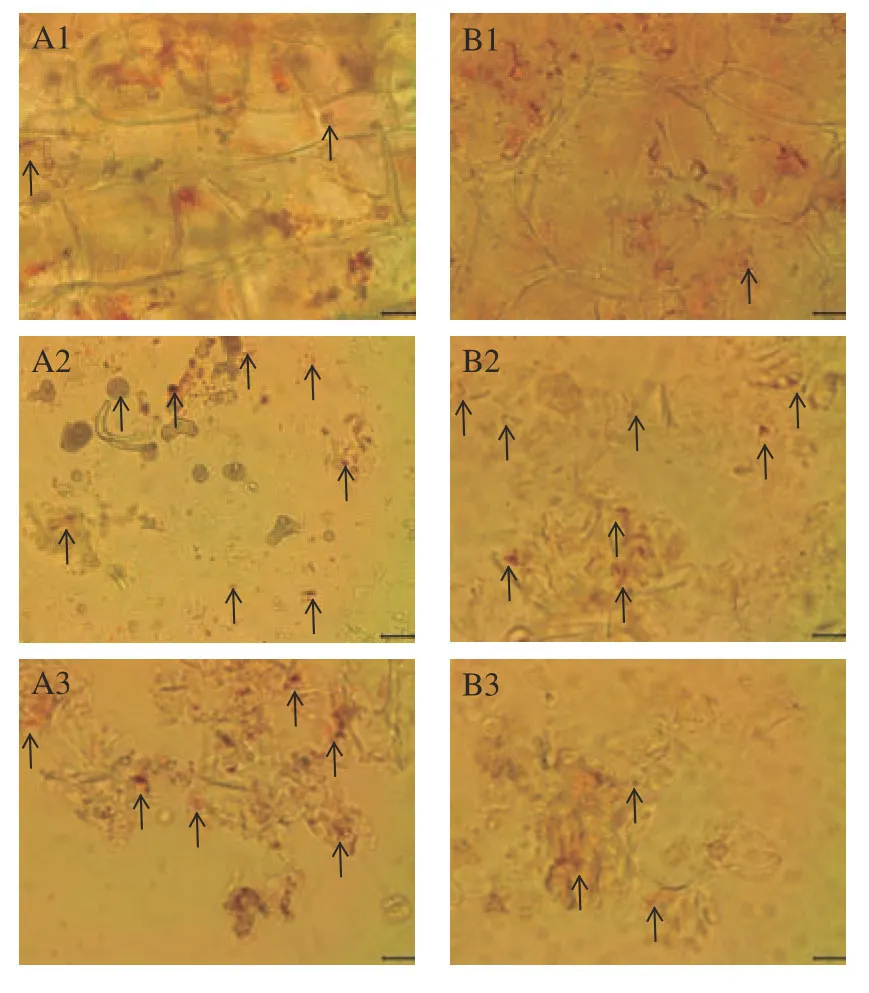
图3 不同微波强度条件下胡萝卜和南瓜消化液的光学显微镜图(40×)Fig.3 Photomicrographs of carrot and pumpkin digests under different microwave intensity(40×)
2.2.2 消化液透射电镜图 通过透射电镜(TEM)观察胡萝卜和南瓜细胞的细胞壁及有色体的结构特征。真空微波干燥对胡萝卜和南瓜消化液微观结构影响如图4 所示。观察图4A1 与图4B1 可以发现胡萝卜和南瓜鲜样经消化后细胞壁仍较完整,但细胞内侧膜结构与细胞壁间隙增大,部分类胡萝卜素分布于新形成的聚集体内部。其中,胡萝卜细胞壁厚度不均匀,内侧膜结构基本完全脱离细胞壁,分散于细胞内部;南瓜细胞壁厚度较均匀。真空微波干燥处理后的蔬菜细胞壁结构松散,出现断裂,膜结构完全从细胞壁内侧脱落,形成新的聚集体,部分类胡萝卜素分布于新形成的结构内部,与胡萝卜相比,南瓜细胞壁降解现象更明显。微波强度为9 W/g时,经体外消化后胡萝卜和南瓜消化液的透射电镜图如图4A2与B2,可以看出此时细胞壁降解严重,无完整细胞壁结构,视野中仅存在大面积絮状结构区域。
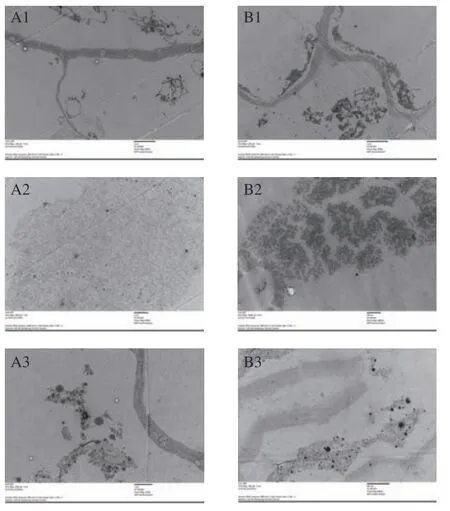
图4 不同微波强度条件下胡萝卜和南瓜消化液的透射电镜图Fig.4 Transmission electron micrograph of digested liquid of carrot and pumpkin under different microwave intensity
通过消化液的透射电镜图发现,胡萝卜和南瓜鲜样经消化后细胞壁略有溶胀,内侧膜结构脱落,但细胞内部结构并未完全被破坏,仍有类胡萝卜素存在于膜结构中,这与Tydeman等[21]的文献报道类似。与鲜样相比,真空微波干燥后的蔬菜细胞结构在消化过程中破坏明显,发生细胞壁结构断裂、内侧膜结构脱落及大面积絮状结构等现象。这是因为真空微波干燥已经破坏了蔬菜细胞壁结构,这种被破坏了的细胞结构在消化液的处理下进一步瓦解。
2.3 不同微波强度下胡萝卜和南瓜消化液黏度
消化液的黏度是影响活性物质生物利用度的重要影响因素。有研究发现细胞壁在高压均质过程中会形成网状结构,阻碍类胡萝卜素从果蔬中高效释放[22−23],而未降解的细胞壁果胶会显著增加消化液的黏度,降低消化酶的作用表面积,抑制类胡萝卜素的胶束化,进而降低其生物利用率[24]。因此本实验测定了不同微波强度处理后胡萝卜和南瓜消化液黏度值(表1)。与鲜样相比,真空微波干燥后的胡萝卜和南瓜消化液黏度显著下降(P<0.05),降幅分别为67.7%~87.5%,78.2%~83.8%。微波强度为12 W/g时,胡萝卜和南瓜消化液黏度较高,分别为1.93×10−3、1.97×10−3Pa·s,但不同微波强度处理的南瓜消化液黏度差异不显著(P>0.05)。

表1 不同微波强度条件下胡萝卜和南瓜消化液的黏度(×10−3 Pa·s)Table 1 The viscosity in digestive fluid of carrot and pumpkin under different microwave intensity(×10−3 Pa·s)
真空微波干燥后胡萝卜和南瓜的消化液黏度显著低于鲜样(P<0.05)。这是因为消化液黏度与未降解的细胞壁果胶含量有关,微波的热效应与非热效应共同促进了果胶的降解,破坏了原有的果胶链,改变了果胶的结构,使果胶的分子量降低,果胶分子间作用力减小[25],从而导致消化液黏度下降,这与真空微波干燥强度为9 W/g时,南瓜中果胶含量降低结果一致[26]。此外,体外消化后获得的南瓜鲜样消化液黏度显著高于胡萝卜(P<0.05),这是因为南瓜细胞壁中的可溶性果胶含量高于胡萝卜,而可溶性果胶聚合物在某种程度上可以增加消化液的黏度[18,27]。
2.4 不同微波强度对胡萝卜和南瓜中类胡萝卜素保留率、生物利用率的影响
真空微波干燥对胡萝卜和南瓜中类胡萝卜素保留率影响结果如表2 所示,结果表明随微波强度的升高,胡萝卜和南瓜中类胡萝卜素保留率呈现降低的趋势,这与汪小娉等[13]的研究结果类似。不同微波强度对类胡萝卜素保留率有明显影响,微波强度不同微波强度对类胡萝卜素保留率有明显影响,微波强度9 W/g条件下,胡萝卜中叶黄素的保留率比6 W/g显著降低21.51%(P<0.05),α-胡萝卜素、β-胡萝卜素的保留率分别降低8.31%、11.66%。微波强度12 与15 W/g差异不显著(P>0.05)。真空微波干燥后的胡萝卜和南瓜中的类胡萝卜素的生物利用率高于鲜样,这与图3 消化液中类胡萝卜素的分布结果一致,表明微波干燥处理有效提高类胡萝卜素的生物释放。胡萝卜和南瓜中类胡萝卜素生物利用率随微波强度的增加呈现先升高后降低的趋势,不同微波强度对类胡萝卜素生物利用率有明显影响。其中当微波强度为9 W/g时,胡萝卜和南瓜中叶黄素、α-胡萝卜素、β-胡萝卜素的生物利用率达到较高水平,其β-胡萝卜素生物利用率相比于鲜样分别增加了12.02、24.2 倍(P<0.05)。
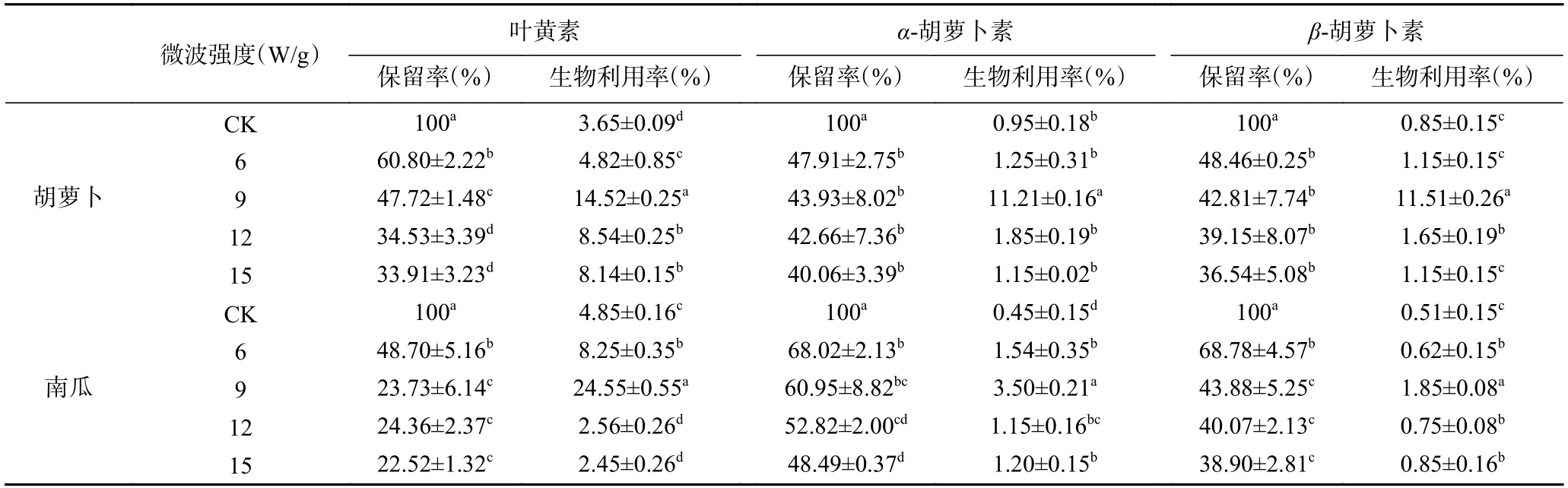
表2 不同微波强度条件下胡萝卜和南瓜中类胡萝卜素的保留率、生物利用率Table 2 Retention and bioavailability of carotenoids in carrot and pumpkin under different microwave intensities
微波处理可有效地提高果蔬中类胡萝卜素从细胞中释放的比例,生物利用率因果蔬种类、微波条件存在显著差异。本研究表明微波强度为9 W/g时,细胞壁变形后形成的孔隙结构增多,使蔬菜细胞结构在消化过程中破坏明显,细胞壁严重破裂,导致类胡萝卜素从有色体结构中大量释放到消化液中,同时,真空微波干燥后消化液黏度显著降低,这会增大消化酶的作用表面积[28],有利于形成胶束进而提高营养素的生物利用率。这与Zhang等[29]研究结果类似,微波场能够穿透果蔬细胞壁对类胡萝卜素基质环境进行重排,显著提高类胡萝卜素的生物利用率。此外,研究表明真空微波干燥处理通过降解蔬菜细胞壁果胶,导致降低了细胞壁的阻碍作用,增加了类胡萝卜素的生物释放[30−31]。然而随着微波强度升高,微波处理使物料内部分子运动加剧,水分汽化速度随之增加[32],干燥产生的过高温度可能使物料内部形成一个新的物理屏障而阻碍类胡萝卜素的释放[33]。本研究结果表明真空微波干燥虽然降低了物料中类胡萝卜素的保留率,但改善了其生物利用率。由此可见,真空微波干燥通过调控类胡萝卜素基质环境提高其生物利用度,这对于果蔬中生物活性物质高效利用具有现实意义。
3 结论
本文探究不同微波强度下胡萝卜和南瓜中类胡萝卜素保留率、生物利用率变化规律。结果发现,真空微波干燥后的胡萝卜和南瓜细胞壁断裂,有色体结构严重破坏,导致其类胡萝卜素的保留率降低。
经体外模拟消化,真空微波干燥后胡萝卜和南瓜细胞结构明显破坏,细胞壁破裂严重,消化液黏度显著降低(P<0.05),进而有利于胶束化的形成,从而改善类胡萝卜素生物利用率。当微波强度为9 W/g时,胡萝卜和南瓜中类胡萝卜素的生物利用率达到较高水平。

