黄精与土霉素协同抑制副溶血弧菌研究
操庆国,郭 钦,蔡佳惠,陈 会,贾 君
(1.江苏农林职业技术学院茶与食品科技学院,江苏句容 212400;2.江苏大学食品与生物工程学院,江苏镇江 212013)
2013 年,全球甲壳类水产养殖产值已超过130 亿美元[1]。然而,甲壳类水产养殖业却面临着巨大的风险。来自海洋的弧菌,如副溶血弧菌、创伤弧菌(V.vulnificus)、哈维氏弧菌(V.harveyi)、溶藻弧菌(V.alginolyticus)和鳗弧菌(V.anguillarum)等,能引起11 种细菌性疾病,从而给水产养殖尤其是对虾养殖业造成巨大的损失。其中,副溶血弧菌是急性肝胰脏坏死病(acute hepatopancreatic necrosis,AHPND)或早期死亡综合征(early mortality syndrome,EMS)的主要病原菌,可使对虾发生组织病理学改变,包括肝胰腺功能障碍、空腹和空肠、软壳和萎缩的肝胰脏等。从2009 年开始,AHPND每年造成全球将近10 亿美元的损失,目前有11 个国家已经加入“降低和管理养殖虾的AHPND风险”计划。
由于水产弧菌病频发,为了杀灭副溶血弧菌,许多抗菌药物被开发和应用,包括抗生素类、阳离子抗菌肽、益生菌和中草药复方制剂等[2]。然而这些都只能作为辅助手段,单独应用效果较差。到目前为止,抗生素仍然是治疗AHPND最为广泛和最有效的措施,但抗生素滥用带来的残留风险和多重耐药性菌株的出现对环境造成恶劣的影响,并对人类健康带来极为严重的威胁。据报道,副溶血弧菌的抗药谱非常广,并随国家和地区的不同而有所区别,其主要耐受的抗生素包括氯霉素类、β-内酰胺类、四环素类、氨基糖苷类和喹诺酮类等,其中,β-内酰胺类耐受性将近100%[3]。近年来世界各地出现多重耐药副溶血弧菌,对全球对虾养殖产业和人类健康带来巨大威胁,因此开发环境友好的、安全无毒的杀菌剂势在必行。已有多种天然产物被开发,如中草药复方制剂、壳聚糖、β-葡聚糖、大蒜和洋葱提取物、海草提取物、混合植物精油等[4−6]。由于天然产物在实际应用中单独抑菌效果较弱,因此寻找能和抗生素协同作用、降低抗生素使用浓度,缩小抗性风险的天然产物成为研究热点。国内外已报道多种可以和抗生素联用协同抑菌的天然植物,其中绝大部分属于外排泵抑制剂,如胡椒碱、防己碱、茶多酚、植物精油、氧化白藜芦醇、香芹酚和水飞蓟等[7−9]。它们以外排泵为靶点,如NorA、MexAB-OprM、Msr(A)、Tet(K)等,降低细菌对抗生素的外排,从而增强细菌对抗生素的敏感性,抑制多重耐药金黄色葡萄球菌(MRSA)、鲍曼不动杆菌、多重耐药假单胞菌和大肠杆菌等致病菌的生长[10](Bucar 2015)。
细菌有多种对抗抗生素压力的机制,如抗生素酶降解、核糖体保护蛋白、细胞膜渗透性屏障、外排泵作用和可移动基因元件等。其中,外排泵作用是研究最为广泛的一种耐药机制[7]。细菌通常都具有一个或多个外排泵,能将抗生素排出体外,主要包括耐药结节分裂子(resistance-nodulation-division,RND)、主要促进者超级家族(major facilitator superfamily,MFS)、多重药物和毒物排出(multidrug and toxic compound extrusion,MATE)、小的多重药物抗性(small multidrug resistance,SMR)以及ATP结合盒膜转运蛋白(ATP-binding cassett transporter,ABC转运子)五种类型[5]。目前,寻找细菌外排泵抑制剂已成为研究热点,安全无毒、药食同源的天然植物是外排泵抑制剂(EPIs)的最佳来源,已经有多篇相关研究报道[11−13]。
黄精(Polygonatum sibiricumRed.)是我国传统中药,其化学成分包括多糖、皂苷、黄酮、生物碱、醌类化合物、木脂素和多种人体必需氨基酸,具有抗衰老、降血糖、降血脂、改善记忆力、调节免疫和抗肿瘤等作用[14−15]。
天然产物由于成分复杂,单独作用效果较差,因此本文通过黄精和抗生素联用抑制副溶血弧菌,研究其协同机制,发现其可作为外排泵抑制剂,降低抗生素杀菌浓度,减少副溶血弧菌抗药性的产生,从而降低水产养殖中抗生素残留风险,为对虾的健康养殖提供科学数据和理论基础,保证对虾食品安全。
1 材料和方法
1.1 材料与仪器
副溶血弧菌RIMD2210633 实验室保存;黄精 镇江存仁堂;中国《水产养殖用药指南》规定可以在水产养殖中应用的八种抗生素,分别为氨基糖苷类(硫酸新霉素)、喹诺酮类(诺氟沙星、恩诺沙星和噁喹酸等)、酰胺醇类(氟苯尼考和甲砜霉素)、四环素类(土霉素和盐酸多西环素)、羰基氰化物间氯苯腙(CCCP)上海源叶生物科技有限公司;RNAprep Pure细菌总RNA提取试剂盒 天根生化科技(北京)有限公司;PrimeScript™ RT reagent Kit with gDNA Eraser、SYBR® Premix Ex Taq™ II(Tli RNaseH Plus)、DNA Maker宝日医生物技术(北京)有限公司;碱性磷酸酶试剂盒 碧云天生物公司;LB肉汤、TCBS琼脂 北京陆桥技术有限责任公司;MH肉汤 青岛海博生物技术有限公司;苹果酸脱氢酶(MDH)试剂盒、琥珀酸脱氢酶(SDH)试剂盒南京建成生物工程研究所;其他试剂 皆为分析纯,上海国药集团。
Infinite 200 多功能酶标仪 瑞士Tecan公司;TCS SP5 II激光共聚焦显微镜 德国 Leica公司;DDS-11A数显电导率仪 上海雷磁·创益仪器仪表有限公司;CFX96 实时荧光定量PCR仪 美国宝特公司(Bio-Rad)。
1.2 实验方法
1.2.1 黄精水提取制备 黄精打粉,过100 目筛。取25 g粉末,200 mL蒸馏水浸泡过夜,55 ℃、180 W超声1 h,静置至室温,4 层纱布过滤药液,200 mL蒸馏水清洗3 遍残渣,过滤后与滤液合并,旋转蒸发仪55 ℃、60 r/min加热浓缩滤液至约20 mL,定容,浓度为1 g/mL,4 ℃保存备用。
1.2.2 CCCP的配制 取1.5 mL的离心管一只,称取10 mg的CCCP粉末溶解于1 mL的甲醇中,混匀,配制成浓度为10 mg/mL的CCCP溶液。
1.2.3 抗生素的配制 取1.5 mL离心管,分别标记8 种抗生素,各自称取12.8 mg的相应抗生素,溶解于1 mL的相应溶剂中,配制成最终浓度为12.8 mg/mL的抗生素溶液,0.22 μm过滤除菌,4 ℃保存备用。
1.2.4 黄精和抗生素单独抑制副溶血性弧菌的最低抑菌浓度(minimal inhibitory concentration,MIC)测定 通过肉汤微量稀释法评估黄精和抗生素单独抑菌效果,采用96 孔板法测定MIC。副溶血弧菌在LB+3% NaCl液体培养基(LBNB)中37 ℃培养过夜,0.5 麦氏比浊管校正浓度。含有副溶血性弧菌的Mueller-Hinton+3% NaCl液体培养基(MHB)用作阳性对照,仅含有黄精或抗生素或CCCP的MHB作为阴性对照。在96 孔板中,对药物用MHB进行连续两倍的梯度稀释,使抗生素含量为128~0.25 μg/mL;羰基氰化氯苯腙(CCCP)浓度为10~1.25 μg/ mL,黄精水提物浓度分别为 200000~195.31 μg/mL,每个孔中加入90 μL菌液,使总体积为200 μL,菌液浓度为5×105CFU/mL,37 ℃摇床振荡培养24 h,观察副溶血性弧菌的生长情况。无细菌生长的最低浓度定义为MIC。
1.2.5 黄精和抗生素联合抑制副溶血性弧菌的抑菌浓度指数(Fractional Inhibitory Concentration,FIC)测定 采用棋盘微量肉汤稀释法测定黄精和抗生素的联合抑菌效果。以土霉素和黄精为例,96 孔板纵排依次为MHB稀释后浓度为 MIC~1/16 MIC黄精,横排依次为MIC~1/16 MIC土霉素,使得每孔中都有不同浓度的黄精水提物和土霉素混合溶液,之后每孔中加入90 μL菌液,使总体积为200 μL,细菌终浓度为5×105CFU/mL,分别设置无药物只含有细菌的培养基和空白培养基作为阴性对照和空白对照,37 ℃培养24 h观察结果,以细菌无生长的最低浓度定义为协同MIC(SMIC)。其他抗生素采用相同步骤进行。
FIC=MIC协同/MIC黄精单用+MIC协同/MIC抗生素单用
式中,FIC≤0.5 为协同作用;0.5
1.2.6 黄精对副溶血弧菌细胞膜的影响
1.2.6.1 电导率检测 副溶血性弧菌在LBNB中37 ℃培养过夜,取100 μL菌液移至含有1/2MIC黄精的5 mL LBNB试管中,加菌和空白不加菌的LBNB作为对照,37 ℃下培养8 h,分别在0、1、2、4、6 和8 h取出5 00 μL培养物,5000 r/min离心10 min,取上清液100 μL加3.9 mL水进行稀释,测定上清液的电导率。
菌液电导率的变化率R(%)计算如下:

1.2.6.2 膜电位检测 副溶血性弧菌在LBNB中37 ℃培养过夜,取500 μL菌液转移至含有1/2 MIC黄精提取物的LBNB中。将100 μL混合物加入到96孔板中,加菌和空白不加菌的LBNB作为对照,培养过夜,用5 μmol/ L Bis(1,3-dibutylbarbituric acid)trimethine oxonol(DiBAC4(3))的HEPES检测缓冲液洗涤96 孔板三次,再加入180 μL DiBAC4(3)的HEPES检测缓冲液进行碘化丙啶(Propidium iodide,PI)染色,37 ℃孵育30 min,每3 min测量一次荧光强度。
1.2.6.3 细菌存活检测 采用PI染色法进行。副溶血性弧菌在LBNB中37 ℃培养过夜,取50 μL菌液转移至5 mL LBNB试管中,37 ℃、180 r/min下培养12 h。将100 μL培养液转移至含有1/2 MIC黄精的LBNB中,37 ℃振荡培养3 h,加菌的LBNB为对照。取1 mL液体5000 r/min离心5 min,收集细胞,用PBS洗涤细胞并重悬于200 μL PBS中,加入10 μL PI(1 mg/ mL),混合均匀,37 ℃避光孵育20 min。将染色的细胞滴在盖玻片上,激光共聚焦显微镜下进行观察。
1.2.7 CCCP对黄精和土霉素联合抑菌的影响CCCP溶解在丙酮中,浓度为12.5 μg/μL,0.22 μm滤膜过滤除菌。用MHB制备1/2MIC~1/16MIC浓度的CCCP,参照1.2.2 和1.2.3 在不同CCCP条件下评估黄精和抗生素的单独和联合抑菌效果。将无细菌生长的最低浓度分别定义为CCCP-单独MIC(CMIC)和CCCP-协同MIC(CSMIC)。
1.2.8 RT-PCR将100 μL过夜培养物转移至5 mL含有1/2 MIC黄精的LBNB中,加菌的LBNB为对照,37 ℃、180 r/min振荡培养12 h。取出1 mL菌液,提取总RNA,并反转录为cDNA,进行RTPCR检测。反应体系:10 μL SYBRPremix Ex Taq II(Tli RNaseH Plus),2 μL cDNA,6.4 μL无RNase ddH2O,0.8 μL正向和反向引物,共25 μL。反应条件为:95 ℃ 30 s,95 ℃变性5 s,58 ℃退火30 s,72 ℃延伸30 s,40 个循环。溶解曲线从65 ℃升至95 ℃,每5 s改变0.5 ℃。使用16S rRNA作为参比基因,计算目的基因的相对表达量。相对表达量=2−∆Ct=2−[Ct(目的基因)−Ct(内参基因)]。引物如表1 所示。

表1 研究所用引物Table 1 Primers used in the study
1.2.9 呼吸代谢途径抑制 参照云宝仪等[16]的方法进行。将3.6 mL PBS(0.1 mol/L,pH 7.2),0.4 mL葡萄糖溶液(1%)和1 mL细菌悬浮液(108CFU/mL)分别加入到四个反应瓶中,振荡5 min,测量溶解氧含量(初始呼吸速率R0);分别加入终浓度为500 μg/mL的碘乙酸、500 μg/mL磷酸钠、500 μg/mL丙二酸和1/2 MIC黄精,测量呼吸率R1;最后,将终浓度为1/2 MIC的黄精分别加入到含有三种抑制剂的LBNB菌液中,确定测量呼吸率R2。整个系统在试验过程中完全封闭。
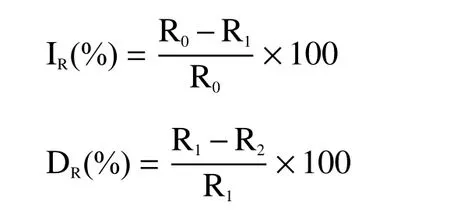
式中:IR-呼吸抑制率;DR-呼吸叠加率;R0、R1和R2-对照组和试验组细菌的呼吸速率(μmol/g/min)。
1.2.10 关键酶酶活测定 苹果酸脱氢酶(malate dehydrogenase,MDH)和琥珀酸脱氢酶(succinate dehydrogenase,SDH)酶活根据所购试剂盒说明进行检测。
1.3 数据处理
每个试验做三个平行,重复三次,所有数据为平均值加减标准差。实验数据用SPSS 19.0t检验进行处理,计算方差和显著性。P<0.05 表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 黄精和抗生素单独和联合抑制副溶血性弧菌的MIC
八种抗生素都能抑制副溶血弧菌的生长,其中,抑菌效果最好的是恩诺沙星、诺氟沙星和噁喹酸,MIC皆为0.25 μg/mL,而新霉素效果较差,MIC为16 μg/mL。黄精水提物有一定的抑菌能力,但MIC为50000 μg/mL,远高于抗生素(表2)。
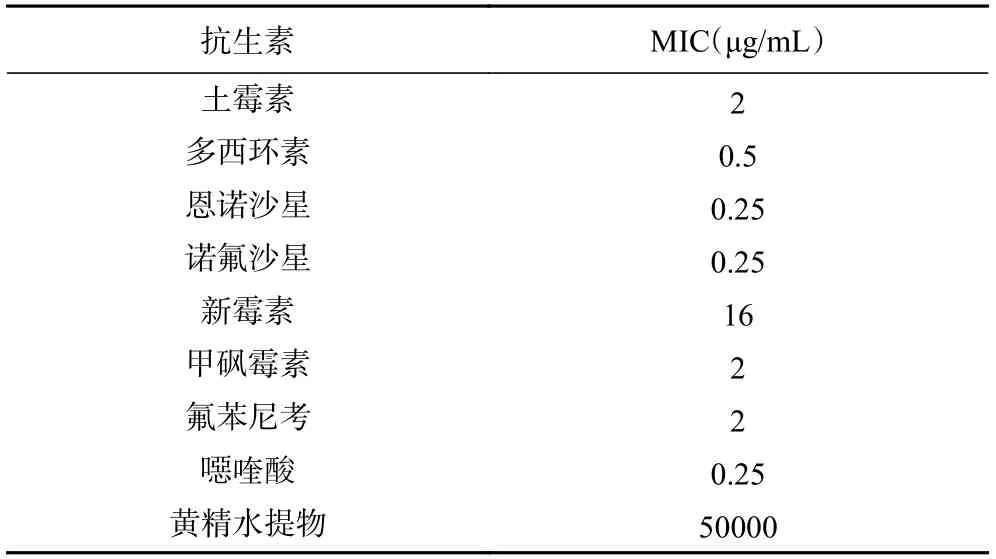
表2 黄精和抗生素单独抑制副溶血弧菌的MICTable 2 MICs of Polygonatum sibiricum Red.and antibiotics against V.parahaemolyticus alone
当1/4MIC黄精和八种抗生素联用时,土霉素展现出较好的协同抑菌作用,MIC降低4 倍,SMIC变为1/4MIC(0.5 μg/mL),FIC为0.5;其他七种抗生素的MIC均没有变化,FIC皆为1.25,表明缺乏协同抑菌能力(表3)。因此,不同浓度土霉素和黄精组合的协同抑菌能力被进一步研究。表4 表明,随着黄精水提物浓度的降低,协同抑菌所需土霉素浓度逐渐增大,具有最佳协同抑菌效果的配比为1/8 MIC黄精+1/4 MIC土霉素,此时FIC最小,为0.38。
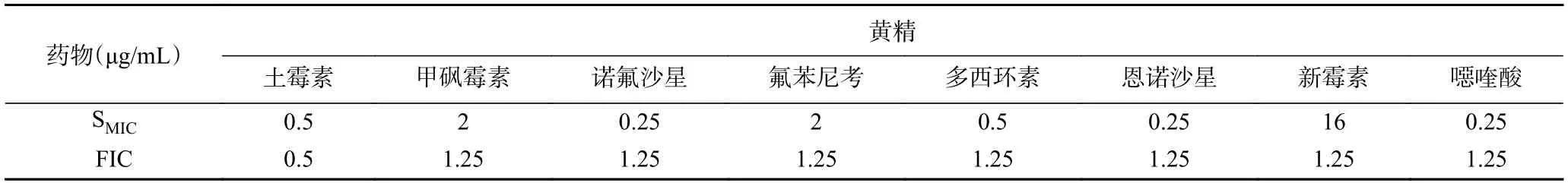
表3 抗生素联合1/4MIC黄精对副溶血弧菌的协同SMIC 和FICTable 3 FIC and SMICs of P.sibiricum Red.in combination with antibiotics against V.Parahaemolyticus

表4 不同浓度土霉素和黄精联合抑制副溶血弧菌的MIC和FICTable 4 FIC and SMICs of P.sibiricum Red.in combination with oxytetracycline against V.Parahaemolyticus
2.2 黄精对副溶血弧菌细胞膜的影响
副溶血弧菌属于革兰氏阴性菌,由于外膜的存在,与革兰氏阳性菌相比,更容易产生耐药性。本实验选择电导率、膜电位和PI染色试验来评估黄精对副溶血弧菌细胞膜的影响。细胞外膜可以转运多种离子和无机盐,当外膜受损时,渗透性变大,电解质溢出胞外,因此可以通过测量电导率的变化来判断细胞膜的损伤程度。与对照组相比,黄精组相对电导率明显升高,8 h升为5.547 ms/cm,而对照组仅仅略微升高(图1A),表明黄精可导致细菌膜受损,电解质被释放到培养液中。
膜电位是细胞膜内部和外部之间的电位差,膜电位的上升和下降分别称为超极化和去极化。作为膜电位敏感的亲脂性阴离子荧光染料,DiBAC4(3)本身没有荧光,进入细胞后可与胞浆内蛋白质结合,发出荧光,去极化时,DiBAC4(3)进入细胞量增多,荧光强度随之增加,反之,超极化时荧光强度降低。图1B表明1/2MIC黄精使副溶血性弧菌细胞膜发生去极化现象,此时Na+通道被激活,大量内流,膜两侧电位差急剧变小。

图1 黄精对副溶血弧菌细胞膜的影响Fig.1 Effects of P.Rhizoma on the cell membrane of V.Parahaemolyticus
PI是一种核染色试剂,只能通过受损的细胞膜插入双链DNA中,与之结合后并发出荧光,白光下对照组和试验组的细菌数目几乎相同,而荧光下黄精组的细胞数远高于对照组(图2),表明黄精使得细菌细胞膜严重受损,从而导致PI大量进入。

图2 PI染色图Fig.2 PI staining
2.3 CCCP对黄精和土霉素联合抑菌的影响
上述研究结果表明,细胞膜也许是黄精抑菌的主要作用靶点。副溶血弧菌外膜上有多种外膜蛋白和药物外排泵,能够单独或相互结合控制小分子物质如抗生素的进出。为了进一步阐明黄精对细胞外膜的作用,本研究进行了CCCP试验。CCCP是一种强电子解偶联剂,可以破坏细胞膜内外跨膜质子梯度,因此抑制大部分依赖质子梯度作为能量的外排泵的表达,属于外排泵抑制剂[17]。
在不同CCCP浓度下,黄精抑菌的MIC没有变化,但土霉素的CMIC下降为1/2~1/4MIC,表明副溶血弧菌体内确实存在药物外排泵(表5)。当CCCP浓度降低到1/8 MIC以下,对土霉素MIC已经没有影响,所以数据未呈现。由于1/4MIC的CCCP对土霉素的外排影响较小,因此选其作为测试黄精和土霉素联合抑菌的CCCP浓度。受CCCP的影响,黄精和土霉素的联合抑菌能力下降,FIC在0.63~1.06之间,此时由协同抑菌变为相加甚至无关作用,说明黄精和土霉素的联合抑菌机制可能和外排泵相关(表6)。
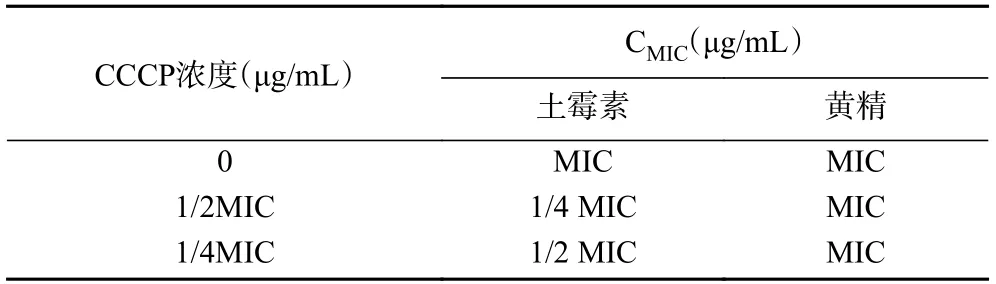
表5 不同浓度CCCP条件下土霉素和黄精水提物单独抑制副溶血弧菌的MICTable 5 CMIC of oxytetracycline and P.Rhizoma against V.Parahaemolyticus under different concentrations of CCCP
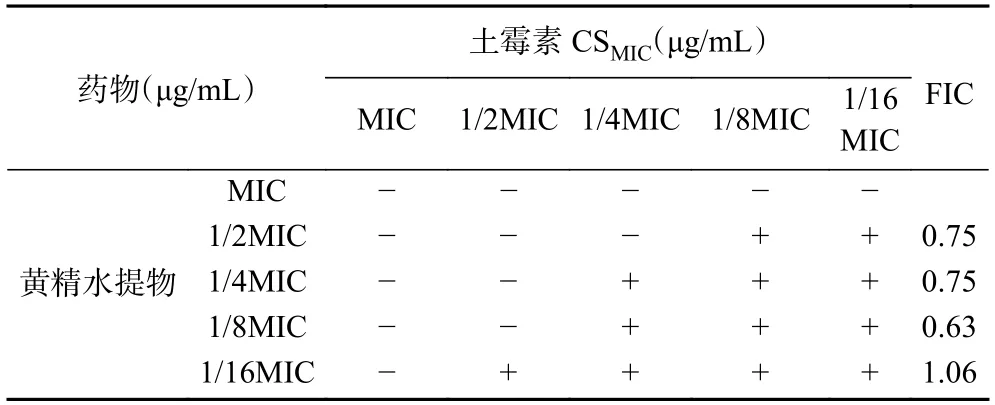
表6 1/4 MIC CCCP条件下黄精水提物和土霉素联合抑菌的FIC和MICTable 6 FIC and CSMIC of oxytetracycline in combination with P.Rhizoma against V.Parahaemolyticus under 1/4 MIC CCCP
2.4 黄精对副溶血弧菌外膜蛋白和外排泵表达的影响
通过文献[18−21],副溶血弧菌外膜上21 个相关基因被选择,包括离子泵相关基因vp1228(nhaA,Na+/H+反向协同运输泵)、vp2072(Na+/H+反向协同运输泵)、vp2449(VmrA,Na+/药物反向协同运输泵)、vp2665(Na+/Ca2+交换蛋白)和vp2867(curA,K+/H+泵),外膜蛋白相关基因vp0425(TolC)、vp1060(TolB)、vpa0096(OmpW)、vpa0318(OmpV)以 及vpa1186(OmpA),RND外排泵相关基因vp0038、vp0941、vp1092、vp1178、vp2472、vpa0344、vpa0363、vpa0471、vpa0480、vpa0809 和vpa1190。
结果表明,21 个基因的表达全被黄精抑制,调控趋势和土霉素截然相反,却和CCCP完全一致。其中,vpa0096(OmpW)下 调 497.51 倍,vp0425(TolC)、vp2072(Na+/H+反向协同运输泵)、vp2665(Na+/Ca2+交换蛋白)、vp1092、vp0941、vp1178、vpa0344和vpa0809 分别下调27.03、73.53、55.56、100.00、35.71、37.74、49.02 和56.18 倍(图3)。黄精也许和CCCP类似,具有外排泵抑制剂功能,通过下调副溶血弧菌细胞外膜上的vpa0096(OmpW)等基因的表达,达到联合抑菌的目的。

图3 相关基因的相对表达倍数Fig.3 Relative expression multiple of related genes
2.5 黄精对副溶血弧菌呼吸代谢途径的影响
黄精作为一种外排泵抑制剂,可以下调RND外排泵的表达,本文猜测它和CCCP类似,也破坏了跨膜质子梯度,对氧化磷酸化进行解偶联,从而反馈抑制呼吸代谢,因此检测了黄精对副溶血弧菌呼吸代谢途径的影响。
结果表明,黄精可以抑制副溶血弧菌的呼吸代谢作用,抑制率为41.6%±0.036%,与丙二酸的呼吸叠加率最小,为11.3%±0.027%(表7)。呼吸叠加率反映了黄精与三种典型抑制剂共作用时的结果,叠加率越小,说明两者抑制同一条呼吸代谢途径的可能性越大,可以推测黄精主要可能通过抑制三羧酸循环(TCA)途径而起作用。
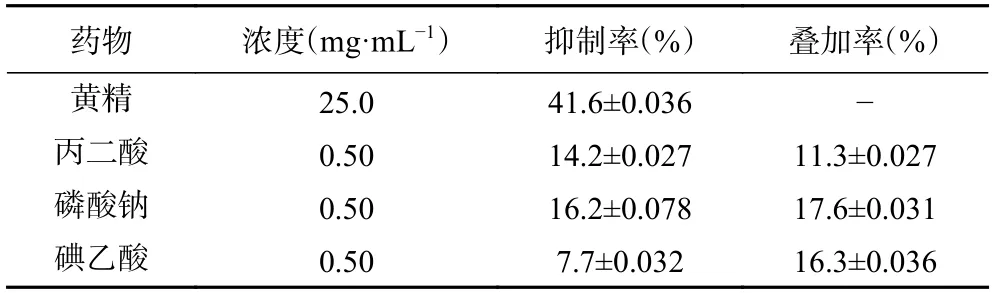
表7 黄精对副溶血性弧菌呼吸代谢的抑制作用Table 7 Inhibitory effect of P.Rhizoma on respiratory metabolism of V.Parahaemolyticus
TCA循环是指丙酮酸在反应中彻底被氧化脱羧生成能量的过程,TCA循环是微生物体内一切代谢的枢纽,不仅可以产生大量的还原力H和能量,而且能产生多种碳架原料以供给微生物体内的生物合成[22]。MDH和SDH是TCA循环的关键酶,MDH能催化苹果酸变成草酰乙酸,后者是TCA循环的起始的必需物质;SDH则能催化琥珀酸脱氢生产延胡索酸,SDH活性可作为评价TCA循环运行程度的指标。与空白组相比,黄精组MDH和SDH的酶活分别下降为(0.27±0.04)U/mg和(16.70±0.31)U/mg,降低55.30%和33.26%(P<0.05)(表8)。黄精显著抑制副溶血弧菌TCA循环关键酶MDH和SDH的酶活,导致细菌无法得到充足的物质和能量供应,从而加速细菌的死亡。

表8 黄精对副溶血性弧菌TCA关键酶酶活的影响Table 8 Effects of P.Rhizoma on the activities of MDH and SDH of V.Parahaemolyticus
3 讨论与结论
探讨黄精水提物和八种水产抗生素协同抑制副溶血弧菌的作用,并研究了协同抑菌机制。研究发现,黄精和土霉素联用协同抑菌效果最佳,可使黄精抑菌MIC和土霉素抑菌MIC分别缩减8 倍和4 倍,但这种协同作用在CCCP的影响下趋于消失,变成相加甚至无关,由此本文推断黄精可能也是一种天然外排泵抑制剂。通过检测筛选的22 个基因的表达,发现黄精和CCCP类似,能显著抑制外膜蛋白和RND外排泵的表达,其中8 个基因下调倍数大于30 倍,尤其是vpa0096(OmpW),其表达下调497.51 倍。
副溶血弧菌有6 个外膜蛋白,分别为OmpW、OmpU、OmpV、OmpA、OmpK和TolC[23]。vpa0096(OmpW)位于细菌细胞外膜上,为β桶状结构,属于多功能蛋白,主要涉及小分子疏水性物质和铁离子的运输以及调节对外界高盐浓度的抗性,是副溶血弧菌的毒力贡献基因之一,同时还参与细菌对抗生素和不利环境的耐受[24−25]。黄精破坏副溶血弧菌细胞膜,增加细胞膜渗透性,导致细胞去极化,导致Na+大量回流,同时又显著抑制vp2072(Na+/H+反向协同运输泵)和vp2665(Na+/Ca2+交换蛋白)的表达,使得胞内Na+无法被细菌排出体外,而细菌又无法通过提高vpa0096(OmpW)的表达来适应胞内急剧升高的盐浓度,因此容易死亡。
RND外排泵是一个三聚体,由外排转运子、膜融合蛋白和外膜蛋白组成,其中TolC是最常见的组成多个RND外排泵的外膜蛋白之一[26]。RND外排泵是副溶血弧菌最主要的药物外排系统,也是天然外排泵抑制剂主要靶点。副溶血弧菌共有12 个RND外排转运子[20],黄精抑制其中11 个转运子的表达,其中vp1092、vp0941、vp1178、vpa0344 和vpa0809的表达下降最为显著。当黄精和土霉素联用,由于RND外排转运子的表达被显著抑制,导致土霉素无法排出而在胞内大量聚集,从而提高细菌对土霉素的敏感性,降低土霉素抑菌浓度。同时,土霉素是TolC的底物之一,vp0425(TolC)表达明显下降,也说明土霉素被阻留在胞内[27−28]。
由于黄精导致细胞膜去极化,同时抑制副溶血弧菌多个Na+/H+反向协同运输泵,导致胞内外质子梯度被破坏,ATP无法生成,能量以热量形式散失,质子梯度是RND外排泵的动力来源,这可能是黄精能抑制外排泵表达的原因。由于氧化磷酸化被解偶联,那么相应的呼吸代谢必然受到影响,黄精通过抑制TCA循环的关键酶MDH和SDH,从而抑制副溶血弧菌的TCA循环,进一步加强细菌对抗生素的不耐性,促进细菌死亡。
土霉素属于四环素类抗生素,其作用机制在于能特异性地与核糖体30S亚基的A位置结合,阻止氨基酰-tRNA在此位置上的连接,从而抑制细菌蛋白质的合成,达到抑菌的目的[29]。黄精和土霉素拥有截然不同的抑菌机制,黄精更能阻留土霉素在细胞内,进一步增强土霉素的抑菌效果,因此能达到协同抑菌的良好效果。
作为和CCCP一样具有解偶联功能的外排泵抑制剂,黄精和土霉素联用能较好地协同抑制副溶血弧菌,与CCCP相比,黄精属于药食同源的天然草本,安全无毒,因此具有极具开发潜力,将来能被应用在水产养殖中,降低弧菌耐药风险,促进水产养殖的健康发展。

