响应面法优化多聚原飞燕草素超声波降解工艺及其抗氧化性的研究
姜 坤,叶焕烽,叶秦轩,杨海花
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
原花色素(Proanthocyanidins,简称PACs),是人类膳食中最丰富充足的类黄酮物质[1],在植物中大量存在。PACs是由黄烷-3-醇亚基在C-C键共存情况下,与附加的C2-O-C7 或C2-O-C5 醚键连接或C4-C8(C4-C6)键连接的组成的多酚化合物,根据其酚羟基类型可分为原花青素、原飞燕草素与原天竺葵素等。PACs具有抗癌[2]、抗氧化、抗心血管疾病,抗糖尿并发症[3−4]、抗菌[5]等多种生理活性。然而其在机体内部的所产生的生理活性与生物可利用性受聚合度大小的影响,且不同聚合度的原花色素所发挥的生物活性功能也不同。PACs根据黄烷-3-醇的聚合程度可分为低聚体(聚合度≤4)和多聚体。近些年来研究表明,多聚体原花色素不可以被完整的形式吸收,只有低聚体形式如二聚体、三聚体可以完整的形式吸收且吸收率不到表儿茶素(单体)的10%[6]。同时多聚体原花色素过高的聚合度、较大分子量和多样的空间结构制约了其的研究,虽然在植物内部中多聚体原花色素含量远远高于低聚体原花色素,但现在有关原花色素研究一般还是以低聚体为研究对象。
目前有关多聚原花色素的降解引起人们的注意,已有研究表明,降解后的多聚原花色素较降解前具有更好的活性功能[7]。现有关于多聚原花色素降解的研究主要为亚硫酸降解[8]、催化氢解和微生物降解[9]等。上述降解方法都基于化学降解或使用金属催化剂,这些方法相对来说不易操作、成本较高、降解中引入化学试剂或金属物质导致其残留难以除去,因此亟待开发出其他绿色、简便的多聚原花色素可控降解方法。超声波作为一种常用于食品加工中的绿色加工技术,目前已有研究表明超声波技术降解己经应用于各种各样的水溶性聚合物如蛋白质、多糖、油脂、风味物质及多酚等的改性研究[10−11],且具备操作简单和环境友好等优点,引起了研究人员的关注,不过目前在有关原花色素研究中多用超声波进行辅助提取[12−13]。
本次试验以杨梅叶为材料,提取制备原花色素多聚体,主要通过液质联用对原花色素多聚体成分结构进行表征,计算其聚合度,再以杨梅叶多聚原花色素进行超声降解。通过单因素实验确定最佳降解功率、温度、时间与占空比后,再通过响应面法优化超声波降解多聚体原花色素得到低聚体原花色素的最佳条件,并测定多聚原花色素降解前后的抗氧化活性变化,为多聚原花色素的深入研究及广泛开发应用提供一定支持。
1 材料与方法
1.1 材料与仪器
杨梅叶(荸荠种)深绿色老叶,着生在枝条上端 采自杭州余杭超山采摘后立即45 ℃烘干粉碎,过80 目筛网后备用;表没食子儿茶素没食子酸酯(EGCG),儿茶素(C)色谱纯Sigma (St.Louis,Missouri,USA)公司;浓盐酸、间苯三酚、抗坏血酸与乙酸钠 分析纯,成都市科隆化学品有限公司;所有有机试剂 均为国产色谱纯。
DC-1006 恒温水槽、Scientz-ⅡD超声波细胞破碎仪 宁波新芝生物科技有限公司;RE-52AA旋转蒸发仪、YR-PTB循环水真空泵 上海亚荣生化仪器厂;85-2A恒温磁力搅拌器 金坛区新瑞仪器厂;SJIA-12N冻干机 宁波双嘉仪器有限公司;LC/MS API200 质谱检测仪、LC-20AD,SPD-20A二极管阵列检测器联用、UV-1240 紫外分光光度计 日本岛津公司;Spark多功能酶标仪 Tecan Austria Gmbh;ULPHW-Ⅱ超纯水机 四川优普超纯科技有限公司;HC-3013R高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.2 实验方法
1.2.1 多聚体原花色素的制备与表征
1.2.1.1 多聚体原花色素的制备 参考文献方法[14]并加以修改,取定量杨梅叶粉末,料液比1:10 加入含有1 mg/mL抗坏血酸的70%丙酮(V/V)溶液,混合均匀后于室温下避光提取12 h,浸提两次,合并两次浸提液,抽滤后与等体积的三氯甲烷萃取分层收集上层液体放置磁力搅拌器上。向其中加入氯化钠不停搅拌直至使上述收集液体饱和且出现片状漂浮物及壁上析出原花色素多聚体,5000 r/min离心3 min除去上清液收集沉淀,用0 ℃水快速溶解多余的盐并除去,以室温水收集溶解壁上的沉淀和离心的沉淀,−55 ℃冷冻干燥12 h后即得原花色素多聚体。根据冻干后的多聚体原花色素干粉与最初的杨梅叶粉末的比值计算实提取率。
1.2.1.2 EGCG标液配制 称取5 mg EGCG标品,溶于2 mL甲醇溶液中配制成2.5 mg/mL的EGCG标准液,分别取0、200、400、600、800、1000 μL于1 mL试管中,用甲醇稀释到1 mL,溶液通过0.22 μm膜过滤后采用RP-HPLC-DAD进行分析,并绘制标准曲线,标准曲线方程为y=11301080.7910203x−8782.597006775(R2=0.9999)。
1.2.1.3 多聚体原花色素结构及聚合度的测定 参考文献[15]方法,称取5 mg制备的杨梅叶多聚原花色素,溶解在1 mL含有0.2 mol/L HCl、50 g/L间苯三酚(phloroglucinol)和10 g/L抗坏血酸的甲醇溶液中。混匀后置于60 ℃恒温水浴锅中反应1 h,反应完后迅速加入等体积的200 mmol/L乙酸钠水溶液终止反应。反应后的溶液过0.22 μm膜后,立即进行HPLC-DAD及HPLC-UV-MS分析。
分析条件:色谱柱为ZORBAX SB-C18(Agilent,USA)(250 mm×4.6 mm,5 μm),柱温为35 ℃,进样量为10 μL,流速为1 mL/min,检测波长为280 nm,流动相为0.1%色谱级甲酸水溶液(A)和色谱级甲醇(B),梯度洗脱:5% B(0~10 min)、5%~20% B(10~20 min)、20%~40% B(20~30 min)、40%~90%B(30~37 min)。多聚原花色素的平均聚合度(mDP)值以下列公式计算:

式中:A0为黄烷三醇单体摩尔数;A1为间苯三酚加合物摩尔数。
1.2.2 多聚原花色素的超声波降解工艺优化
1.2.2.1 多聚原花色素的超声降解单因素实验 称取25 mg步骤1.2.1.1 所得制备样品溶于甲醇中配制0.25 mg/mL样液,每次取20 mL样液于定制玻璃管中(液面高度≥3 cm),将超声振幅杆置于玻璃管中心后探入样液内部,深度固定为1.5 cm[16−17]。以外部循环恒温水槽控制超声内部温度,恒定后设定参数进行超声降解。以多聚原花色素降解后得到的低聚原花色素得率为响应值,固定其他参数,选择时间、温度、功率、占空比[18−19]4 个因素进行单因素实验研究各因素对低聚体得率的影响。时间为超声总时间,选择时间为50、60、70、80、90 min,此时其他条件固定为超声功率360 W,温度45 ℃,占空比67%;温度为超声过程中内部环境温度,选择5、15、25、35、45、55 ℃为单因素自变量,此时其他条件固定为时间70 min,超声功率360 W,占空比67%;超声功率为Scientz-ⅡD超声波粉碎机(总功率950 W)的实时功率,选择功率180、270、360、450、540 W,此时其他条件固定为时间70 min,温度45 ℃,占空比67%;超声占空比为超声脉冲时间与停止时间的比值,固定总时间为5 s,选取56%、67%、79%、92%、100%作为单因素自变量(即对应脉冲时间1.6、1.8、2、2.2、2.4 和2.5 s),此时其他条件固定为时间70 min,温度45 ℃,超声功率360 W。单因素超声试验降解结束后以方法1.2.2.3 测小分子低聚体原花色素得率。
1.2.2.2 响应面试验 根据1.2.2.1 单因素实验结果,选取时间(A),温度(B),功率(C)和占空比(D)为实验因素,以超声降解的小分子低聚体原花色素得率为响应值。通过Box-Behnken试验设计原理设计响应面试验。从而确定最佳的超声波降解原花色素工艺。响应面设计因素及水平如表1 所示。

表1 响应面设计因素及水平Table 1 Independent variables and their levels employed in a central composite design
1.2.2.3 超声降解后低聚体原花色素得率的测定原花色素含量的测定参考文献[15],配制2.5 mg/mL儿茶素标准甲醇溶液,梯度稀释后加入2.5 mL 1%香草醛甲醇溶液和2.5 mL 20%(v/v)的硫酸甲醇溶液,混匀后置于30 ℃水浴中避光反应15 min,在500 nm处测定吸光度,空白为纯甲醇,绘制标准曲线,标准曲线方程为y=2.3162x+0.0837(R²=0.99)。取1 mL降解前后样液,用甲醇稀释至两毫升后测定其吸光度,超声前测定多聚原花色素的总原花色素吸光度A0,超声后通过乙酸乙酯萃取得到新生成的低聚体原花色素,并测定其吸光度A1。通过计算A0与A1的关系可以得到低聚体原花色素得率,其计算方法如下:
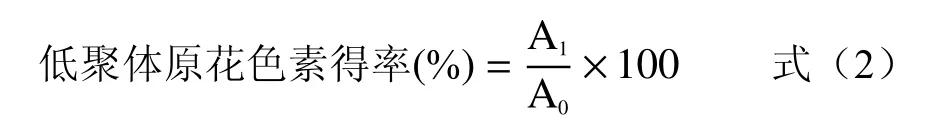
式中:A1为超声降解后低聚体原花色素含量吸光度;A0为超声降解前多聚原花色素的原花色素含量吸光度。
1.2.3 降解前后抗氧化活性的测定
1.2.3.1 DPPH自由基清除率 DPPH·清除率试验参考文献[20]并有所改进,取3.5 mg DPPH溶于100 mL甲醇配制DPPH·标准液。收集超声降解0、30、50、70 min后样液,梯度稀释后,取0.2 mL待测稀释液加入2.8 mL DPPH·标准液中,30 ℃水浴避光30 min,于517 nm处测定各样品DPPH自由基清除率并计算EC50值,EC50值为自由基清除率达到50%时的样品浓度。以抗坏血酸(Vc)与丁基羟基茴香醚(BHA)为对照组,以DPPH·标准液溶液为空白组。自由基清除率计算公式如下:

式中:A0为空白组吸光度;A1为样品吸光度。
1.2.3.2 ABTS自由基清除率测定 参考文献[21],并有所改进,配制7 mmol/L ABTS·+储备液和140 mmol/L过硫酸钾溶液,取7.5 mL ABTS·+储备液与132 μL过硫酸钾溶液混合均匀室温避光储备过夜后稀释到600 mL得标准液。收集超声降解0、30、50、70 min后样液,梯度稀释后,取0.2 mL待测液加入3.8 mL ABTS·+标准液,室温避光反应10 min后于734 nm处测定样品ABTS·+自由基清除率并计算EC50值。以抗坏血酸(Vc)与丁基羟基茴香醚(BHA)为对照。以ABTS·+标准液溶液为空白组。自由基清除率计算公式同式3。
1.3 数据处理
所有实验作三次平行测定取平均值加减标准差,采用SPSS 26 进行单因素方差分析与显著性差异分析,运用Prism 8.02 进行作图,Design expert 8.06 进行响应面试验。
2 结果与分析
2.1 多聚体原花色素的制备与表征
2.1.1 多聚原花色素的制备 经计算,制备所得的杨梅叶多聚体原花色素提取率为5.96%(干重),低于杨海花[15]以杨梅叶为材料时的原花色素提取率(11.7%),但杨海花的研究中提取对象为整体原花色素,包括低聚体与多聚体原花色素,并非只提取多聚体原花色素。目前现有的原花色素提取方法所提取对象与其一致,并没有针对多聚体原花色素提取的研究。此外根据提取材料与方法的不同,提取率也不同,李明月[22]以高压脉冲电场提取山葡萄籽原花色素提取率为8.23%,且其主要由聚合度低于3.4 的原花青素构成。Liu等[11]超声辅助提取油樟叶原花色素提取率为7.88%,其主要构成也为低聚体的原花青素。此外,上述方法后续为得到多聚体原花色素还需进一步分离,相比于此,本试验方法操作简单且可得到多聚体原花色素。
2.1.2 杨梅叶多聚原花色素的组成及聚合度 采用间苯三酚法结合RPHPLC-DAD-ESIMS分析了多聚原花色素的结构组成,结果如图1 所示。图中结果显示多聚原花色素经酸水解后主要生成了两种产物,保留时间分别为14.6 min(峰1)与26.7 min(峰2)。峰1 的分子离子([M-H]−)为581.1,双分子离子([2M-H]−)为1163.3,结合其紫外吸收特征及参考文献,判定峰1 为EGCG-ph,即EGCG的间苯三酚加合物。峰2 的紫外最大吸收波长为273.5 nm(290 nm至325 nm有一肩峰),质谱中分子离子[M-H]−为457.1,双分子离子[2M-H]-为915.3,此外通过与图2中的EGCG标准品(即峰3)进行比对,确定峰2 为EGCG。以上结果说明制备得到的多聚原花色素组成单元主要为EGCG,为多聚原飞燕草素,该结果与文献研究一致[15]。

图1 杨梅叶多聚原花色素酸降解RP-HPLC-UV结果Fig.1 Acidolysis of PACs from bayberry leaves by high performance liquid chromatography RP-HPLC-UV
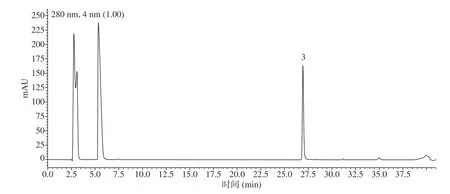
图2 标品EGCG的RP-HPLC-UV结果Fig.2 High performance liquid chromatography RP-HPLC-UV of EGCG standard
原花色素的聚合度可根据其经间苯三酚处理后的加合物及单体摩尔数比例进行计算,参考文献[23]可知对应比例,根据EGCG标曲得出对应EGCG的摩尔数,根据比例以公式1 计算可知,通过该方法提取的杨梅叶多聚体原飞燕草素平均聚合度约为27.8。通过该方法提取制备杨梅叶原飞燕草素构成结构简单且聚合度高,因此选择其进行后续的超声降解。
2.2 超声降解的单因素实验
2.2.1 时间对超声降解的影响 试验研究了不同超声时间对多聚体原飞燕草素降解后小分子低聚体原花色素得率的影响,该得率随时间的延长变化显著(P<0.05)。如图3 所示,在前70 min内,随着超声时间的延长小分子低聚体原花色素得率显著提高(P<0.05),且在50~60 min时间段小分子得率大幅提高,从7.66%上升到16.58%,并在70 min时到达最大值。超过70 min后,小分子得率迅速降低,超声时间的过度延长会带来负面影响例如氧化或聚合[24],从而减少小分子的得率。随着降解时间延长到90 min后,小分子得率减少到3.55%。这可能是由于超声过长时间所产生的自由基如羟基自由基含量的增加,到达了反应阈值引起了小分子原花色素的降解[25]。因此选定超声时间70 min作为后续研究参数。
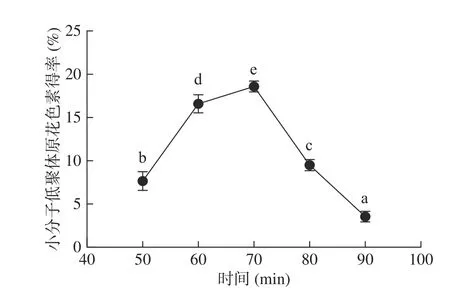
图3 时间对小分子低聚体原花色素得率的影响Fig.3 Effect of time on the yield of oligomeric prodelphinidins
2.2.2 温度对超声降解的影响 温度是影响超声空化效应的重要因素。如图4 所示,在5~45 ℃范围内,随着体系温度的增加,小分子低聚体原花色素得率稳定升高,该过程中,温度的升高促进原飞燕草素多聚体及其他聚合物的热分解,伴随着甲醇溶剂的渗透和原飞燕草素的扩散[25],促进多聚体的超声降解。当温度在45 ℃时,小分子得率到达最大值。超过45 ℃后,小分子得率迅速下降,此时由于温度的上升,虽然降低了甲醇空化阈值并使其易于产生空化效应,但温度的上升增加了蒸气压并降低了空化强度[22]。当温度为55 ℃小分子得率为0.76%,此时小分子得率极低,可能源于空化效应的降低及温度上升导致的对小分子的热降解。因此选定温度45 ℃作为后续研究参数。

图4 温度对小分子低聚体原花色素得率的影响Fig.4 Effect of temperature on the yield of oligomeric prodelphinidins
2.2.3 功率对超声降解的影响 超声波功率达到空化阈值后才能产生空化效应。试验研究了不同超声功率对多聚体原飞燕草素降解后小分子低聚体原花色素得率的影响。如图5 所示,在180~360 W范围内,随着降解功率的升高,小分子得率不断上升,当功率为360 W时得到最高得率。后续随着功率的增加,小分子得率逐渐降低。这主要是因为在低功率情况下,随着功率的上升,空化气泡数目增加且容易破裂[24],增强了空化效应,带来更强烈的机械和声化学效应。随着功率的不断增高,气泡不断增大,导致其难以破裂或仅仅发生微小坍塌,从而降低空化效应,且空化气泡过多影响超声波的传播[26−27]。因此选定功率360 W作为后续研究参数。

图5 功率对小分子低聚体原花色素得率的影响Fig.5 Effect of power on the yield of oligomeric prodelphinidins
2.2.4 占空比对超声降解的影响 超声占空比的改变影响超声波的强度与自由基的产生[28]。试验研究了不同超声占空比对多聚体原花色素降解后小分子低聚体原花色素得率的影响。如图6 所示,整个曲线趋势为先增大后降低至平缓。随着占空比的增加,更多能量传递至溶剂体系,加速了多聚原飞燕草素的降解以及单位体积内空化气泡的产生,从而小分子得率不断升高[29−30]。当占空比为67%时,具有最大小分子得率,此时超声脉冲时间为2 s,停止时间为3 s。当占空比增加到67%以上时,随着占空比的增加,小分子得率逐渐变低,这源于过多的空化气泡形成阻碍超声波能量的传输以及过多的羟基自由基的产生[31]。因此选定占空比为67%作为后续研究参数。

图6 占空比对小分子低聚体原花色素得率的影响Fig.6 Effect of duty cycle on the yield of oligomeric prodelphinidins
2.3 响应面实验结果及分析
2.3.1 回归模型的建立及方差分析 利用Design Expert对时间,温度,功率与占空比进行四因素三水平Box-Behnken试验,响应面实验设计及结果如表2所示。对结果进行方差分析,将数据进行多元回归拟合,得到小分子低聚体原花色素得率(Y)与时间(A),温度(B),功率(C)与占空比(D)的二次响应面回归方程为:

表2 响应面试验设计及结果Table 2 The design and result of response surface methodology
Y=18.51−0.81A−0.93B+0.5C+0.23D+0.21AB+0.028AC−0.47AD−0.17BC+0.21BD+0.26CD−2.99A2−3.23B2−2.84C2−2.12D2
超声降解后小分子低聚体原花色素得率的回归方程方差分析如表3 所示。结果显示回归方程模型中因变量与自变量存在极显著多元回归关系,整体模型的P<0.0001,即该模型达到极显著水平。根据回归方程一次项系数绝对值大小可知,影响多聚体原花色素超声降解的主次因素为温度(B)>时间(A)>功率(C)>占空比(D),其中A,B,C三项对多聚原花色素的降解具有极显著影响(P<0.01);D占空比不显著(P>0.05),其对小分子低聚体原花色素得率的影响不如前三者[32]。失拟项P=0.06316>0.05,失拟项检验不显著,说明未知因素对试验结果的影响较小,残差主要由随机误差引起,表明模型选择适当正确。在整个模型中,模型中的调整系数R2Adj为95.50%,说明95.50%的响应值变化可以通过模型进行解释,相关系数R2为97.75%,信噪比21.1238>4,表明模型可信度很高,且模型与试验拟合良好,可以用此模型进行分析和预测[33−34]。

表3 回归方程方差分析Table 3 Analysis of variance of the regression model
2.3.2 工艺优化及结果验证 图7 直观显示了各因变量交互效应对多聚体原花色素超声降解后小分子低聚体原花色素得率的影响。小分子得率在试验范围内都出现最大值,说明因素水平选择合理,能反映出各因素交互作用对小分子低聚体得率的影响。随着不同双变量的增加,多聚体原花色素超声降解后的小分子低聚体原花色素得率趋势相似,即为先增大后降低。通过响应面试验优化,得出多聚体原花色素降解的最佳工艺参数为时间74.02 min,温度44.34 ℃,功率363.77 W,占空比67.08%。为方便操作将其修正为时间74 min,温度44 ℃,功率361 W,占空比67%。在此条件下进行验证试验的小分子得率为17.31%±0.23%,与预测值17.78%基本吻合。实测值与预测值之间具有良好的拟合性,从而证实了模型的有效性。
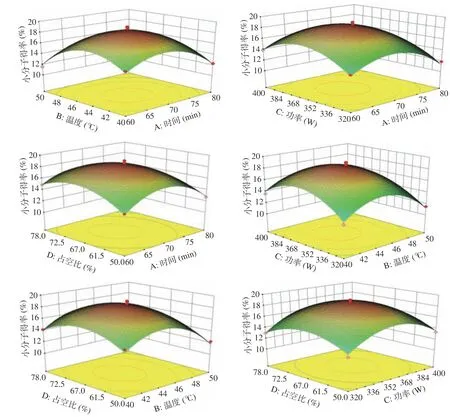
图7 各因素交互响应面图Fig.7 Response surface of the interactive effects of various factors on degradation
2.4 超声降解前后多聚原花色素的HPLC对比
取超声降解前后的多聚原飞燕草素样液,过0.22 μm膜后以1.2.1.3 条件进行RP-HPLC检测。降解前的原花色素多聚体聚合度高,极性较大,同分异构体较多,因此极难直接通过RP-HPLC进行分离[15],其谱图中出现图8 所示的大驼峰。而经超声降解后的多聚原飞燕草素,并未出现类似驼峰,此时可证明该条件下超声对杨梅叶多聚原飞燕草素起到一定的降解作用。
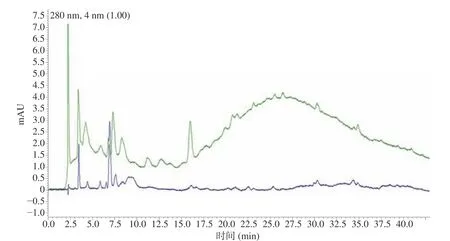
图8 超声前后RP-HPLC对比Fig.8 Comparison of RP-HPLC before and after ultrasound
2.5 降解前后抗氧化活性的测定
2.5.1 清除DPPH自由基能力 测定了不同降解时间的多聚体原花色素,抗坏血酸(Vc)以及常用的食品抗氧化剂丁基羟基茴香醚(BHA)的DPPH自由基清除能力。如图9 所示,相比于BHA,原花色素的清除能力更强。降解后各时间段的多聚原花色素清除能力明显高于降解前,且随着降解时间的延长活性增强。在5~25 μg/mL范围内,超声降解前后的原花色素浓度与其抗氧化活性呈线性关系且极其相关。超声降解前EC50值为16.83 μg/mL,降解后EC50值为7.54 μg/mL,超声降解前后的DPPH自由基清除能力具有极显著差异(P<0.01)。Vc的EC50与降解50 min的原花色素类似且低于降解70 min的原花色素。降解后的原花色素表现出更强的DPPH自由基清除能力。

图9 样品的DPPH自由基清除曲线Fig.9 DPPH free radical scavenging curve of samples
2.5.2 清除ABTS自由基能力 如图10 所示,与2.5.1类似,经过降解的原花色素表现出更强的ABTS自由基清楚能力且随着降解时间的延长而增强。在5~25 μg/mL范围内,超声降解前后的原花色素浓度与其抗氧化活性呈线性关系且极其相关。超声降解前EC50值为12.33 μg/mL。降解后EC50值为3.594 μg/mL,具有极显著差异(P<0.01)。降解后的原花色素清除能力显著高于降解前原花色素与BHA(P<0.05)。相比Vc,降解50 min的原花色素EC50与其相似,且都低于降解70 min的原花色素。经超声降解处理后的原花色素表现出更强的清除ABTS自由基能力。
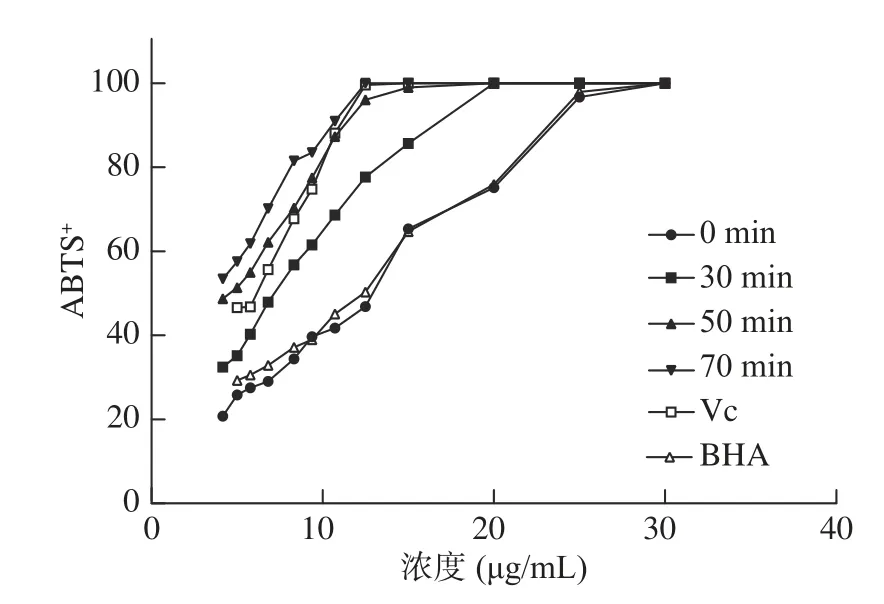
图10 样品的ABTS自由基清除曲线Fig.10 ABTS free radical scavenging curve of samples
上述降解后的多聚原飞燕草素相比于降解前,具有更强的DPPH及ABTS自由基清除能力,经超声处理过后的整体抗氧化活性显著增加,这主要源于单体及低聚体原花色素的释放[7],由于单体及低聚体较小的空间位阻使得其酚羟基活性更强[22]。此外,超声条件下导致的原本与其他非原花色素聚合物如蛋白质或多糖相连的原花色素的释放,也可能是抗氧化活性增强的部分原因[35]。
3 结论
本试验选择成分简单,聚合度较高的杨梅叶多聚原飞燕草素进行超声波降解。通过单因素实验确定了影响超声降解后小分子低聚体原花色素得率的四个主要因素:时间,温度,功率与占空比。在此基础上利用响应面Box-Behnken试验建立了多项式回归模型优化超声降解工艺,最终确定工艺条件为时间74 min,温度44 ℃,功率361 W,占空比67%。在此条件下进行验证试验的小分子得率为17.31%±0.23%。降解后的杨梅叶多聚原飞燕草素相比于降解前表现出更强的抗氧化活性。
原花色素的低聚体具有更强的生理活性,更易被人体吸收利用。超声降解后的单体及低聚体原花色素相对于多聚体,可更广泛的应用于食品、化妆品以及保健品等领域。此外,超声降解多聚原花色素所得的单体,低聚原花色素的结构,种类,降解机制及途径,仍需进一步探索。总之,该优化后的工艺方法为多聚体原花色素的开发利用及后续研究提供一定理论基础。

