盐酸羟胺/铁基MOFs/过硫酸盐体系降解磺胺嘧啶
吴承梓,张 巍*,万彦涛,修光利
盐酸羟胺/铁基MOFs/过硫酸盐体系降解磺胺嘧啶
吴承梓1,2,3,张 巍1,2,3*,万彦涛1,2,3,修光利1,2,3
(1.华东理工大学资源与环境工程学院,国家环境保护化工过程环境风险评价与控制重点实验室,上海 200237;2.上海市环境保护化学污染物环境标准与风险管理重点实验室,上海 200237;3.上海污染控制与生态安全研究院,上海 200092)
使用盐酸羟胺(HA)促进Fe(Ⅲ)/Fe(Ⅱ)循环,强化铁基金属有机骨架(Fe-MOFs)/过硫酸盐(PS)体系降解水中磺胺嘧啶(SDZ).通过X射线衍射(XRD)、扫描电子显微镜(SEM)、傅立叶变换红外光谱(FTIR)和X射线光电子能谱仪(XPS)对Fe-MOFs进行结构和形貌的表征.探究了溶液初始pH值、PS浓度、Fe-MOFs投加量、HA浓度、SDZ浓度、共存离子、腐殖酸等对SDZ去除效果的影响,并考察了该体系的实际应用前景.结果表明,Fe-MOFs/PS/HA体系在较宽的初始pH值范围(3~6)内,对于SDZ的180min去除率可达到90.1%以上.适量的HA可以促进Fe-MOFs/PS体系降解SDZ的性能.自由基清扫实验和电子顺磁共振实验表明,Fe-MOFs/PS/HA体系降解SDZ的过程中产生了SO4-•、•OH、O2-•以及1O2.在本文考察范围内,Fe-MOFs/PS/HA体系对SDZ的降解性能随pH值(pH=3~6)升高逐渐下降;随着PS、HA、Fe-MOFs浓度的升高,SDZ去除率呈现率先上升后下降的趋势.氯离子、腐殖酸等因素对该体系应用于实际地表水存在负面作用,但HA可以强化该体系在自然环境下降解SDZ的效果.循环实验结果表明,Fe-MOFs具有良好的重复使用性,表现出了良好的应用潜力.
铁基金属有机骨架;还原剂;过硫酸盐;催化降解机制;磺胺嘧啶
磺胺类药物(SAs)是以对氨基苯磺酰胺为基本化学结构的一类人工合成的广谱抗菌药物,广泛应用于养殖业中的饲料添加剂和兽医临床治疗药物[1].然而,该类药物使用后不能被人体或动物完全吸收,大部分以原形或者代谢物的形式进入到环境,成为环境中的潜在污染物[2].
过硫酸盐(PS)在常温下较为稳定,氧化能力远超过普通的化学氧化剂,因此近年来基于过硫酸盐的高级氧化技术受到了广泛的关注[3].非均相反应体系的优点是催化剂可以多次循环利用,并且体系可以在一个较宽的pH值条件下进行.金属有机骨架材料(MOFs)是一种具有空间三维孔洞的新型晶态配合物,具有强的金属配体间的相互作用力、结晶性以及多孔性等特点[4].铁基金属有机骨架(Fe-MOFs)中的不饱和Fe位点可以活化PS产生•OH或SO4-•降解有机污染物,如通过MIL-53(Fe)活化PS产生SO4-•降解水溶液中的甲基橙[5],通过2-磺酸蒽醌改性NH2-MIL-101(Fe)并催化PS产生SO4-•和•OH降解双酚A[6].由此可见Fe-MOFs是一类具有研究价值的非均相催化剂.
然而,Fe-MOFs催化类芬顿反应体系中存在Fe(Ⅲ)/Fe(Ⅱ)循环还原反应速率较慢这一缺陷,限制了PS活化反应的整体速率[7].解决这一问题的策略一方面是增加催化剂本身Fe(II)点位的数量,比如在一些Fe基催化剂研究中,用Fe3O4代替Fe2O3可以增加Fe(II)点位,进而活化PS促进阿特拉津的降解[8];通过增加MIL-53中的Fe(II)点位可以更好地活化PS促进甲基橙的降解[9];通过合成富含Fe(II)点位的Fe-MOFs-A/B/C/D-0.25可以活化PS促进甲基橙的降解[10].另一方面则是通过加入还原剂等外界手段促进催化剂中的Fe(Ⅲ)/Fe(Ⅱ)循环.比如L-半胱氨酸可促进Fe(Ⅲ)/Fe(Ⅱ)循环,进而促进亚甲蓝的降解[11];抗坏血酸可促进Fe@Fe2O3降解甲草胺[12];羟胺可促进非均相Fenton反应体系中阿特拉津的降解[7].目前还原剂引入Fe-MOFs非均相类芬顿反应促进降解反应进行的报道尚不多见,催化机制和适用范围尚不明确,有待进一步探索.
本研究通过制备富含Fe(Ⅱ)点位的Fe-MOFs作为非均相类芬顿催化剂用于活化PS催化降解磺胺嘧啶(SDZ),通过盐酸羟胺(HA)促进Fe(Ⅲ)/Fe(Ⅱ)循环,进而促进反应体系SDZ的降解.通过X射线衍射(XRD)、扫描电子显微镜(SEM)和傅立叶变换红外光谱(FTIR)等对Fe-MOFs的结构和性能进行表征,研究了还原剂投加量、PS浓度、Fe(II)-MOFs投加量、溶液初始pH值和SDZ初始浓度等反应条件对Fe-MOFs催化活性的影响,同时对HA促进反应体系的催化降解机理进行探讨分析,并测试了Fe-MOFs的重复使用性及稳定性,以评价其作为类芬顿催化剂的实际应用潜力.
1 实验材料与方法
1.1 实验试剂
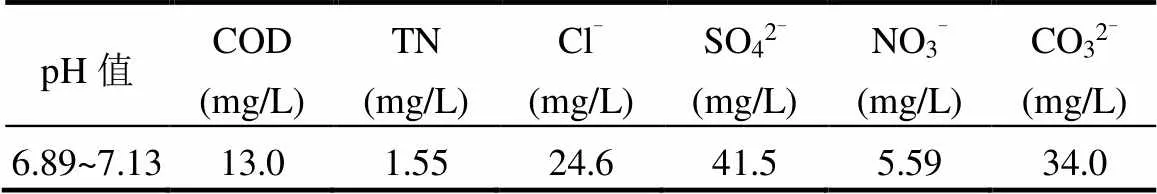
所用试剂包括:磺胺嘧啶(C10H10N4O2S,99%)购自上海麦克林生化科技有限公司;过硫酸钾(K2S2O8,≥99.5%)、氯仿(CHCl3,³99%)购自国药集团化学试剂有限公司;N,N-二甲基甲酰胺(DMF,C3H7NO,³99.5%)、甲醇(CH3OH,³99.5%)、2,2,6,6-四甲基-4-哌啶醇(TEMP,C9H18NO,>98%)、L-组氨酸(C6H9N3O2,98%)购自上海泰坦化学有限公司;盐酸羟胺(NH2OH·HCl,99%)、对苯二甲酸(PTA,C8H6O4,³99%)、氢氟酸(HF,³40%)、5,5-二甲基-1-吡咯啉- N-氧化物(DMPO,C6H11NO,>98%)、腐殖酸(FA,³90%)购自上海阿拉丁生化科技股份有限公司;叔丁醇(TBA,C4H10O,98%)购自上海凌峰化学试剂有限公司;四水合氯化亚铁(FeCl2·4H2O,99%)购自上海源叶生物科技有限公司.实验用水一般采用MQ超纯水(电阻率18.2MΩ·cm),地表水样取自上海徐汇区春申港某桥断面(31°8'42''N,121°26'59''E).
1.2 Fe-MOFs的制备
Fe-MOFs使用如下方法制备[13],在200mL三颈烧瓶中分别将1.06g四水合氯化亚铁、0.424g对苯二甲酸加入100mL DMF中,之后加入12mL甲醇和3.2mL氢氟酸,在高纯氮气保护下进行搅拌加热反应24h,反应温度393K.反应结束后,密封三口烧瓶,转移至厌氧培养箱中缓慢冷却,冷却后分别用DMF和甲醇洗涤样品,并在高纯氮气保护下晾干,得到反应所需材料,命名为Fe-MOFs,并放置于氮气环境下保存.
1.3 降解实验
在298K下,将Fe-MOFs及HA加入到250mL的SDZ溶液中,用HCl和NaOH调节所需初始pH值.在磁力搅拌下加入一定量的PS,进行降解反应.在既定时间点取1mL样品通过0.22μm水相过滤器过滤后,迅速转移至含有1mL甲醇的棕色样品瓶中终止反应,用高效液相色谱仪(HPLC)测定SDZ的浓度.同时设置对照实验.反应结束后,过滤分离Fe- MOFs,用水和甲醇洗涤、干燥后再次用于反应.重复该过程若干次探究Fe-MOFs的重复使用性.
1.4 表征及分析方法
采用Waters 2998型高效液相色谱仪进行SDZ浓度分析.用C18反相色谱柱(Agilent ZORBAX Eclipse Plus,4.6mm×250mm,5 µm),流动相为80%甲醇和20% H2O(含0.1% H3PO4),流速1mL/min,柱温40℃,进样量30µL,采用光电二极管阵列(PDA)检测器,检测波长为257nm.反应结束的铁溶出情况通过邻菲罗啉分光光度法来测定[14].铁离子浓度采用哈希DR-6000紫外分光光度计,在波长512nm处测定.
使用日本理学电机公司的D/max2550VB/PC型X射线衍射仪(XRD)进行表征, 采用日本电子株式会社JSM 6360LV型真空扫描式电子显微镜(SEM)观测Fe-MOFs的表面形貌.FTIR测试在美国尼高力公司的6700型红外光谱分析仪上用KBr压片法进行测定.通过美国麦克默瑞克仪器公司所生产的Tristar Ⅱ 3020型比表面积孔径分析仪对Fe-MOFs的比表面积及孔径进行测定.通过美国铂金埃尔默股份有限公司生产的PHI5300型X射线光电子能谱仪(XPS)进行材料表面层的元素组成及元素的电子状态分析.
反应过程中的活性氧化物种通过Bruker ELEXSYS E500型号的EPR搭配SHQ谐振器和Oxford ESR900连续流动低温恒温器进行检测.实验中使用DMPO作为羟基自由基(•OH)、硫酸根自由基(SO4−•)、超氧自由基(O2-•)的捕获剂,使用TEMP作为单线态氧(1O2)的捕获剂. EPR检测条件为:20 ℃,中心磁场为326mT,扫描宽度为10mT,扫描时间为30s,调制频率为100kHz,调制幅度为1G,微波频率为9.63GHz,微波功率为10mW.
2 结果与讨论
2.1 材料表征
由图1a可知,本次研究合成的Fe-MOFs的XRD图谱在2等于7.5°、9.2°和10.5°和22.1°处出现较为明显的衍射峰,与文献[15]中记载采用类似方法所制得的Fe-MOFs匹配度很高,其他杂质的衍射峰较不明显,说明较好地完成富含Fe(Ⅱ)的Fe- MOFs的合成.
由图1b可知,Fe-MOFs的特征吸收峰在746, 1376, 1546cm-1处.其中,746cm-1处的尖峰和苯环中的C-H键有关,1376, 1546cm-1处的2个尖峰主要由C-O键的不对称振动和C=C伸缩振动引起[16]. 3442cm-1处的峰则来源于Fe-MOFs表面O-H吸附的H2O拉伸振动.

通过图1c和图1d可以看出,通过本方法合成的SEM呈明显的棒状结构,成型较好.对Fe-MOFs的比表面积及孔径进行测定.由图1e的N2吸附-解吸等温线可知,Fe-MOFs为多孔结构,比表面积为228.69m2/g,孔体积为0.22cm3/g.图1f孔径分布表明Fe-MOFs的孔径以微孔和介孔为主,平均孔径为4.02nm.
2.2 Fe-MOFs/PS/HA体系催化降解磺胺嘧啶的效果
如图2所示,Fe-MOFs/PS/HA体系对SDZ的降解效果明显好于其他反应体系,在180min内可去除99.4%以上的SDZ.而在只有Fe-MOFs的条件下, SDZ的去除率仅7.87%,说明Fe-MOFs对SDZ基本无吸附效果.在仅存在PS的条件下,SDZ去除率仅6.83%,说明SDZ难以直接被PS氧化[17].
为了确定本体系为类芬顿非均相反应,而不是Fe-MOFs的溶出铁离子进行反应,本研究将Fe- MOFs浸泡于250mL的超纯水中,浸泡时间24h,通过离心过滤得到滤液,并在其中加入PS引发降解反应.结果表明,Fe-MOFs溶出液/PS/HA体系对SDZ的去除率仅16.7%,远低于Fe-MOFs/PS/HA体系的去除效率,说明本体系主要是非均相的Fe-MOFs上的活性位点起催化作用.
通过Fe-MOFs/PS和Fe-MOFs/PS/HA两个体系的对比可以发现,HA对Fe-MOFs/PS体系会起到明显的促进作用.这是因为在无还原剂的反应体系中,Fe(Ⅲ)/Fe(Ⅱ)的循环较慢,Fe(Ⅲ)的还原是限制反应速率的一大难题[18].而HA可以促进加速这一还原反应过程,从而加速SDZ的降解反应进行,如式(1)~(4)所示.
Fe(Ⅱ)+S2O82-→Fe(Ⅲ)+ SO4-•+SO42-(1)
Fe(Ⅱ)+SO4-• → Fe(Ⅲ)+SO42-(2)
Fe(Ⅱ) +•OH + H+→ Fe(Ⅲ) + H2O (3)
Fe(Ⅲ)+HA→Fe(Ⅱ) + HAprod(4)

图2 不同反应体系中SDZ降解情况
反应条件: SDZ=5mg/L, Fe-MOFs=0.2g/L, HA=0.4mmol/L, PS=0.9mmol/L,初始pH=4, 反应温度=298K
2.3 活性自由基鉴定
2.3.1 自由基清除实验 为了探究Fe-MOFs/PS/ HA体系降解SDZ过程中产生的自由基种类,依据各种自由基清除剂与自由基的反应速率各不相同,在原有反应体系中引入叔丁醇作为×OH清除剂,甲醇作为SO4-×和×OH共同的清除剂,氯仿作为O2-×的清除剂[19],L-组氨酸作为1O2的清扫剂[20].实验结果如图3所示.
当体系中加入100mmol/L的叔丁醇后,SDZ在60min的去除率为51.1%,180min的去除率为64.3%,说明×OH在反应体系中起到了去除SDZ的作用.加入100mmol/L的甲醇后,SDZ在180min的去除率仅为41.9%,说明除了×OH,SO4-×在反应体系中同样起到了重要作用.向体系中加入100mmol/L的氯仿后,SDZ在60min的去除率为56.8%,在180min的去除率为75.8%,这表明O2-×同样参与了SDZ的降解反应.如式(5)~式(10)所示[21],O2-×在体系中主要起到了促进SO4-×和×OH生成的作用,进而促进SDZ的去除.在加入10mmol/L的L-组氨酸后,SDZ在180min内的去除率为65.8%,说明1O2可能存在并参与了SDZ的降解反应.
S2O82-+ 2H2O→3H++ HO2-+ 2SO42-(5)
S2O82-+ HO2-→O2-• + SO42-+ SO4-• + H+(6)
Fe(Ⅱ)+O2→Fe(Ⅲ)+ O2-• (7)
O2-•+S2O82-→SO42-+SO4-•+O2(8)
2O2-• + 2H+→ H2O2+ O2(9)
Fe(Ⅱ) + H2O2→Fe(Ⅲ) + •OH + OH-(10)
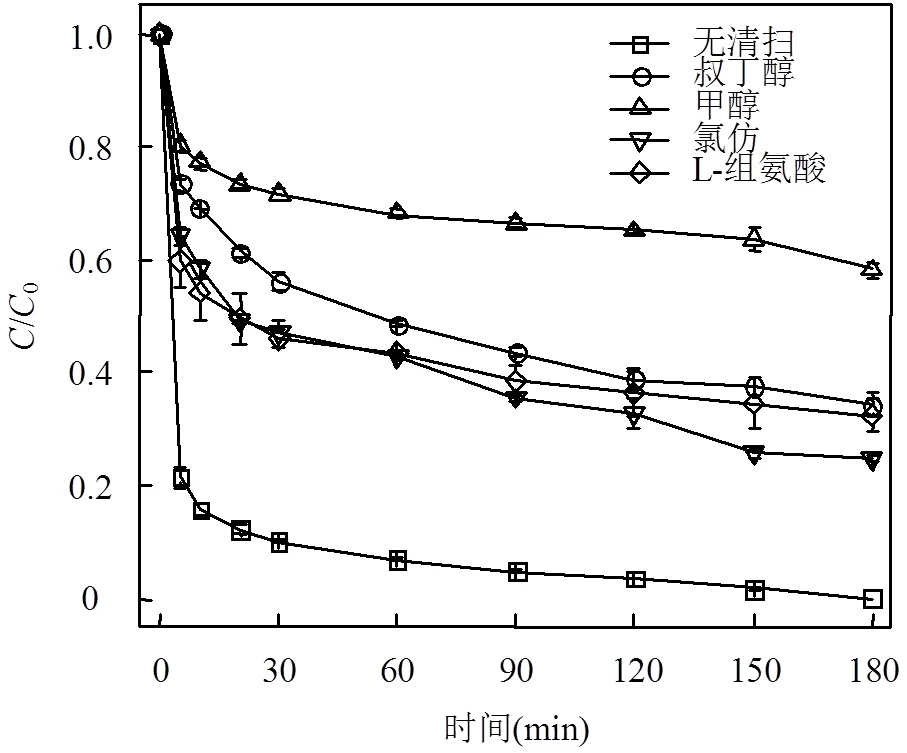
图3 自由基清除剂对SDZ降解效果的影响
反应条件:SDZ=5mg/L, Fe-MOFs=0.2g/L, HA=0.4mmol/L, PS=0.9mmol/L, 初始pH=4, 反应温度=298K
2.3.2 电子顺磁共振实验 为了进一步验证Fe- MOFs/PS/HA体系产生的自由基种类,本研究在SDZ降解反应进行至15min时,向反应体系中分别加入DMPO和TEMP作为自由基捕获剂[22],捕获后通过EPR分别检测DMPO、TEMP和活性自由基的加合物来判断反应体系中所产生的自由基的种类.
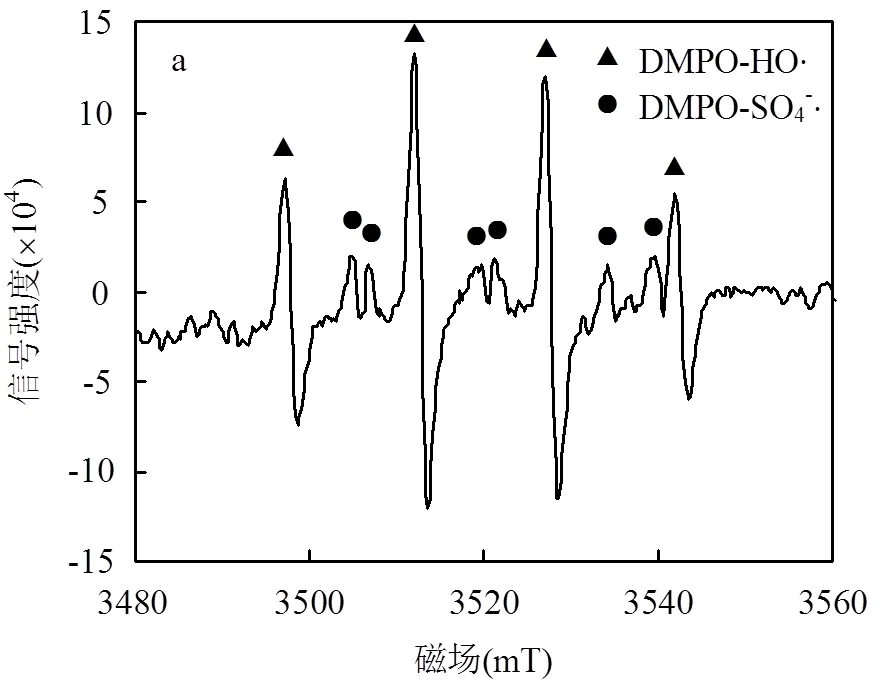
反应进行15min时的EPR谱图如图4所示.图4a中可以发现,属于DMPO-×OH的峰强度比为1:2:2:1的典型特征峰,说明反应体系中存在•OH.此外,在四重特征峰之间可见6个属于DMPO-SO4-×的典型特征峰,这也证明了反应体系同时也存在SO4-×.图4b中可见DMPO-O2-×的特征峰,这进一步证明了反应体系中O2-×的存在.图4c中有明显的TEMP-1O2三重特征峰,说明反应体系中的O2-×在H2O和×OH的作用下可能进一步转化为1O2.如式(11)~式(13)所示,1O2可能在反应体系中起到降解SDZ的作用[23].
O2−• + H2O→1/21O2+ 1/2H2O2+OH-(11)
O2−• + •OH→1O2+ OH-(12)
SO4-•/•OH/1O2+SDZ→SDZprod+CO2+H2O (13)
2.4 反应条件的影响
2.4.1 pH值的影响 如图5所示, 在初始pH值为3和4时,反应体系表现出良好的降解效率,SDZ在180min内的去除率为99.3%以上,高于初始pH值为5和6时的去除率.这是因为当初始pH值上升至5和6时,部分PS 会先与水反应生成HSO4-,之后被进一步分解生成SO42-,无法产生自由基促进反应进行(式14~式15)[24].
S2O82-+ H2O → 2HSO4-+ 1/2O2(14)
HSO4-→SO42-+ H+(15)
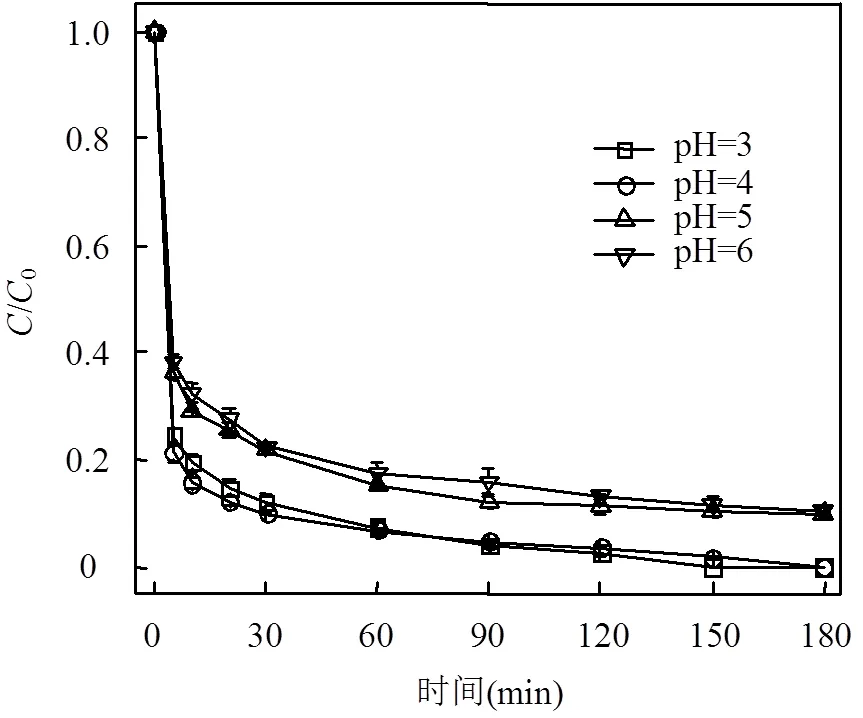
图5 不同初始pH值条件下SDZ降解情况
从图5中还可以看出,在初始pH值范围为3~6时,反应体系对SDZ的去除率均达到90.1%以上,说明本体系可以在较宽的pH值范围(3~6)内进行.通过表1得出,在初始pH值为3~6时,各反应体系在180min后的最终pH值均低于3.4.这也进一步说明其可以适应较高的初始pH值条件.此外,SO4-•通过反应生成•OH过程中产生的H+使体系pH值降低,有助于反应的进一步进行.
SO4-×+ H2O→ SO42−+×OH + H+(16)
综上可知,当初始pH值接近中性时,Fe-MOFs/ PS/HA体系对SDZ的降解率仍然较高,与传统的部分非均相催化剂相比, Fe-MOFs具有良好的催化效果和较高的适应能力.
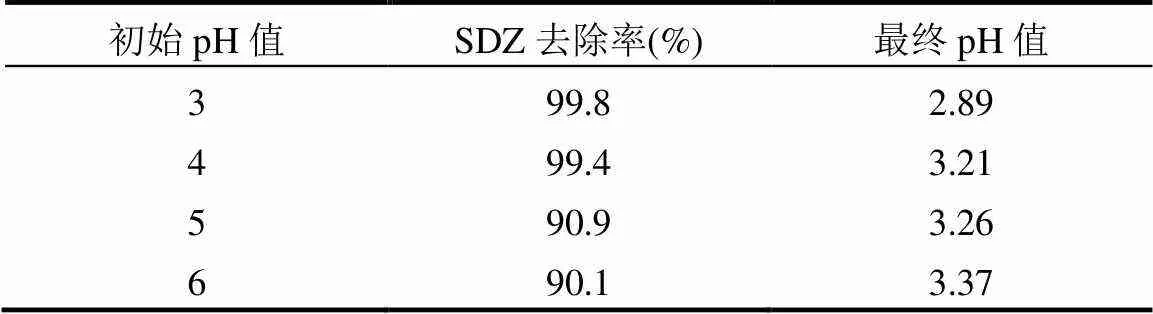
表1 溶液初始pH值下SDZ去除率及溶液最终pH值
2.4.2 PS投加量的影响 如图6a所示.当PS浓度由0.3上升至0.9mmol/L时,SDZ的去除率由78.6%上升至99.4%,当PS浓度为进一步上升至1.2mmol/L时,SDZ去除率略有下降,此时去除率为90.2%.说明适当增加PS浓度,有助于Fe-MOFs/PS/HA体系中产生更多的活性自由基,提高SDZ的降解率.但是当PS浓度过高时,产生过量的SO4-•自由基会相互消耗,从而对反应的进行起到一定的抑制作用(式17~式18)[25].
SO4-×+ SO4-×→ S2O82-×(17)
SO4-×+ S2O82-×→ SO42-+ S2O8-(18)
2.4.3 HA投加量的影响 如图6b所示, 当HA浓度从0增加至0.6mmol/L时,SDZ的去除率先增大而后减小.当HA投加量达到0.4mmol/L时,体系对于SDZ去除率最大,达到了99.4%.SDZ去除率在一开始上升是因为适量的HA促进Fe(Ⅲ)还原为Fe(Ⅱ),加快Fe(Ⅲ)/Fe(Ⅱ)循环,从而使反应速率加快[12,26].后来随着HA浓度上升,SDZ去除被抑制的主要原因是HA会和污染物共同竞争活性自由基,SDZ去除率下降(式19~式21)[27].因此,在实际应用过程中,需要确定适当的HA浓度,在保证去除率的同时控制成本,提升HA的使用效益.
S2O82-+HA→SO4-×+SO42-+HAprod(19)
SO4-×+HA→SO42-+HAprod(20)
×OH+HA→HAprod(21)
2.4.4 Fe-MOFs投加量的影响 从图6c中可以看出,当Fe-MOFs投加量为0g/L时,SDZ在180min的去除率仅14.4%,说明HA直接活化PS的效果较差.当Fe-MOFs投加量由0上升至0.2g/L时,SDZ的去除效率由14.4%上升至99.3%.当Fe-MOFs进一步上升至0.3g/L时,SDZ的去除率下降至81.9%.更多的Fe-MOFs加入,意味着体系中存在更多的活性点位,从而加快产生降解SDZ所需的自由基等氧化剂,而当Fe-MOFs投加量为0.3g/L时,SDZ的去除效率却开始降低.这是因为过量Fe-MOFs中的Fe(Ⅱ)同样会消耗SO4-•和•OH等自由基[28],从而抑制SDZ降解反应的进行.
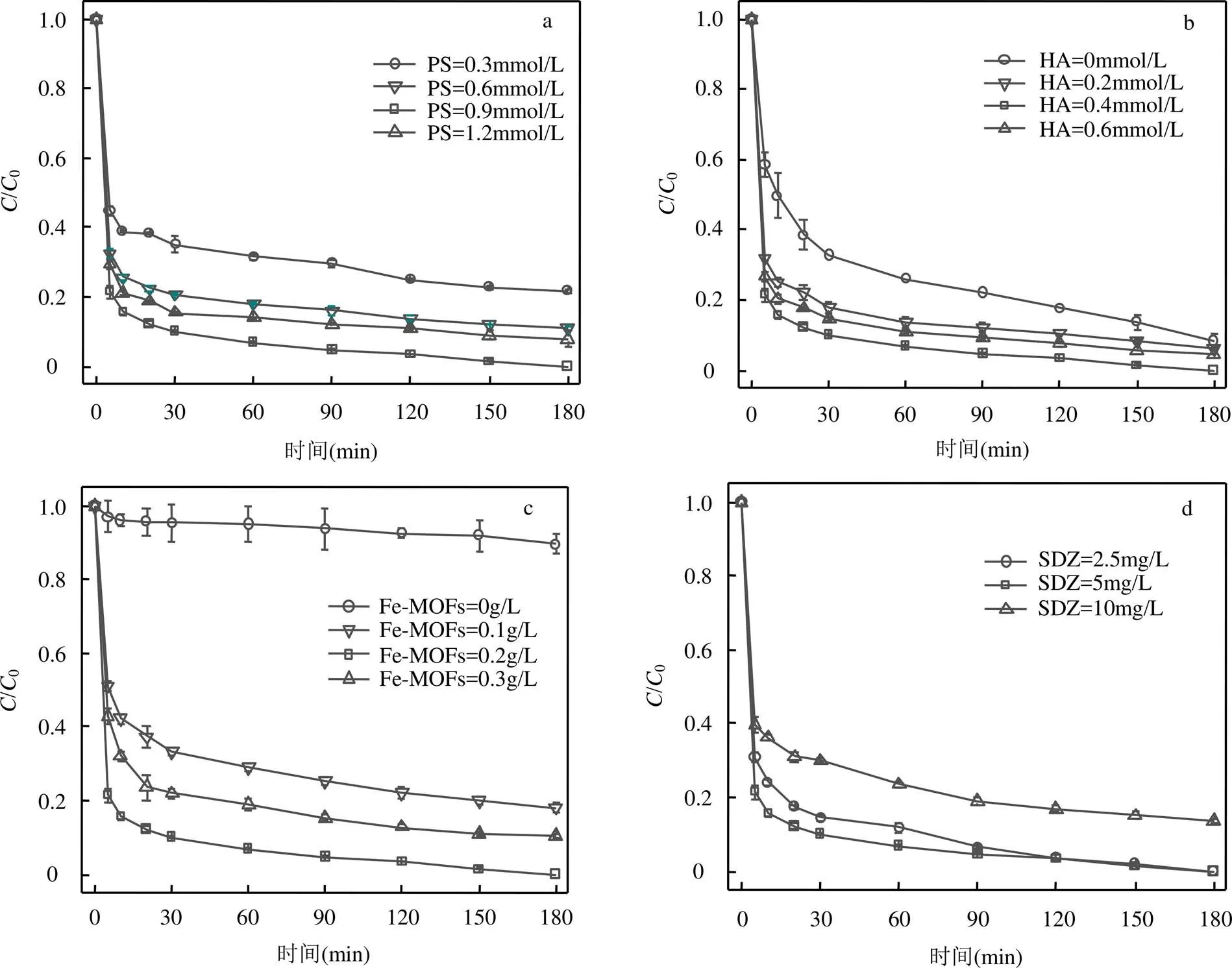
图6 不同反应条件下SDZ降解情况
a.不同PS浓度;b.不同HA浓度;c.不同Fe-MOFs投加量;d.不同SDZ初始浓度

表2 不同催化剂类芬顿反应催化效果比较
2.4.5 SDZ初始浓度的影响 如图6d所示,当SDZ浓度由2.5升至5mg/L时,SDZ在60min内的去除率上升,这是由于SDZ浓度升高时,反应体系产生的自由基等氧化剂快速地与SDZ反应,从而提高60min内SDZ的去除效率.而当SDZ的初始浓度升至10mg/L时,SDZ的去除率为86.3%.这是因为SDZ浓度过高时,反应所需的自由基量也会增大,从而导致反应体系中的自由基被大量消耗.同时,降解过高浓度的SDZ需要消耗更多的Fe(Ⅱ)活性点位,对HA浓度也提出更高要求.因此,在其他条件不变前提下,当SDZ初始浓度过高时,体系中SDZ的去除率开始下降.
2.4.6 催化剂对SDZ催化降解效果 对比从表2中可以看出,Fe-MOFs在体系无盐酸羟胺情况下180min内对SDZ的去除率达98.3%,在体系有盐酸羟胺情况下180min内对SDZ的去除率达99.4%,相比于其他的类芬顿催化剂,本研究制备的Fe-MOFs在相似条件下体现出了明显的优势.
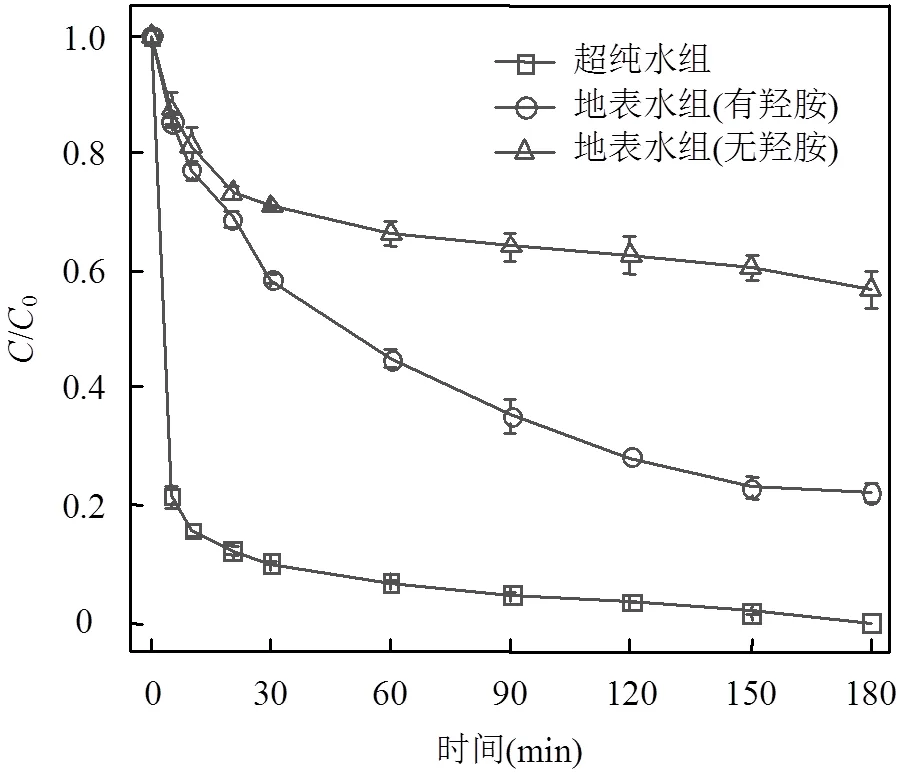
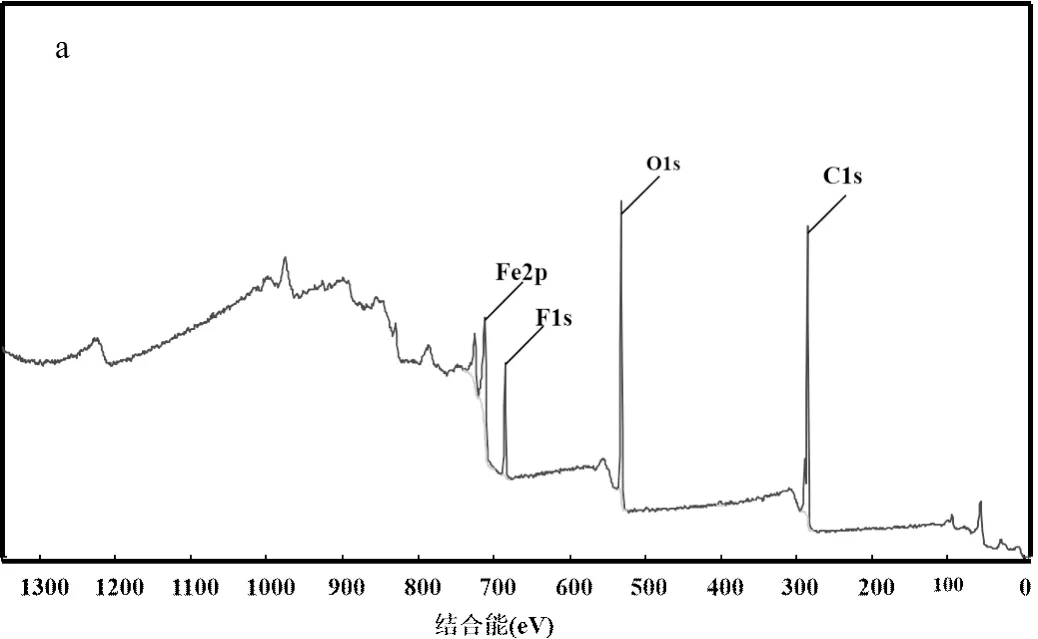
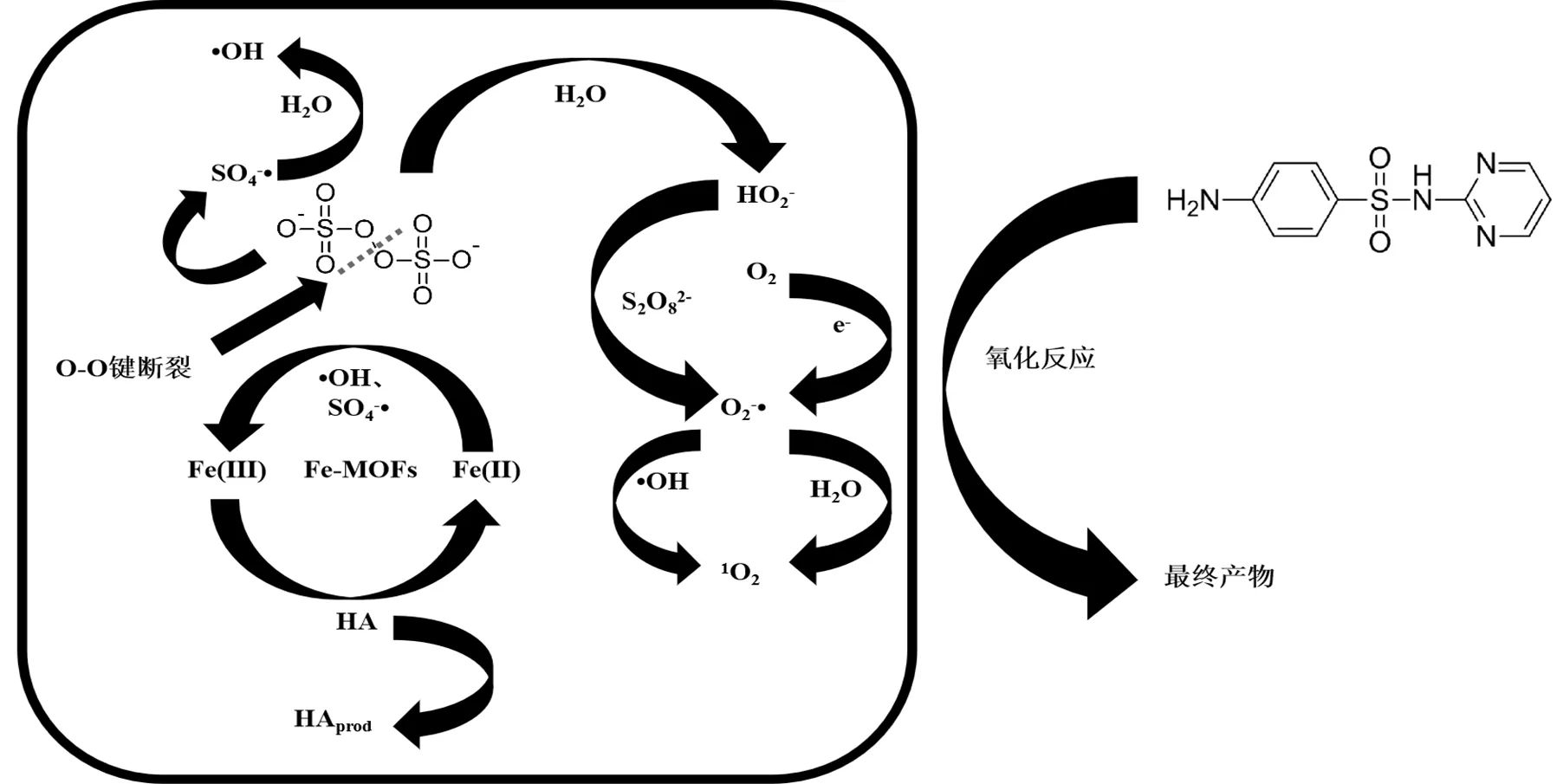
2.4.7 无机阴离子的影响 实际水体中含有大量的无机离子可能会对SDZ的降解产生影响,因此本研究选择水体中4种常见的阴离子SO42−、NO3−、Cl−和HCO3−进行实验,探究4种无机阴离子分别对Fe-MOFs/PS/HA体系和Fe-MOFs/PS体系降解SDZ的影响.在含有SDZ的初始反应溶液中分别加入几种阴离子对应的钠盐,使其阴离子浓度分别为0.5, 5, 50mmol/L(图7).向反应体系中投加Cl-时,SDZ的去除率明显呈下降趋势,并且随着Cl-的浓度上升,SDZ的去除率由99.4%下降至51.4%.这是由于氯离子和Fe(III)反应,生成相应的络合物[29],从而降低Fe(III)/Fe(II)的循环速率.此外,Cl-会与体系中的污染物竞争SO4-•和•OH,生成反应活性较低的含氯自由基(Cl•/Cl-=2.41V Cl-+×OH →×ClOH-(22) Cl-+ SO4-×→ SO42--+ Cl×(23) HCO3-被认为是SO4-×和×OH的自由基清除剂,可以清扫反应体系中的SO4-×和×OH,导致反应速率下降.从实验结果中可以看出,当HCO3-投加量为5, 50mmol/L时,SDZ的去除率降低至22.6%和1.36%.这是因为HCO3-对反应体系起到了自由基清扫的作用[31-32],导致反应速率迅速下降. HCO3−+×OH→ CO3−×+ H2O (24) HCO3−+ SO4-×→SO42--+ CO3−×+ H+(25) 当SO42−浓度由0.5mmol/L提升至50mmol/L时,SDZ降解率由91.9%降至84.5%.当NO3−浓度由0.5mmol/L提升至50mmol/L时,SDZ降解率由89.7%降至84.0%.实验结果表明,向体系中加入SO42−、NO3−后,SDZ去除率保持在84.0%以上,说明Fe-MOFs/PS/HA体系降解SDZ这一过程受SO42−和NO3−的影响较小.考虑到实际水体中SO42−和NO3−几乎都低于50mmol/L.因此,该体系在实际应用过程中不易受到SO42−和NO3−的干扰. a. Fe-MOFs/PS/HA体系; b.Fe-MOFs/PS体系;反应条件:SDZ=5mg/L, Fe-MOFs=0.2g/L, HA=0.4mmol/L, PS=0.9mmol/L, 初始pH=4, 反应温度=298K 通过图7可以看出,HA可以减弱阴离子对降解SDZ效果的影响.尤其是在添加Cl-和HCO3-后,HA可以有效降低Cl-和HCO3-对原体系降解SDZ的抑制作用.这是因为Cl-会与SDZ竞争Fe(Ⅲ),从而抑制反应体系对SDZ的降解.而HA的加入会使Fe(Ⅲ)在形成络合物之前就被还原为Fe(Ⅱ),减少Fe(Ⅲ)的消耗,从而使一部分Fe(Ⅲ)参与到降解SDZ的反应中,提高SDZ的去除效率[33].此外,加入HA可以促进Fe(Ⅲ)/Fe(Ⅱ),产生更多的自由基,从而促进SDZ的降解. 2.4.8 腐殖酸的影响 有研究表明,在实际应用过程中,腐殖酸对高级氧化过程有重要影响[34].因此,本研究选择对1,5,10,20mg/L 4种浓度下腐殖酸对SDZ降解的影响进行探究.实验结果如图8所示,腐殖酸对反应体系降解SDZ有抑制作用,当腐殖酸浓度为1mg/L时,SDZ的去除率下降至87.7%,并且随着腐殖酸浓度的上升,抑制作用更为显著.腐殖酸浓度为20mg/L时,SDZ的去除率仅有47.5%.其原因是腐殖酸会竞争反应体系中的PS,抑制自由基的产生,使反应体系中的过硫酸盐和自由基浓度下降,进而抑制SDZ降解反应的进行.此外,腐殖酸会和体系中的自由基发生反应,消耗已经产生的部分自由基[35]. 图8 腐殖酸对PS降解SDZ的影响 反应条件:SDZ=5mg/L, Fe-MOFs=0.2g/L, HA=0.4mmol/L, PS=0.9mmol/L, 初始pH=4, 反应温度=298K 通过图8还可以看出,在加入HA的反应体系中,腐殖酸浓度为1mg/L时,SDZ的去除率仍有87.7%,而当腐殖酸浓度为20mg/L时,SDZ的去除率为47.5%.在未加入HA的反应体系中,腐殖酸浓度为1mg/L时,SDZ的去除率为73.4%,而当腐殖酸浓度为20mg/L时,SDZ的去除率仅有12.9%.这说明HA在反应体系中可以促进Fe(Ⅲ)/Fe(Ⅱ)循环,使Fe在和腐殖酸竞争过硫酸钾的过程中占据优势,产生更多的自由基,从而促进SDZ的去除效率. 2.4.9 地表水的影响 地表水中含有大量的阴离子和阳离子,且由于地表水成分复杂,可能会对Fe-MOFs/PS/HA体系降解SDZ产生一定的影响.因此,本研究通过用实际地表水代替超纯水进行降解反应,进一步验证Fe-MOFs/PS/HA体系的实际应用效果.本实验采用的地表水样为上海市龙腾大道某桥断面水样,水质参数如表3所示. 表3 春申港某桥断面水样主要水质参数 由图9可知,地表水组的去除率低于超纯水组,60min内SDZ的去除率为55.3%,180min内SDZ的去除率为77.9%.这是因为在地表水体中成分复杂,存在不少阴离子和有机物,如低浓度的Cl-会起到自由基清扫的作用导致自由基浓度下降,腐殖酸会和SDZ竞争PS等等.通过对比地表水组是否加入HA可以发现,加入HA的地表水组中SDZ去除率明显高于未加入HA的地表水组.考虑到地表水成分复杂,HA的加入可以使反应体系中的Fe(Ⅲ)更多地还原为Fe(Ⅱ),避免Fe(Ⅲ)和Fe(Ⅱ)过多地被消耗,从而促进反应进行.此外,HA的加入可以使反应体系的pH值略微降低,有利于促进反应朝着类芬顿反应的方向进行,提高实际水体中SDZ的去除效率. 图9 实际地表水中SDZ降解效果 反应条件:SDZ=5mg/L, Fe-MOFs=0.2g/L, HA=0.4mmol/L, PS=0.9mmol/L 2.5.1 XPS分析 由图10可以看出,反应前后的Fe- MOFs均有较为明显的Fe/C/O信号.通过对比可以看出,反应前后的Fe-MOFs没有明显的Cl元素信号.反应前后的F元素主要为金属氟化物的化合态. a.反应前Fe-MOFs元素全扫描;b.反应后Fe-MOFs元素全扫描 由图11a、b可知,反应前Fe-MOFs中Fe(Ⅲ)的结合能为725.73eV(Fe 2p1)和712.00eV(Fe 2p3), Fe(Ⅱ)的结合能为723.82eV(Fe 2p1)和710.45eV (Fe 2p1),这表明Fe-MOFs中的Fe存在Fe(Ⅲ)和Fe(Ⅱ)两种形态.此外,718.00和714.84eV处的卫星峰也进一步表明Fe(Ⅲ)和Fe(Ⅱ)的存在.在进行反应之后,Fe(Ⅲ)的结合能移动至725.85eV(Fe 2p1)和712.05eV(Fe 2p3),Fe(Ⅱ)的结合能为723.96eV(Fe 2p1)和710.55eV(Fe 2p1).从质量分数角度看,通过XPS Peak软件处理数据并拟合后可以得出,Fe(Ⅲ)的质量分数由4.86%变为5.92%,Fe(Ⅱ)的质量分数由5.43%降至2.72%,这说明在Fe(Ⅲ)和Fe(Ⅱ)均参与到反应过程中,并通过Fe(Ⅲ)和Fe(Ⅱ)之间的相互转化催化PS产生各类自由基. 从图11c、d可以看出,反应前的Fe-MOFs中含有2.24%的C-O键和11.08%的C=O官能团,反应后的Fe-MOFs中含有1.20%的C-O键和15.1%的C=O官能团.这表明在反应过程中,部分C-O键所代表的C-OH官能团可能可以活化PS产生SO4-×,同时自身转化为C=O官能团,进而促进SDZ的去除[36]. 2.5.2 Fe-MOFs/PS/HA体系对SDZ降解的机理探究 Fe-MOFs/PS/HA体系降解SDZ的主要机理如图12所示.Fe-MOFs的Fe基金属中心(Fe(Ⅱ)/Fe(Ⅲ))促进PS结构中的O-O键断裂并产生SO4-×.同时,过硫酸盐在水溶液中可以生成HO2-,S2O82-进一步和HO2-生成O2−×,O2−×可能进一步转化为1O2(式11~12).此外,Fe-MOFs表面的O2由于得电子也可以转换为O2−×.PS所产生的SO4-×可以通过反应(8~10)得到×OH,×OH和SO4-×共同促进SDZ降解,而O2−×则通过自由基链式反应促进×OH、SO4-×和1O2产生.HA在这过程中将Fe(Ⅲ)还原为Fe(Ⅱ),从而加快Fe(Ⅲ)/Fe(Ⅱ)循环(式4).这一循环过程也使得体系中的自由基数量不断增加,进一步促进SDZ的降解.此外,反应体系中存在的少量Fe2+也起到活化PS的作用. 综上,Fe-MOFs的金属中心活性位点能对PS起到活化作用,并通过HA促进Fe(Ⅲ)/Fe(Ⅱ)循环等不同途径的协同作用,提升Fe-MOFs/PS/HA体系对SDZ的降解效果. 图11 反应前后Fe-MOFs的XPS元素细扫分析 a.反应前Fe元素细扫;b.反应后Fe元素细扫;c.反应前C元素细扫;d.反应后C元素细扫 图12 HA促进Fe-MOFs催化PS降解SDZ机理分析 图13 Fe-MOFs重复使用情况 如图13所示,经过5次循环实验后SDZ的去除率保持在86.7%以上,经过8次循环实验后SDZ的去除率可达74.3%,说明Fe-MOFs具有良好的可重复使用性.通过图1中反应前后XRD和FTIR的对比,也可以看出,反应前后Fe-MOFs的组成和结构无明显变化,说明其可以被重复使用,体现了良好的应用潜力. 随着循环次数的增加,反应体系中铁的溶出有所上升,分别为0.299, 0.468, 0.516, 0.548, 0.651, 0.663, 0.712, 0.697mg/L,均低于欧盟规定的排放限值[40],说明Fe-MOFs/PS/HA体系中铁溶出量较少,避免对水体产生新的污染. 3.1 当溶液初始pH值范围在3~6,PS浓度为0.9mmol/L,Fe-MOFs投加量为0.2g/L,HA浓度为0.4mmol/L,SDZ浓度为5mg/L的条件下,Fe-MOFs/ PS/HA体系在180min内对SDZ的去除率可达到90.1%以上,和传统的类芬顿催化剂相比,Fe-MOFs具有良好的催化效果和实际应用前景. 3.2 Fe-MOFs/PS/HA体系有SO4-×、×OH以及O2-×的产生,且这3种自由基对SDZ的降解均有重要作用.此外,1O2也可能在反应体系中起到降解SDZ的作用. 3.3 在本研究考察范围内,Fe-MOFs/PS/HA体系降解SDZ的效率随pH值升高逐渐下降.在其他条件不变的情况下,随着PS,HA,Fe-MOFs浓度分别升高,SDZ的去除率先上升后下降.共存离子中,HCO3-和Cl-会对反应体系起到明显的抑制作用,而SO42-和NO3-对反应体系的影响较小.另外,腐殖酸也会对SDZ的去除效果产生一定影响.但HA的加入会增强Fe-MOFs/PS体系在腐殖酸,共存离子以及地表水条件下对SDZ的去除效果. 3.4 循环实验结果显示,Fe-MOFs在循环8次后仍保持良好的催化效果,说明Fe-MOFs具有重复使用性和稳定性,体现出良好的应用价值和开发前景. [1] 秦丽婷,童 蕾,刘 慧,等.环境中磺胺类抗生素的生物降解及其抗性基因污染现状[J].环境化学, 2016,35(5):875-883. Qin L T, Tong L, Liu H, et al. Biodegradation of sulfonamides and the pollution characteristics of sulfonamide resistance genes in the environment [J]. Environmental Chemistry, 2016,35(5):875-883. [2] Zhang Q, Ying G, Pan G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science & Technology, 2015,49(11):6772-6782. [3] Xiao S, Cheng M, Zhong H, et al. Iron-mediated activation of persulfate and peroxymonosulfate in both homogeneous and heterogeneous ways: A review [J]. Chemical Engineering Journal, 2020,384:123265. [4] Haldar D, Duarah P, Purkait M K. MOFs for the treatment of arsenic, fluoride and iron contaminated drinking water: A review [J]. Chemosphere, 2020,251:126388. [5] Pu M J, Guan Z Y, Ma Y W, et al. Synthesis of iron-based metal- organic framework MIL-53 as an efficient catalyst to activate persulfate for the degradation of Orange G in aqueous solution [J]. Applied Catalysis A: General, 2018,549:82-92. [6] Li X H, Guo W L, Liu Z H, et al. Quinone-modified NH2-MIL- 101(Fe) composite as a redox mediator for improved degradation of bisphenol A [J]. Journal of Hazardous Materials, 2017,324:665-672. [7] Li J, Wan Y J, Li Y J, et al. Surface Fe(III)/Fe(II) cycle promoted the degradation of atrazine by peroxymonosulfate activation in the presence of hydroxylamine [J]. Applied Catalysis B: Environmental, 2019,256:117782. [8] Xu X M, Chen W M, Zong S Y, et al. Atrazine degradation using Fe3O4-sepiolite catalyzed persulfate: Reactivity,mechanism and stability [J]. Journal of Hazardous Materials, 2019,377:62-69. [9] Pu M J, Ma Y W, Wan J Q, et al. Activation performance and mechanism of a novel heterogeneous persulfate catalyst: metal– organic framework MIL-53(Fe) with FeII/FeIIImixed-valence coordinatively unsaturated iron center [J]. Catalysis Science & Technology, 2017,7(5):1129-1140. [10] Wan Y J, Wan J Q, Ma Y W,et al. Sustainable synthesis of modulated Fe-MOFs with enhanced catalyst performance for persulfate to degrade organic pollutants [J]. Science of the Total Environment, 2020,701:134806. [11] Luo LS, Yao Y Y, Gong F, et al. Drastic enhancement on Fenton oxidation oforganic contaminants by accelerating Fe(III)/Fe(II)cycle with L-cysteine [J]. Royal Society of Chemistry Advance, 2016,6: 47661–47668. [12] Hou X J, Huang X P, Ai Z H, et al. Ascorbic acid/Fe@Fe2O3: A highly efficient combined Fenton reagent to remove organic contaminants. [J]. Journal of Hazardous Materials, 2016,310:170-178. [13] Bloch E D, Murray L J, Queen W L, et al. Selective binding of O2over N2in a redox-active metal-organic framework with open iron(II) coordination sites [J]. Journal of the American Chemical Society, 2011,133(37):14814-14822. [14] Tamura H, Goto K, Yotsuyanagi T, et al. Spectrophotometric determination of iron(II) with 1,10-phenanthroline in the presence of large amounts of iron(II) [J]. Talanta, 1974,21(4):314-318. [15] Chi H Y, Wan J Q, Ma Y W, et al. Ferrous metal-organic frameworks with stronger coordinatively unsaturated metal sites for persulfate activation to effectively degrade dibutyl phthalate in wastewater [J]. Journal of Hazardous Materials, 2019,377:163-171. [16] Huang S, Yang K L, Liu X F, et al. MIL-100(Fe)-catalyzed efficient conversion of hexoses to lactic acid [J]. Royal Society of Chemistry Advance, 2017,7:5621-5627. [17] Guo W Q, Zhao Q, Du J S, et al. Enhanced removal of sulfadiazine by sulfidated ZVI activated persulfate process: Performance, mechanisms and degradation pathways [J]. Chemical Engineering Journal, 2020, 388:124303. [18] Miao Z W, Gu X G, Lu S G, et al. Enhancement effects of reducing agents on the degradation of tetrachloroethene in the Fe(II)/Fe(III) catalyzed percarbonate system [J]. Journal of Hazardous Materials, 2015,300:530-537. [19] Guo Y, Zhang Y X, Yu G, et al. Revisiting the role of reactive oxygen species for pollutant abatement duringcatalytic ozonation: The probe approach versus the scavenger approach [J]. Applied Catalysis B: Environmental, 2020,280:119418. [20] Chen X, Guo H G, Li W, et al. Metal-free carbocatalysis for persulfate activation toward nonradical oxidation: Enhanced singlet oxygen generation based on active sites and electronic property [J]. Chemical Engineering Journal, 2020,396:125107. [21] Kamagatea M, Assadi A A, Kone T, et al. Activation of persulfate by irradiated laterite for removal of fluoroquinolones in multi-component systems [J]. Journal of Hazardous Materials, 2018,346:159-166. [22] Keith P M, Hitoshi T. The role of the DMPO-hydrated electron spin adduct in DMPO-•OH spin trapping [J]. Free Radical Biology and Medicine, 2001,30(12):1374-1380. [23] Xu Y Y, Wang Y, Wan J Q, et al. Reduced graphene oxide-supported metal organic framework as a synergistic catalyst for enhanced performance on persulfate induced degradation of trichlorophenol [J]. Chemosphere, 2020,240:124849. [24] Rao L J, Yang Y F, Liu X D, et al. Heterogeneous activation of persulfate by supporting ferric oxalate onto activated carbon fibers for organic contaminants removal [J]. Materials Research Bulletin, 2020, 130:110919. [25] Lin C C, Chen Y H. Feasibility of using nanoscale zero-valent iron and persulfate to degrade sulfamethazine in aqueous solutions [J]. Separation and Purification Technology, 2018,194:388-395. [26] Chen L W, Ma J, Li X C, et al. Strong enhancement on fenton oxidation by addition of hydroxylamine to accelerate the ferric and ferrous iron cycles [J]. Environmental Science & Technology. 2011,45: 3925-3930. [27] Jin Y Y, Sun S P, Yang X Y, et al. Degradation of ibuprofen in water by Fe(II) -NTA complex-activated persulfate with hydroxylamine at neutral pH [J]. Chemical Engineering Journal, 2018,337:152-160. [28] Zhuo Y L, Lu W, Yu L L, et al. Unraveling the interaction of hydroxylamine and Fe(III) in Fe(II)/Persulfate system: A kinetic and simulating study [J]. Water Research, 2020,168:115093. [29] Zhou L, Zhang Y, Ying R, et al. Thermoactivated persulfate oxidation of pesticide chlorpyrifos in aquatic system: kinetic and mechanistic investigations [J]. Environmental Science and Pollution Research, 2017,24(12):11549-11558. [30] Yang Y, Pignatello J J, Ma J, et al. Comparison of halide impacts on the efficiency ofcontaminant degradation by sulfate and hydroxyl radical-based advanced oxidationprocesses (aops) [J]. Environmental Science & Technology, 2014,48(4):2344-2351. [31] Zuo Z, Cai Z, Katsumura Y, et al. Reinvestigation of the acid–base equilibrium of the (bi) carbonate radical and ph dependence of its reactivity with inorganic reactants [J]. Radiation Physics and Chemistry, 1999,55(1):15-23. [32] Valentine R L, Wang H A. Iron oxide surface catalyzed oxidation of quinoline by hydrogen peroxide [J]. Journal of Environmental Engineering, 1998,124(1):31-38. [33] Hou X J, Huang X P, Li M L,et al. Fenton oxidation of organic contaminants with aquifer sediment activatedby ascorbic acid [J]. Chemical Engineering Journal, 2018,348:255-262. [34] Zhou Y X, Shi J Q,Li Y P, et al. Degradation kinetics and mechanism of bis(2-chloroethyl) ether by electromagnetic induction electrodeless lamp activated persulfate [J]. Chemosphere, 2020,261:127709. [35] Liu H, Chen J, Wu N, et al. Oxidative degradation of chlorpyrifos using ferrate(VI): Kinetics and reaction mechanism [J]. Ecotoxicology and Environmental Safety, 2019,170:259-266. [36] Li X J, Liao F Z, Ye L M, et al. Controlled pyrolysis of MIL-88A to prepare iron/carbon composites for synergistic persulfate oxidation of phenol: Catalytic performance and mechanism [J]. Journal of Hazardous Materials, 2020,398:122938. [37] Liu T, Wu K, Wang M, et al. Performance and mechanisms of sulfadiazine removal using persulfate activated by Fe3O4@CuOhollow spheres [J]. Chemosphere, 2021,262:127845. [38] Zou X L, Zhou T, Mao J, et al.Synergistic degradation of antibiotic sulfadiazine in a heterogeneousultrasound-enhanced Fe0/persulfate Fenton-like system [J]. Chemical Engineering Journal, 2014,257:36– 44. [39] Feng Y, Wu D L, Liao C Z, et al. Red mud powders as low-cost and efficient catalysts for persulfateactivation: Pathways and reusability of mineralizing sulfadiazine [J]. Separation and Purification Technology, 2016,167:136–145. [40] 王楠楠, 张巍, 修光利. MIL-88B(Fe)非均相芬顿催化降解磺胺甲恶唑[J]. 环境污染与防治, 2020,42(6):682–689. Wang N N, Zhang W, Xiu G L. Heterogeneous Fenton catalyzed degradation of sulfamethoxazole by MIL-88B(Fe)[J]. Environmental Pollution & Control, 2020,42(6):682–689. 致谢:感谢孙勇、蒋希昊、孙雪城、黄靖瑶在实验过程中的陪伴和照顾,感谢潘昕、邾玉香、王楠楠、陈晓菲、李娜、杨雪瑞、丁曦、赵擎在实验期间的帮助,感谢各位老师对本实验的规划和指导,感谢上海市化工环境保护监测站在采样过程中给予的帮助,感谢华东理工大学分析测试中心在材料表征方面给予的仪器和技术支持. Degradation of sulfadiazine by hydroxylamine hydrochloride/Fe-MOFs/persulfate system. WU Cheng-zi1,2,3, ZHANG Wei1,2,3*, WAN Yan-tao1,2,3, XIU Guang-li1,2,3 (1.State Environmental Protection Key Laboratory of Environmental Risk Assessment and Control on Chemical Process,East China University of Science and Technology, Shanghai 200237;2.Shanghai Key Laboratory of Environmental Standards and Risk Management of Chemical Pollutants,Shanghai 200237;3.Shanghai Institute of Pollution Control and Ecological Safety,Shanghai 200092, China)., 2021,41(6):2685~2697 Hydroxylamine hydrochloride was used to promote Fe(Ⅲ)/Fe(Ⅱ) cycle in iron-based metal organic framework (Fe-MOFs)/persulfate(PS) system to degrade sulfadiazine (SDZ) in water. The structure and morphology of Fe-MOFs were characterized by X-ray diffraction (XRD), scanning electron microscopy (SEM), Fourier transform infrared spectroscopy (FTIR) and X-ray photoelectron spectroscopy (XPS). The influence of initial pH, PS, Fe-MOFs, HA, SDZ, co-existing ions and humic acid on the removal of SDZ were investigated and the prospect for practical application of this system was also evaluated. The results showed that Fe-MOFs/PS/HA system had a good removal performance of SDZ in a wide initial pH range (3~6), and the removal of SDZ at 180min reached above 90.1%. The appropriate amount of HA could promote the degradation of SDZ in Fe-MOFs/PS system. The results of the free radical scavenging and electron paramagnetic resonance experiments showed that the SO4-•、•OH、O2-• and1O2were produced in the Fe-MOFs/PS/HA system during the degradation process of SDZ. Within the experiment scope of this study, the degradation performance of SDZ by Fe-MOFs/PS/HA system decreased gradually with the increase of pH value in the range of (pH=3~6). With the increase of the concentration of PS, HA and Fe-MOFs, the removal of SDZ exhibited the rising-then-falling pattern. Chlorine ion, humic acid and other factors had the negative effects on the removal of SDZ in the system in actual surface water, however HA could enhance the degradation of SDZ in the natural environment. The result of recycle experiment revealed that Fe-MOFs system had a good reusability and exhibited a great application potential. iron-based metal organic framework;reducing agent;persulfate;catalytic degradation mechanism;sulfadiazine X703 A 1000-6923(2021)06-2685-13 吴承梓(1996-),男,浙江衢州人,华东理工大学硕士研究生,主要从事水污染防治研究. 2020-10-17 国家自然科学基金资助项目(41201302);上海市自然科学基金资助项目(17ZR1407000) * 责任作者, 副教授, zhangwei@ecust.edu.cn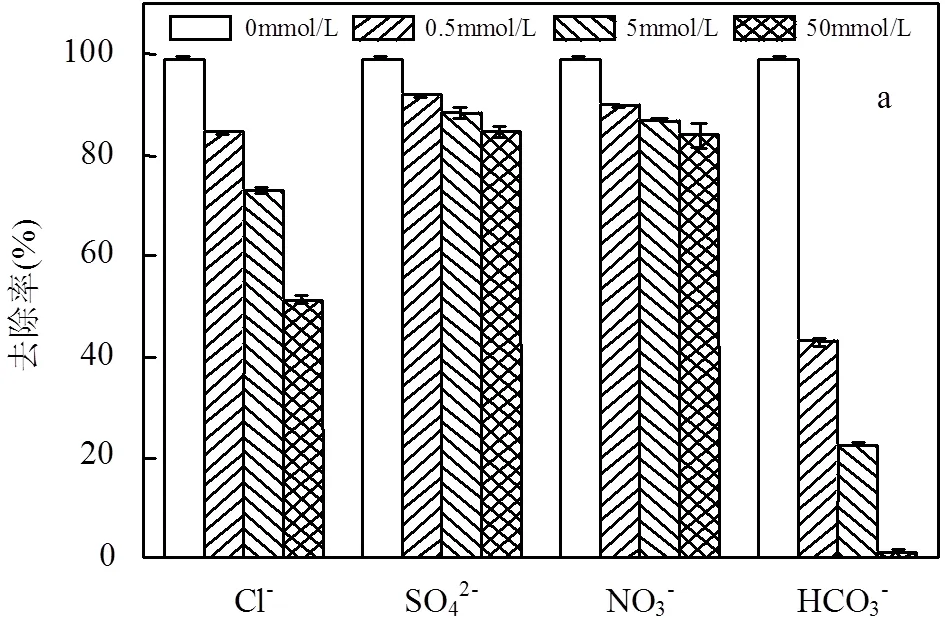
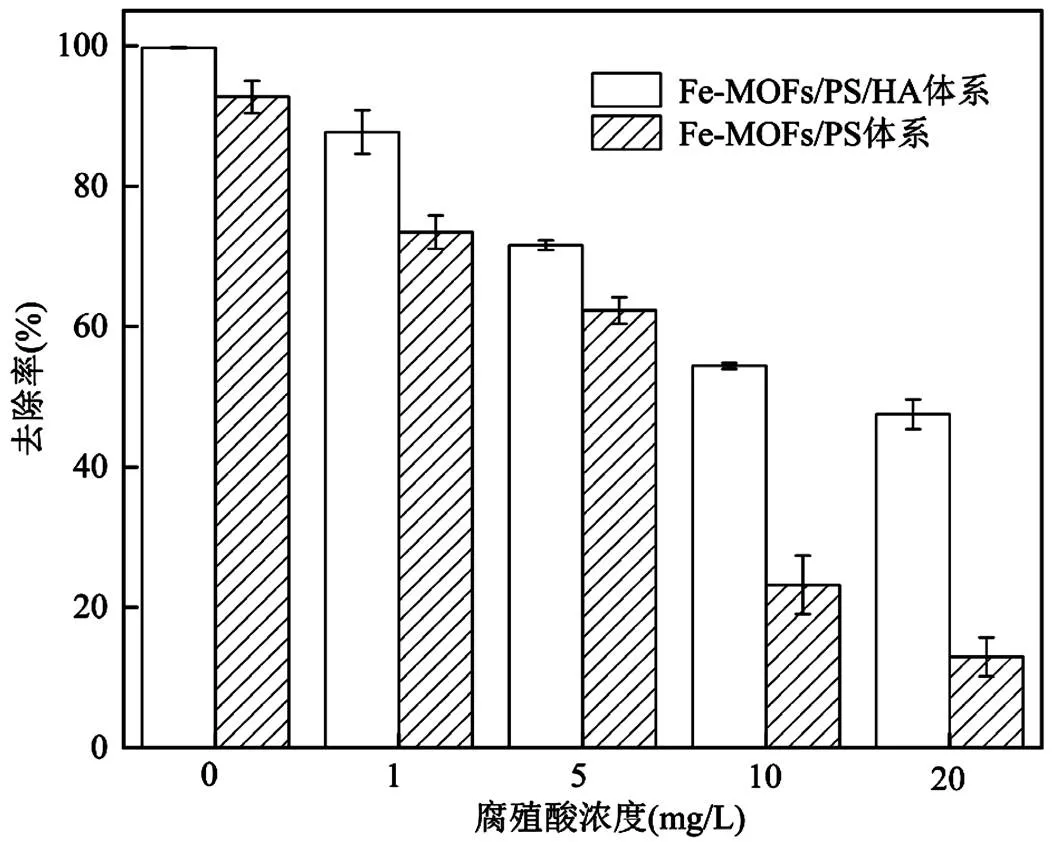
2.5 降解机制探究

2.6 Fe-MOFs重复使用性能探究

3 结论

