海水养殖底泥中外源汞甲基化及生物响应研究
王书平,宋玉梅,刘 爽,郭鹏然*
海水养殖底泥中外源汞甲基化及生物响应研究
王书平1,2,宋玉梅1,刘 爽1,郭鹏然1*
(1.广东省科学院测试分析研究所(中国广州分析测试中心),广东省化学危害应急检测技术重点实验室,广东省水环境污染在线监测工程技术研究中心,广东 广州 510070;2.昆明理工大学环境科学与工程学院,云南 昆明 650500)
本文选择沙蚕作为底栖生物,通过模拟海水养殖环境,研究在外源汞(Hg(NO3)2)胁迫下,沙蚕对汞(Hg)的甲基化和甲基汞(MeHg)的富集,以及沙蚕的生物应激响应.结果表明,海水养殖区沙蚕一方面自身具有将汞转化为MeHg的能力,同时沙蚕扰动会促进沉积物中Hg的甲基化,沙蚕扰动沉积物中MeHg的含量为无扰动沉积物中的1.93倍.随着外源汞含量和暴露时间的增加,沙蚕对MeHg的富集量逐渐增加,而富集速率逐渐降低.沙蚕体内MeHg富集含量为0.007~0.079mg/kg,占沙蚕体内总汞(THg)含量的31.20%~86.90%.与无机Hg相比,MeHg会对沙蚕造成更大的氧化压力,具有更强的生物毒性.沙蚕的SOD,CAT活性和GSH,MDA含量与暴露时间及含量有显著相关性.当沉积物中外源汞输入含量超过0.5mg/kg,沙蚕抗氧化应激系统将超过防御极限.
外源汞;甲基化;沉积物;沙蚕;氧化应激
中国的海水养殖长期采用高密度和高投饵料的养殖方式,而海水养殖的饲料转化率通常为59%左右,近40%的饲料将残留在沉积物中,造成近海养殖场沉积物中有机质大量沉积[1],含大量有机质的沉积物非常适合微生物和底栖生物的生长繁殖,生物活动会影响沉积物中重金属的形态和迁移转化[2-3].Hg是海水养殖沉积物中最常见的有毒重金属之一,中国海水养殖区及部分地区近海沉积物中THg含量为0.07~11.90mg/kg[2,4],最大值高于国家标准值[GB 18668–2002][5]59.40倍.海水养殖沉积物中Hg以多种形式存在(例如元素汞(Hg0),二价汞(Hg2+)和甲基汞(MeHg)),MeHg具有很强的神经毒性,其毒性强于其他任何形态的汞,并且MeHg能够沿食物链逐渐放大[6],最终危害到人类身体健康.沉积物中的Hg可通过生物[7]和非生物作用[8]2种途径进行甲基化.研究表明,厌氧微生物(硫酸盐还原菌,铁还原细菌和产甲烷菌等)在厌氧条件下对Hg具有高亲和力和甲基化作用,是环境中MeHg的主要贡献者,同时还发现某些需氧微生物和含有特定基因簇(HgcAB)的微生物也具有将Hg甲基化的能力[7].汞生物甲基化的主要影响因素为生物可利用态Hg和微生物群落[10],但以上2个因素受环境中包括温度,pH值,氧化还原电位(Eh),有机质,生物扰动等诸多条件影响[7,9-10].有研究证明,相比于其他近海沉积物,海水养殖沉积物中微小粒径的有机物含量增长更明显,Hg在沉积物中更倾向于与粒径较小,比表面积更大,活性位点更多的有机颗粒结合[11].有机质作为碳源可以增强沉积物中微生物的活性,提高厌氧微生物(如产甲烷菌,铁还原菌,硫酸盐还原菌)对无机汞的生物甲基化能力[10].同时,大型生物(蚯蚓,鱼类和水生植物)也能将无机汞转化成MeHg[6,12-13].沙蚕作为底栖生物链的主要组成部分,以摄食沉积物为生,也是多种水环境捕食者(如鱼,螃蟹)的食物,同时还是水产养殖业中难得的优质饵料,对海水养殖环境中汞在食物链的生物放大过程起着重要作用[14].研究发现,底栖生物对沉积物的摄食是其富集Hg和MeHg的主要途径[15].同时,底栖生物体内的MeHg也可能来自生物体内辅酶或微生物对Hg的甲基化[15].然而,底栖生物中的MeHg的可能来源和产生机理,以及底栖生物对外源汞甲基化的影响仍未得到充分研究.
Hg在生物体内的蓄积毒性由的暴露剂量和持续时间决定,测量生物对Hg的富集是评估环境中Hg风险的常规做法[16-17],但是仅测量Hg在生物体内的富集和分布,以及对生物生理结构损伤不能完全评估环境损害.相比之下,分子水平的生物指示物对Hg污染更加敏感.生物在受到Hg胁迫时,生物体内会发生Haber-Weiss反应导致活性氧(ROS)的产生,ROS是一系列具有强氧化性的物质,如超氧自由基(O2•−),过氧化氢(H2O2)和羟基自由基(HO•)等[18].为了确保机体的正常生理代谢,生物体的抗氧化系统会被激活,超氧化物歧化酶(SOD),过氧化氢酶(CAT),还原型谷胱甘肽(GSH)作为生物体内抗氧化系统的重要防线,可去除体内因暴露于汞而产生的ROS,保护生物体免受氧化压力[19-20].当生物体自身抗氧化系统不能够消除污染物造成的氧化物时,未能消除的ROS将氧化生物体膜,从而导致丙二醛(MDA)的生成,即MDA水平的升高表明膜损伤.因此,本研究使用生物标志物(SOD,CAT,GSH,MDA)对环境Hg污染进行监测,研究外源汞胁迫下沙蚕的生物响应,对海水养殖区沉积物中Hg污染生物毒性评价具有重要指示意义.
本研究以近海养殖区沉积物为供试材料,沙蚕为研究对象,在模拟试验条件下研究海水养殖区沉积物外源汞输入后,沙蚕对MeHg的富集,Hg的甲基化影响,以及沙蚕的生物应激响应,以期待了解受外源汞污染沉积物中汞的形态转化,为底栖生物对汞污染早期预警提供参考.
1 材料与方法
1.1 沉积物样品
沉积物样品采自柘林湾海水养殖区,利用彼得森采样器采集表层沉积物(0~20cm),快速将样品装入充满氮气的聚乙烯采样袋中,放入装有冰块的保温箱,运回实验室后测定其基本理化性质与Hg含量(表1).剩余样品冷冻干燥处理(-75℃,真空度5.0Pa),研磨过60目筛保存.
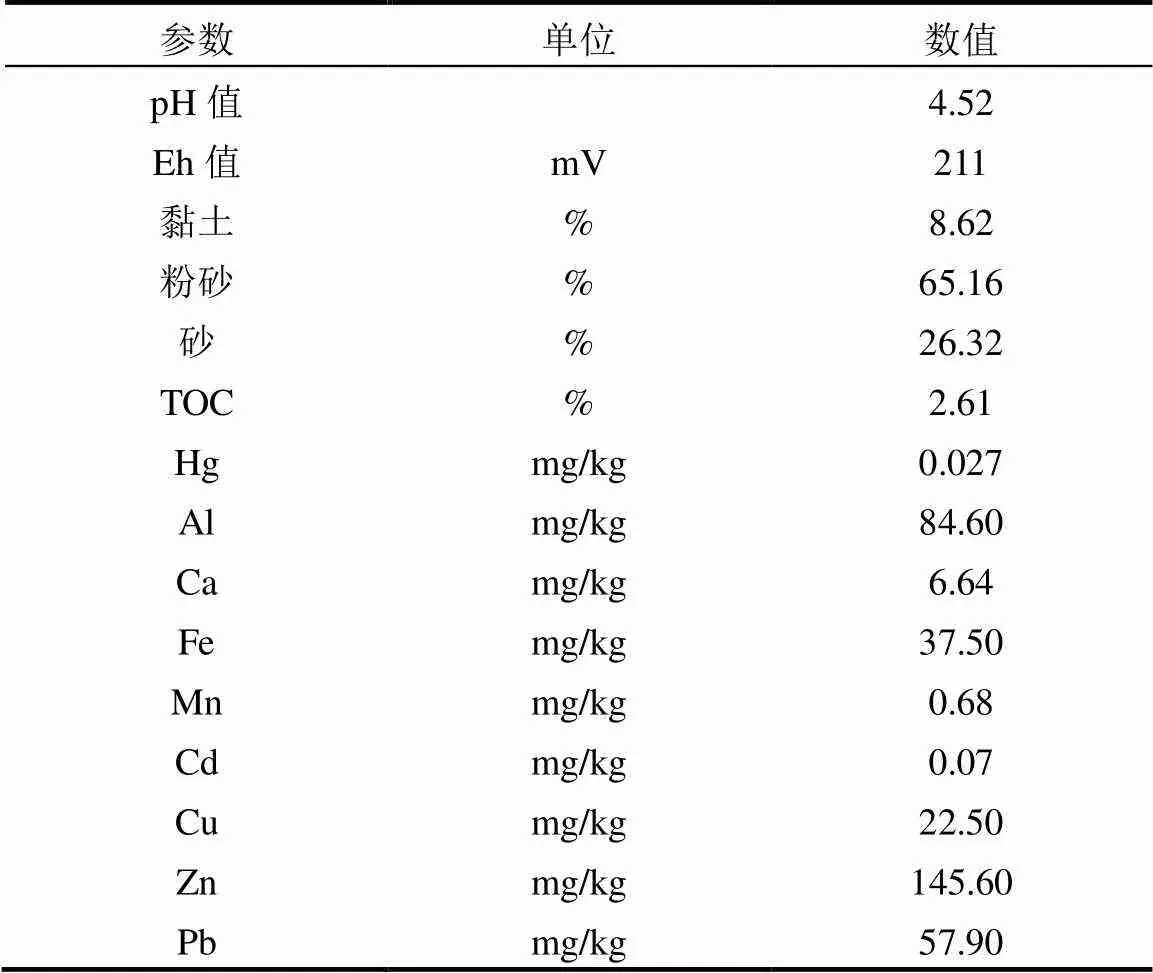
表1 柘林湾沉积物重金属含量与基本理化信息
1.2 实验模拟
模拟海水养殖实验装置为长30cm,宽20cm,高20cm的玻璃缸,将6kg过筛的沉积物均匀填装到模拟海水养殖实验装置中,模拟装置中沉积物最终厚度约10~12cm.向各个模拟装置沉积物中添加外源汞溶液使沉积物中外源汞含量分别为0,0.2,0.5,1,2, 5mg/kg(干重),外源汞处理后,测得沉积物的THg平均值分别为0.03,0.15,0.86,1.69,4.43mg/kg.添加盐度为(21±2)‰的模拟海水使沉积物湿度一致,再用搅拌器将沉积物搅拌均匀,并保持温度(26±1)℃,实验体系的pH值平均值为5.08,Eh平均值为231m.生物组投放底栖生物,非生物组不投放底栖生物,共计12个实验组,每个实验组设置3个平行.
1.3 沙蚕暴露与样品采集
人工养殖的沙蚕采购于中国广东省湛江市沙蚕养殖厂,先将沙蚕漂洗并在曝气的模拟海水中洗涤72h,之后将其转移至Hg含量很低的沉积物(0.027mg/kg)中驯化7d.驯养结束后,用超纯水清洗沙蚕,并将沙蚕置于铺有滤纸的烧杯中清肠24h.从中选择大小及重量较均一[平均长度(9±0.50)cm,平均质量为(3±0.20)g]的沙蚕进行暴露实验.每个实验装置投放30条沙蚕,在(25±1)℃环境下暴露21d,暴露过程中若发现沙蚕死亡,立刻剔除.沙蚕暴露时间为7,14,21d时,从每个实验装置中取20g沉积物,并从存在沙蚕的实验装置中随机取6条沙蚕用于生化指标测定.沙蚕取出后先用超纯水清洗,再将沙蚕置于铺有滤纸的烧杯中清肠24h,之后将一部分沙蚕冷冻保存用于测定生物体酶活性,另一部分沙蚕与沉积物冷冻干燥研磨处理后用于测定Hg和MeHg的含量.
1.4 化学分析
1.4.1 总汞分析 准确称取0.05g待测物,采用Lumex RA-915+汞分析仪及PYRO-915配件(俄罗斯Lumex分析仪器公司),使用Model I模式,在热解析温度为680~740℃,气体流量为0.80~1.20L/min,积分时间为90s的条件下测定暴露实验过程及暴露后沉积物和沙蚕体内Hg的含量.
1.4.2 甲基汞(MeHg)的萃取与分析 沉积物中MeHg采用文献[21]方法进行萃取.准确称取2g冷冻干燥的沉积物于50mL离心管中,然后加入5mL酸性KBr和1mL CuSO4溶液萃取沉积物中的MeHg,混和均匀后静置1h;再加6mL二氯甲烷到离心管中,超声浸提30min,使MeHg萃取至二氯甲烷中.以3000r/min离心15min,使用分相滤纸对有机相和水相进行分离,收集有机相;取5mL有机相至40mL玻璃瓶中,加入15mL去离子水,放入3粒高纯聚四氟乙烯(PTFE)沸石,65℃加热至有机相消失后再加热4h,使二氯甲烷完全挥发,将剩余的样品溶液用流动相(0.10%(/)L-半胱氨酸-60mmol/L乙酸铵)定容至25mL.
沙蚕中MeHg采用Wang等的方法进行萃取[22].准确称取0.10g冷冻干燥的沙蚕于10mL聚乙烯管中,然后加入5mL由0.10%(/)HCl,0.10%(/)2-巯基乙醇和0.15%(/)KCl溶液萃取沙蚕中的MeHg,将混合溶液放入摇床中,150r/min,30℃振荡12h,随后超声15min,以3000r/min离心15min,收集上清液,再向残余物中加5mL萃取溶液并振荡5min,重复上述操作,将所得的上清液混合并过0.45μm滤膜,用流动相定容至25mL.
间隙水样品采用离心法进行萃取,每次样品采集完成后,立即取30g沉积物,加入到50mL离心管中,4000r/min离心15min,上清液过0.45μm滤膜,再加10μL浓HNO3酸化过滤液,用去离子水定容到25mL.
用高效液相色谱(HPLC,Agilent 1100,USA)和电感耦合等离子质谱(ICP-MS,Agilent 8800,USA)联用技术测定不同形态的Hg[23].采用C18反向色谱柱(Agilent Zorbax Plus,USA)分离各溶液中的Hg,以5%(/)甲醇,0.10%(/)L-半胱氨酸和0.06mol/L乙酸铵为流动相,用氨水和乙酸调节pH值为4.5,进样量20μL,流速1.0mL/min,测定沉积物,沙蚕以及间隙水样品中的Hg.
1.5 生物分析
取0.10g冷冻干燥的沙蚕,按照1:9(/)的比例加入预冷的生理盐水(0.90% NaCl),于全自动样品快速研磨仪中以10000r/min匀浆10s,匀浆液在低温离心机中3000r/min下离心15min,取上清液4 ℃保存待测.使用商业测试试剂盒(南京建成生物工程研究所,南京,中国)对沙蚕样品的蛋白质,SOD,CAT, MDA,GSH进行测定.
1.6 质量保证和质量控制(QA/QC)
沉积物和生物样品的分析均采用方法空白,试剂空白和标准物质进行质量控制.以确保分析方法和样品中THg,MeHg分析结果的准确度.THg和MeHg标准参考物质的回收率分别为84.80%~ 98.50%和83.60%~99.10%,方法测量结果准确度和精密度均较好.
1.7 统计分析
所有数据均使用统计分析软件SPSS 22.0进行统计分析,使用ANOVA分析实验组之间的显著性差异,显着性水平设置为*<0.05,**<0.01,使用皮尔逊相关性分析不同实验组之间的相关性.图均用Origin version 8.0绘制.
2 结果分析
2.1 外源汞暴露过程中沙蚕体内THg和MeHg的富集
从图1(a)可知,沙蚕体内THg含量随外源汞的增加而显著增加,THg含量范围为0.01~0.19mg/kg.沙蚕暴露于外源汞含量分别为0.2,0.5,1,2,5mg/kg沉积物中,其体内THg的最大富集量分别为无外源汞含量时的2.55,3.49,4.59,8.31和11.90倍.沙蚕在不同外源汞含量沉积物中暴露7,14和21d,其体内THg增加量分别为暴露前的0.60~6.70,0.15~0.33和0.05~0.25倍,沙蚕体内THg的富集量随着暴露时间的延长而显著增加.
如图1(b)所示,暴露前7d为沙蚕对Hg的富集高峰期,随着暴露时间的延长,沙蚕对外源汞的富集速率逐渐降低,暴露14~21d时富集速率最低,沙蚕对Hg的富集速率随暴露时间的延长呈先快后缓的趋势.同一暴露时间段沙蚕对Hg的富集速率随外源汞含量的增加而增加.
如图1(c)可知,沙蚕体内MeHg的含量为0.007~0.079mg/kg,占沙蚕体内THg含量的31.20%~ 86.90%.沙蚕暴露于外源汞含量分别为0.2,0.5,1,2和5mg/kg沉积物中,其体内MeHg的最大富集量为无外源汞时的2.13,3.19,3.83,5.62和6.78倍.沙蚕在不同外源汞含量沉积物中暴露7,14和21d,其体内MeHg增加量分别为暴露前的0.70~4.39,0.28~0.45和0.17~0.21倍.沙蚕体内MeHg含量随着暴露时间和含量的增加而显著增加.
如图1(d)所示,沙蚕体内MeHg在暴露前7d的增长速率最快,7~14d的增长速率显著低于前7d, 14~21d的增长速率最低,沙蚕体内MeHg的增长速率随着暴露时间延长逐渐降低,沙蚕对MeHg的增长速率随暴露时间的延长呈先快后缓的趋势.同一暴露时间段沙蚕体内MeHg的增长速率随着外源汞含量的增加而增加.
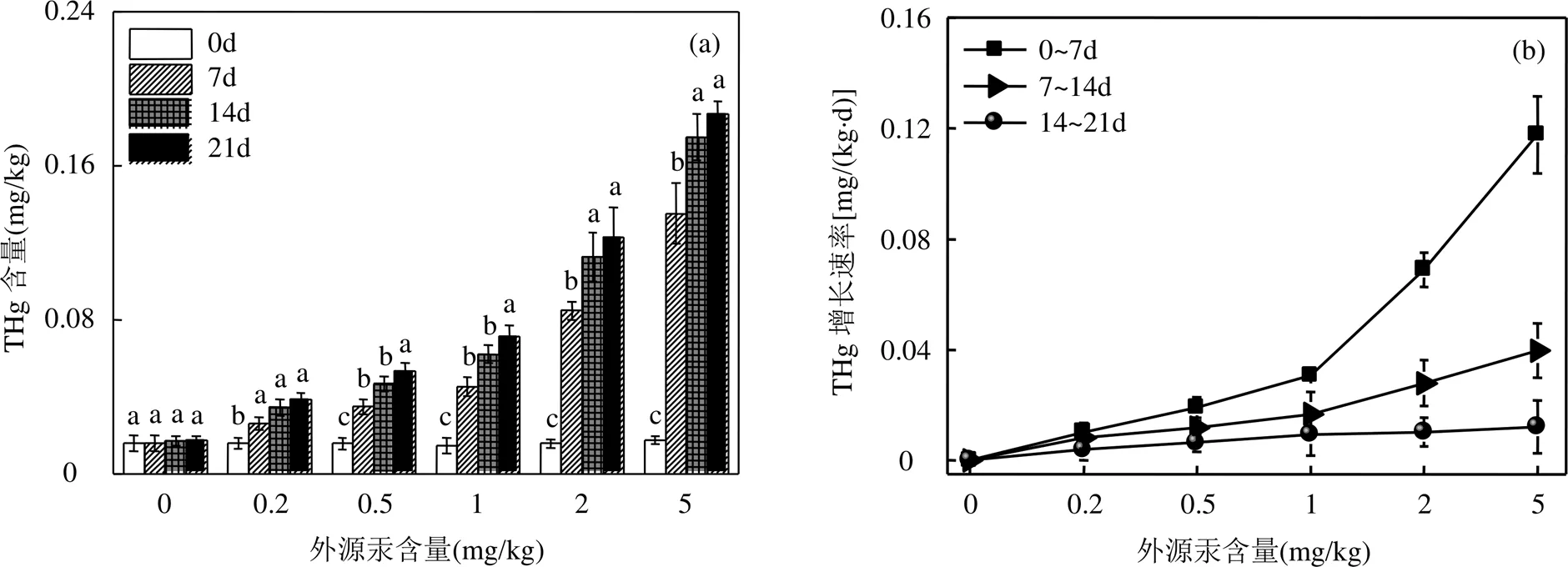
同一浓度暴露实验组不同字母表示存在显著性差异(<0.05)
2.2 外源汞输入后沉积物中THg和MeHg的含量变化
如图2(a)可知,在沙蚕扰动下,低含量处理(0.2, 0.5,1mg/kg)沉积物在整个暴露过程THg含量变化不存在显著差异;高含量外源汞处理(2,5mg/kg)的沉积物中THg含量在暴露7d后存在降低的现象,但差异不显著.图2(b)表明,在无沙蚕扰动下,不同含量外源汞处理的沉积物中THg含量变化均不存在显著差异.
据图2(c)和2(d)可知,低外源汞含量处理(0,0.2和0.5mg/kg)时,沉积物中未检出MeHg;高外源汞含量处理(1,2和5mg/kg)时,沉积物中MeHg可明显检出,且随沉积物外源汞含量和暴露时间的增加而增加.在外源汞含量1,2,5mg/kg处理下,存在沙蚕扰动的沉积物中MeHg含量均高于无沙蚕扰动的沉积物,MeHg含量分别为无沙蚕扰动沉积物中的2.62,1.37和1.39倍,表明底栖生物的存在使其周围沉积物中MeHg含量明显增多.
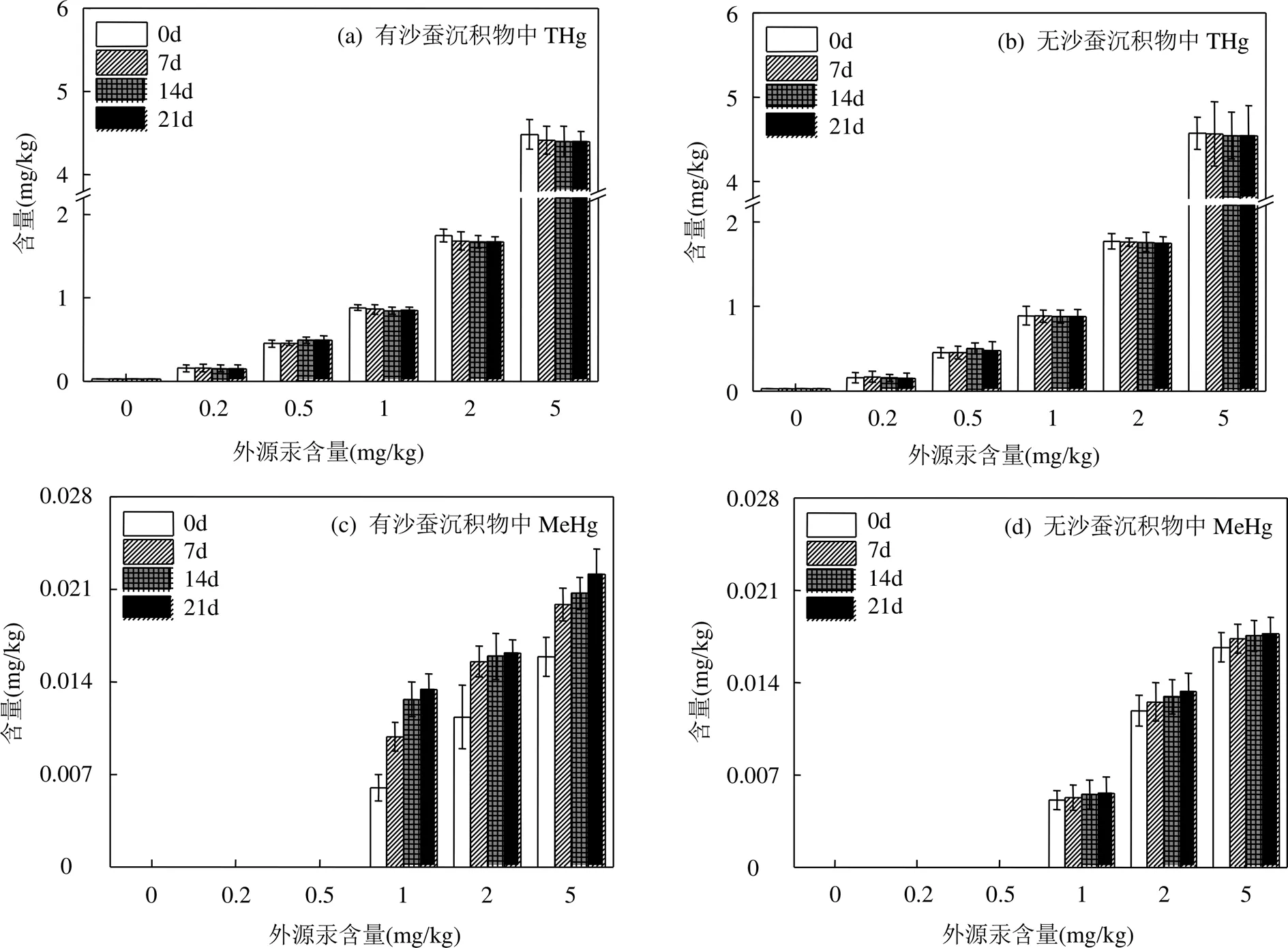
图2 沉积物中THg和MeHg含量
2.3 汞暴露过程中底栖生物应激响应指标的变化
由图3可知,沙蚕体内SOD,CAT活性和GSH, MDA含量均随外源汞含量的增加而逐渐增加,在暴露前7d呈显著增长.
根据图3(a)可知,沙蚕体内SOD活性增长速率随着外源汞暴露含量增加均呈现先快后缓的趋势.沉积物中外源汞含量为0.2,0.5mg/kg时,沙蚕体内SOD活性增长速率较快,其中外源汞含量为0.5mg/kg时,SOD活性在暴露14~21d出现显著性增长;沉积物中外源汞含量为1,2,5mg/kg时,SOD活性在暴露7~21d无显著性变化,且增长较缓慢.
由图3(b)可知,沙蚕体内GSH含量随着暴露含量呈现先快后缓的上升趋势,沉积物中外源汞含量为0.2和0.5mg/kg时,沙蚕体内GSH含量增长速率较快,暴露14~21d时,GSH含量均呈现显著性增长,沉积物中外源汞含量为1,2,5mg/kg时, GSH含量在暴露7~21d无显著性变化、且增长较缓慢.
外源汞含量为0.2,0.5mg/kg时,随暴露时间延长,沙蚕体内CAT活性先升高后降低,且在14d达到峰值,与0d时相比CAT活性分别增加了1.73和2.09倍;沉积物中外源汞含量为1,2,5mg/kg时,CAT活性随暴露时间的延长显著增长(图3(c)).
如图3(d),MDA含量随着外源汞暴露含量的增加而增加.外源汞含量为0.2,0.5,1,2,5mg/kg时,沙蚕体内MDA含量在暴露前7d的增长量为暴露前的0.79,1.79,2.99,3.37和3.73倍.外源汞含量为0.2,1,2和5mg/kg,在暴露7~21d时,MDA含量未出现显著性增长.但沉积物中外源汞含量为0.5mg/kg时,MDA含量在暴露7~21d时再次出现显著性增长.

图3 沙蚕体内SOD,CAT活性和GSH,MDA含量
同一浓度暴露实验组不同字母表示存在显著性差异(<0.05)
3 讨论
3.1 外源汞胁迫下底栖生物对体内外汞甲基化的影响
沉积物THg含量均随着外源汞含量增加而逐渐增加(图2(a),(b)),且存在沙蚕扰动的高外源汞含量处理(2,5mg/kg)组沉积物中THg含量在沙蚕暴露至第7d时呈明显降低而后变化平缓,与沙蚕体内THg含量增长速率随暴露时间先快后缓变化趋势较一致.沙蚕在暴露期间对Hg的富集量随着外源汞含量增加而增加(图1(b)),而富集速率随着暴露时间的延长逐渐降低,且其在高外源汞含量处理组富集速率高于低外源汞含量处理组,这可能是高外源汞含量处理组沙蚕体内Hg的富集量接近“饱和点”,导致富集速率逐渐降低[19,24];低外源汞含量处理组沉积物中外源汞暴露浓度低于高外源汞处理组,暴露浓度较低从而影响沙蚕对Hg的吸收速率.在设置暴露含量范围内,沙蚕体内Hg富集量在暴露期间未达到“饱和点”,这可能是暴露时间较短,沙蚕对Hg的摄取率与消除率尚未达到平衡.
低外源汞含量(£0.5mg/kg)下,沉积物中MeHg未检出,而沙蚕体内检出MeHg,且MeHg含量随着暴露时间的延长逐渐增加.这一方面可能是沙蚕吸收沉积物中Hg[4],使得沉积物中Hg含量降低,导致沉积物中转化为MeHg的量太少而无法检出;另一方面可能是沙蚕直接吸收沉积物中Hg转化的MeHg导致[25].而且研究发现生物体内富集的MeHg不仅是从沉积物摄入,还可能由无机汞在生物体内转化形成[6].沙蚕摄食的沉积物含有复杂的腐殖质,沙蚕消化道内微生物会对其进行消化和吸收,该耗氧消化过程会导致沙蚕内氧化还原电位值梯度下降,使消化道形成适宜厌氧微生物生存的缺氧环境[26];同时沙蚕消化道内的酸性环境使消化道沉积物中的稳定态Hg从吸附位点解吸转化成易被甲基化的生物可利用态Hg[27-28].在沙蚕消化道缺氧环境中,消化道中的厌氧微生物(如产甲烷菌,铁还原菌和硫酸盐还原菌)[29]会将沉积物中的生物可利用态Hg转化为MeHg,并在消化道内由消化液的促进作用吸收富集于沙蚕体内[28].因此,沙蚕体内富集的MeHg可能源自无机汞在沙蚕体内的转化和其对周围沉积物中MeHg的吸收.
高外源汞含量(>0.5mg/kg)下,沉积物和沙蚕均检出MeHg,且外源汞含量为2mg/kg,暴露21d时,沙蚕体内MeHg平均含量为其周围沉积物中MeHg平均含量的3.88倍(图1(c),图2(c)),表明沙蚕对MeHg具有较强富集能力.沉积物和沙蚕体内不同形态Hg与沙蚕氧化应激指标的相关系数矩阵见表2,据表中沉积物和沙蚕体内不同形态Hg的数据,沙蚕体内MeHg与沙蚕体内THg及沉积物中MeHg均呈极显著正相关(2=0.924,<0.01;2=0.684,<0.01),且与前者相关性更好.这表明沙蚕体内富集的MeHg不仅是从沉积物摄入,还可能是沙蚕体内无机汞转化形成[4];沙蚕体内转化吸收的MeHg较其从沉积物中吸收的MeHg对沙蚕体内MeHg含量影响更明显,具体贡献比例目前研究工作尚未确定.沙蚕体内MeHg与沉积物中THg不存在显著相关性(2= 0.296,>0.05),表明沉积物THg含量对沙蚕体内MeHg含量影响不大,可能是沙蚕对沉积物中无机Hg的吸收速率远大于沙蚕消化道对汞甲基化速率.沙蚕存在时沉积物中MeHg含量比无沙蚕存在时明显较高,最高达1.93倍,这表明沙蚕扰动会促进沉积物中Hg的甲基化[30].这可能是沙蚕分泌液提高了沉积物中Hg的生物可利用性[4],促使沉积物中其他微生物的生物甲基化和光化学甲基化;也可能是分泌液中微生物促进了沉积物中Hg的生物甲基化[30].因此,沙蚕扰动对沉积物中汞甲基化极可能存在化学作用,同时存在化学-生物作用.如图4所示,沙蚕可通摄食和皮肤吸收沉积物中Hg和MeHg,沙蚕消化道环境能促进Hg转化为MeHg.沙蚕的分泌物会促进沉积物中Hg转化为MeHg,从而增加沙蚕皮肤对MeHg的富集量.

图4 沙蚕对周围沉积物中汞的甲基化作用示意
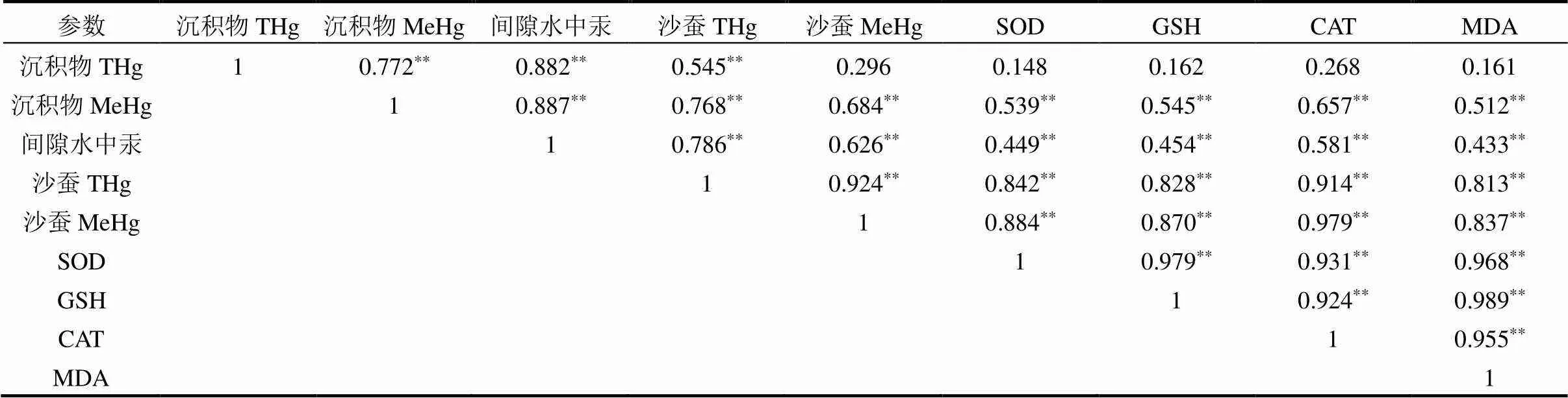
表2 沉积物和沙蚕体内不同形态Hg与沙蚕氧化应激指标的相关系数矩阵
注:**为0.01水平(双侧)上显著相关.
高外源汞含量下,沉积物中可明显检出MeHg (图2(c),2(d)),随着暴露时间的延长,沉积物中MeHg含量增长速率呈现降低趋势,与目前研究结果一致,随着暴露时间延长,MeHg的含量逐渐进入平稳期,沉积物中汞的甲基化与脱甲基化过程趋于平衡[31].沉积物中MeHg含量与沉积物中THg含量及间隙水含量均呈极显著正相关(2=0.722,<0.01;2=0.887,<0.01),但与后者相关性更好,说明沉积物中Hg甲基化受沉积物中THg含量的影响,而沉积物中生物可利用态Hg对沉积物中MeHg贡献率更高[32].
由于海水养殖区沉积物中沉积大量鱼粪和未食用的鱼食,导致海水养殖区沉积物中有机质含量显著增加[11],有机质作为碳源可以增强沉积物中微生物的活性,提高厌氧微生物(如产甲烷菌,铁还原菌,硫酸盐还原菌)对无机汞的生物甲基化能力[10],有机质含量与MeHg含量具有很好的相关性[33].同时沉积物中高含量有机质具有-SH基团,可与无机汞形成高稳定性和低溶解度的有机质-Hg络合物,降低汞的生物可利用性,从而降低汞的甲基化率[34].但沉积物中MeHg与生物可利用态Hg显著正相关,表明有机质通过降低汞的生物可利用性对汞甲基化影响不大,而有机质通过为厌氧微生物提供碳源促进了沉积物中Hg的甲基化.
3.2 外源汞胁迫下底栖生物的应激响应
沙蚕体内SOD,CAT活性和GSH,MDA含量随外源汞含量的增加而增加,且在暴露前7d均呈显著增长,表明沙蚕受到外源汞胁迫时,抗氧化防御系统能被迅速激活[35].沙蚕氧化应激指标与沙蚕体内THg和MeHg呈极显著正相关(2³0.813,<0.01),且与后者的相关性更好,这表明沙蚕抗氧化防御系统对Hg胁迫的应激性受沙蚕体内Hg富集量的影响,而MeHg会对底栖生物造成更大的氧化压力,具有更强的生物毒性.
受外源汞胁迫时,沙蚕体内的SOD活性随着暴露时间的增加而显著增加,且增长速率与沙蚕体内Hg和MeHg一致,随暴露时间延长呈先快后缓的上升趋势,而SOD是生物体内去除O2•−的主要酶[36],这说明在外源汞暴露下沙蚕体内会产生大量O2•−,且其体内在暴露期间一直存在大量O2•−,可能是富集在沙蚕体内的Hg和MeHg均会诱导其产生大量ROS(O2•−,H2O2,HO•等).同时SOD在消除O2•−的过程中会生成H2O2[37].
2O2•−+ 2H+→H2O2+O2(1)
GSH能够在谷胱甘肽过氧化物酶的作用下将H2O2还原为H2O[38],而GSH含量随外源汞暴露含量与暴露时间变化的趋势与SOD较一致,且沙蚕体内SOD与GSH呈极显著正相关(2=0.986,<0.01),进一步说明了GSH具有清除生物体内的H2O2的能力.沙蚕体内GSH含量与沙蚕体内THg和MeHg含量随外源汞暴露含量与暴露时间变化的趋势相近,且沙蚕体内GSH含量与沙蚕体内THg和MeHg含量均呈极显著正相关(2=0.828,<0.01;2=0.870,< 0.01),这可能是沙蚕体内Hg能诱导其GSH基因的表达,随着沙蚕体内富集的Hg含量增加,大量GSH被诱导合成[39],同时,GSH作为生物体最重要的非酶类抗氧化物,可通过-SH将Hg络合形成GS-Hg-SG巯基共轭物,从而去除沙蚕体内的Hg[40].
GSH+Hg2+⇄GS-Hg1++H+(2)
GSH+GS-Hg1+⇄GS-Hg-SG (3)
虽GSH具有还原H2O2的能力,但生物体内去除H2O2主要清除剂为CAT[36].低外源汞含量(£0.5mg/ kg)时,CAT的活性随暴露时间的增加呈先增后降的趋势,且在暴露至第14d时达到峰值,这可能是沙蚕被Hg诱发产生较低水平的H2O2,CAT会通过催化H2O2氧化沙蚕体内其他细胞毒性物质(如酚和醇)[38],从而使沙蚕体内的H2O2被逐渐消耗,以致沙蚕体内CAT的诱导程度减弱.高外源汞含量(>0.5mg/kg)时,沙蚕体内CAT活性随暴露时间的延长呈显著上升趋势,且在暴露至第21d时CAT活性仍继续升高,这可能是沙蚕被高含量Hg诱导产生大量H2O2,而较高水平的H2O2会导致CAT的催化反应发生转变,转变后的催化反应中H2O2既充当氢分子的受体,又充当氢分子的供体,反应生成H2O和O2[38],以致沙蚕体内CAT的诱导程度增强.
2H2O2→2H2O+O2(4)
外源汞含量为0.2mg/kg时,沙蚕MDA含量在暴露前7d呈显著增长而后变化平缓,且其含量较低,这可能是沙蚕暴露于较低含量Hg时,其体内的抗氧化防御系统虽启动,但尚未及时消除沙蚕体内的全部H2O2和O2•−,在Hg2+的诱导下发生Fenton和Haber Weiss反应,引起较低程度的脂质过氧化[41-42].当外源汞含量为0.5mg/kg时,沙蚕MDA含量出现显著增长,且其最大含量与外源汞含量为1mg/kg时的最大含量不存在显著差异,而外源汞含量大于0.5mg/kg时,ROS被大量诱导,导致MDA含量暴露前7d迅速增加,在暴露第7d之后,MDA含量达到最大值且不再降低,这表明当沉积物中外源汞含量超过0.5mg/kg时,沙蚕的抗氧化防御系统将无法抵御汞的毒性,并严重引起细胞膜损伤[43].沙蚕体内SOD活性,GSH含量与MDA含量随暴露时间和含量变化的趋势较一致,说明沉积物中外源汞输入含量超过0.5mg/kg,沙蚕抗氧化应激系统则超过防御极限.
4 结论
4.1 海水养殖区沙蚕一方面具有将汞转化为MeHg的能力,同时沙蚕活动会促进沉积物中Hg的甲基化,存在沙蚕扰动的沉积物中MeHg含量为无沙蚕扰动沉积物中MgHg含量的1.93倍.
4.2 海水养殖沉积物中沙蚕对MeHg具有明显的蓄积性,随着外源汞含量和暴露时间的增加,其体内MeHg富集量逐渐增加,而富集速率逐渐降低;沙蚕体内MeHg富集含量为0.007~0.079mg/kg,占沙蚕体内THg含量的31.20%~86.90%.
4.3 SOD,CAT活性和GSH,MDA含量对Hg的响应与Hg暴露时间和Hg含量有关,沙蚕体内SOD, CAT活性和GSH,MDA含量均随外源汞含量的增加而逐渐增加,在暴露前7d均呈显著增长;沉积物中外源汞含量超过0.5mg/kg时,沙蚕抗氧化应激系统超过防御极限;与无机Hg相比,MeHg会对沙蚕造成更大的氧化压力,具有更强的生物毒性.
[1] 黄洪辉,林 钦,林燕棠,等.大亚湾网箱养殖海域大型底栖动物的时空变化 [J]. 中国环境科学, 2005,25(4):412-416.
Huang H H, Ling Q, Lin Y T, et al. Spatial-temporal variation of large macrobenthic animals in cage culture sea area in Daya Bay [J]. China Environmental Science, 2005,25(4):412-416.
[2] Wang Y, Wei Y N, Guo P R, et al. Distribution variation of heavy metals in maricultural sediments and their enrichment, ecological risk and possible source-A case study from Zhelin bay in Southern China [J]. Marine Pollution Bulletin, 2016,113(1/2):240-246.
[3] Wu Q H, Zhou H C, Tam N F Y, et al. Contamination, toxicity and speciation of heavy metals in an industrialized urban river: Implications for the dispersal of heavy metals [J]. Marine Pollution Bulletin, 2016,104(1/2):153-161.
[4] Xu Z, Fan W, Shi Z, et al. Mercury and methylmercury bioaccumulation in a contaminated bay [J]. Marine Pollution Bulletin, 2019,143:134-139.
[5] GB 18668-2002 海洋沉积物质量 [S].
[6] GB 18668-2002 Marine sediment quality [S].
[7] Wang R, Feng X B, Wang W X, In vivo mercury methylation and demethylation in freshwater tilapia quantified by mercury stable isotopes [J]. Environmental Science & Technology, 2013,47(14): 7949-7957.
[8] Helieen H K, Katarzyk K H, Zhang T, et al. Mechanisms regulating mercury bioavailability for methylating microorganisms in the aquatic environment: a critical review [J]. Environmental Science & Technology, 2013,47(6):2441-2456.
[9] Celo V, Lean D R, Scott S L, Abiotic methylation of mercury in the aquatic environment, Science of the Total Environment [J], 2006, 368(1):126-137.
[10] 任家盈,姜 霞,陈春霄,等.太湖营养状态对沉积物中总汞和甲基汞分布特征的影响 [J]. 中国环境科学, 2013,33(7):1290-1297.
Ren J Y, Jiang X, Cheng C X, et al. The Effect of nutrition status on sediments distribution characteristics of total mercury and methylmercury in Lake Taihu [J]. China Environmental Science, 2013, 33(7):1290-1297.
[11] Ullrich S M, Tanton T W, Abdrashitova S A, Mercury in the Aquatic Environment: A Review of Factors Affecting Methylation [J]. Critical Reviews in Environmental Science and Technology, 2001,31(3):241- 293.
[12] Xu Z, Wu S, Christie P, et al. Impacts of estuarine dissolved organic matter and suspended particles from fish farming on the biogeochemical cycling of mercury in Zhoushan island, eastern China Sea [J]. Science of the Total Environment, 2020,705:135921.
[13] Gothberg A, Greger M, Formation of methyl mercury in an aquatic macrophyte [J]. Chemosphere, 2006,65(11):2096-2105.
[14] Rieder S R, Brunner I, Daniel O, et al. Methylation of mercury in earthworms and the effect of mercury on the associated bacterial communities [J]. PLOS One, 2013,8(4):e61215.
[15] Patrick S, A review of the biology, ecology and potential use of the common ragworm Hediste diversicolor (O.F. Müller) (Annelida Polychaeta) [J]. Hydrobiologia, 2002,470(1-3):203-218.
[16] Wang W X, Stupakoff I, Gagnon C, et al. Bioavailability of inorganic and methylmercury to a marine deposit-feeding polychaete [J]. Environmental Science & Technology, 1998,32(17):2564-2571.
[17] Ernst G, Zimmermann S, Christie P, et al. Mercury, cadmium and lead concentrations in different ecophysiological groups of earthworms in forest soils [J]. Environmental Pollution, 2008,156(3):1304-1313.
[18] Suthar S, Singh S, Dhawan S, Earthworms as bioindicator of metals (Zn, Fe, Mn, Cu, Pb and Cd) in soils: Is metal bioaccumulation affected by their ecological category? [J]. Ecological Engineering, 2008,32(2):99-107.
[19] Francesco R, Winston W G, Quantification of Total Oxidant Scavenging Capacity of Antioxidants for Peroxynitrite, Peroxyl Radicals, and Hydroxyl Radicals [J]. Toxicology and Applied Pharmacology, 1999,156(2):96-105.
[20] Jaramillo D M, Rocha A M, Chiang G, et al. Biochemical and behavioral responses in the estuarine polychaete Perinereis gualpensis (Nereididae) after in situ exposure to polluted sediments [J]. Ecotoxicology and Environmental Safety, 2013,89:182-188.
[21] 刘 爽,马 旭,刘 宁,等.高效液相色谱-电感耦合等离子体质谱法测定海水养殖底泥中甲基汞和乙基汞[J]. 分析实验室, 2019, 38(9):1043-1047.
Liu S, Ma X, Liu N, et al. Detection of methylmercury and ethylmercury in marine culture sediment by high performance liquid chromatography-inductively coupled plasma mass spectrometry [J]. Chinese Journal of Analysis Laboratory, 2019,38(9):1043-1047.
[22] Wang M, Feng W, Shi J, et al. Development of a mild mercaptoethanol extraction method for determination of mercury species in biological samples by HPLC-ICP-MS [J]. Talanta, 2007,71(5):2034-2039.
[23] Jia X Y, Gong D R, Han Y, et al. Fast speciation of mercury in seawater by short-column high-performance liquid chromatography hyphenated to inductively coupled plasma spectrometry after on-line cation exchange column preconcentration [J]. Talanta, 2012,88:724- 729.
[24] Cardoso P G, Lillebo A I, Pereira E, et al. Different mercury bioaccumulation kinetics by two macrobenthic species: the bivalve Scrobicularia plana and the polychaete Hediste diversicolor [J]. Marine Environmental Research, 2009,68(1):12-18.
[25] Taylor V F, Bugge D, Jackson B P, et al. Pathways of CH3Hg and Hg ingestion in benthic organisms: an enriched isotope approach [J]. Environmental Science & Technology, 2014,48(9):5058-5065.
[26] Canario J, Miguel C, Evidence for elevated production of methylmercury in salt marshes [J]. Environmental Science & Technology, 2007,41(21):7376-7382.
[27] Kaschak E, Knopf B, Petersen J H, et al. Biotic methylation of mercury by intestinal and sulfate-reducing bacteria and their potential role in mercury accumulation in the tissue of the soil-living Eisenia foetida [J]. Soil Biology and Biochemistry, 2014,69:202-211.
[28] Dang F, Zhao J, Greenfield B K, et al. Soil geochemistry and digestive solubilization control mercury bioaccumulation in the earthworm Pheretima guillemi [J]. Journal of Hazardous Materials, 2015,292: 44-51.
[29] Li M, Yang H, Gu J D, Phylogenetic diversity and axial distribution of microbes in the intestinal tract of the polychaete Neanthes glandicincta [J]. Microbial Ecology, 2009,58(4):892-902.
[30] Sizmur T, Canario J, Edmonds S, et al. The polychaete worm Nereis diversicolor increases mercury lability and methylation in intertidal mudflats [J]. Environmental Toxicology and Chemistry, 2013,32(8): 1888-1895.
[31] Jonsson S, Skyllberg U, Nilsson M B, et al. Mercury methylation rates for geochemically relevant Hg(II) species in sediments [J]. Environmental Science & Technology, 2012,46(21):11653-11659.
[32] Zhao L, Wang R, Zhang C, et al. Geochemical controls on the distribution of mercury and methylmercury in sediments of the coastal East China Sea [J]. Science of the Total Environment, 2019,667:133- 141.
[33] Ding L, Zhao K, Zhang L, et al. Distribution and speciation of mercury affected by humic acid in mariculture sites at the Pearl River estuary [J]. Environmental Pollution, 2018,240:623-629.
[34] Hammerschmidt C R, Fitzgerald W F., Geochemical controls on the production and distribution of methylmercury in near-shore marine sediments [J]. Environmental Science & Technology, 2004,38(5): 1487-1495.
[35] Maity S, Banerjee R, Goswami P, et al. Oxidative stress responses of two different ecophysiological species of earthworms (Eutyphoeus waltoni and Eisenia fetida) exposed to Cd-contaminated soil [J]. Chemosphere, 2018,203:307-317.
[36] Liu T, Wang X, Xu J, et al. Biochemical and genetic toxicity of dinotefuran on earthworms (Eisenia fetida) [J]. Chemosphere, 2017, 176:156-164.
[37] Jonas N, Elias S J A, Reactive oxygen species, antioxidants, and the mammalian thioredoxin system [J]. Free Radical Biology and Medicine, 2001,31(11):1287-1312.
[38] Regoli F, Giuliani M E, Oxidative pathways of chemical toxicity and oxidative stress biomarkers in marine organisms [J]. Marine Environmental Research, 2014,93(SI):106-117.
[39] Beyersmann D, Hechtenberg S, Cadmium, Gene Regulation, and Cellular Signalling in Mammalian Cells [J]. Toxicology and Applied Pharmacology, 1997,144(2):247-261.
[40] Rubino F M, Toxicity of Glutathione-Binding Metals: A Review of Targets and Mechanisms [J]. Toxics, 2015,3(1):20-62.
[41] Moltedo G, Martuccio G, Catalano B, et al. Biological responses of the polychaete Hediste diversicolor (O.F.Muller, 1776) to inorganic mercury exposure: A multimarker approach [J]. Chemosphere, 2019, 219:989-996.
[42] Sun F H, Zhou Q X, Oxidative stress biomarkers of the polychaete Nereis diversicolor exposed to cadmium and petroleum hydrocarbons [J]. Ecotoxicology and Environmental Safety, 2008,70(1):106-114.
[43] Geracitano L A, Bocchetti R, Monserrat J M, et al. Oxidative stress responses in two populations of Laeonereis acuta (Polychaeta, Nereididae) after acute and chronic exposure to copper [J]. Marine Environmental Research, 2004,58(1):1-17.
Research of the methylation and biological response of exogenous mercury in mariculture sediments.
WANG Shu-ping1,2, SONG Yu-mei1, LIU Shuang1, GUO Peng-ran1*
(1.Guangdong Provincial Engineering Research Center for Online Monitoring of Water Pollution, Guangdong Provincial Key Laboratory of Emergency Test for Dangerous Chemicals, Institute of Analysis, Guangdong Academy of Sciences(China National Analytical Center,Guangzhou) Guangzhou 510070, China;2.Faculty of Environmental Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China)., 2021,41(6):2871~2880
By simulation of mariculture environment and Nereis diversicolor as benthic, the methylation of Mercury (Hg), accumulation of methylmercury (MeHg) and the oxidative stress of Nereis diversicolor were studied under the existence of Hg(NO3)2. The results showed that mercury could be transformed to methylmercury by both Nereis diversicolor and the environment, especially in that with Nereis diversicolor. The concentration of MeHg in the sediments with Nereis diversicolor was 1.93 times that without Nereis diversicolor. With increasing of the external input mercury concentration and exposure time, the concentration of MeHg increased and the accumulation rate decreases gradually in benthic body. The concentration of methylmercury in Nereis diversicolor body was 0.007~0.079mg/kg that was 31.20%~86.90% of Total mercury. The activity of SOD and CAT, the concentration of GSH and MDA in the Nereis diversicolor were significantly correlated with exposed time and Hg concentration. Compared with inorganic Hg, Methylmercury could cause more oxidative stress and had stronger biotoxicity. The defense limit of the oxidative stress system of the silkworm would be broken, when the concentration of external input mercury exceeds 0.5mg/kg in the sediment.
exogenous mercury;methylation;sediment;nereis diversicolor;oxidative stress
X503.23;X55
A
1000-6923(2021)06-2871-10
2020-11-02
国家自然科学基金资助项目(21777150);国家重点研发计划资助项目(2018YFC1801701)
* 责任作者, 研究员, prguo@fenxi.com.cn
王书平(1996-),男,湖北恩施人,昆明理工大学硕士研究生,主要从事固体废物资源化利用研究.发表论文2篇.

