细菌活细胞分离的HPLC研究
桂 亮,林 娟,刘树滔
(1.安徽卫生健康职业学院 医学系,安徽 池州 247099;2.福州大学 生物科学与工程学院,福建 福州 350108)
由于微生物体积小、分布广和多样性等生物学特点,使其在整个生命科学的发展中起着无可争辩的关键作用[1]。随着现代生物技术的发展,一系列微生物分离分析的新方法层出不穷,人类对微生物生命活动的认识也日趋丰富[2]。因此,打破传统观念的束缚,探求一种创新性的微生物形态学研究方法,快速准确地分离鉴定微生物的生物学特性,是推进微生物学乃至整个生命科学发展的重要因素[3-4]。
细菌是一类形体微小(直径约0.5 μm,长度约0.5~5 μm)、结构简单的单细胞原核微生物。它们是在自然界分布最广、个体数量最多的有机体,与大自然和人类有着密不可分的联系,因此,也是最具有代表性的微生物类群。在特定的生理状态下,不同细菌或同种细菌由于细胞表面物质的化学基团解离状态不同,决定了其带电荷的不同,因此可以使用高效液相离子交换色谱(HPLC)使不同吸附力的细菌依次被洗脱下来,从而实现不同表面特性构造的细菌的分离分析,并能对分离的细菌活细胞进行再研究[5-6]。
郑雪芳、邱丹腾等[7-8]利用高效离子交换色谱对单一细胞进行了分离,但对混合细菌体系的HPLC研究较少。本研究将不同种属细菌进行色谱表征,对利用高效离子交换色谱分离细菌活细胞的分离条件进行优化,并探讨如何对肠道混合菌株体系进行色谱分离。
1 材料
1.1 菌株
大肠杆菌(Escherichia coli),植物乳杆菌(Lactobacillus plantarum),枯草芽孢杆菌(Bacillus subtilis),变形杆菌(Protens vulgaris),产气杆菌(Enterobacter aerogenes)。
1.2 缓冲液
平衡缓冲液:0.02 mol/L哌嗪盐酸缓冲液(pH7.0)。洗脱缓冲液:0.02 mol/L哌嗪盐酸缓冲液(pH7.0)+1 mol/L NaCl。所用试剂均为分析纯以上,所有色谱缓冲液用超纯水配制,且经0.22 μm孔径的醋酸纤维素膜过滤。
1.3 仪器设备和材料
高效液相色谱仪(Beckman Golden System,美国Bechman公司),激光光散射仪(Dawn Eos Enhanced Optical System,美国Wyatt Technology 公司)、离心机(CF15RX,日本Hitachi公司)、超纯水机(MILLI-Q,美国Millipore公司)、超净工作台(1285型,美国Thermo Forma公司)、光学显微镜(XSB-3,上海光学仪器厂)、强阴离子交换树脂(Toyopearl TSKgel SuperQ-650C,日本Tosoh公司)。
2 方法
2.1 样品的预处理
2.2.1 固体培养菌样品的制备
将经平板培养至对数生长期的菌体,经无菌操作,挑取菌落溶解于无菌水中,制备成菌悬液,漩涡充分振荡均匀,调整至适合的菌浓[5],即为色谱上样品。
2.1.2 液体培养菌样品的制备
菌体经活化后,接种至相应液体培养基,培养至对数生长期,于4 ℃,5 000 r/min下,离心10 min,取菌泥加入超纯水,漩涡振荡后,离心洗涤菌体,以除去残余培养基,将两次离心洗涤处理后的菌泥,加入适量超纯水,漩涡振荡均匀,调整至相应的菌浓,即为上样菌悬液。
2.2 高效离子交换色谱分析
色谱柱规格100 mm×7.6 mm,流速1 mL/min,室温。采用高效液相色谱仪紫外检测器和激光光散射仪串联的在线双检测系统,跟踪检测细菌过柱情况。紫外检测波长为280 nm,激光光散射仪检测波长为600 nm,信号倍增系数为1。整个HPLC色谱体系中的所有管路、部件先经0.1 mol/L NaOH冲洗30 min,再经无菌水、20%酒精溶液、无菌水依次冲洗,最后用无菌的缓冲液冲洗、平衡系统。
2.3 细菌色谱分离条件的优化
2.3.1 pH值的优化
选择pH6.0、pH7.0两个pH值的哌嗪-HCl缓冲液(0.02 mol/L),样品上样后,0~10 min经平衡缓冲液平衡,使进样的细菌充分吸附到树脂上;10~50 min线性梯度洗脱,洗脱梯度为0.05~0.7 mol/L NaCl;50~55 min洗脱梯度为0.7~1.0 mol/L NaCl;55~65 min完全转换为洗脱缓冲液。对大肠杆菌、枯草芽孢杆菌、产气杆菌、变形杆菌、植物乳杆菌5种不同细菌进行色谱分离效果的比较,以确定合适的缓冲液pH值。
2.3.2 流速的选择
选择pH7.0的哌嗪-HCl缓冲液(0.02 mol/L),洗脱梯度为:0~10 min,平衡缓冲液平衡,10~50 min,0.05~0.7 mol/L NaCl线性洗脱,50~60 min,完全转换为洗脱缓冲液。选择0.25 mL/min、0.5 mL/min、0.75 mL/min、1.0 mL/min、1.25 mL/min、1.5 mL/min、2.0 mL/min 7种不同流速,对醋化醋杆菌进行色谱表征;选择0.5 mL/min、0.75 mL/min、1.0 mL/min、1.5 mL/min、2.0 mL/min 5种不同流速,对植物乳杆菌进行色谱表征,比较两种不同来源的细菌的分离效果,以确定最佳流速。
2.3.3 洗脱梯度的优化
选择pH7.0的哌嗪-HCl缓冲液(0.02 mol/L),以3种不同的洗脱梯度,对大肠杆菌、枯草芽孢杆菌、产气杆菌、变形杆菌、植物乳杆菌5种不同细菌进行色谱分离效果的比较,确定最佳洗脱梯度。
梯度1:0~10 min平衡缓冲液平衡,10~ 50 min,0~1.0 mol/L NaCl线性洗脱,50~60 min,完全转换为洗脱缓冲液。
梯度2:0~10 min平衡缓冲液平衡,10~50 min,0.05~0.7 mol/L NaCl线性洗脱,50~55 min,0.7~1.0 mol/L NaCl线性洗脱,55~65 min,完全转换为洗脱缓冲液。
梯度3:0~10 min平衡缓冲液平衡,10~50 min,0.05~0.7 mol/L NaCl线性洗脱,50~60 min,完全转换为洗脱缓冲液。
2.4 肠道菌的混合菌株分离表征
将固体培养18 h的大肠杆菌、变形杆菌及培养36 h的植物乳杆菌,无菌条件下,分别用接种环挑取适量菌泥,溶解于超纯水中,漩涡振荡均匀,制备成菌悬液。按一定比例将3种菌株混合均匀,对混合菌株进行色谱表征。
2.5 显微镜检验
用灭菌的离心管收集不同色谱峰组分,分别于4 ℃下12 000×g 离心5 min,收集沉淀;挑取少许沉淀涂片,0.01%的美兰染色,油镜(×100)下观察。
3 结果与讨论
3.1 pH值的优化
缓冲液pH值,不仅决定了样品各组分的有效分离,同时也直接影响细菌的生理活性和结构。本课题选择了pH6.0、pH7.0两个最接近细菌生长环境的pH值,对5种细菌进行色谱分离效果的比较,以确定最合适的缓冲液pH值。
如图1所示,当pH为6.0时,色谱曲线除分离主峰外,还会出现小的杂峰,影响分离效果;从图2可以看出,当pH为7.0时,各种细菌的分离峰型较为对称,形成尖锐的色谱峰。
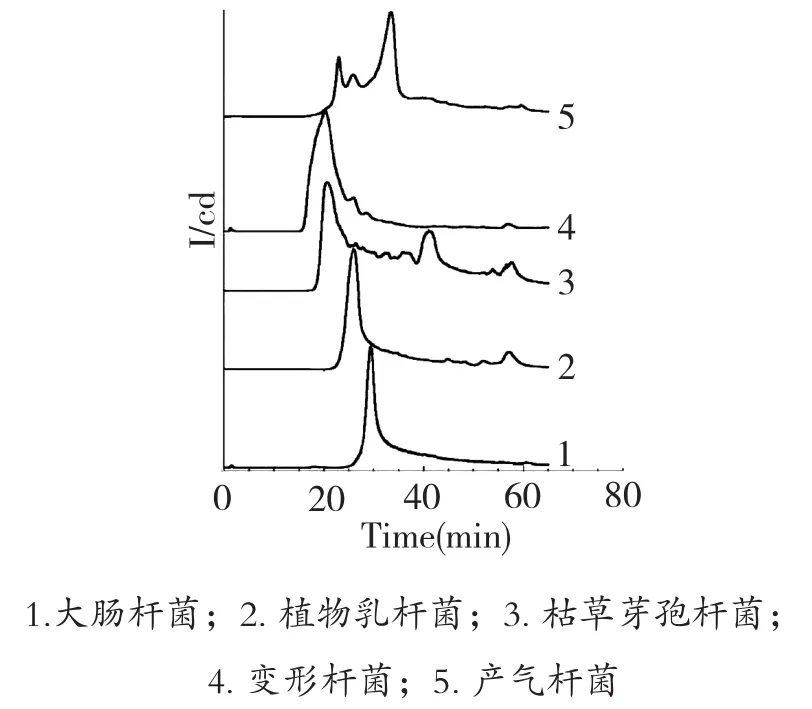
图1 pH6.0哌嗪-HCl缓冲液(0.02 mol/L)的分离效果比较
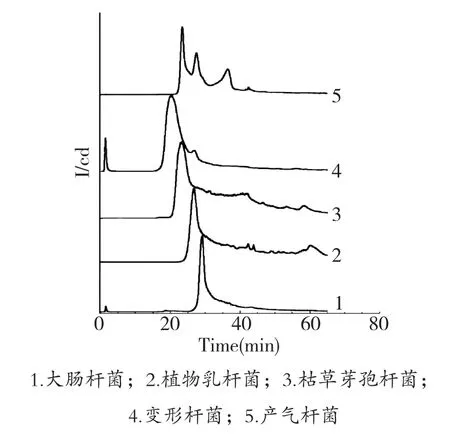
图2 pH7.0哌嗪-HCl缓冲液(0.02 mol/L)的分离效果比较
分析不同pH条件下5种细菌的色谱峰保留时间(表1),当pH为7.0时,所有细菌的保留时间较pH为6.0时均有所推迟,由于溶液pH大于细菌的等电点时,菌体表面带负电荷,pH越高,菌体表面带电量越大,与树脂的吸附程度越强,因此保留时间也随之延长。综合以上各因素考虑,选定缓冲液的pH值为7.0。
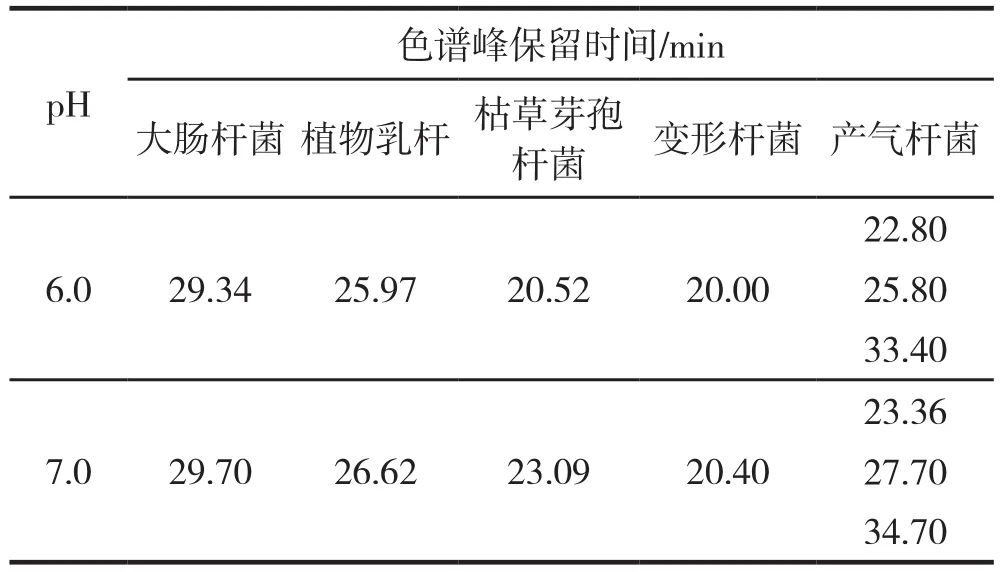
表1 不同pH条件下5种细菌的色谱峰保留时间
3.2 流速的选择
高效离子交换色谱的分离方法,除考虑缓冲液盐浓度、pH值等因素以外,选择适合的流速是高效快速分离方法必不可少的因素。流速过小会导致整个分离时间延长从而影响细菌生理状态及分离效果,流速太大会影响细菌和树脂结合度并缩短色谱柱的使用周期。本课题选择了0.5 mL/min~2.0 mL/min一系列不同的流速,针对植物乳杆菌进行色谱表征,研究不同流速对分离效果的影响。
植物乳杆菌经平板培养至对数生长期(32~36 h),无菌操作挑取少量菌,溶解于无菌水中,漩涡振荡均匀,调整至适合菌浓,每次上样量一致,以0.5 mL/min、0.75 mL/min、1.0 mL/min、1.5 mL/min、2.0 mL/min 5种不同流速分别进行色谱分析,比较不同流速色谱分离效果(图3)。
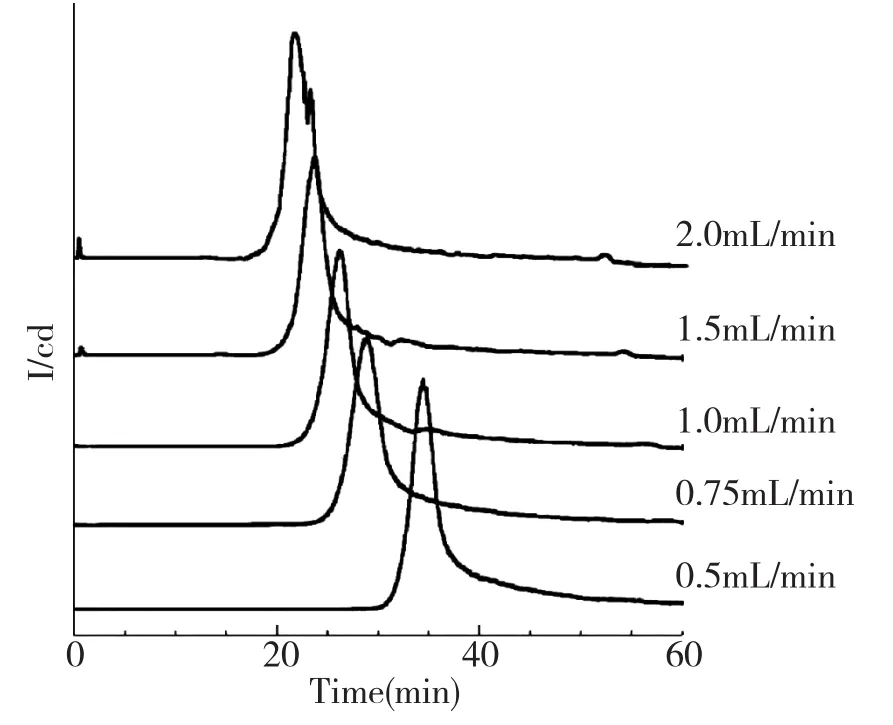
图3 不同流速对植物乳杆菌分离效果的比较
如图3所示,植物乳杆菌色谱峰呈现典型的对称单峰,当流速增加至1.5 mL/min时,在死时间附近开始出现峰1;随流速的增大,峰1面积有逐渐增大的趋势。并且,色谱峰的保留时间随流速的增加依次递减。对植物乳杆菌色谱峰峰面积进行积分,分析比较不同流速对峰面积的影响。
从表2可以得出结论,随着流速逐渐地增大,植物乳杆菌在死体积附近逐渐形成色谱峰1,并且峰1面积比逐渐增大,导致峰2面积相应减少。由色谱图分析可知,流速太小,形成的色谱峰峰形较宽,影响分离效果;菌体在色谱柱上的保留时间增加,延长了色谱分离时间;流速过大,影响菌体与离子交换树脂的吸附程度,保留时间缩短。当流速为1 mL/min时,出现对称尖锐的色谱峰,保留时间也适中,因此,选择1 mL/min的流速作为色谱分离的最适流速。
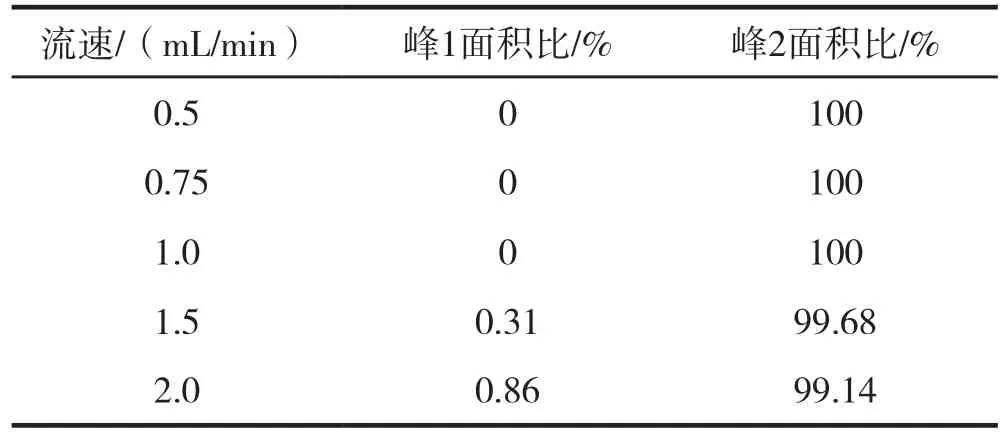
表2 不同流速下植物乳杆菌相应峰面积比
3.3 洗脱梯度的优化
洗脱梯度很大程度上决定了组分在离子交换色谱柱上的保留时间及分离度,因此,确立良好的洗脱梯度是分离效果的保证。图4、图5、图6分别为3种不同的洗脱梯度对大肠杆菌、枯草芽孢杆菌、产气杆菌、变形杆菌、植物乳杆菌5种不同细菌的色谱分离效果比较。
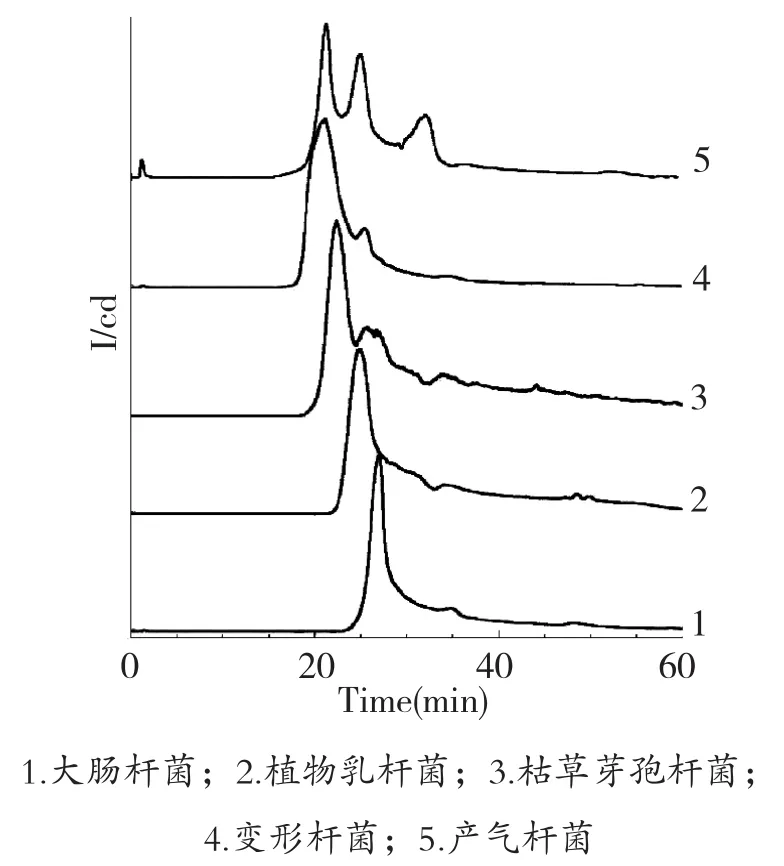
图4 梯度1洗脱

图5 梯度2洗脱
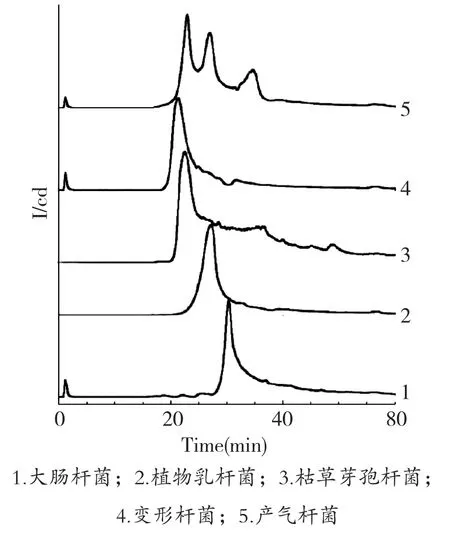
图6 梯度3洗脱
由图4、图5、图6可以看出,相同的洗脱时间内,0~1.0 mol/L NaCl线性洗脱比0.05~0.7 mol/L NaCl线性洗脱的梯度更快,从表3结果来看,5种细菌的保留时间比较在梯度1时比在梯度2时更接近,因此,相对较缓的梯度,可以提高各组分的分离度。梯度3对梯度2进行改进,减少了0.7~1.0 mol/L NaCl线性洗脱5 min的步骤,对比两个梯度分离色谱图,55~65 min过程中,5种细菌均未出现洗脱峰,说明各组分在0.05~0.7 mol/L NaCl线性洗脱过程中,已经全部洗脱下来,为缩短梯度时间,提高分离效率,选用梯度3:0~10 min平衡缓冲液平衡,10~50 min,0.05~0.7 mol/L NaCl线性洗脱,50~60 min,完全转换为洗脱缓冲液,作为最佳分离梯度。
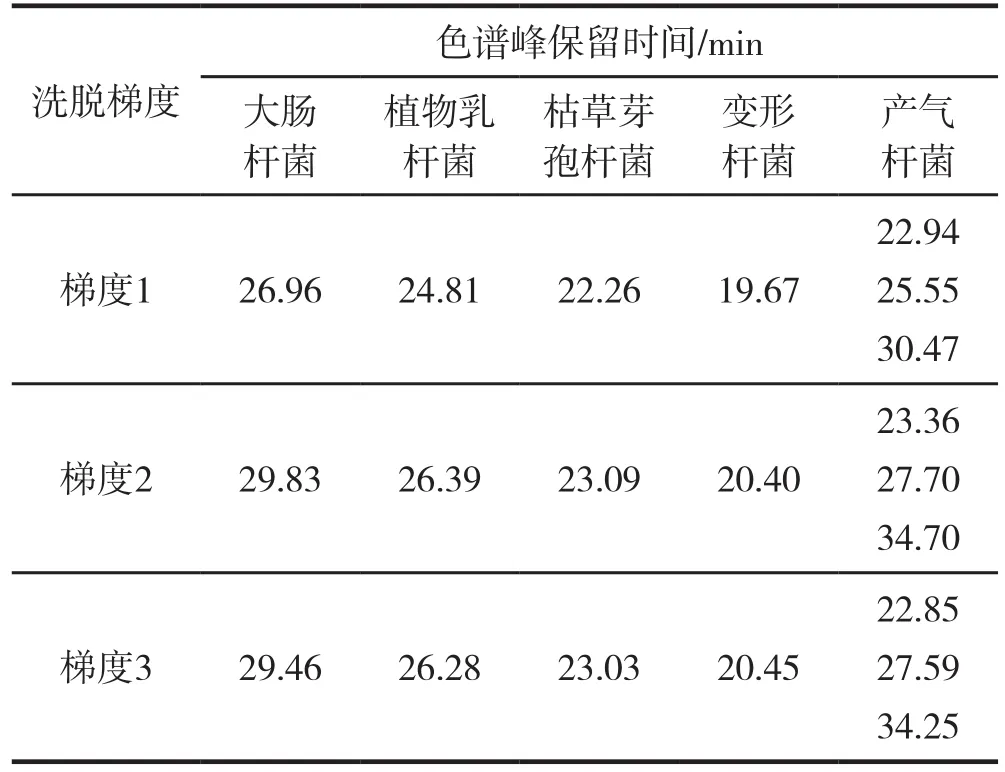
表3 不同洗脱梯度条件下5种细菌的色谱峰保留时间
3.4 肠道菌的混合菌株分离表征
肠道菌群是一个极其复杂的微生态系统,对宿主的营养与健康有着重要的影响。传统的检测肠道微生物技术主要是通过微生物的选择性培养,或者靠直接形态观察来获得部分信息,再进行鉴定和分类[9-11]。分子生物学、免疫学等新技术等应用不依赖纯培养的分子生态学方法及分子工具,能大大扩展对肠道分离物的鉴定能力[12-13],这些方法在为肠道菌群检验带来高特异性,但无法对细菌细胞回收以用于进一步的形态、生理和生化研究,无法真实全面地反映肠道菌群的生存状态。
大肠杆菌、变形杆菌、植物乳杆菌生存于人类和动物的肠道,为人体内的正常菌相[14-15]。为研究肠道细菌活细胞的色谱分离分析,采用确定的色谱条件对大肠杆菌、变形杆菌、植物乳杆菌3种菌株组成的肠道菌混合菌株进行色谱表征,见图7。单菌株和混合菌株的色谱峰保留时间见表4。

图7 纯培养菌株的混合色谱分离表征

表4 单菌与混合菌株色谱峰保留时间对比
收集各色谱峰组分离心,取沉淀,按方法2.5进行显微镜观察。结果如图8所示。
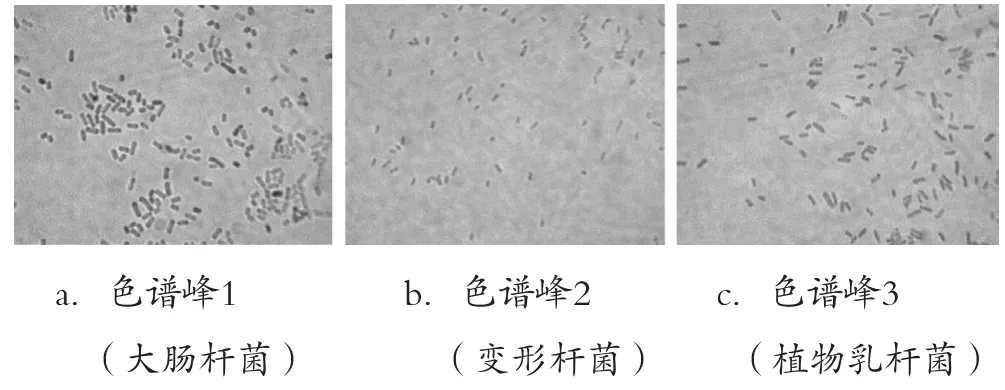
图8 各色谱峰镜检图
变形杆菌、大肠杆菌及植物乳杆菌组成的肠道菌的混合菌株进行色谱表征,可以得到效果较好的分离,混合菌株的色谱保留时间与单菌保留时间基本一致(表4)。色谱峰2、3组分比较接近是由于植物乳杆菌和大肠杆菌的色谱保留时间相近,要实现完全分离需在后续研究中进一步优化色谱分离条件。通过对各色谱峰显微镜检验发现(图8),HPLC法对不同表面构造的细菌活细胞实现分离后,可对各色谱峰中细菌进行回收,且细菌形态并无明显变化。因此,利用高效离子交换色谱用于分离分析活菌细胞,不仅具有良好的分离效果,还可以实现对细菌活细胞进行下一步的形态研究和生理、生化分析,是一种快速、准确、使用的分离检测方法。
4 结论
确立了高效离子交换色谱分离细菌活细胞的最佳色谱条件:采用Toyopearl TSKgel SuperQ-650C强阴离子交换树脂、pH7.0、0.02 mol/L的哌嗪-HCl,洗脱盐浓度为1 mol/L NaCl、洗脱梯度为:0~10 min平衡缓冲液平衡,10~50 min,0.05~0.7mol/L NaCl线性洗脱,50~60 min,完全转换为洗脱缓冲液、流速1 mL/min;同时应用高效离子交换色谱方法分离3种纯培养的肠道菌的混合菌株悬液,得到了较好的分离效果,具有良好的稳定性和广泛的实用性,为进一步研究微生态体系中混合菌株的数量变化及其相互作用奠定了基础。

