基于体素的磁共振形态学腰椎间盘突出症慢性下肢痛模型大鼠的实验研究
赵继荣,薛旭,袁毓喆,陈祁青,陈文,张海清,赵宁,马同,张天龙,杨涛
1.甘肃省中医院脊柱骨科,甘肃兰州730050;2.中国药科大学药学院,江苏南京210000;3.甘肃中医药大学研究生院,甘肃兰州730030
前言
腰椎间盘突出症(Lumbar Disc Herniation,LDH)是因在外力作用下或椎间盘自身退变后纤维环破裂,髓核突出,刺激或压迫脊髓、脊神经根和马尾神经而引起腰部疼痛伴双下肢疼痛、麻木的一系列证候群[1]。LDH是脊柱外科的常见病和多发病,也是引起腰腿痛的最主要原因,随着人们生活方式和社会节奏的改变,LDH 的发病率不断上升且呈年轻化态势。Jordon 等[2]报道LDH 在普通人群中的发病率为1%~3%,以20~50 岁的人群患病率最高。Matsumoto等[3]发现人体椎间盘自20 岁开始出现蛋白多糖含量下降、髓核水分丢失、弹性纤维密度降低,并出现裂隙和不规则空洞等退变。LDH 后期出现的慢性疼痛、脊柱畸形、马尾综合征等严重影响人们的生活质量与工作能力,给家庭和社会带来沉重的负担[4]。
慢性腰腿痛是LDH 患者就医的最主要原因之一,缓解疼痛是患者最主要的诉求。目前LDH 的治疗方法主要有保守治疗和手术治疗这两大疗法。保守治疗因无法从根本上解除致病因素而易致症状反复,迁延难愈。手术治疗因对脊柱结构破坏和巨大的心理创伤而不易被患者接受。无论是保守治疗还是手术治疗,远期疗效都不尽人意。究其原因,可能与LDH 疼痛机制尚未完全阐明有很大关系。目前人们普遍接受的LDH 疼痛机制主要有:机械压迫机制、炎症化学刺激机制、自身免疫反应机制。然而这3大机制不能完全解释LDH 的所有临床表现,现有的针对这3种机制的治疗方法也缺乏有效的响应。因此,研究LDH 致痛机制,寻找治疗LDH 的新途径和新靶点,切实提高临床疗效,具有深远的临床意义和社会价值。
近年来,随着脑形态学检测和脑功能成像技术的进步,大脑在疼痛中的作用日益受到重视。有研究发现慢性痛患者的大脑存在多个脑区的异常激活和功能连接的改变,甚至结构的改变[5‐9]。基于体素的磁共振形态测量学(Voxel‐based Magnetic Resonance Morphometry, VBM)是使用最广泛的方法,VBM是以体素为基础的局部容积测量方法,是目前磁共振在脑形态学测量上的最主要应用手段之一,经过计算机后处理及对影像资料特殊分析以后,对于发现普通磁共振难以发现的慢性疼痛的脑形态及结构的变化具有重要价值[10]。VBM已广泛应用于阿尔茨海默病、特发性全身性癫痫、注意力缺陷多动症、精神分裂症、帕金森病等领域的研究,同时VBM对于三叉神经痛、偏头痛、带状孢疹后神经痛、膝骨性关节炎、慢性腰背痛等慢性疼痛的研究也屡见不鲜;但关于LDH 慢性下肢痛的VBM 研究尚不多见。本研究基于VBM 分析了LDH 慢性下肢痛模型大鼠脑结构及形态改变的相关性及特点,揭示了LDH 慢性下肢痛的脑机制。
1 方法
1.1 实验动物及分组
选用SD雄性大鼠24只,6~8周龄,体质量(250±20)g,由南京医科大学医药实验动物中心提供,动物合格证:SCXK(苏)2011‐0003。实验伦理编号:1ACUC‐1905020。按照随机数字表法分为正常组(Normal组)、假手术组(Sham‐LDH 组)、模型组(LDH 组),每组8只。
1.2 主要仪器和试剂
电子VonFrey 测痛仪(美国IITC Life Science 公司)、热板痛觉测试仪(美国IITC Life Science 公司)、7.0 T 动物专用核磁(德国Bruker 公司)、大鼠麻醉机(北京友诚生物科技有限公司)、电子天平等;异氟烷。
1.3 LDH组及Sham‐LDH组模型建立
参照Shamji等[11]采用自体髓核移植法建立LDH慢性下肢痛模型大鼠。以5%水合氯醛(40 mg∙kg‐1)腹腔内注射麻醉。麻醉生效后,剃毛器剔除大鼠尾椎至腰椎毛发,范围约5 cm×4 cm,取俯卧位固定于解剖台上,碘伏棉球以L4~L6 为中心皮肤消毒3 遍,取后正中纵行切口约2.5 cm,止血钳轻提棘突旁肌肉,切开皮肤,自棘突右侧用组织剪逐层分离皮肤、筋膜层、肌肉层,眼科镊清理椎旁肌肉组织,充分暴露L5 右侧椎板及乳状突,弯头止血钳侵蚀法咬除L5右侧椎板、横突及乳状突,暴露硬膜外腔及L5 神经根,眼科镊轻触L5 神经根诱发出右下肢神经痛体征后,湿盐水纱布块填盖切口。快速在距离大鼠肛门1 cm处断尾,使用3‐0 尼龙缝线单层闭合尾部切口,依次切开髓核环,取出3 个尾椎髓核放置于刮匙中备用。再将取出的尾椎髓核压迫于L5 神经根侧方,逐层缝合。Sham‐LDH 组仅暴露至硬膜外腔及L5 神经根处,不断尾,不放入髓核,逐层缝合切口。
1.4 疼痛行为学测定
1.4.1 机械痛阈值检测检测方法参照Cunha 等[12]采用的方法进行。分别于建模前和建模后第2、7、14、21、28 天共6 个时间点检测。将大鼠置于电子VonFrey测痛仪的半透明有机玻璃箱中,底为0.5 cm×0.5 cm 孔径铁丝网,实验前适应15 min,然后用刚性测试头刺激大鼠右足底中部,大鼠出现缩足、舔足行为即为阳性反应,记录阳性反应读数为机械缩足反射阈值(Mechanical Withdrawal Threshold,MWT),每只大鼠同一时间点测量5 次,每次测量间隔5 min,去掉1个最高值和1个最低值,取其平均值。
1.4.2 热痛阈值检测检测方法参照Hargreaves 等[13]采用的方法进行。分别于建模前和建模后第2、7、14、21、28 天共6 个时间点检测。设置热板痛觉测试仪的恒定温度为49 ℃,将大鼠放置于热板痛觉测试仪的半透明有机玻璃箱中,开启记时按钮,大鼠出现抬足、逃避、舔足视为阳性反应,记录开始至出现阳性反应的时间为热缩足反射潜伏期(Thermal Withdrawal Latency,TWL),截至时间为30 s,避免大鼠热损伤。每只大鼠同一时间点测量5次,每次测量间隔5 min,去掉1 个最高值和1 个最低值,取其平均值。
1.5 VBM图像采集
大鼠采用吸入性异氟烷混合气体麻醉的方式,待麻醉生效后通过调节大鼠头部固定器的活动齿杆和耳杆将大鼠放置并固定于磁共振立体定位平台上,之后以0.1 mg/kg∙h‐1维持麻醉,保持动物处于镇静状态。应用生理测量仪监测其生命体征,呼吸频率保持在40~50 次/min,维持在生理状态下。应用Bruker公司7.0 T动物MRI扫描仪进行检查,选用20 cm的梯度线圈。扫描参数如下:体素大小(0.5×0.5×0.5)mm3,TE=15 ms,TR=2 s,层厚=1 mm,层数=50,阵大小64×64,FOV=(3×3)cm2,使用GE EPI 序列。T2加权结构像采集使用MDEFT序列。
1.6 统计学分析
本研究所得数据均采用SPSS 25.0软件进行统计学描述和推断,其中服从正态分布的计量资料采用均值±标准差表示,完全随机设计组间比较采用单因素方差分析,重复测量设计组间比较采用重复测量方差分析,存在交互作用时采用简单效应分析,并采用GraphPad Prism7 软件进行作图,以P<0.05 为差异具有统计学意义。影像学数据采用重复测量方差分析,存在交互作用时采用事后检验分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 3组大鼠基线资料比较
3 组大鼠间体质量和鼠龄比较差异均无统计学意义(P>0.05),提示具有可比性。详见表1。
表1 3组大鼠基线资料比较(± s)Tab.1 Comparison of baseline data among 3 groups of rats(Mean±SD)
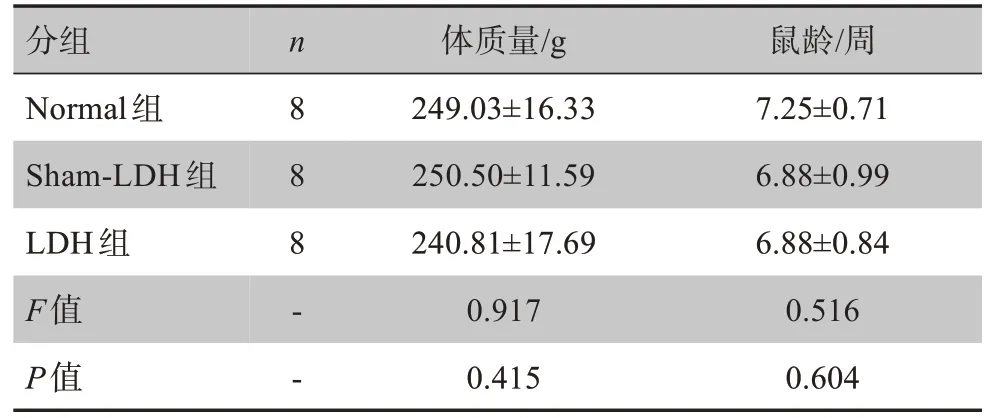
表1 3组大鼠基线资料比较(± s)Tab.1 Comparison of baseline data among 3 groups of rats(Mean±SD)
分组n 体质量/g 鼠龄/周Normal组Sham‐LDH组LDH组F值P值8 88‐‐249.03±16.33 250.50±11.59 240.81±17.69 0.917 0.415 7.25±0.71 6.88±0.99 6.88±0.84 0.516 0.604
2.2 3组大鼠不同时间点MWT比较
经重复测量方差分析,结果通过Mauchly球形度检验(P=0.152)。采用球形度检验结果,因分组与时间点存在交互作用(F组别×时点=43.488,P<0.001),所以再采用简单效应进行分析。详细结果见表2。其中,F组别/F时点代表组别和时间点两个因变量经过重复测量方差分析的峰值,即F值;P组别/P时点代表组别和时间点两个因变量经过重复测量方差分析的Sig.值,即P值。
表2 3组大鼠不同时点MWT比较(± s)Tab.2 Comparison of mechanical withdrawal threshold in 3 groups of rats at different time points(Mean±SD)

表2 3组大鼠不同时点MWT比较(± s)Tab.2 Comparison of mechanical withdrawal threshold in 3 groups of rats at different time points(Mean±SD)
a表示与LDH组比较,差异具有统计学意义,P<0.05
时间点建模前建模后第2天建模后第7天建模后第14天建模后第21天建模后第28天Normal组38.72±4.83 38.24±2.84a 38.04±2.68a 38.44±1.62a 38.03±2.81a 38.37±2.05a Sham‐LDH组37.96±3.85 34.89±2.04a 35.75±2.17a 36.32±2.55a 37.85±2.63a 38.09±2.12a F组别/F时点P组别/P时点LDH组39.63±2.63 30.31±4.53 18.63±1.89 11.88±1.88 11.45±1.22 11.58±3.67 1 044.772/43.092<0.001/<0.001
3组大鼠建模前MWT比较,差异无统计学意义(P>0.05);Sham‐LDH组大鼠MWT建模后第2、7、14、21、28天分别与Normal组大鼠比较,差异无统计学意义(P>0.05);LDH组大鼠MWT从建模后第2天至第14天显著降低,建模后第14天至28天,MWT稳定;LDH组大鼠MWT建模后第2、7、14、21、28 天分别与Normal 组大鼠和Sham‐LDH 组大鼠比较,差异有统计学意义(P<0.05)。
2.3 3组大鼠不同时间点TWL比较
经重复测量方差分析,结果通过Mauchly球形度检验(P=0.263)。采用球形度检验结果,因分组与时间点存在交互作用(F组别×时点=18.966,P<0.001),所以再采用简单效应进行分析。详细结果见表3。可见TWL分析结果与MWT分析结果相似。
表3 3组大鼠不同时点TWL比较(± s)Tab.3 Comparison of thermal withdrawal latency in 3 groups of rats at天ifferent time points(Mean±SD)

表3 3组大鼠不同时点TWL比较(± s)Tab.3 Comparison of thermal withdrawal latency in 3 groups of rats at天ifferent time points(Mean±SD)
a表示与LDH组比较,差异具有统计学意义,P<0.05
时间点建模前建模后第2天建模后第7天建模后第14天建模后第21天建模后第28天Normal组18.78±2.52 17.89±1.49a 18.09±1.28a 18.64±1.96a 18.34±1.27a 18.06±2.13a Sham‐LDH组18.93±2.32 16.04±2.49a 16.58±1.71a 17.58±0.86a 17.81±2.52a 17.86±1.20a LDH组18.58±1.96 12.02±1.58 8.62±1.41 5.91±1.24 6.11±1.43 6.03±1.03 F组别/F时点P组别/P时点595.871/24.632<0.001/<0.001
2.4 3组大鼠不同时间点VBM比较
3 组大鼠不同时间点脑结构区域比较存在交互作用,差异具有统计学意义(P<0.05)。本研究结果显示灰质体积减少的脑区有左下丘脑、左海马下托、右次级运动皮层、右纹状体、右隔区、右海马、双侧小脑分子层、胼胝体及双侧皮质下灰质。详细结果见表4和图1。

图1 3组大鼠不同时间点灰质体积减少的脑区域图Fig.1 Brain regions of gray matter volume decreasing at different time points in 3 groups of rats

表4 3组大鼠不同时间点灰质体积减少的脑区报告Tab.4 Report on brain regions of gray matter volume decreasing at different time points in 3 groups of rats
3 讨论
3.1 动物模型的意义与疼痛机制评价
LDH 疼痛机制的研究与动物模型的成功建立密不可分。Mixter 等[14]于1934年提出椎间盘纤维环破、髓核组织突入椎管刺激和压迫神经根引起的慢性下肢痛是LDH 引起疼痛的神经解剖学基础,形成了LDH 致痛机制学说之一的机械压迫机制。对小鼠、大鼠、兔、狗、绵羊、猪等多种动物实现机械压迫机制理论指导的LDH 模型建立均获得成功复制[15]。然而临床实例证明机械压迫机制并不是LDH 慢性疼痛产生的唯一机制。相当一部分病例影像学提示有明显的LDH 但并未产生下肢神经根症状,也有一部分病例影像学未见椎间盘突出神经根造成压迫的征象却产生严重的下肢根性痛。正常髓核组织位于纤维环和终板之间,闭合系统内呈液体胶冻状形态,无血液供应,其主要营养物质来源依赖于终板的弥散功能,因此基于椎间盘特殊的解剖结构,认为突出椎间盘具有自身免疫作用,当髓核与盘外组织接触时引起连锁的体液免疫反应和细胞免疫反应[16‐17]。此外Shamash 等[18]报道椎间盘组织可自身分泌炎性细胞因子如TNF‐α、IL‐1α/β、IL‐6 和IL‐17 等,这些炎性细胞因子促进椎间盘内有效生化成分降解,趋化因子产生和细胞形态改变[19]。国内外学者采用物理方式诱导、化学方式诱导、基因修饰技术等多种手段实现以炎症化学刺激和自身免疫反应为理论基础的建模方法[20‐21]。为更好地模拟临床中椎间盘源性诱发慢性下肢痛的产生及疼痛的维持,更贴近临床中LDH 的病理形式,本实验采用机械压迫与炎性刺激共存的致痛机制,通过大鼠自体髓核移植法,将大鼠自体尾椎髓核直接移植压迫于L5 神经根,有效的动物模型成为研究LDH 慢性疼痛发生机制及脑功能改变的基础与保证。
3.2 动物模型的验证与评估
对神经根直接压迫和尾椎髓核组织所分泌的炎性细胞因子对大鼠背根神经节造成炎性浸润的双重致痛效果。使得LDH 组大鼠在术后产生一个长时程的MWT 和TWL 的降低,即出现了痛觉过敏,造模成功。有研究发现背根神经节造成的机械压迫对动物模型的机械痛觉与热痛觉均会产生影响,痛觉过敏的产生时间的迟早和维持时程的长短与动物类型的选择、手术方式和术后干预手段联系密切[22‐23];也有文献报道,机械痛觉过敏和热痛觉过敏有时并非同时存在[24]。本研究中的结果与多数研究者证实的机械痛阈值和热痛阈值均下降并疼痛持续产生相一致。Kawakami 等[25]发现采用自体髓核移植方法但对硬膜外腔及神经根不造成压迫的情况下同样会诱发机械痛阈值和热痛阈值降低。痛觉过敏作为神经损伤后的特征,弱刺激通过有髓鞘的粗神经纤维上低阈值感受器诱发强烈疼痛,通过测量疼痛的阈值来间接量化疼痛的程度。综上,本实验通过自体髓核移植法建立的LDH 慢性下肢痛大鼠模型在建模后产生了长时程的痛觉过敏现象,这与临床上LDH 慢性下肢痛患者的表现和疼痛发生的病理形式相符合,并且疼痛行为学检测进一步验证模型的可行性,另外大鼠能耐受手术创伤,模型具有很好的可复制性。
3.3 VBM结果分析
利用VBM 脑形态学分析显示,3 组大鼠不同时间点脑结构区域比较存在交互作用,差异具有统计学意义(P<0.05)。脑图结果显示灰质体积(Gray Matter Volume, GMV)减少的脑区有左下丘脑、左海马下托、右次级运动皮层、右纹状体、右隔区、右海马、双侧小脑分子层、胼胝体及双侧皮质下灰质。纹状体是大脑基底神经节之一,是锥体外系的组成部分,主要的机能是调节肌肉张力、协调各种精细复杂的运动。大量的证据表明,基底神经节独特参与丘脑‐皮质‐基底神经节回路以整合慢性疼痛对于运动、情绪、自主神经和认知反应等方面的痛觉信息[26]。次级运动皮层的损伤或者失活会导致运动或运动学习过程产生障碍,但并不会影响机体的基本运动机能[27]。但Bishop 等[28]认为慢性骨骼肌疼痛是一种影响中枢神经系统结构的疾病,该团队使用VBM 及牛津大学脑功能磁共振结构神经成像技术(FMRIB's Software Library, FSL)确定慢性骨骼肌疼痛患者外侧前额叶皮层以及次级运动皮层GMV 减少。海马是介导疼痛应激反应的重要脑区,慢性疼痛可使海马出现细胞数目减少、细胞萎缩、体积减小等多种神经元可塑性受损的表现,同时伴随抑郁、焦虑等情绪[29]。Jia 等[30]基于VBM 研究雄性大鼠偏头痛引起的结构性脑部改变,发现在海马、胼胝体、基底节及感觉皮层等区域的GMV 减少。大量研究证实慢性疼痛可导致大脑区域形态或结构改变,这对疼痛的感知和加工至关重要。疼痛不仅被理解为功能状态的改变,而且还被理解为中枢神经系统可塑性的结果。因此,LDH 慢性下肢痛作为慢性疼痛的一种,会导致LDH 模型大鼠脑部特定区域灰质的改变,本研究可望能初步阐明LDH 慢性痛脑部形态学改变,揭示LDH慢性痛的脑机制,发现治疗新靶点。

