白头翁皂苷D白蛋白纳米粒制备及初步质量评价
★ 王凯艳 饶小勇, 杨婧 周冠芮 罗晓健, 张尧(.江西中医药大学 南昌 330004;.中药固体制剂制造技术国家工程研究中心 南昌 330006)
白头翁皂苷D是从药材白头翁(Pulsatilla cheninsis(Bge.)Regel)中分离得到的一种具有抗肿瘤作用的化学成分,对肺癌、黑色素瘤及乳腺癌等表现较强的作用[1-2]。白头翁皂苷D[3-4]是一种皂苷类化学成分,表现出皂苷类成分溶血通性,此外,前期研究结果表明其在水中溶解度较小,从而限制了发展成新药,因此,亟需通过制剂手段改善溶解性、降低溶血性,提高其成药性。
白蛋白因具有生物相容性好、生物可降解、生物利用度高等特点,已经成为一种较好的载药材料[5]。随着紫杉醇白蛋白纳米粒(商品名: Abraxane)在临床上成功应用,白蛋白纳米制剂已成为药物制剂的研究热点,解决了众多天然活性成分存在的溶解性差、生物利用度低等问题[6-7],提高了该类成分的成药性,为临床用药扩大提供了可能,此外,白蛋白纳米制剂由于缓释作用可以改善化学成分的溶血性[8]。因此,本文在白头翁皂苷D与白蛋白表现较强的结合作用前提下[9],以牛血清白蛋白为载体材料,将白头翁皂苷D研制成白蛋白纳米粒,为其成药性提供一种新的有效策略。
1 仪器与试药
1.1 仪器Agilent 1260 Series高效液相色谱仪(美国Agilent公司,包括四元泵、自动进样器、DAD检测器、色谱工作站),MSA6.6S-CE型1/100万电子分析天平(SARTORIUS),AB204-S型1/10万电子分析天平( METTLER TOLEDO),RO10多点磁力搅拌器(德国IKA仪器设备有限公司),BT100-2J蠕动泵驱动器(兰格恒流泵有限公司),ZEN3690纳米激光粒度仪(英国马尔文仪器有限公司),HC-3018R高速冷冻离心机(安徽中科中佳科学仪器有限公司),Milli-Q纯水处理系统(美国MILLIPORE公司),Tecnai Spirit 120kV 透射电子显微镜(美国FEI公司)。
1.2 试药白头翁皂苷D原料药(江西本草天工科技有限责任公司,批号20171011,纯度>90 %),白头翁皂苷D对照品(中药固体制剂制造技术国家工程研究中心对照品室提供,纯度>99 %),牛血清白蛋白(上海罗氏制药有限公司,纯度≥98%),甲醇为色谱纯Fisher Scientific(NJ,USA),其他试剂均为分析纯,水为纯化水。
2 实验方法
2.1 白头翁皂苷D白蛋白纳米粒的制备称取牛血清白蛋白200 mg,溶于5 mL纯化水中,作为水相。称取白头翁皂苷D原料15 mg,溶于4 mL有机溶剂中,作为有机相。取水相置磁力搅拌器上,设置搅拌速度为500 r·min-1,另取有机相以1 mL·min-1速度滴加至水相中,溶液形成乳白色胶状混悬液。在相同搅拌的条件下,滴加2.5 %戊二醛200 μL,交联固化12 h,即得白头翁皂苷D白蛋白纳米粒 混悬液。
2.2 白蛋白纳米粒白头翁皂苷D含量的测定
2.2.1 色谱条件采用煊美赛铂思SHARPSIL-U C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为甲醇-水-甲酸(75∶25∶0.1),检测波长为203 nm,流速为1.0 mL·min-1,柱温为30 ℃,进样量为10 μL。
2.2.2 供试品的制备
2.2.2.1 对照品溶液的制备取白头翁皂苷D约6 mg,精密称定,置10 mL量瓶中,加甲醇溶解,稀释至刻度,即得浓度为0.601 mg·mL-1对照品溶液,备用。
2.2.2.2 空白白蛋白纳米粒待测样品的制备称取牛血清白蛋白200 mg置烧杯中,用5 mL纯化水溶解,置磁力搅拌器上,设置搅拌速度为500 r·min-1。另取无水乙醇4 mL,以1 mL·min-1的速率滴加至白蛋白溶液,在继续搅拌的条件下,滴加180 μL的2.5 %戊二醛溶液,搅拌固化12 h,即得空白白蛋白纳米粒溶液。取空白白蛋白纳米粒2.0 mL,置超高速离心管中,离心1 h(4℃,12 000 r·min-1),取上清液即为空白白蛋白纳米粒待测溶液。
2.2.2.3 载药白蛋白纳米粒上清液样品的制备取白头翁皂苷D白蛋白纳米粒2.0 mL,置超高速离心管中,离心1 h(4 ℃,12 000 r·min-1),即为载药白蛋白纳米粒上清液待测溶液。
2.2.3 专属性试验取对照品溶液、空白白蛋白纳米粒待测溶液及载药白蛋白纳米粒上清液待测溶液,分别进样,结果见图1-3。由图可知,白蛋白对载药待测溶液含量测定无干扰。
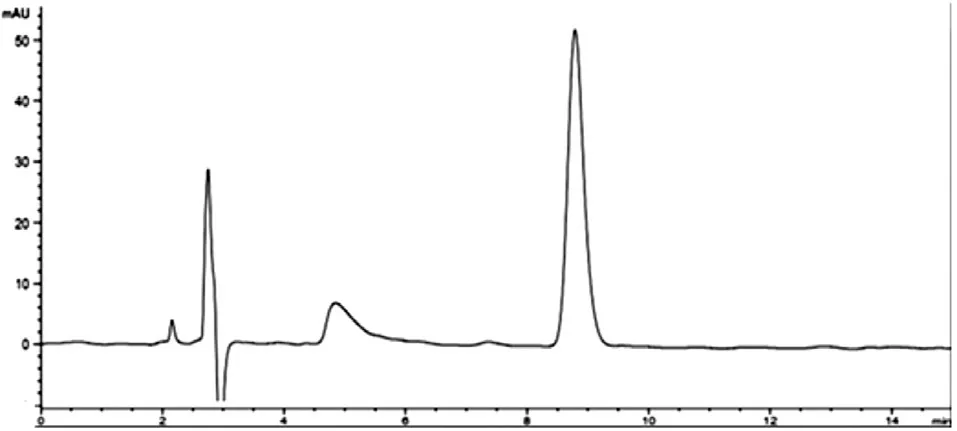
图1 对照品溶液色谱图

图2 空白白蛋白纳米粒待测溶液色谱图
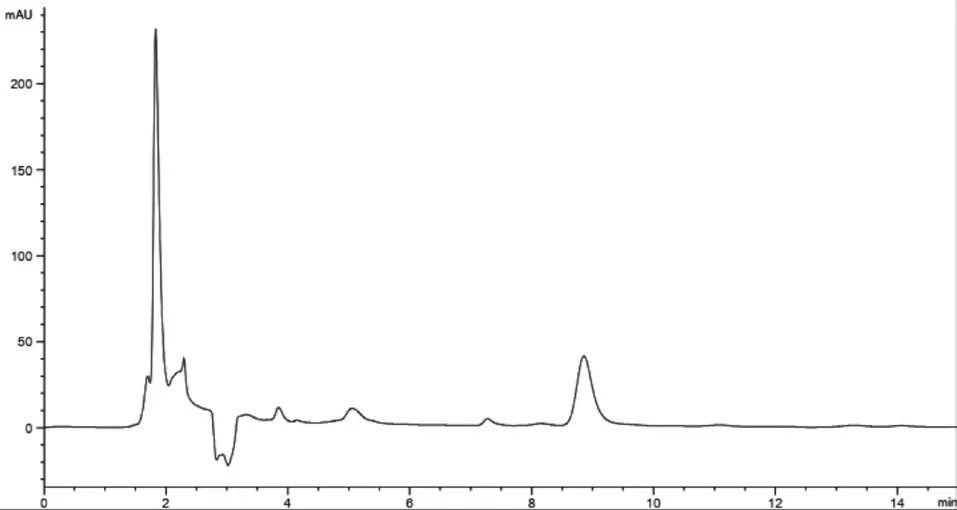
图3 载药白蛋白纳米粒待测溶液色谱图
2.2.4 线性关系考察取对照品溶液储备液,加甲醇分别稀释至浓度为0.060 1、0.120 2、0.300 5、0.601、0.901 5 mg·mL-1。取稀释后的各对照品溶液和对照品储备液,进样,记录峰面积。以浓度为X、峰面积为Y,绘制标准曲线,得标准曲线为Y= 3 243.4X+12.212,相关系数为0.999 9。由相关系数可知白头翁皂苷D在浓度0.060 1-1.202 mg·mL-1之间呈良好线性关系。
2.2.5 精密度试验取对照品溶液,按确定色谱条件,连续进样6次,记录峰面积,计算RSD为0.36 %,由结果说明测定方法仪器精密度良好。
2.2.6 重复性试验取同一份白蛋白纳米粒混悬液,取其中2.0 mL,共6份,置超高速离心管中,离心1 h(4 ℃,12 000 r·min-1),按确定的色谱条件进样,记录峰面积,计算RSD为2.07 %,由结果说明溶液处理重现性较好。
2.2.7 稳定性试验取载药白蛋白纳米粒待测溶液1份,分别于0、1、2、3、6、12 h进样,记录峰面积,计算RSD为0.81 %,由结果表明待测上清液在12 h内是稳定的。
2.2.8 加样回收率试验取已知含量的载药白蛋白纳米粒待测上清溶液共9份,按其含量的80、100、120 %加入白头翁皂苷对照品溶液,混合均匀,依照确定液相条件测定混合液的含量,按公式:加样回收率=(测定总量-加入量)/已知量×100 %计算,方法的回收率在96.42-101.25 %范围内,说明该方法准确度良好。
2.3 纳米粒表征指标的测定
2.3.1 纳米粒粒径及多分散系数(PDI)的测定方法采用激光粒度测定仪测定白蛋白纳米粒的平均粒径大小、分布范围及多分散性。取适量白蛋白纳米粒均匀分散在纯化水中,置于样品皿中,进行测定。每份样品测定重复3次。
2.3.2 纳米粒包封率和载药量的测定采用超高速离心法测定白头翁皂苷D白蛋白纳米粒的包封率和载药量。取白头翁皂苷D白蛋白纳米粒混悬液2.0 mL,置超高速离心管中,离心1h(4 ℃,12 000 r·min-1),取上清液,按照“2.2”项下含量测定方法测定,计算出白头翁皂苷D白蛋白纳米粒中游离的白头翁皂苷D量,依据如下公式分别计算出纳米粒载药量和包封率,取其平均值。

2.4 纳米粒制备影响因素的考察
2.4.1 有机相溶剂的考察有文献[10]报道溶剂的极性对蛋白质的乳化特性和界面构象会产生一定的影响。因此,考察不同有机溶剂(70 %甲醇、70 %乙醇、甲醇∶二氯甲烷、乙醇∶二氯甲烷)对纳米粒的影响。结果见表1。
由表1可知,不同的有机溶剂对白蛋白纳米粒的粒径和多分散系数均有一定影响。纳米粒要求粒径越小越好,多分散系数越小越好,综合粒径大小和多分散系数考虑,当乙醇∶二氯甲烷=5∶1为有机相溶剂时可以获得纳米粒目标粒径。
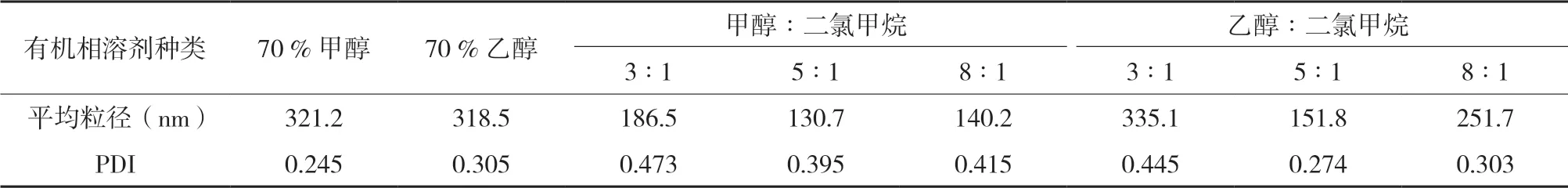
表1 有机溶剂对纳米粒特性的影响
2.4.2 有机相用量的考察考察有机相用量1.5、2.0、2.5、3.0 mL的乙醇∶二氯甲烷(5∶1)对白蛋白纳米粒的影响,结果见表2。
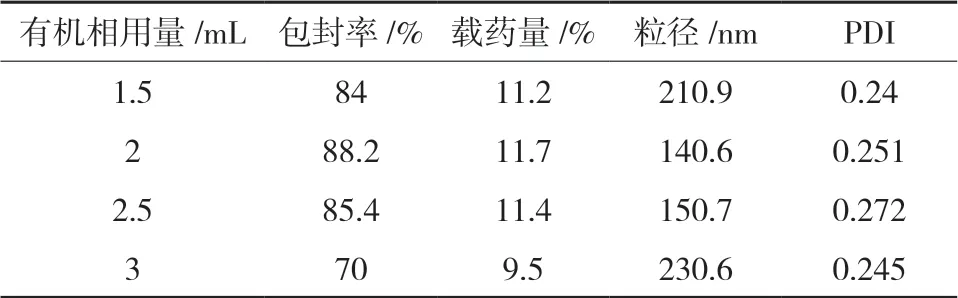
表2 有机相用量对纳米粒特性的影响
由表2可知,有机相用量对包封率、载药量、和PDI影响不大,但对粒径大小有影响,所考察有机相溶剂用量均能满足目标粒径要求,考虑有机溶剂中二氯甲烷存在安全性问题,初步选择有机相用量1.5 mL。
2.4.3 交联剂用量的考察有文献报道[11]交联剂戊二醛对蛋白微观形态与性能均会产生一定的影响。考察交联剂戊二醛对白蛋白纳米粒的影响,结果见表3。
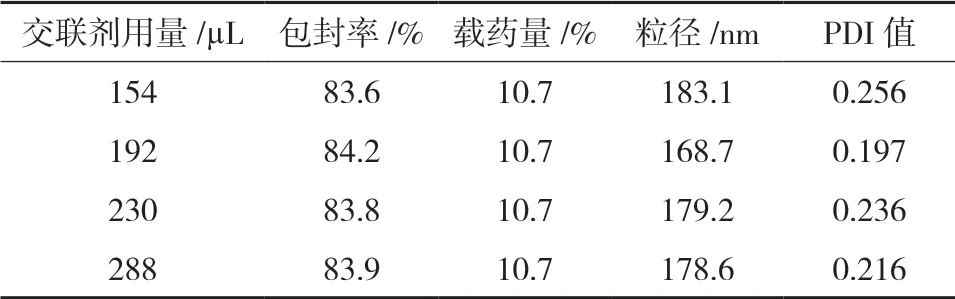
表3 交联剂用量对纳米粒特性的影响
由表2-5可知,交联剂用量对白蛋白纳米粒的包封率和载药量以及粒径的影响均较小,说明戊二醛在154-280 μL范围之内均可获得所需目标产品。
2.4.4 交联时间的考察考察不同交联时间3、6、9和12 h对白蛋白纳米粒的影响,结果见表4。
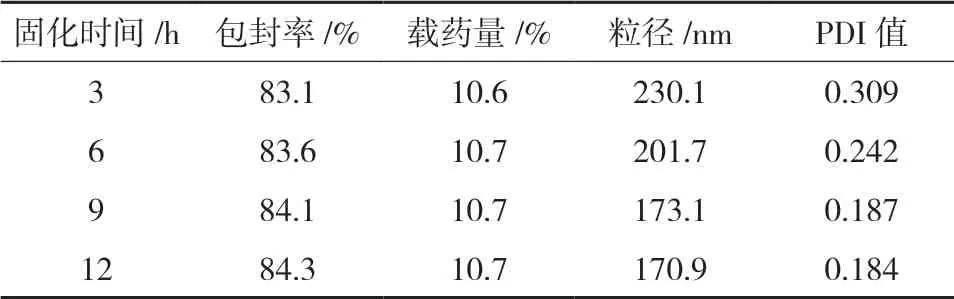
表4 交联时间对纳米粒特性的影响
由表4可知,随着交联时间的延长,对纳米粒的包封率和载药量几乎没有影响。但对粒径大小和PDI有影响,当交联时间达到9 h后其平均粒径与PDI均没有变化,说明交联时间9 h后基本达到稳态。
2.5 制备方法的优化根据单因素影响考察结果,选择白蛋白的浓度、投药量、有机相用量作为制剂的重要因素。采用Box-Behnken效应面法进一步优化,考察白蛋白用量(A)、有机相用量(B)、白头翁皂苷D用量(C)对纳米粒性质的影响,以包封率(Y1,EE/%)、粒径(Y2,Size/d.nm)和多分散性指数(Y3,PDI)为评价指标,以粒径(Y2)和多分散性指数(Y3)两个指标按标准化的0~1之间的“归一值”,各指标“归一值”求算术平均数,得总评“归一值”(overall desirability,OD)为评价指标,计算为OD=(d1×d2×d3……dk)1/k进行计算(k为指标数)[12]。对于粒径(Y2)和多分散性指数(Y3)两个指标值越小越好,选用di=(Ymax-Yi)/(Ymax-Ymin)。利用Design-Expert 8.0.6软件进行3因素3水平的Box-Behnken设计及效应面优化白头翁皂苷D白蛋白纳米粒制备方法。因素水平见表5,试验安排和结果见表6。

表5 Box-Behnken 设计因素水平
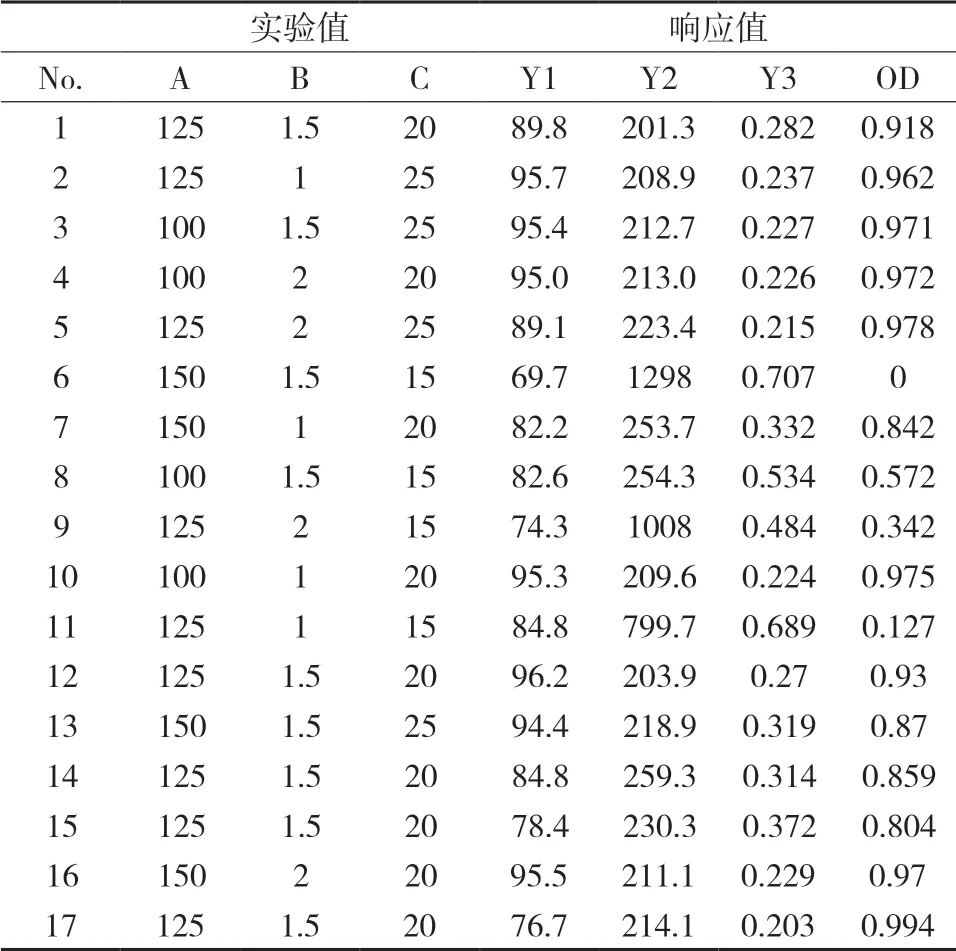
表6 Box-Behnken 试验设计表及结果值
2.5.1 方差分析和显著性的检验采用Design-Expert 8.0.6软件处理表6中所得实验数据,以包封率、粒径和多分散性指数为指标分别对各影响因素进行数学模型拟合,得Y1=87.05-3.31A-0.51B+7.90C(R2=0.492 7,P=0.027 6),Y2=221.78+136.51A+ 22.95B-312.01C-11.50AB-259.38AC-48.45BC-31.98A2+32.05B2-306.17C2(R2=0.917 2,P=0.004 8),Y3=0.29+0.047A-0.041B-0.18C-0.026AB-0.020AC+0.046BC+ 2.525E-003A2-0.038B2+0.16C2(R2=0.951 7,P=0.000 8),由拟合结果可知,包封率尽管P值有显著性,但其相关系数R2拟合度不高,所以没有做响应值预测。粒径和多分散性指数均体现出显著性和良好的相关性,所以采用两者的OD值为因变量,以白蛋白用量(A)、有机相用量(B)、白头翁皂苷D用量(C)为自变量,进行多元线性回归和二次多项式拟合,得多元二次回归方程OD=0.90-0.10A+0.044B+0.34C+0.033AB+0.12AC-0.050BC+0.020A2+0.019B2-0.32C2(R2=0.960 1,P=0.000 4),由R2和P值可知二项式模型具有较好的统计学意义,可信度较高可用作分析预测模型。并采用Design-Expert 8.0.6软件对OD值进行方差分析,结果见表7。
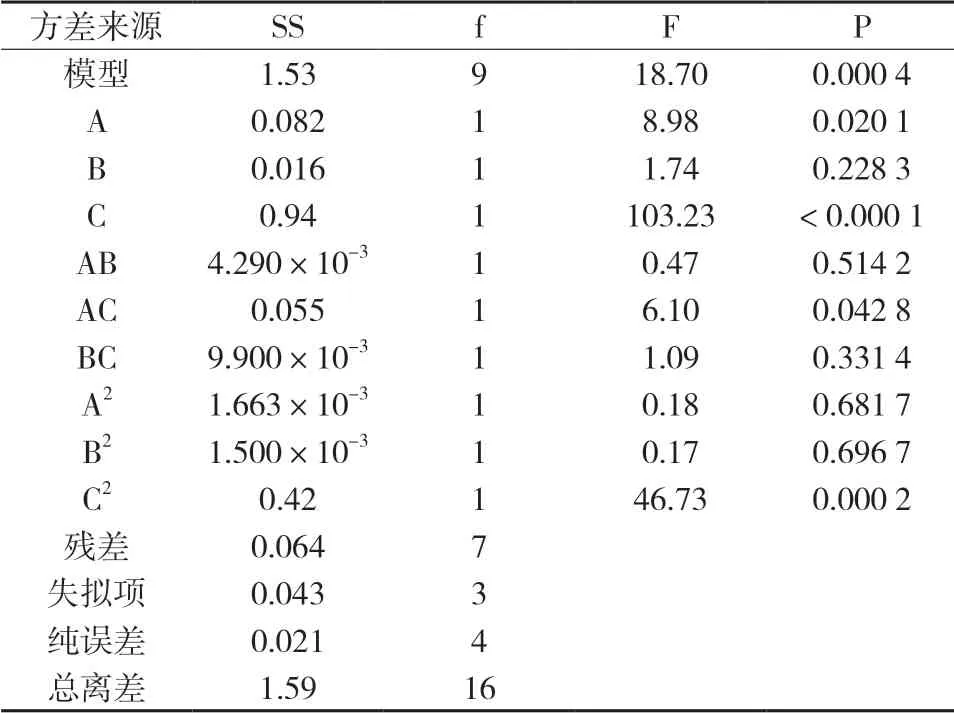
表7 OD回归方程的方差分析
由表7可知,各自变量对OD影响排序为C>A>B;交互项AB和BC对OD均影响不显著,AC对OD的影响显著;二次项A2和B2对OD的影响不显著,C2对OD的影响显著。
2.5.2 效应面分析为了更加了解各个自变量之间的影响及其对因变量的影响。依据回归方程绘制了三维效应面图,见图4。
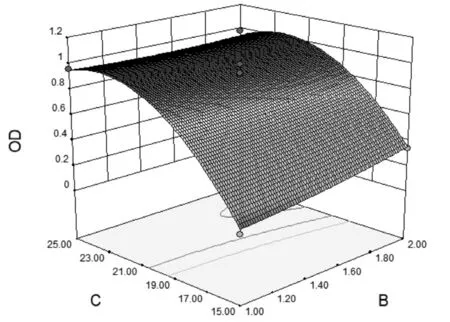
图4 各因素交互作用的效应面图

由图4可知,白头翁皂苷D的用量对OD值影响最大,其次为白蛋白用量,最小为有机相用量;在一定范围内,随着白头翁皂苷D用量减小,OD值急剧减小,表现曲面较陡;在一定范围内,随着白蛋白用量和有机相用量减小,OD值有减小趋势,表现曲面平缓。
2.5.3 最优处方的预测与验证利用Design-Expert 8.0.6软件对数据进行分析,得最佳处方为白蛋白用量为100 mg,有机相用量1 mL,白头翁皂苷D用量为22.78 mg。按最优处方平行制备3批白蛋白纳米粒,分别测定其粒径和包封率,结果见表8。

表8 最佳实验条件的验证
由表8可知,实测值和模型预测值都比较接近,表明模型的预测性良好。
2.6 纳米粒的质量初步表征
2.6.1 形貌的表征取少量纳米粒混悬液,加入注射用水稀释,取稀释液滴加到碳作为支持膜的铜网上,滴样时要防止铜网翻转,静置数分钟,用滤纸从铜网边缘吸去多余的液体。用2 %磷钨酸溶液(1 mol·L-1氢氧化钠调至pH=7.0)进行染色,染色2 min用滤纸吸去染色液,自然晾干。在透射电镜下观察白头翁皂苷D白蛋白纳米粒的微观结构,并拍摄电镜照片如图5(B)。由透射电镜图可知,纳米粒呈类球形,大小较均一,粒子之间没有黏连的现象,分散性良好。

图5 白头翁皂苷D白蛋白纳米粒形貌图(A实物,B透射电镜图)
2.6.2 粒径大小及分布的测定采用纳米激光粒度仪测定白蛋白纳米粒的粒径大小、分布范围及多分散性。结果见6。由图可知,白头翁皂苷D白蛋白粒径主要分布比较集中,且粒径大小为200 nm左右。
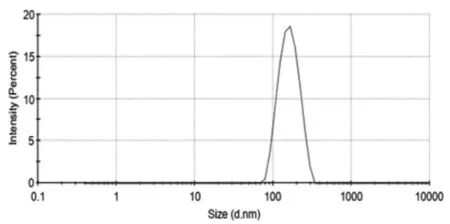
图6 白头翁皂苷D白蛋白纳米粒的粒径分布
2.6.3 载药量和包封率的测定按确定的工艺和处方制备3批次白头翁皂苷D白蛋白纳米粒,测定产品的载药量和包封率。结果见表9。
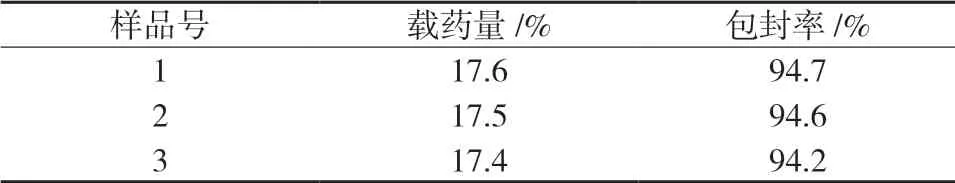
表9 纳米粒的载药量和包封率的测定
由表9可知,所制备的3批纳米粒的载药量和包封率接近,不存在明显差异,表明确定的制备工艺稳定。
3 讨论与结论
白蛋白纳米粒常用的制备方法有去溶剂化法、乳化固化法、高压均质法等[13],本文采用了常用的去溶剂化法,研究表明该方法可以满足实验需求。在制备预试过程中发现溶解白蛋白的水选择很重要,采用自来水和生理盐水溶解白蛋白后采用去溶剂制备纳米粒时,混悬液易凝聚成团,粒径过大,现象与F.Galisteo-Gonzáleza[14]研究相类似,可能是自来水与生理盐水中pH值和离子等的影响,所以最终确定采用纯化水为水相溶剂。
制备过程中药物加入方式通过蠕动泵加入,以恒定速度有效防止加入速度对纳米粒的影响,并对输药管道采用药液先饱和输送管道的吸附性,以提高加药量的准确性。通过预试验和单因素考察,确定了制备过程关键影响因素为白蛋白用量、有机相用量以及投药量,采用了Box-Behnken效应面法评价了各因素对包封率、粒径大小及分布的影响,绘制了各因素变化的效应曲面图,利用Design-Expert 8.0.6软件对数据进行分析获得了最佳制备方式,建立了预测性良好的数学模型,该方法较常用的正交试验优化法更直接、准确度更好。
本文建立了稳定、重现性好的白蛋白纳米粒中白头翁皂苷D的含量测定方法,为制剂载药量和包封率的测定奠定了坚实基础。通过对白头翁皂苷D白蛋白纳米制剂成型较为系统的研究,获得稳定、载药量高的纳粒制剂,虽然为白头翁皂苷D临床应用提供了新策略,但该制剂在体内安全性和体内变化情况还有待于深入研究。

