牛源复合微生态制剂的应用效果评价
赵 杰 徐静茹 马 立 陈佳雯 谢 昕 李璐鑫 杨克礼 冯士彬 李 玉 吴金节 王希春*
(1.安徽农业大学动物科技学院,合肥 230036;2.湖北省农业科学院畜牧兽医研究所,武汉 430064)
我国农业农村部于2019年7月9日发布第194号公告,要求“自2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料”,标志着我国全面进入药物限抗、饲料禁抗新时代,寻求绿色环保型无抗生产已成为一种必然的趋势。微生态制剂是一种根据微生态理论,使用益生菌提高免疫力,保持体内微生态平衡,进而提高宿主健康水平的活菌制剂[1]。一种有效的微生态制剂不仅能够降低动物病死率,提高养殖产量,同时可以保障肉制品的质量安全,维护生态安全[2]。微生态制剂可以改善动物机体的健康水平,调节肠道菌群的紊乱,促进营养物质的消化吸收,具有防治消化道疾病和促进生长双重作用,且体内无残留[3]。此外,微生态制剂还可以产生免疫调节因子和干扰素等免疫活性物质,刺激局部免疫器官,增强机体免疫力,提高动物机体的抵抗力[4]。益生菌类微生态制剂可在改善宿主肠道菌群结构的同时提高宿主健康水平和健康状态。动物胃肠道内拥有丰富的菌群,乳酸菌是动物胃肠道中一种固有优势菌群,已作为饲料添加剂应用于生产中[5]。芽孢杆菌在肠道中主要通过微生物夺氧,维持肠道生态平衡[7],在肠道短时间定植后,可以消耗大量的氧气,维持肠道厌氧环境,增强肠道厌氧菌的定植,抑制病原微生物的同时促进乳酸菌等有益微生物的生长,具备提高动物生长性能、降低料重比和抑制致病菌生长等较多优点[8-9]。在养殖业的发展中,反刍动物占据着重要的地位。微生态制剂能够稳定反刍动物瘤胃内环境,增加瘤胃微生物数量,促进氮代谢,提高机体对饲料的利用率。杨华等[6]研究表明,微生态制剂进入瘤胃后能激活奶牛瘤胃微生物的活性,促进瘤胃内有益菌的增殖,抑制有害菌的增殖,提高脂肪、蛋白质和纤维素等营养物质的消化率。
有研究表明,菌株的定植能力具有宿主特异性,来源不同的菌株在不同的动物胃肠道内具有不同的定植能力[10]。目前,市场上购买到的微生态制剂其菌株一般来源于体外环境,而在生产上应用的大多数益生菌株主要来自土壤、水环境中,这种生态环境与动物胃肠道生理环境相差甚远,动物胃肠道内的酸性环境、胆盐和厌氧环境在很大程度上制约了许多微生物的生长,因此这些微生态制剂被应用于动物时往往得不到很好的效果[11]。与此相比,附着于胃肠道内的微生物经过胃肠道自身的筛选,能适应胃肠道环境且能大量繁殖。为此,本研究拟从大别山黄牛肠道中针对性地筛选出具有益生菌潜质的菌株,通过细菌扩大培养后制成复合微生态制剂,在饲粮中添加后饲喂大别山黄牛,探讨复合微生态制剂与单一芽孢杆菌相比,对大别山黄牛免疫、抗氧化能力和肠道菌群结构的影响,以期为复合微生态制剂在动物健康养殖领域的应用提供参考。
1 材料与方法
1.1 试验动物
采样及临床饲喂用大别山黄牛由安徽省安庆市望江县小月山农业发展有限公司提供。临床饲喂用黄牛均在6月龄左右,共12头,公母各占1/2。
1.2 试验材料与仪器
LB琼脂培养基和MRS琼脂培养基,杭州百思生物技术有限公司;商品枯草芽孢杆菌菌粉(活菌数≥1.0×1010CFU/g),拜耳(墨西哥)有限公司;牛源酶联免疫吸附测定(ELISA)试剂盒,上海晶抗生物工程有限公司;TGL-18R型冷冻高速离心机,珠海黑马医学仪器有限公司;Smart Pure超纯水仪,美国Thermo公司;AE224电子天平,上海舜宇恒平科学仪器有限公司;可控硅控温水浴锅,金坛市金城国胜实验仪器;DW-86L388A-80 ℃冰箱,青岛海尔特种电器有限公司;微量移液器,Eppendaorf有限公司;BK-500全自动生化分析仪,济南鑫贝生物科技有限公司;Infinite M200 PRO酶标仪,澳大利亚帝肯TECAN公司;超净工作台,苏州净化设备有限公司。
1.3 菌株分离
1.3.1 样品采集
选择未经抗生素及微生态制剂处理过的健康成年大别山黄牛3头,经放血屠宰。无菌采集各肠段的内容物,冰盒保存,带回实验室进行分离。
1.3.2 菌株的分离与纯化
将采集的肠道内容物样品置于80 ℃的水浴锅中水浴处理20 min,采用稀释平板法,无菌接种于LB固体培养基上,37 ℃培养24 h后挑取不同形态菌落,反复划线纯化筛选芽孢杆菌。采用稀释平板法,将采集的肠道内容物分别无菌操作接种于MRS固体培养基上,37 ℃厌氧培养48 h后挑取不同形态菌落,反复划线纯化筛选乳酸菌。
1.3.3 菌株的鉴定
根据细菌的形态、染色和菌落生长情况进行鉴定。将纯化后的菌液送往擎科生物公司进行16S rDNA基因序列测序,测序结果利用GenBank中的BLAST程序比对,对细菌种属进行鉴定。
1.3.4 酸耐受性试验
参考Guo等[12]的试验步骤进行耐酸试验。将磷酸盐缓冲溶液(PBS)的pH分别调整为7.4、4.0、3.0、2.0,菌液按1∶10的体积比加入到上述配制好的PBS中,在37 ℃的摇床中孵育2 h后取出,倍比稀释后涂板,培养计数,每组重复3次,取平均值,计算所测菌株的存活率,计算公式如下:
存活率(%)=(酸处理菌液活菌数/
未处理菌液活菌数)×100。
1.3.5 胆盐耐受性试验
参考宋献艺[13]的试验步骤进行耐胆盐试验。用PBS将牛胆盐稀释成浓度分别为0、0.15%、0.30%和0.60%的胆盐溶液,菌液按1∶10的体积比加入到上述配制好的胆盐溶液中,在37 ℃的摇床中孵育2 h后取出,倍比稀释后涂板,培养计数,每组重复3次,取平均值,计算所测菌株的存活率,计算公式如下:
存活率(%)=(牛胆盐处理菌液活菌数/
未处理菌液活菌数)×100。
1.4 微生态制剂的制备
将菌株接种于固体培养基上活化后接种于液体培养基内,制作一级种子液。以5%的接种量将一级种子液接种于液体培养基中培养16 h,将培养后的菌液摇匀后吸取100 μL,倍比稀释后涂布于LB固体培养基,重复3次,培养24 h计数活菌数,根据结果稀释菌液至1×108CFU/mL,作为二级种子液。将二级种子液送往南京阡晟源生物技术有限公司进行细菌扩大培养。对所得菌液进行活菌计数,测得芽孢杆菌菌液浓度约为0.96×108CFU/mL,乳酸菌菌液浓度约为1.24×108CFU/mL。
1.5 试验设计
选取12只体型相近的健康断奶大别山黄牛犊牛,随机分为3组,分别为对照组(C组)、芽孢杆菌组(B组)、复合微生态制剂组(E组),每组4头,组与组之间隔离,与牛群隔离,采用栓系饲喂。C组饲喂正常的基础饲粮,B组饲喂添加枯草芽孢杆菌菌粉的基础饲粮,E组饲喂添加由牛源芽孢杆菌与乳酸菌制备的复合微生态制剂的基础饲粮。枯草芽孢杆菌菌粉和复合微生态制剂均按照每天活菌数不低于1×1011CFU的剂量进行添加,根据菌液浓度计算得出每天牛源芽孢杆菌与乳酸菌的添加量各为500 mL。基础饲粮组成及营养水平见表1。每日饲喂2次,每次饲喂后自由饮水。试验期为30 d。
1.6 样品采集
在试验第0、15和30天,分别对各组牛进行空腹颈静脉采血,分离血清,于-20 ℃冻存待测。在试验第30天上午对各组牛进行无菌粪便采集,采集粪便样品放入无菌冻存管内,立即放入液氮中淬灭并保存。

表1 基础饲粮组成及营养水平(风干基础)
1.7 指标测定
1.7.1 血清抗氧化指标的测定
采用ELISA试剂盒检测血清中总抗氧化能力(T-AOC)及超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性与丙二醛(MDA)含量。
1.7.2 血清免疫指标的测定
采用ELISA试剂盒检测血清中免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)含量。
1.7.3 血清细胞因子的测定
通过ELISA试剂盒检测血清中白细胞介素-1(IL-1)、白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)含量。
1.7.4 肠道高通量测序
将粪便样品送往北京诺禾致源科技股份有限公司进行测序分析,主要流程包括样本检测、DNA提取与检测、PCR扩增、产物纯化、文库制备与库检、Illumina NovaSeq测序等。
1.8 数据统计分析
试验数据使Excel 2019软件进行统计。血清细胞因子、免疫与抗氧化指标数据使用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),并采用LSD法进行多重比较,结果以平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 16S rDNA基因序列的测定与细菌鉴定
从大别山黄牛各段肠道内容物中分离出的菌落经革兰氏染色后,选择6株革兰氏阳性菌,分别编号为B1~B6;分离出5株疑似乳酸菌,分别编号为L1~L5。将反馈的16S rDNA基因序列与GenBank数据库中进行同源性比对,同源性均在99%~100%,结果如表2所示。

表2 各菌株16S rDNA基因序列同源性比较
2.2 酸耐受性试验
由图1可知,随着PBS pH的降低,所有菌株的存活率整体呈现下降的趋势,其中B1、B4表现出对酸环境较为敏感,分别在pH为4和3时存活率降至0,因此选择B2、B3、B5、B6这4株芽孢杆菌进行下一步胆盐耐受性的筛选;同理,在pH为2时,L2的存活率降至0,因此选择L1、L3、L4、L5这4株乳酸菌作为进一步胆盐耐受性试验的菌株。
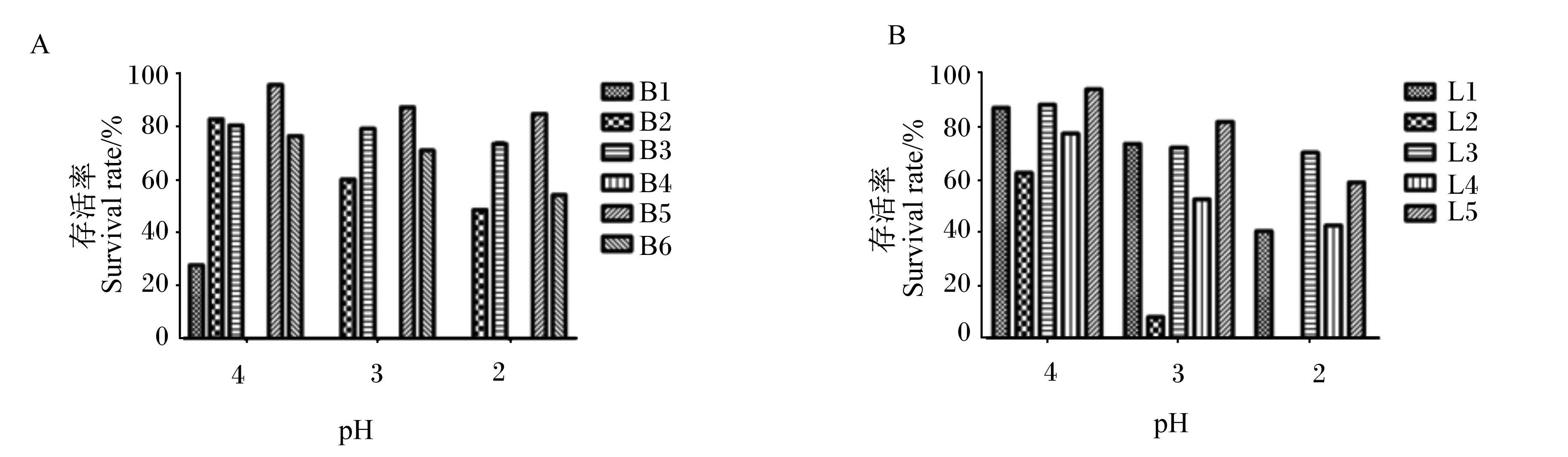
图A表示孵育2 h后各芽孢杆菌菌株在不同pH PBS中的存活率;图B表示孵育2 h后各乳酸菌菌株在不同pH PBS中的存活率。
2.3 胆盐耐受性试验
由图2可知,牛胆盐对所有菌株均呈现抑制生长的作用,随着胆盐浓度的升高,各菌株的存活率整体呈现下降的趋势。4株芽孢杆菌中,B6在0.3%的胆盐溶液中存活率降至0,而B5的存活率则达到了68.16%,明显高于B2、B3,因此最终选取B5(枯草芽孢杆菌)作为制作复合微生态制剂的芽孢杆菌菌株;4株乳酸菌中,L5对牛胆盐的耐受力最差,在0.3%的胆盐溶液中存活率已降至0,L1在0.6%的胆盐溶液中存活率降至0,而L3在0.6%的胆盐溶液中存活率最高,达到了50.57%,因此最终选择L3(乳酸乳球菌)作为制作复合微生态制剂的乳酸菌菌株。
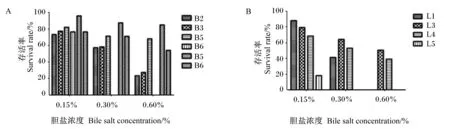
图A表示孵育2 h后各芽孢杆菌菌株在不同浓度胆盐溶液中的存活率;图B表示孵育2 h后各乳酸菌菌株在不同浓度胆盐溶液中的存活率
2.4 牛源复合微生态制剂对大别山黄牛血清抗氧化指标的影响
由表3可知,第0和15天时,所测血清抗氧化指标各组间差异均不显著(P>0.05)。第30天时,与C组相比,B组与E组血清T-AOC及GSH-Px、CAT活性均显著升高(P<0.05),B组与E组间差异均不显著(P>0.05);B组和E组血清MDA含量显著低于C组(P<0.05);E组血清SOD活性极显著高于C组(P<0.01),B组显著高于C组(P<0.05),B组与E组间差异不显著(P>0.05)。
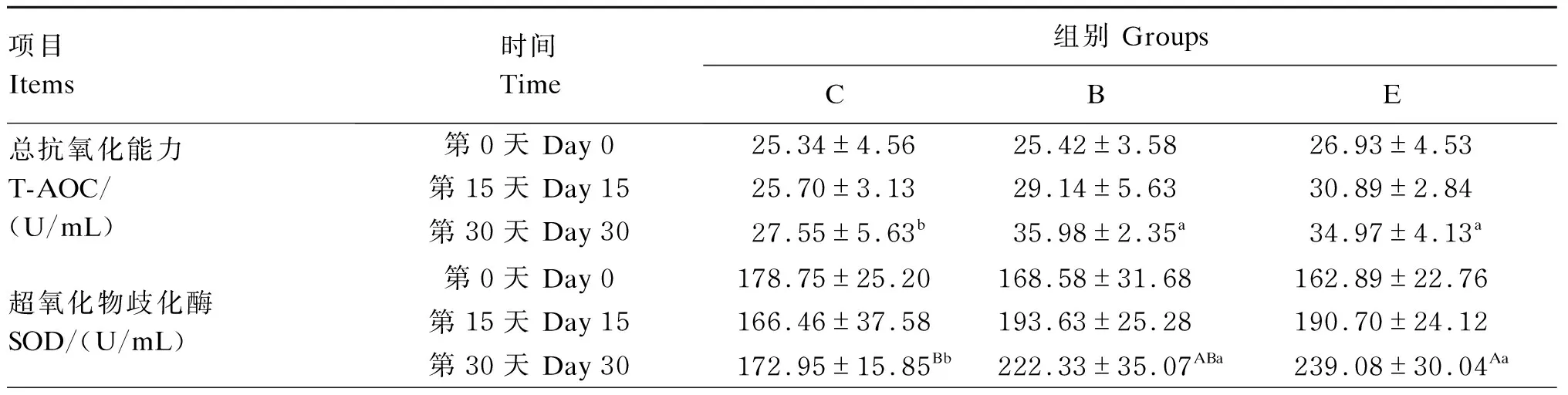
表3 牛源复合微生态制剂对大别山黄牛血清抗氧化指标的影响

续表3项目 Items时间 Time组别 GroupsCBE谷胱甘肽过氧化物酶GSH-Px/(U/mL)第0天 Day 0644.68±69.78649.86±58.96646.85±70.16第15天 Day 15656.79±45.86713.78±76.24699.99±61.08第30天 Day 30624.10±41.96b729.11±55.52a726.38±64.74a过氧化氢酶CAT/(U/mL)第0天 Day 091.31±14.0490.91±14.6091.73±11.83第15天 Day 1592.14±12.6896.10±11.7596.74±10.34第30天 Day 3091.32±14.86b113.53±11.97a115.54±14.46a丙二醛 MDA/(nmol/mL)第0天 Day 06.09±0.916.14±0.956.02±0.93第15天 Day 156.41±1.965.90±0.995.32±1.07第30天 Day 306.23±0.98a4.80±0.60b4.50±0.88b
2.5 牛源复合微生态制剂对大别山黄牛血清免疫指标的影响
由表4可知,第15、30天时,与C组相比,B组、E组的血清IgG含量极显著提高(P<0.01),且第30天时E组血清IgG含量显著高于B组(P<0.05)。第15、30天时,E组血清IgM含量极显著高于C组与B组(P<0.01);与C组相比,B组血清IgM含量虽有升高趋势,但差异不显著(P>0.05)。第0、15和30天时,B组与E组血清IgA含量与C组相比差异均不显著(P>0.05)。
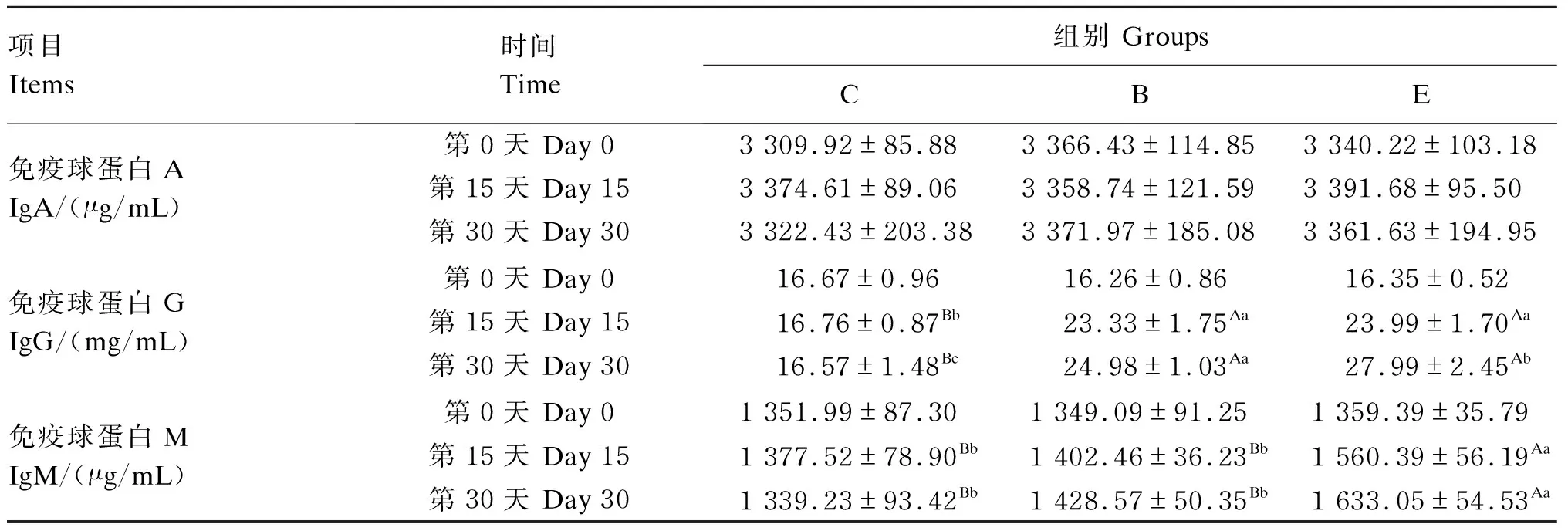
表4 牛源复合微生态制剂对大别山黄牛血清免疫指标的影响
2.6 牛源复合微生态制剂对大别山黄牛血清细胞因子的影响
由表5可知,第0、15和30天时,B组与E组血清IL-1含量与C组均差异不显著(P>0.05)。第30天时,E组血清IL-2含量显著升高(P<0.05),B组具有上升趋势,但差异不显著(P>0.05)。第30天时,B组和E组血清IL-6含量较C组显著升高(P<0.05)。在第15和30天时,B组与E组血清IFN-γ含量显著高于C组(P<0.05)。第0、15和30天时,各组间血清TNF-α含量差异不显著(P>0.05)。
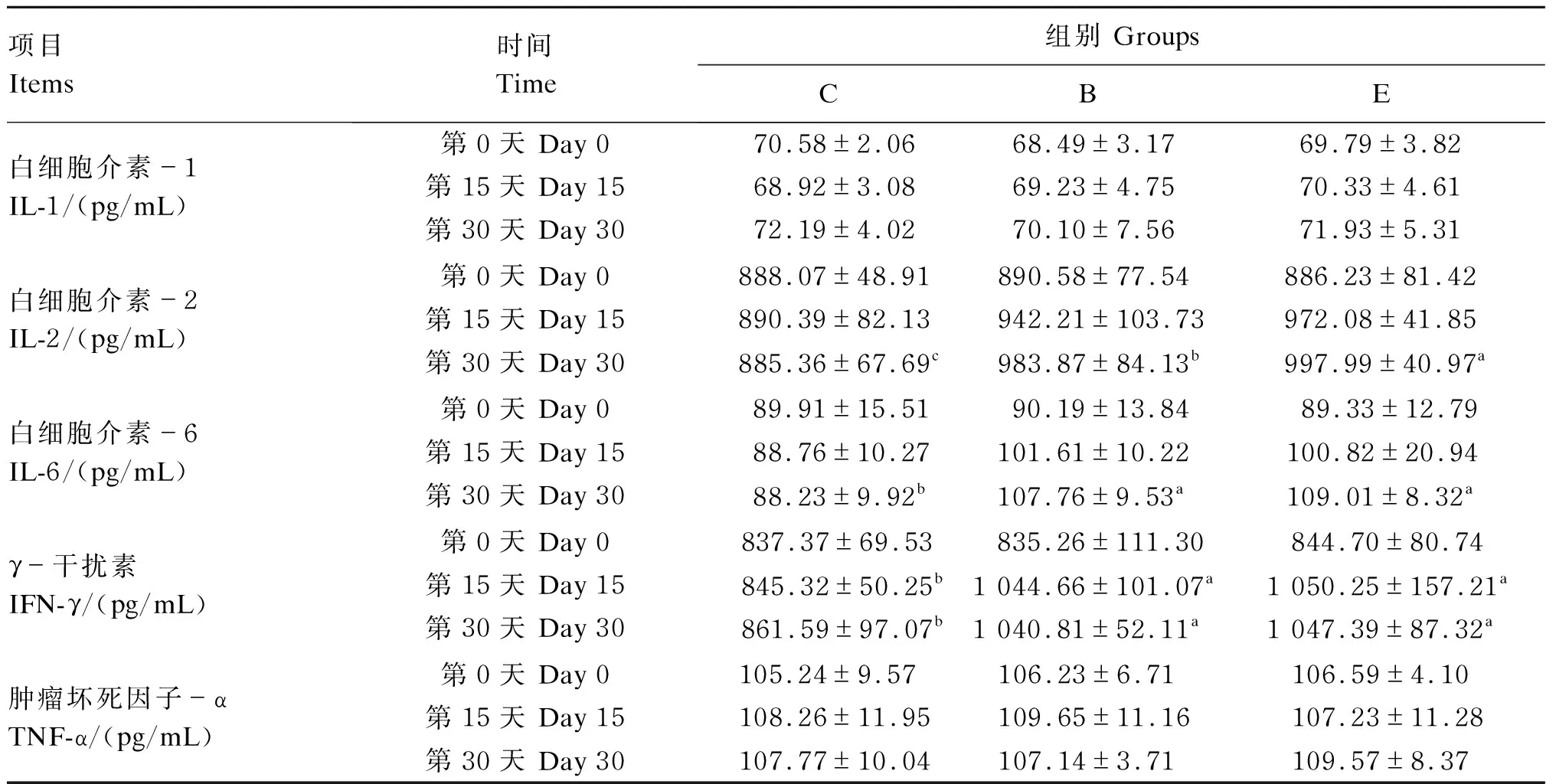
表5 牛源复合微生态制剂对大别山黄牛血清细胞因子的影响
2.7 牛源微生态制剂对大别山黄牛肠道菌群结构的影响
2.7.1 样品操作分类单元(OTU)统计结果及基于OTU的Venn图
以97%的一致性阈值进行OTU聚类,每一个OTU都表示出一种微生物物种,OTU的丰度能够初步表达物种的丰富程度。由表5可以看出,12个样品通过拼接共产生1 065 589条Tag,Tag的平均长度为253nt,连接率均达到了99%以上,表明数据具有可靠性,3组样品共产生16 397个OTU,其中C组有5 284个,B组有5 971个,E组有5 139个,表明3组之间的菌群丰度差异不明显。
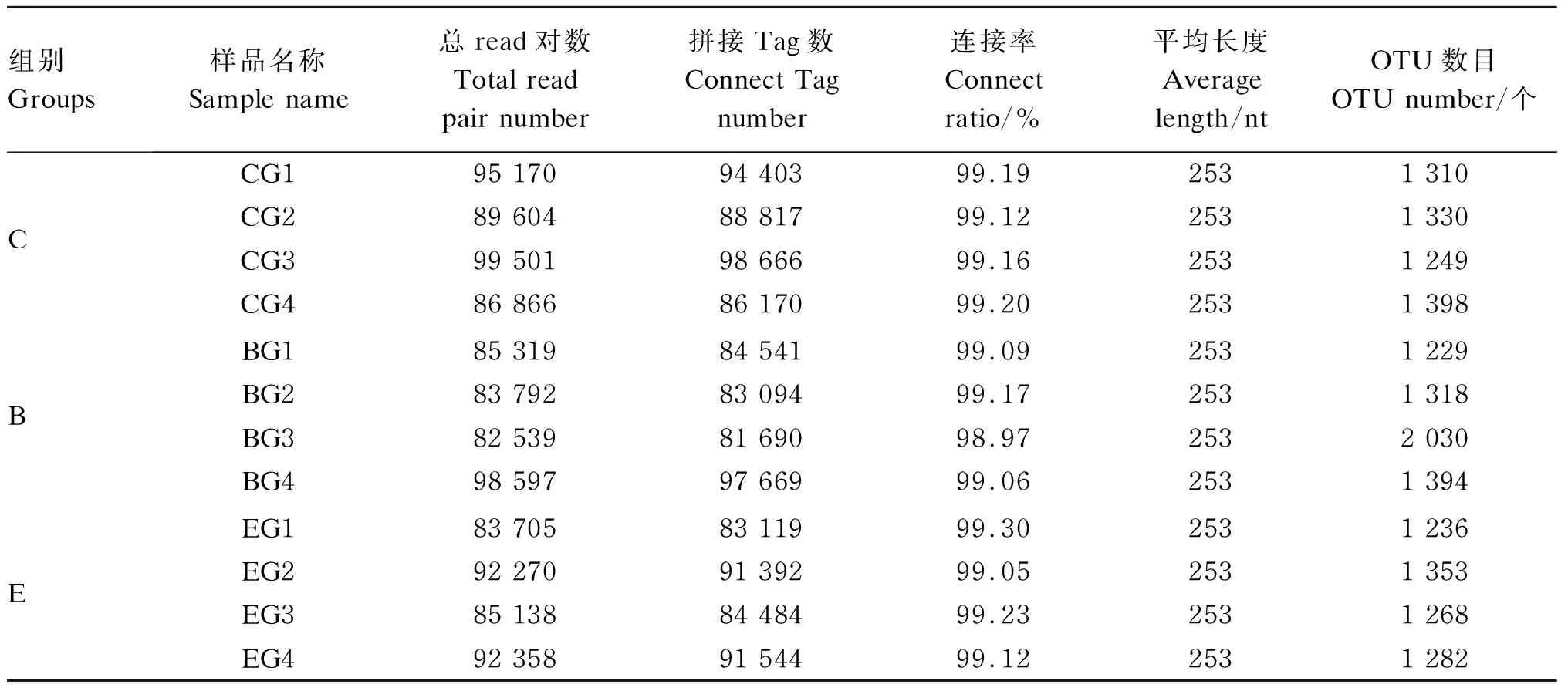
表6 测序数据统计结果及样品OTU统计
Venn图能够直观看出各组特有的OTU数目和不同组之间共有的OTU数目。由图3可知,3组共含有2 604个OTU,3组共有1 471个OTU,C组特有65个OTU,B组特有647个OTU,E组特有69个OTU,C组与B组共有1 614个OTU,C组与E组共有1 547个OTU,E组与B组共有1 604个OTU。3组之间特有OTU数目存在一定的差异,且B组的OTU数目较多。

图3 各组样品基于OTU的Venn图
2.7.2 基于OTU的α多样性分析
由表7可知,B组的Observed species指数、Shannon指数、Shao1指数、ACE指数高于C组与E组,C组与E组的Observed species指数、Shannon指数、Chao1指数、ACE指数基本一致,Simpson指数与Goods coverage指数3组表现基本一致,且Goods coverage指数均≥0.997,表明基本覆盖到样品中所有的物种。

表7 各组样品的α多样性分析
2.7.3 物种累积箱型图分析
物种累积箱型图主要是用来描述随着样本量增加对物种多样性的影响。由图4可知,横坐标为样本量;纵坐标为抽样后OTU数目。在样本量为1~4时,OTU数目急剧上升,表明送检样本中有大量物种被发现,随着样本量继续增加,OTU数目逐渐趋于平缓,说明物种数目不会随着样本数量继续增加而急剧增加,表明样本量充分,能够用于估算物种丰富度。
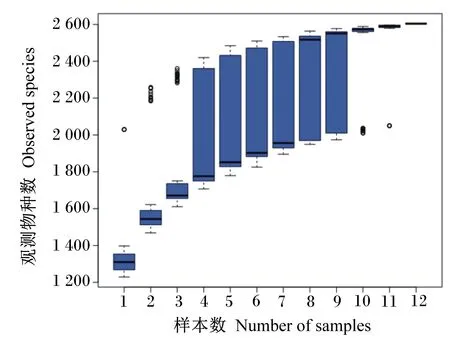
图4 物种累积箱形图
2.7.4 肠道菌群结构
物种分布柱状图能够直观的看出每个门水平物种在样品中的占比。由图5可知,12个样品中都罗列了丰度最高的10个菌门,其中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)的丰度较高,这些微生物占据牛直肠微生物的94.24%以上。物种丰度聚类热图显示物种分类丰度数据中每个样品在属水平的物种比例,图中深红色表示该OTU对样品总OTU有较高比例贡献值,高亮绿色表示该OTU对样品总OTU有较低比例贡献值。由图6可知,厚壁菌门、变形菌门为优势菌属,其中厚壁菌门的乳酸菌属(Lactobacillus)在E组占优,可调节肠道菌群紊乱,说明复合微生态制剂调节大别山黄牛肠道菌群处于动态平衡状态中。
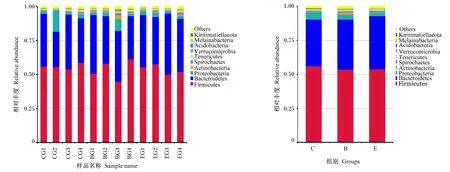
Others:其他;Melainabacteria:黑水仙菌门;Acidobacteria:酸杆菌门;Verrucomicrobia:疣微菌门;Tenericutes:软壁菌门;Spirochaetes:螺旋体门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门。
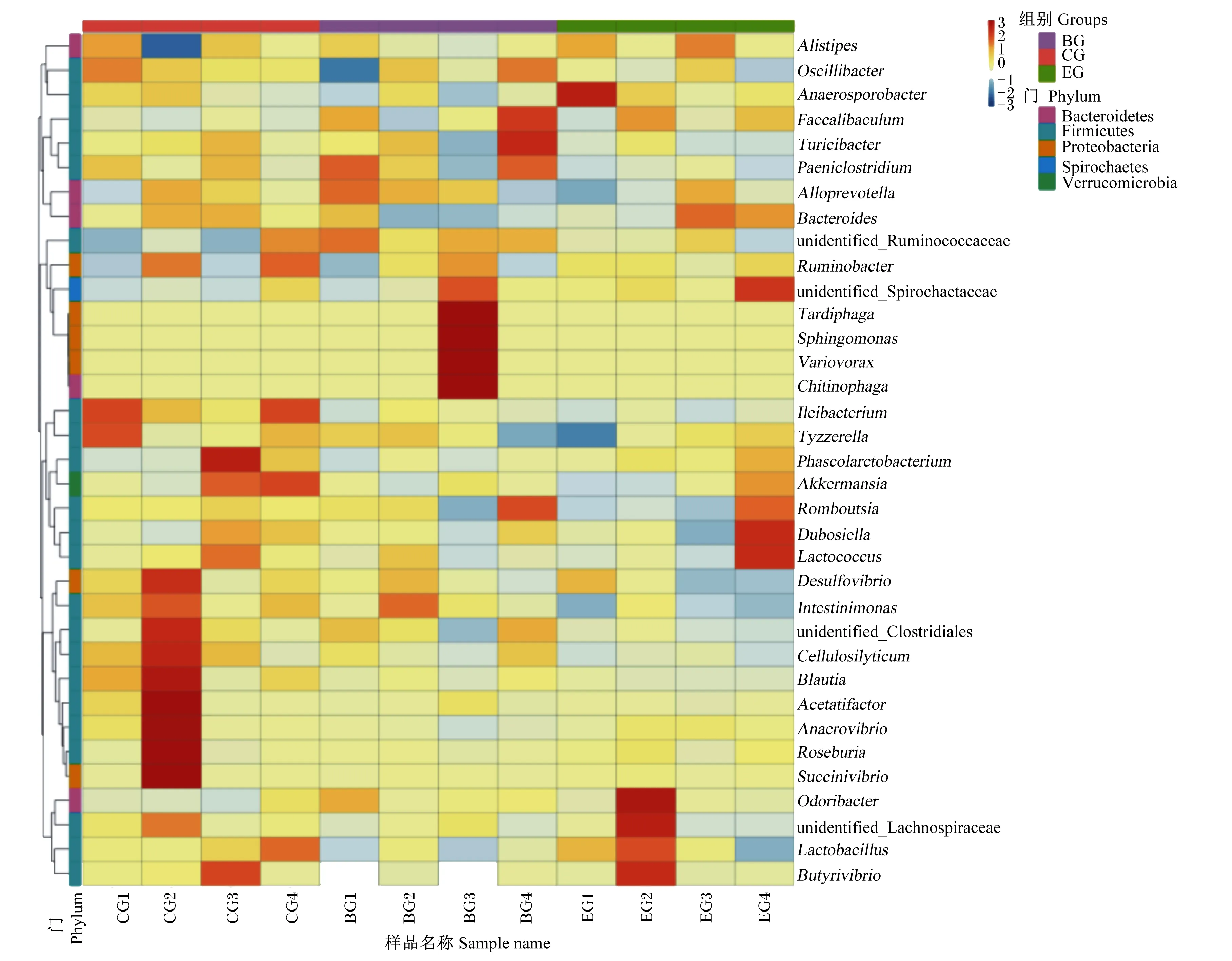
Alistipes:另枝菌属;Oscillibacter:螺旋菌属;Anaerosporobacter:厌氧孢杆菌属;Alloprevotella:普雷沃氏菌属;Bacteroides:拟杆菌属;unidentified_Ruminococcaceae:未鉴定瘤胃菌科;Ruminobacter:反刍杆菌属;unidentified_Spirochaetaceae:未鉴定螺旋体科;Sphingomonas:鞘脂单胞菌属;Variovorax:贪噬菌属;Chitinophaga:鞘氨醇菌属;Phascolarctobacterium:考拉杆菌属;Akkermansia:阿克曼菌属;Romboutsia:罗姆布茨菌属;Dubosiella:杜氏杆菌属;Lactococcus:乳球菌属;Desulfovibrio:脱硫弧菌属;unidentified_Clostridiales:未鉴定梭菌目;Blautia:布劳特氏菌属;Anaerovibrio:厌氧弧菌属;Roseburia:罗氏菌属;Succinivibrio:琥珀酸弧菌属;Odoribacter:气味杆菌属;unidentified_Lachnospiraceae:未鉴定毛螺旋菌科;Lactobacillus:乳杆菌属;Butyrivibrio:丁酸弧菌属;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Spirochaetes:螺旋体门;Verrucomicrobia:疣微菌门。
由表8可知,厚壁菌门的丰度,B组与E组基本一致,较C组略有降低;拟杆菌门的丰度,E组和B组比C组有所升高;变形菌门的丰度,E组和B组比C组有所降低。
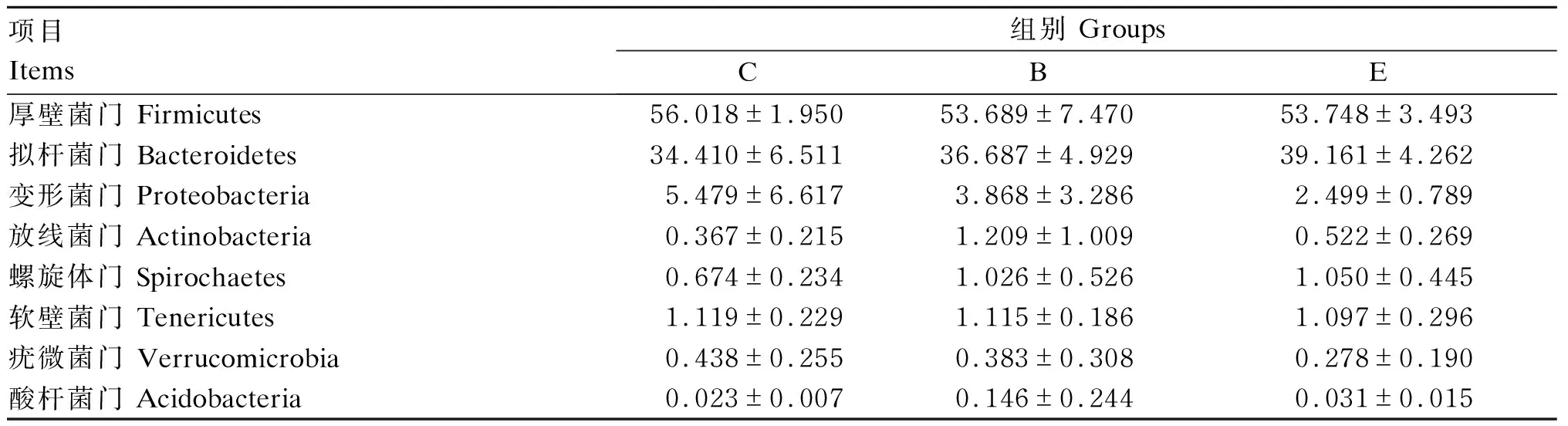
表8 肠道菌群在门水平上的多样性比较
3 讨 论
已有研究表明,微生态制剂对反刍动物具体营养和疾病防治等功能,但市场上购买到的微生态制剂其菌株一般来源于体外环境,由于缺乏针对性而无法得到良好的应用效果[2,11]。因此,本试验将从大别山黄牛各段肠道内容物中分离出的菌落经革兰氏染色、耐酸耐胆盐筛选后,最终选取枯草芽孢杆菌与乳酸乳球菌为制作复合微生态制剂的菌株,并通过测定大别山黄牛血清细胞因子、抗氧化与免疫指标及肠道菌群,探究该牛源微生态制剂在大别山黄牛上的应用效果。
3.1 牛源复合微生态制剂对大别山黄牛血清抗氧化指标的影响
动物体内的抗氧化酶主要有SOD、GSH-Px、CAT,机体对氧自由基的清除能力与这些酶的活性有直接关系。MDA是脂质发生过氧化反应的终产物,具有细胞毒性,其含量的高低能够反映机体过氧化损伤的程度。本试验结果表明,试验第30天时,与C组相比,B组和E组血清T-AOC及GSH-Px、CAT活性均显著升高,B组血清SOD活性显著高于C组;E组血清SOD活性极显著高于C组。秦顺义等[14]研究发现,在羔羊饲粮中加入富硒益生菌能够使血清T-AOC与SOD活性显著或极显著升高,同时使血清MDA含量显著或极显著降低,与本试验结果一致,说明微生态制剂能够帮助机体提高抗氧化能力,且复合微生态制剂的效果要略好于单一菌株的微生态制剂。
3.2 牛源复合微生态制剂对大别山黄牛血清免疫指标的影响
IgG、IgA、IgM均是血清中常见的免疫球蛋白,也是反映机体中体液免疫强弱的3个重要指标。赵鹏等[15]在羔羊的微生态制剂应用试验中得出,添加复合微生态制剂能够显著提高羔羊血清IgG、IgM含量。屈圣富等[16]研究发现,在猪饲粮中添加复合微生态制剂能够使血清IgG含量显著增加,但对血清IgA含量无显著影响。从本试验结果可以看出,血清IgG含量在第15天时B组和E组极显著高于C组,且在第30天时E组显著高于B组;血清IgM含量在第15和30天时E组比C组和B组极显著升高,B组血清IgM含量随饲喂时间的延长呈上升趋势,本试验结果与上述研究结果保持一致。试验过程中大别山黄犊牛无感染疾病情况,可能是复合微生态制剂刺激肠道上皮细胞促使机体产生IgG和IgM,导致二者的含量升高,进而提高机体免疫力[17]。与B组相比,添加复合微生态制剂的E组提升血清IgG和IgM含量的能力要比单一菌株枯草芽孢杆菌的效果要好,可能是因为本试验制备的牛源复合微生态制剂中的2种菌在肠道内能够发挥协同作用,从而对机体免疫力的提升更加明显。
3.3 牛源复合微生态制剂对大别山黄牛血清细胞因子的影响
细胞因子是由多种细胞被免疫原刺激进而诱导产生的具有调节免疫反应的小分子蛋白质,能够参与机体的免疫反应,与机体的炎症反应相关。鲍玉林等[18]研究发现,给犊牦牛应用微生态制剂能够显著提高血清IL-2和IFN-γ含量。本试验中,第30天时,与C组相比,B组与E组血清IL-6和IFN-γ含量显著升高,同时E组血清IL-2含量也显著升高,而B组虽呈现上升趋势,但差异不显著,这一结果与上述研究结果基本一致,这说明复合微生态制剂进入肠道后作用于宿主的免疫系统,增强了宿主体内免疫细胞的活性,进而提高了动物机体的免疫力。
3.4 牛源复合微生态制剂对大别山黄牛肠道菌群结构的影响
肠道菌群结构的变化一般通过粪便菌群结构的变化来反映[19],动物肠道内有超过100万亿的细菌等微生物,这些微生物具有抵御病原体侵袭、维持肠道黏膜体系的屏障作用。良好的肠道菌群结构对动物的健康生长至关重要,益生菌能够帮助宿主消化营养物质,促进动物机体发育与维持肠道内环境的稳态,并参与机体的免疫反应[20]。Rey等[21]研究指出,犊牛瘤胃内的菌群会随着日龄增长发生变化,随着日龄增长,拟杆菌门会逐渐替代变形菌门,厚壁菌门中含有大量能够对纤维起到消化作用的细菌。杜琪等[22]研究发现,犊牛胃肠道内厚壁菌门和拟杆菌门为主要优势菌群。本试验结果发现,厚壁菌门、拟杆菌门以及变形菌门构成犊牛肠道的优势菌群,且从试验结果可以看出,E组和B组拟杆菌门所占比例增加,且添加复合微生态制剂的E组比B组拟杆菌门丰度增加的更为显著,而拟杆菌门能够促进机体对多糖的消化吸收,提高纤维的利用率;同时,E组和B组变形菌门所占比例有所降低,且添加复合微生态制剂的E组厚壁菌门中乳酸菌属占优,同时比B组变形菌门丰度降低的更为显著,变形菌门中含有大肠杆菌及沙门氏菌等多种致病菌,说明复合微生态制剂能够调节大别山黄牛肠道菌群处于动态平衡状态中,抑制有害微生物的繁殖。综上所述,本试验所制备的牛源复合微生态制剂能够改善大别山黄牛的肠道菌群结构,增加有益菌群数量,同时降低有害菌群数量。
4 结 论
① 本试验通过耐酸与耐胆盐试验,从大别山黄牛肠道内筛选出对酸和胆盐耐受性都较高的枯草芽孢杆菌和乳酸乳球菌,并将这2株菌进行扩大培养,制备成牛源复合微生态制剂。
② 该牛源复合微生态制剂能够增强大别山黄牛的免疫功能和抗氧化能力,改善肠道菌群结构,且其应用效果优于单一菌株的微生态制剂。

