微生物源性抗氧化剂对葡聚糖硫酸钠诱发小鼠肝脏氧化损伤和炎症反应的影响
李 莉 马 升 张 京 徐维娜 徐建雄
(上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海 200240)
动物养殖过程中,受环境、营养、心理等因素影响,易发生肠道炎症,肠道炎症发生的同时往往伴随肝脏疾病,因此,开发新型饲料添加剂缓解肠道和肝脏损伤具有重要意义。Uko等[1]观察到肠道炎症会诱发肝脏并发症,并且大多数治疗炎症性肠病(inflammatory bowel disease,IBD)的药物对肠道和肝脏有不良影响[2]。IBD是一种非特异性肠道炎症疾病,以葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导的小鼠结肠炎是最常见的研究模型[3],之前的研究大多集中于利用DSS溃疡性结肠炎模型研究IBD。Kitajima等[4]发现利用DSS处理小鼠后,DSS会分布在肝脏枯否氏细胞、肠系膜淋巴结巨噬细胞和大肠固有层细胞,但目前未见关于DSS处理是否会对肝脏造成损伤的报道。研究发现,活性氧自由基(ROS)参与调控结肠炎的发展[5],抗氧化剂如维生素C、维生素E等具有清除自由基、缓解氧化应激和炎症的作用[6-7]。课题组前期研究发现,微生物源性抗氧化剂(microbe-derived antioxidants,MA)可以缓解敌草快引起的小鼠肝脏和肠道氧化应激,提高空肠养分转运能力[8],缓解肝脏内质网应激[9]。因此,本试验旨在探究DSS处理小鼠是否会发生肝脏损伤以及MA的缓解作用,为肠道炎症疾病及其肝脏损伤的治疗提供新的治疗思路。
1 材料与方法
1.1 试验设计
选择48只6周龄C57BL/6J雄性小鼠,预饲养1周后,随机分为4组,每组12只。对照组和DSS组每天每只小鼠灌胃0.020 mL/g BW的生理盐水,低剂量MA组(LMA组)每天每只小鼠灌胃0.002 mL/g BW的MA,高剂量MA组(HMA组)每天每只小鼠灌胃0.003 mL/g BW的MA。对照组每天饮用双蒸水;其余各组1~7 d饮用双蒸水,8~14 d饮用含3% DSS的双蒸水。试验期14 d。小鼠饲养于25 cm×40 cm加不锈钢盖的塑料笼盒中,温度控制在20~25 ℃,相对湿度为50%~60%,光照和黑暗各占12 h,自由饮水,自由采食。试验期结束后1 d将小鼠脱颈处死,解剖后取出肝脏,去除结缔组织,用预冷生理盐水冲洗后装入冻存管,在液氮中速冻之后置于-80 ℃冰箱保存。
1.2 试验材料
6周龄C57BL/6J雄性小鼠(18~22 g)购于常州卡文斯实验动物有限公司,生产许可证号:SCXK(苏)2016-0010。小鼠基础饲粮购于江苏协同生物有限公司,其营养水平见表1。DSS购自美国MP Biomedicals公司;MA(商品名KB-120)由上海江翰生物科技有限公司提供,是以沙棘、刺梨果实为原料,经枯草芽孢杆菌、乳酸杆菌、酵母菌等益菌发酵,经提取、浓缩、灭活、冻干等固液复合发酵处理而成,含有微生素C、维生素E、异黄酮、谷胱甘肽(GSH,glutathione)、超氧化物歧化酶(SOD)和多种微量元素的金属衍生物,MA可清除组织过量ROS,提高小鼠血清中免疫球蛋白A(IgA)含量,提高脾脏淋巴细胞转化率,促进脾脏和胸腺发育。过氧化氢(H2O2)、丙二醛(malondialdehyde,MDA)、GSH含量和总抗氧化能力(total antioxidant capacity,T-AOC)及总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine transaminase,ALT)活性检测试剂盒均购于南京建成生物工程研究所。Trizol购于美国Invitrogen公司。反转录试剂盒PrimeScript RT reagent Kit(Perfect Real Time)和荧光定量PCR试剂盒SYBR Premix Ex TaqTM(Perfect Real Time)购自日本TaKaRa公司。线粒体提取试剂盒购自北京索莱宝科技有限公司。线粒体膜电位检测试剂盒(JC-1法)购自北京雷根生物技术有限公司。

表1 基础饲粮营养水平(饲喂基础)
1.3 肝脏组织形态观察
取新鲜肝脏组织转移到4%的多聚甲醛中,通过脱水、石蜡包埋、苏木精-伊红(HE)染色并封片之后,光学显微镜下观察组织形态。
1.4 氧化应激指标及AST、ALT活性测定
取冻存的肝脏组织称重后,按1∶9比例加入生理盐水,冰上匀浆,4 000 r/min离心20 min,取上清液进行相关指标测定。依据试剂盒说明书测定H2O2、MDA、GSH含量T-AOC及T-SOD、GSH-Px、AST和ALT活性。
1.5 线粒体膜电位测定
取冻存的肝脏组织200 mg,加入预冷裂解缓冲液(lysis buffer)冰上匀浆,按照试剂盒步骤提取出线粒体。取100 μL纯化的线粒体与900 μL JC-1染色工作液混合,取200 μL转移到96孔板于荧光酶标仪下读数,检测JC-1单体激发光设置为490 nm,发射光设置为590 nm;检测JC-1聚合体激发光设置为525 nm,发射光设置为590 nm,2次读数比值为线粒体膜电位。取20 μL转移至玻板于荧光显微镜下观察,设置绿色荧光蛋白(GFP,标记绿色荧光)观察JC-1单体,设置Cy5(标记红色荧光)观察JC-1聚合物。
1.6 实时荧光定量PCR
检测肝脏组织相关基因[含pyrin结构域NOD样受体家族蛋白3(NLRP3)、白细胞介素-18(IL-18)、凋亡相关斑点样蛋白(ASC)、半胱天冬蛋白酶-1(Caspase-1)、白细胞介素-1β(IL-1β)、端粒酶逆转录酶(Tert)、肿瘤坏死因子-α(TNF-α)、细胞外调节蛋白激酶(PERK)、活化转录因子6(ATF6)、肌醇依赖性激酶1(IRE1)和葡萄糖调节蛋白78(GRP78)]表达:将肝脏组织在液氮中研磨后使用Trizol法提取RNA,并用Nanodrop测定RNA浓度,按照PrimeScript RT reagent Kit(Perfect Real Time)说明书进行,首先去除基因组DNA,反应条件为42 ℃ 2 min,4 ℃ 30 s。将RNA逆转录为cDNA,反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 30 s。设计引物序列并委托Invitrogen公司合成。引物序列见表2。以cDNA为模板,根据SYBR Premix Ex TaqTM(Perfect Real Time)试剂盒进行实时荧光定量PCR反应,反应条件:预变性,95 ℃ 30 s;PCR反应,95 ℃ 3 s,60 ℃ 30 s;熔解曲线,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,循环40次。实时荧光定量PCR结果以β-肌动蛋白(β-actin)作为内参基因,采用2-ΔΔCt法计算待测样品的相对表达量。
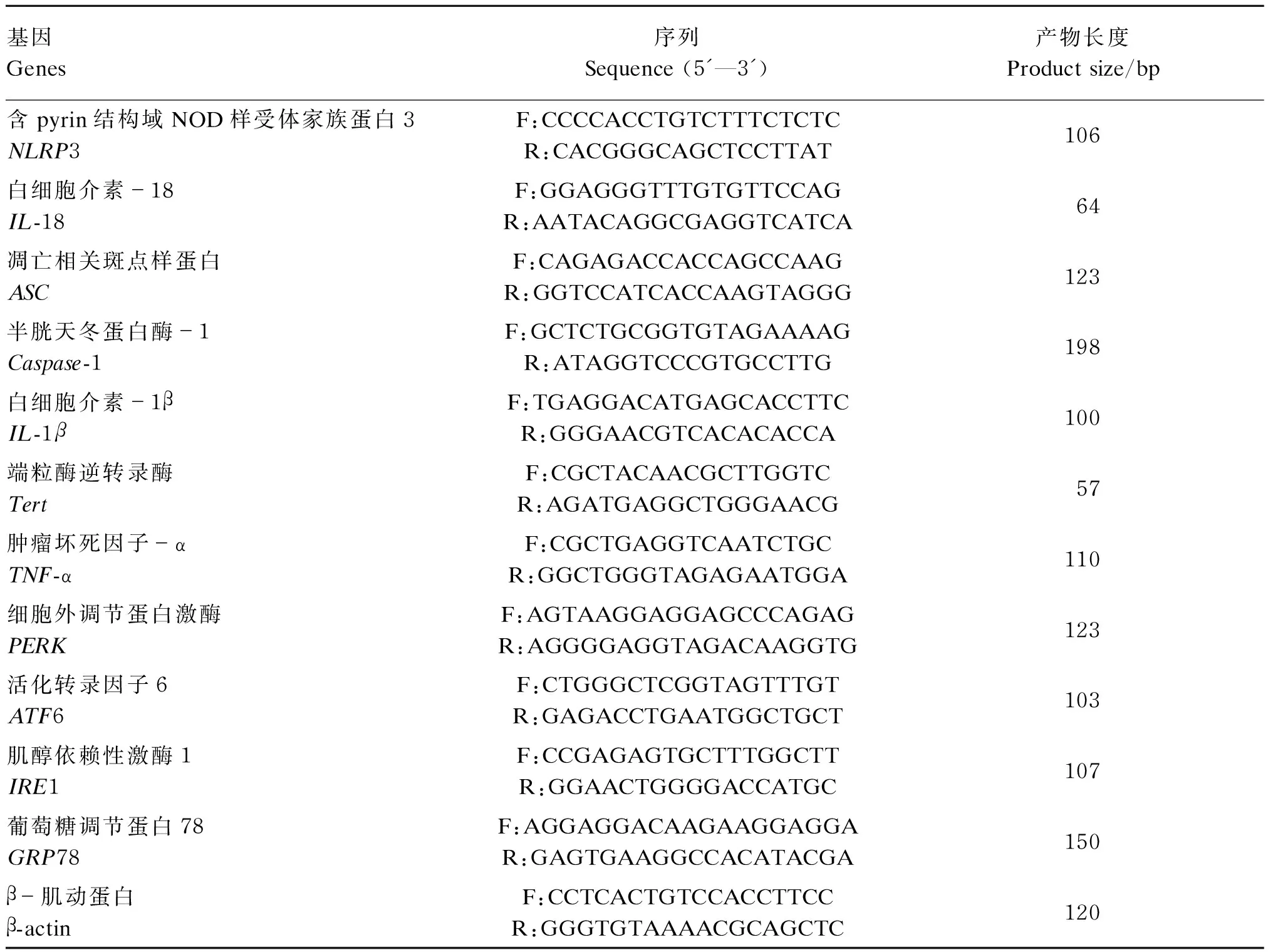
表2 引物序列
1.7 统计分析
采用SPSS 20.0软件进行统计分析,采用单因素方差分析(one-way ANOVA)和LSD法统计组间差异,结果以均值±标准误表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 肝脏组织切片HE染色
如图1所示,DSS组小鼠的肝小叶中央汇管区炎性细胞浸润,肝细胞发生脂肪变性;HMA组的DSS诱导结肠炎发生的肝脏病理变化明显改善。这表明MA缓解了DSS引起的肝脏组织损伤。
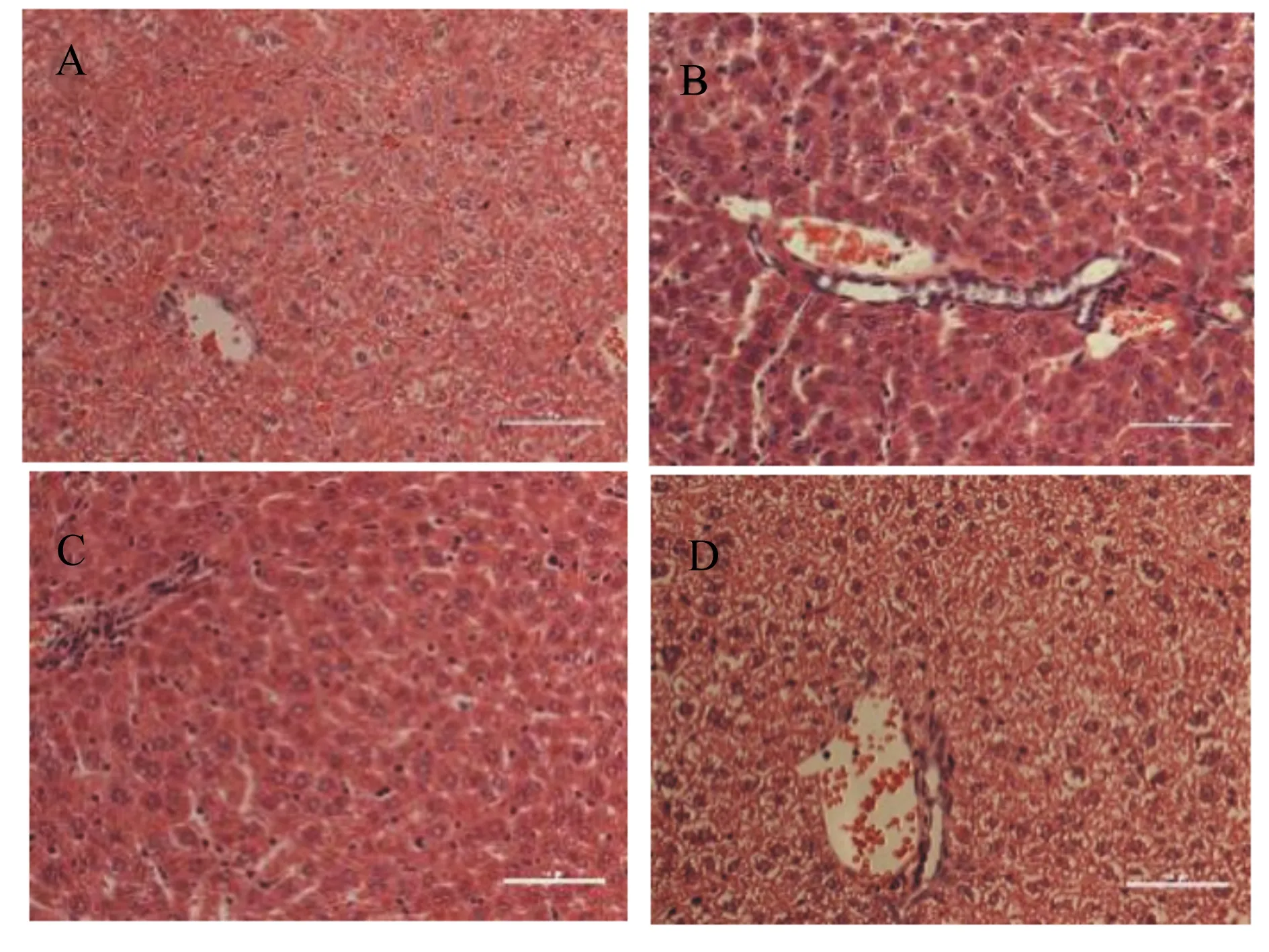
图1 对照组(A)、DSS组(B)、LMA组(C)和
2.2 肝脏组织氧化应激指标
如表3所示,与对照组相比,DSS组H2O2、MDA含量极显著升高(P<0.01),T-SOD、GSH-Px活性和GSH含量及T-AOC显著或极显著降低(P<0.05或P<0.01)。与DSS组相比,LMA组H2O2含量显著降低(P<0.05),T-AOC和GSH-Px活性显著升高(P<0.05);HMA组H2O2、MDA含量显著降低(P<0.05),T-SOD、GSH-Px活性和GSH含量及T-AOC显著升高(P<0.05)。这表明DSS诱导肝脏组织发生氧化应激,MA清除肝脏组织过量ROS,提高肝脏组织抗氧化能力。
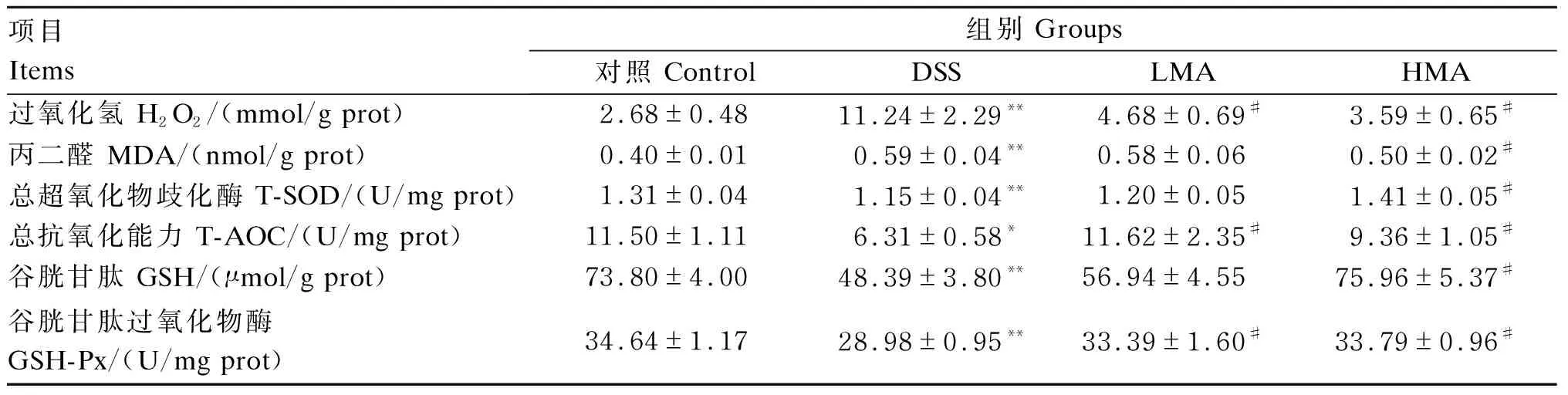
表3 肝脏组织氧化应激指标
2.3 肝脏AST和ALT活性
如图2所示,与对照组相比,DSS组AST和ALT活性降低,但差异不显著(P>0.05)。与DSS组相比,LMA组和HMA组AST和ALT活性没有显著差异(P>0.05)。这表明DSS未造成肝脏AST和ALT活性下降。

数据柱标*表示与对照组相比差异显著(P<0.05),标#表示与DSS组相比差异显著(P<0.05)。下图同。
2.4 肝脏线粒体膜电位
如图3所示,与对照组相比,DSS组绿色荧光强度明显增强,且观察不到红色荧光;MA处理后绿色荧光强度明显减弱,红色荧光强度明显增强。与对照组相比,DSS组线粒体膜电位显著降低(P<0.05);与DSS组相比,LMA组和HMA组线粒体膜电位显著升高(P<0.05)。这表明MA缓解DSS引起的肝脏线粒体膜电位下降。

A、B、C、D:GFP荧光图;E、F、G、H:Cy5荧光图。
2.5 GRP78、ATF6、IRE1、PERK、Tert mRNA表达
如图4所示,与对照组相比,DSS组GRP78、ATF6、IRE1、PERK、TertmRNA相对表达量显著升高(P<0.05)。与DSS组相比,LMA组IRE1、TertmRNA相对表达量显著升高(P<0.05),GRP78、ATF6、PERKmRNA相对表达量没有显著差异(P>0.05);HMA组GRP78 mRNA相对表达量显著降低(P<0.05),IRE1 mRNA相对表达量显著升高(P<0.05),ATF6、PERKmRNA相对表达量没有显著差异(P>0.05)。这表明MA缓解DSS引起的肝脏内质网应激。
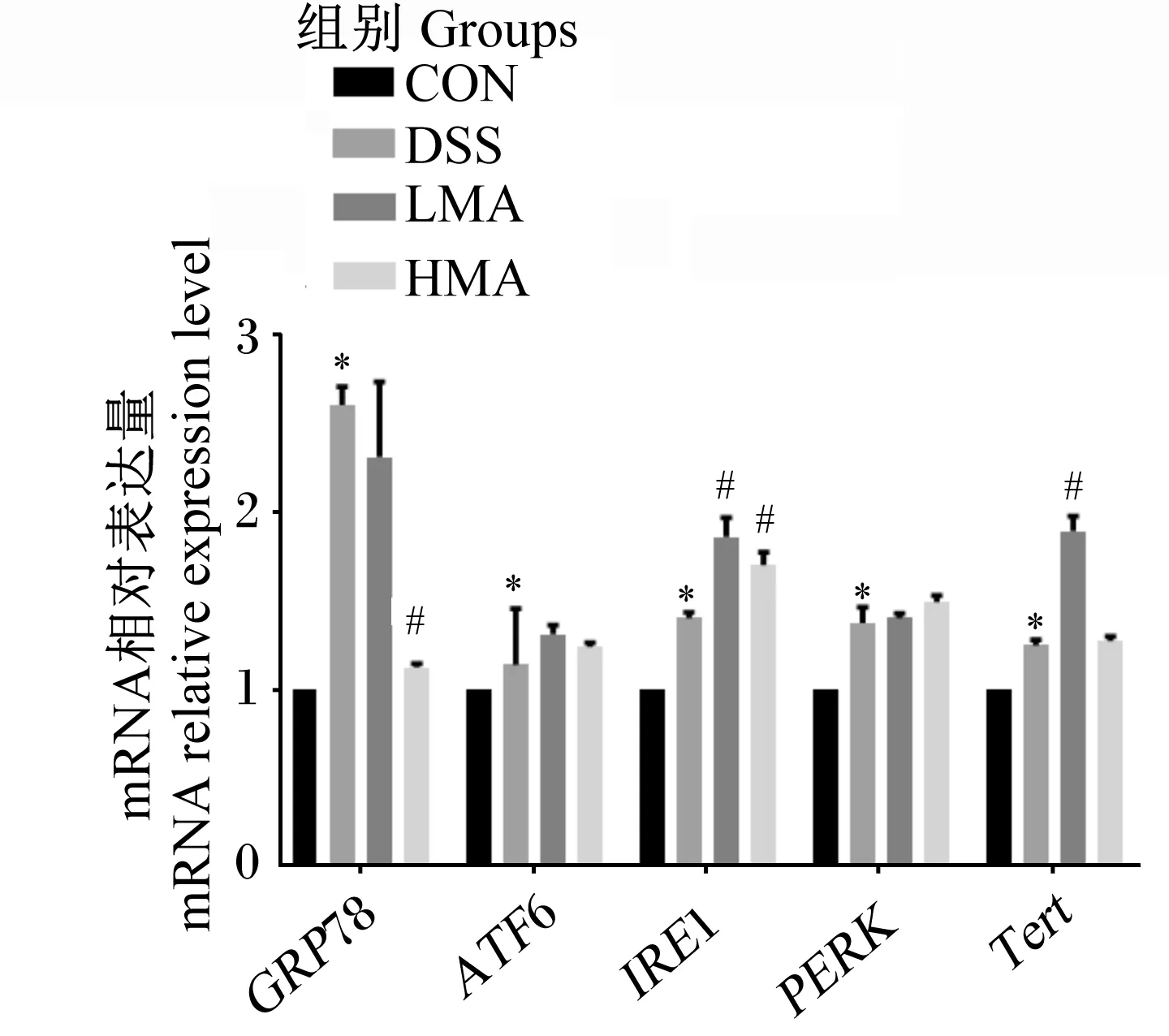
GRP78:葡萄糖调节蛋白78 glucose regulated protein 78;ATF6:活化转录因子6 activating transcription factor 6;IRE1:肌醇依赖性激酶1 inositol requiring enzyme 1;PERK:细胞外调节蛋白激酶 extracellular regulated protein kinases;Tert:端粒酶逆转录酶 telomerase reverse transcriptase。
2.6 TNF-α mRNA表达
如图5所示,与对照组相比,DSS组TNF-α mRNA相对表达量显著升高(P<0.05)。与DSS组相比,LMA组和HMA组TNF-α mRNA相对表达量没有显著差异(P>0.05)。这表明DSS诱发肝脏发生炎症,MA对DSS处理后肝脏TNF-α mRNA表达没有显著影响。
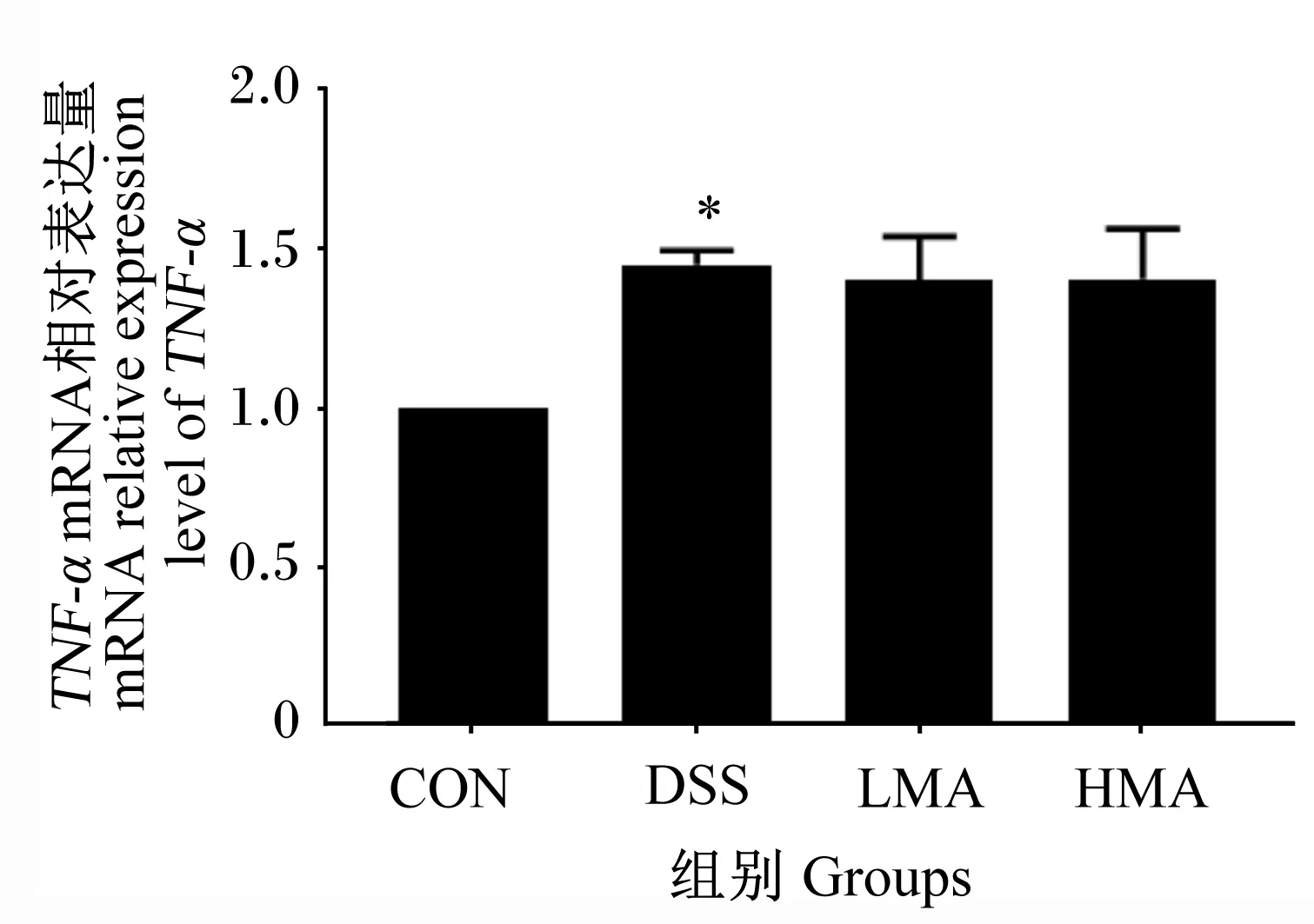
图5 肝脏TNF-α mRNA表达
2.7 NLRP3、ASC、Caspase-1、IL-18和IL-1β mRNA表达
如图6所示,与对照组相比,DSS组ASC、Caspase-1、IL-1βmRNA相对表达量显著升高(P<0.05),NLRP3、IL-18 mRNA相对表达量没有显著差异(P>0.05)。与DSS组相比,LMA组Caspase-1、IL-1βmRNA相对表达量显著降低(P<0.05),HMA组ASC、Caspase-1、IL-1βmRNA相对表达量显著降低(P<0.05)。这表明NLRP3相关基因参与调控MA缓解DSS引起的肝脏炎症。
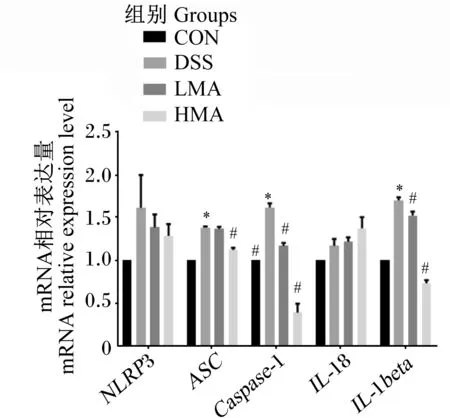
NLRP3:Nod样受体家族含pyrin结构域蛋白3 Nod-like receptor family pyrin domain-containing protein 3;ASC:凋亡相关斑点样蛋白 apoptosis-associated speck-like protein containing a CARD;Caspase-1:半胱天冬蛋白酶-1 cysteine aspartatespecific proteinase-1;IL-18:白细胞介素-18 interleukin-18;IL-1β:白细胞介素-1β interleukin-1β。
3 讨 论
本研究发现,DSS处理后小鼠肝脏H2O2和MDA含量极显著升高,肝脏T-SOD、GSH-Px活性和GSH含量及T-AOC显著或极显著降低,表明肝脏产生过量自由基发生氧化应激,组织抗氧化能力下降。线粒体功能是细胞健康的重要指标,是评估线粒体功能的指标之一,线粒体膜电位越高,促进细胞能量转换越强[10],在各种凋亡信号的诱导下,线粒体会发生显著的结构与功能性的变化,比如线粒体膜电位的丢失、电子传递链的变化以及细胞内氧化还原状态的变化[11]。本试验中,DSS处理后,肝脏线粒体膜电位显著降低,表明肝脏细胞处于凋亡早期。氧化应激是导致肝功能异常变化的原因之一[12],当肝细胞受损,会释放AST、ALT进入血液循环[13],AST主要存在于线粒体中,肝细胞坏死严重时,AST活性才会明显变化,ALT绝大多数存在于细胞质中[14]。本试验结果发现,DSS处理后,肝脏AST和ALT活性虽然有下降趋势但差异不显著,仍说明肝脏有部分AST和ALT释放。GPR78是发生内质网应激的标志性蛋白,当内质网处于应激状态时,大量未折叠或错误折叠蛋白堆积于内质网腔中,GRP78与ATF-6和PERK感应蛋白解离,转而与未折叠蛋白结合[15],IRE1可被未折叠蛋白直接激活[16],导致其相对表达量升高;Tert表达是检测肝脏组织内端粒酶活性的重要指标,端粒酶活性及TertmRNA相对表达量与细胞坏死凋亡具有相关性[17]。在本试验中,DSS处理后,GRP78、ATF6、IRE1、PERK、TertmRNA相对表达量显著升高,肝脏组织出现炎性细胞浸润和脂肪变性,炎性因子IL-1β和TNF-α mRNA表达量显著上升,表明肝脏发生内质网应激并有早期凋亡、炎症和组织损伤。
本研究发现,MA处理后,LMA组和HMA组肝脏H2O2含量显著下降,HMA组肝脏MDA含量显著下降,LMA组和HMA组肝脏T-AOC和GSH-Px活性显著升高,HMA组肝脏T-SOD活性和GSH含量也显著升高,这一结果与报道中花青素等抗氧化剂可以有效降低肝脏中H2O2和MDA含量的结果[18-19]一致。MA处理后,LMA组和HMA组肝脏线粒体膜电位显著升高,表明MA能够有效改善细胞凋亡。HMA处理后,HMA组肝脏GRP78 mRNA相对表达量显著降低,LMA组和HMA组肝脏IRE1 mRNA相对表达量显著升高,可能是在内质网应激时短期活化IRE1可剪切X盒结合蛋白-1(X-box binding protein 1,XBP-1)mRNA来促进细胞生存[20],小鼠肝脏炎性细胞浸润和脂肪变性有明显改善;LMA组和HMA组肝脏IL-1βmRNA相对表达量显著下降,表明MA可以缓解肝脏内质网应激、炎症反应和组织损伤,出现一定的剂量依赖性。
本研究发现,DSS处理后,小鼠肝脏ASC、Caspase-1、IL-1βmRNA相对表达量显著升高,表明NLRP3炎性小体参与了肝脏炎症调控。MA处理后,LMA组和HMA组肝脏Caspase-1、IL-1βmRNA相对表达量显著降低,HMA组肝脏ASCmRNA相对表达量显著降低。有报道发现,NLRP3基因表达后小鼠IBD的病死率显著提高[21],当肠道屏障受损肠肝轴[22]会放大肠道与肝脏Toll样受体(Toll like receptors,TLRs)之间的关联信号[23],导致肝脏损伤,白细胞介素受体相关激酶(interleukin receptor associated kinase,IRAK)会绕过引发过程,并将TLRs快速连接到NLRP3炎性小体使其被激活[24],DSS在肝脏枯否氏细胞分布,DSS可以通过巨噬细胞上的TLRs诱导炎症[25],从而进一步促进肝病的发展。
4 结 论
综上所述,DSS诱发了小鼠肝脏组织损伤、氧化应激、内质网应激、膜电位下降和炎症反应,MA对此有明显的缓解作用,其中高剂量MA的缓解作用更强,并且NLRP3炎性小体参与调控炎症。

