葡萄籽原花青素提取物对大鼠脂肪沉积及脂质代谢的影响
顾艾鑫 张 童 王天虎 吴 泽 单安山 李建平
(东北农业大学动物科学技术学院,哈尔滨 150030)
原花青素是一种富含酚羟基的多酚,广泛存在于各种谷物、豆类种子和蔬菜水果的核、皮或种籽中,对提高血脂、调节脂类代谢、抗氧化等有明显的促进作用[1-2],在植物饲料添加剂开发方面具有广阔的前景。葡萄籽原花青素提取物(grape seed procyanidin extract, GSPE)主要由(+)儿茶素和(-)表儿茶素的二聚体或三聚体组成,因其原花青素含量较高而成为原花青素的主要来源[3-4]。原花青素具有改善畜禽肉品质的潜在作用[5]。张楠等[6]发现在玉米-豆粕型饲粮中添加GSPE可显著降低育成猪背最长肌内的肌苷酸含量,提高猪肉鲜味。杨文军等[7]报道,饲粮中添加40 mg/kg体重的GSPE可有效提高羔羊屠宰性能,改善羊肉品质。李德鹏等[8]观察到GSPE能通过抑制脂质合成,减少绵羊前脂肪细胞脂质沉积。Pascual-Serrano等[9]发现服用GSPE的肥胖大鼠白色脂肪组织(WAT)中脂肪细胞变小,高血脂症也有所缓解。畜禽体脂沉积是影响畜禽产品品质的因素之一,伴随着人们对饮食健康的逐渐重视,肉类制品中的脂肪含量也随之成为消费者关注的焦点[10]。目前的研究表明,GSPE可以显著抑制动物的脂肪沉积并改善脂质代谢。尽管GSPE对畜禽肉品质的影响已有初步研究,但关于其在脂肪沉积和脂质代谢机制方面的研究尚不完善。脂质代谢系统可以通过无翅型MMTV整合位点家族3a(Wnt3a)/β-连环蛋白(β-catenin)途径来调节脂肪细胞中脂质代谢基因的表达,进而调控脂质代谢和脂肪沉积[11]。因此,本研究以肥胖模型大鼠为研究对象,探讨GSPE能否降低肥胖鼠体脂沉积、脂肪肝、缓解高血脂并探究Wnt3a/β-catenin信号通路是否在其中发挥作用,为通过营养手段调控畜产品质量提供科学依据。
1 材料与方法
1.1 试验材料
雌性SD大鼠购自北京维通利华实验动物技术有限公司;基础饲粮(大小鼠生长繁殖饲料Q/CYKAF 002—2018)和高脂饲粮由北京科奥协力饲料有限公司提供;GSPE由天津尖峰天然产物研究开发有限公司提供,原花青素含量≥95%;cDNA反转录试剂盒(RR047A)和染料法荧光定量试剂盒(RR420B)由大连TaKaRa公司提供;Wnt3a酶联免疫试剂盒和β-catenin酶联免疫试剂盒购自上海酶联生物科技有限公司;二辛可宁酸(BCA)蛋白浓度测定试剂盒(P0010S)购自上海碧云天生物科技有限公司。
1.2 试验仪器
微量移液器[赛默飞世尔科技(中国)有限公司/中国艾本德];多功能酶标仪(澳大利亚Tecen Austria GmbH);7500荧光定量PCR仪(美国ABI);高速低温离心机(德国Sigma);手持式组织匀浆机(北京大龙兴创实验仪器有限公司)等。
1.3 试验设计
1.3.1 试验饲粮
基础饲粮组成参见商品饲粮说明;高脂饲粮组成为15.00%猪油、12.00%全脂乳粉、13.00%蛋黄粉、1.00%胆固醇和59.00%基础饲粮。基础饲粮及高脂饲粮营养水平见表1。

表1 基础饲粮及高脂饲粮营养水平
1.3.2 大鼠分组及样品采集
52只5~7周龄(体重170~220 g)雌性SD大鼠被单笼饲养在环境温度为(21±4) ℃、室内湿度为(60±5)%、通风良好、持续12 h明/12 h暗循环照明周期的动物房中,试验期间大鼠随意摄入食物和水。适应性饲养1周后,将大鼠随机分成2组:对照组(n=22)和高脂组(n=30),分别饲喂基础饲粮和高脂饲粮,每周记录采食量并称量体重1次。饲养8周后,从对照组中选出20只体重相近的大鼠随机分成2组(n=10),分别为Ⅰ组和Ⅱ组;同时,淘汰高脂组中增重较低的肥胖抵抗型大鼠,以体重大于正常组的平均体重±1.96倍标准差为建模成功标准,将体重符合建模要求的20只肥胖敏感型大鼠随机分为2组(n=10),分别为Ⅲ组和Ⅳ组。用生理盐水溶解GSPE,Ⅰ组和Ⅲ组大鼠用生理盐水灌胃,Ⅱ组和Ⅳ组大鼠均按500 mg/kg体重剂量用GSPE溶液灌胃。GSPE干预5周,每周日记录大鼠采食量及体重1次,试验期间大鼠均被单笼饲养。在处死大鼠前,禁食12 h,处死当日称量大鼠终体重及采食量后,用无水乙醚麻醉大鼠并进行眼球取血,2 400 r/min离心1 min后分离血清,保存于-80 ℃冰箱。迅速剖取WAT、肝脏、脾脏、肾脏、腿肌称量后保存于液氮中,后转移到-80 ℃冰箱保存。
1.4 测定指标及方法
1.4.1 脏器重量
试验结束后,将剖取的WAT、肝脏、脾脏、肾脏、腿肌用生理盐水冲洗干净,电子天平准确称重。
1.4.2 血清生化指标
使用南京建城生物工程研究所的试剂盒测定血清中高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及葡萄糖(Glu)含量。
1.4.3 WAT中Wnt3a和β-catenin含量
使用无水乙醇将大鼠WAT在4 ℃低温匀浆后离心取上清液,使用BCA试剂盒检测上清液蛋白浓度,根据吸光度(OD)值使用酶联免疫试剂盒检测WAT中Wnt3a和β-catenin含量。
1.4.4 WAT中脂肪合成相关基因表达量
用TRIZOL试剂分离WAT中的总RNA,对RNA样品进行提纯,并在-80 ℃冷冻直至进行分析。根据制造商的说明,使用Prime Script RT试剂盒,在去除基因组污染后通过逆转录5 μL总RNA合成cDNA。靶基因的引物序列根据已发表的GenBank设计,由上海生工生物工程有限公司合成(表2)。本研究中,β-肌动蛋白(β-actin)被用来标准化目的基因的表达。瞬时离心样品,并在实时荧光定量PCR设备上以匹配的程序进行40个循环:95 ℃ 5 s,60 ℃ 34 s。所有PCR反应每个样品均进行3个平行,并且通过2-ΔΔCt法计算过氧化物酶体增殖剂激活受体γ(PPARγ)和脂肪酸合成酶(FAS)基因相对表达量。

表2 脂肪沉积相关基因引物序列
1.5 数据统计分析
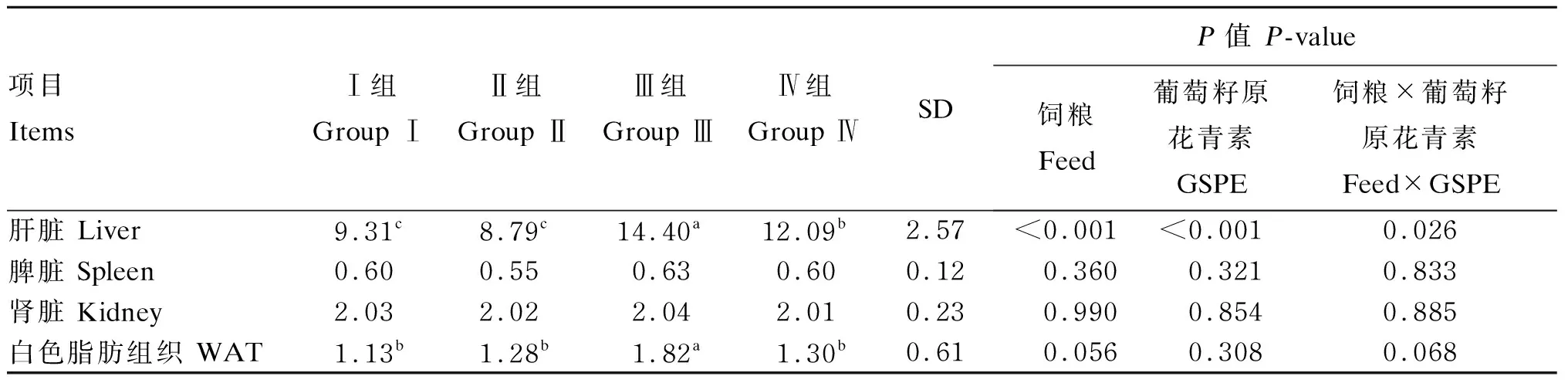
采用SAS 9.2软件处理数据,试验前期建造大鼠肥胖模型时采用独立样本t检验对试验数据进行两两比较;试验结束后,对试验数据进行多因素方差分析。数据以平均值±标准差的形式表示,当P<0.05时为差异显著,当0.05 由表3可知,经过8周的饲喂,高脂组造模后体重显著高于对照组(P<0.05),肥胖大鼠模型建立成功。 表3 建模阶段大鼠的体重变化 由表4可知,高脂饲粮显著增加大鼠肝脏重量(P<0.05),对WAT重量具有增加的趋势(0.05 表4 GSPE对肥胖大鼠脏器重量的影响 由表5可知,高脂饲粮显著降低血清HDL-C含量(P<0.05),显著增加血清LDL-C含量(P<0.05),并对血清Glu含量有增加的趋势(0.05 表5 GSPE对肥胖大鼠血清生化指标的影响 由表6可知,高脂饲粮显著上调WAT中PPARγ基因相对表达量(P<0.05),对FAS基因相对表达量无显著影响(P>0.05)。此外,GSPE显著下调WAT中PPARγ基因相对表达量(P<0.05),对FAS基因相对表达量有下调趋势(0.05 表6 GSPE对肥胖大鼠WAT中脂代谢基因相对表达量的影响 由表7可知,高脂饲粮对WAT中Wnt3a及β-catenin含量均无显著影响(P>0.05),而GSPE显著降低WAT中Wnt3a及β-catenin含量(P<0.05)。此外,高脂饲粮与GSPE对WAT中Wnt3a及β-catenin含量的影响均存在显著交互作用(P<0.05)。对Wnt3a及β-catenin含量进一步单因素方差分析,与Ⅰ组相比,Ⅲ组WAT中Wnt3a含量显著升高(P<0.05),Ⅱ组、Ⅳ组无显著差异(P>0.05);与Ⅲ组相比,Ⅳ组显著降低(P<0.05)。与Ⅰ组相比,Ⅲ组WAT中β-catenin含量显著升高(P<0.05),Ⅳ组显著降低(P<0.05),Ⅱ组无显著差异(P>0.05);与Ⅲ组相比,Ⅳ组显著降低(P<0.05)。 表7 GSPE对大鼠WAT中Wnt3a和β-catenin含量的影响 畜禽肉品质与脂质代谢密切相关[12],因此对于脂质代谢及脂肪沉积方面的研究至关重要。据报道,饮食中摄入过量的脂肪酸和胆固醇会影响血液胆固醇代谢,表现为血清中LDL-C含量异常升高及HDL-C含量降低[13]。而研究表明GSPE干预会促进体内的降胆固醇作用[14]。本试验结果表明,GSPE可显著下调肥胖模型大鼠血清中的LDL-C含量并使HDL-C含量升高。据报道,脂肪沉积与血清中LDL-C含量升高有关[15]。本试验中,采用GSPE干预可以显著缓解高脂饲粮所致大鼠WAT重量的升高,这与前人研究结果[16]一致。本试验同时发现,GSPE可显著降低肥胖大鼠的肝脏重量并对其他器官重量无显著影响。这表明GSPE可抑制脂肪沉积,降低肥胖大鼠患高血脂及脂肪肝的风险性。PPARγ途径是调控脂肪细胞中的脂质沉积的重要途径之一[17]。PPARγ是许多脂肪合成基因的关键转录调节因子,它通过激活脂肪形成程序并将脂肪酸存储在脂滴中,从而在脂肪细胞增殖和分化过程中发挥重要作用,脂质累积的过程中往往伴随着PPARγ基因过度表达[18-19]。FAS是一种多功能脂肪合成关键靶基因,通过抑制FAS基因表达可抑制脂肪酸的从头合成[20]。此外,FAS还可以通过提高PPARγ转录活性来参与脂肪合成[21]。研究表明,PPARγ特异性缺失可能影响脂肪在肝脏组织中的形成机制,降低FAS基因表达水平,减少肝脏脂肪沉积[22]。Lu等[23]还在体内试验中发现,GSPE可有效地抑制饲喂高脂饲粮的草鱼肝脏内PPARγ的mRNA表达量。本试验中观察到GSPE干预后的肥胖大鼠WAT重量减少以及WAT中脂肪酸合成基因FAS和PPARγ的基因相对表达量下调。以上结果表明,GSPE可以通过下调WAT内脂肪合成基因表达至正常水平来降低体内WAT含量,与本试验中GSPE降低WAT含量的结果一致。 脂质积累过多是引起脂肪细胞功能障碍的主要原因之一[24]。Wnt3a是重要的分泌蛋白,已被证实在细胞发育增殖、脂质代谢等生理过程中有重要作用[25]。作为Wnt3a途径中的主要细胞质效应子,β-catenin由细胞质转位至细胞核是Wnt3a信号转导的关键步骤[26]。Wnt3a可与其受体低密度脂蛋白(LDL)受体相关蛋白(LRP)5/6及卷曲蛋白(Fz)相结合,使β-catenin稳定,启动Wnt3a/β-catenin信号通路[27]。研究表明,Wnt3a/β-catenin信号通路参与肥胖的合成,抑制Wnt3a的表达,阻断Wnt3a/β-catenin信号通路可以促进脂肪细胞凋亡[26,28]。有报道称,植物多酚可通过抑制Wnt3a/β-catenin信号通路抑制结肠癌细胞增殖分化[29]。Joven等[30]发现植物多酚可以调节肝脏中miRNA-103的表达量,而miRNA-103具有通过靶向抑制Wnt3a的表达来缓解脂肪沉积的功能[26],因此植物多酚对脂肪形成的抑制作用可能与Wnt有关[31]。在本研究中,GSPE下调了WAT中Wnt3a及β-catenin的含量,这意味着GSPE可能通过抑制Wnt3a与LRP的结合,进而抑制Wnt3a/β-catenin信号通路而破坏大鼠脂肪细胞的增殖分化。由此可见,GSPE可能通过抑制Wnt3a/β-catenin信号通路来抑制大鼠脂肪细胞的增殖和分化。 GSPE能够缓解肥胖大鼠脂肪肝、高血脂,抑制肥胖大鼠脂肪沉积,并对其他器官重量无显著影响。Wnt3a/β-catenin信号通路可能参与了GSPE对肥胖大鼠脂肪形成的抑制作用。2 结果与分析
2.1 高脂饲粮诱导肥胖大鼠模型的建立

2.2 GSPE对肥胖大鼠脏器重量的影响
2.3 GSPE对肥胖大鼠血清生化指标的影响

2.4 GSPE对肥胖大鼠WAT中脂质代谢相关基因相对表达量的影响

2.5 GSPE对肥胖大鼠WAT中Wnt3a和β-catenin含量的影响

3 讨 论
3.1 GSPE对肥胖大鼠脂质代谢的影响
3.2 GSPE对肥胖大鼠WAT中Wnt3a/β-catenin信号通路的影响
4 结 论

