水稻表皮毛发育相关基因研究进展
冯连杰 安文静 刘迪 刘亚菲 王凯婕 梁卫红
(河南师范大学生命科学学院,新乡 453007)
表皮毛是广泛分布于植物表面的一种特殊结构,由表皮细胞分化形成[1]。作为植物表面与环境之间的屏障,表皮毛增加了植物组织表皮厚度,帮助植物减少水分流失、增强抗冻能力,具腺体的表皮毛还可通过分泌次生代谢产物使植物获得生化保护,从而增强植物的抗逆能力[2]。水稻叶片和颖壳表面普遍存在表皮毛,可分为长毛、微毛和腺毛,长毛主要分布在维管束的硅质细胞上,而微毛和腺毛主要分布在气孔或运动细胞的周围[3],还有专家将水稻表皮毛细分为长毛、钩毛、刺毛、纤细毛和锯齿毛等类型[4],不同类型的表皮毛在一定程度上反映了水稻品种与其生存环境的适应关系。但具有表皮毛的毛叶水稻在收割晾晒过程中会产生大量扬尘,造成空气污染的同时还易引起农事人员眼睛及皮肤过敏、呼吸道感染等,危害身体健康,妨碍农业生产,而缺乏表皮毛的优质高产光叶水稻的培育和推广是解决这一问题的有效途径[5]。光叶稻作为一种重要的种质资源,大多茎秆粗壮、具有较强抗倒伏能力,对高光强适应性强、成穗率高、籽粒饱满、米质优良,后代杂交优势明显等特点[6],尤其是因叶片、茎秆、叶鞘、颖壳等表面光滑无毛,不仅适合现代农业的机械化操作,而且可增加单位体积稻米的仓储量,提高运输效率,更适合现代化农业机械操作[7]。
与拟南芥相比,对水稻表皮毛发育相关基因的挖掘目前仍然很有限,表皮毛发育的分子调控网络很大程度上并不明确。由于表皮毛发育相关基因的突变可导致水稻产生光叶表型,因此,水稻表皮毛相关基因的鉴定以及表皮毛发育机制的研究具有重要意义。近年来,一些水稻表皮毛相关基因相继被鉴定或克隆,已有的研究结果显示,水稻表皮毛发育与相关基因的表观遗传修饰[8-11]、启动子序列突变[12-14]、编码蛋白质序列变化[15-17]有关,此外还涉及细胞器功能异常[18-20]、激素信号通路变化[14]等多种途径。本文总结了近年来水稻表皮毛相关基因及其功能的研究进展、已知的水稻表皮毛发育调控途径,并对水稻表皮毛发育相关基因研究的前景及应用进行展望。
1 已知的表皮毛发育相关基因
现有的研究认为,植物表皮毛相关的正负调控因子的平衡决定了表皮毛的发生[21]。在模式植物拟南芥中,已发现的正调控因子主要有GL1[22]、GL3[23-24]、EGL3[25]、TTG1[26]。GL1是最先被克隆的基因,编码R2R3 MYB蛋白,在表皮毛发育初期特异表达,gl1突变体表现出表皮毛缺失或减少的表型[22]。GL3和EGL3编码bHLH蛋白,gl3和egl3单突变体均表现为表皮毛减少,gl3 egl3双突变体则表现为表皮毛缺失,表明GL3和EGL3存在功能冗余[23-25,27]。TTG1编码WD40重复序列蛋白,该基因的强等位突变体ttg1表现为无毛,而弱等位突变体则表现为表皮毛簇生[26]。由于上述这些基因突变后拟南芥表皮毛减少或缺失,表明它们对表皮毛发育具有正调控作用。
拟南芥中已发现的负调控因子主要有TRY[28]、CPC[29]、ETC1[30]和ETC2[30],它们都属于R3型MYB蛋白,其中TRY和CPC是主要的负调控因子,调控拟南芥叶片表皮毛的发育,try突变体表现为表皮毛簇生[28];cpc突变体表皮毛数量增多[29];ETC1和ETC2主要在茎表皮毛中起负调控作用,其中etc2突变体表皮毛增多,etc1突变体尽管没有明显的表型,但能增强CPC和TRY在表皮毛发育中的作用。当同时突变TRY、CPC、ETC1和ETC2后,拟南芥表皮毛剧增[30],表明这些基因对表皮毛发生具有抑制作用。
关于拟南芥表皮毛发育机制,曾提出激活-抑制模型(the activator-inhibitor model)[31]和激活(底物)-消耗模型(the activator-substrate model)[32],Balkunde[33]认为目前的研究结果皆适用于上述两个模型,即在拟南芥表皮毛发育过程中存在一个MBW复合体(GL1/ MYB23-GL3/EGL3-TTG1)来启动表皮毛的发育,该复合体还负责调控TRY、CPC、ETC1和ETC2等负调控因子转移至相邻的非表皮细胞,并与GL1竞争性的结合GL3,使相邻细胞由于GL3缺失而导致MBW复合体的含量降低,从而抑制表皮毛的发生[33-34]。随着表皮毛发育研究的不断深入,上述模型相继得到拓展。从组蛋白修饰方面进行的研究发现,组蛋白乙酰转移酶GCN5通过组蛋白乙酰化修饰,上调GL1、GL2、GL3和CPC的表达水平,从而促进了表皮毛的形成[35]。最近,Huang等[36]的研究发现,组蛋白去甲基化酶JmjC家族成员JMJ29可以直接结合在GL3基因的启动子上,激活该基因的表达,同时JMJ29还间接调控了GL1和GL2基因的表达,最终促进了表皮毛的发育。同时,mRNA稳定性调控方面的研究也取得重要进展,如Wei等[37]发现表皮毛发育相关基因转录产物的稳定性维持和转录因子ETC2相关,ECT2可结合于mRNA上的m6A(N6-methyladenosine)修饰位点,不仅在核内参与其3′UTR的加工,而且调节mRNA在胞质中的稳定性,敲除ECT2后,加速了表皮毛发育相关基因TTG1,ITB1和DIS2转录产物的降解,从而影响表皮毛的分枝。最近的研究还发现GL1基因3′端UTR区的一段153 bp的序列可能通过影响其mRNA的稳定性和转录激活特性,在表皮毛形成过程中具有重要作用[38]。一些研究还发现表皮毛发育过程涉及蛋白质降解的调控,如E3泛素蛋白连接酶UPL3可通过促进GL3和EGL3的降解,抑制表皮毛的形成[39]。另有一些研究将转录因子和激素信号之间的联系建立起来,如RAV家族转录因子TEM1和TEM2通过控制赤霉素(GA)在叶肉细胞中的累积,抑制表皮毛发育的起始,且TEM2的抑制作用强于TEM1[40]。上述研究表明,组蛋白修饰、mRNA稳定性的调控、蛋白质降解过程以及转录因子、植物激素都可以通过调节表皮毛发育正负调控因子的表达,进而调控MBW复合体的构建以及在细胞中的含量,从而指导拟南芥表皮毛的形成。尽管现有研究已经建立了拟南芥表皮毛发育的核心模型,但具体的调控网络仍不清楚[41]。
与拟南芥相比,目前对水稻表皮毛的研究还有待深入,分离鉴定的相关基因或QTL仅涉及表皮毛发育的正向调控过程。已知的相关基因主要有OsWOX3B(GLR1、NUDA/ GL-1/dep、GL5)[8-11]、GL6(HL6)[12-14]、glr2[15]、GLR3(OsSPL10)[16-17]、gl1[18-19]、GLL[20]等(表1),这些基因的突变往往导致水稻叶片与颖壳表皮毛减少或缺失。
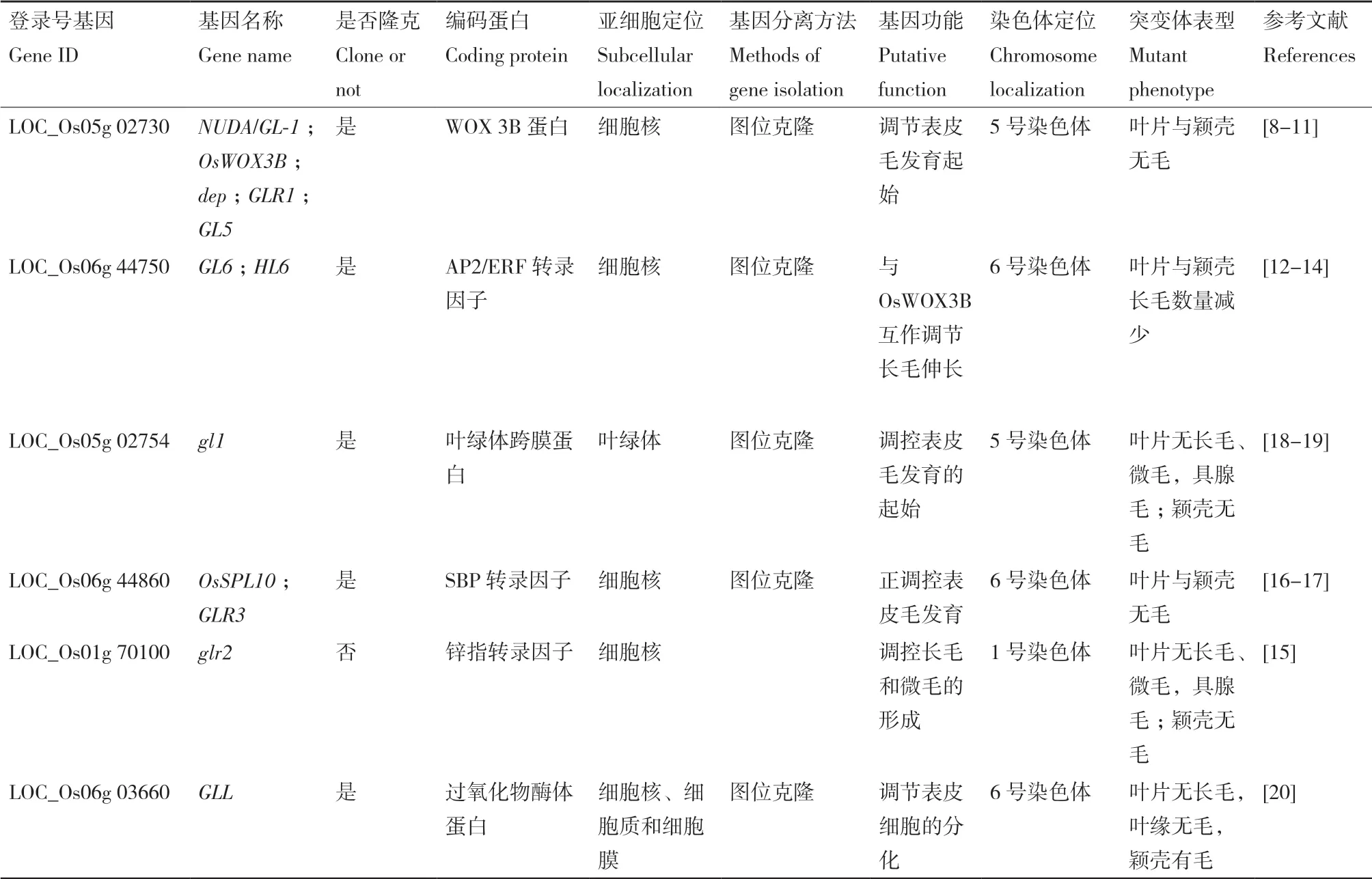
表1 水稻表皮毛发育已知基因Table 1 Known genes for rice trichomes development
最早被关注的水稻光叶基因是OsWOX3B/GLR1/NUDA/GL-1/dep/GL5,该基因的报道分别来自不同实验室的独立研究,其中Li等[8]利用美国水稻品种Rico No. 1和光叶水稻品种Jia64构建了光叶稻的近等基因系(NIL),将光叶基因GLR1精细定位在5号染色体标记M6与M7之间的21 kb内,对GLR1进行互补实验发现,减弱GLR1表达量可导致表皮毛数量显著减少或完全消失,并且在敲除株系NILglr1中组成型表达GLR1能够弥补T0代NILglr1的无毛表型[8-9]。Zhang等[10]对另一个光叶基因NUDA/GL-1的研究显示,光叶性状受该基因隐性遗传控制,NUDA/GL-1与WUSCHEL-like基因OsWOX3B同源,但OsWOX3B基因在具毛水稻品种TN1和光叶稻品种HMK中并没有DNA水平的差异,因而推测NUDA/GL-1产生的无毛表型可能由表观遗传修饰引起[10]。Angeles-Shim等[11]也发现了该光叶基因并将其命名为dep,其编码蛋白WOX 3B定位于细胞核中,然而对无毛品种与具毛品种的dep序列比较并未发现差异,提示控制光叶性状的dep基因可能也涉及表观遗传修饰作用的调节。但是究竟是何种表观遗传修饰在控制OsWOX3B/GLR1/ NUDA/GL-1/dep/GL5的表达尚未见报道。
光叶基因HL6/GL6编码含AP2保守结构域的蛋白,对该基因的研究也来自不同实验室的报道,其中Sun等通过互补实验证明HL6以剂量依赖性调节长毛的生长,HL6过表达会导致水稻叶片表皮毛更长,并推测HL6的启动子序列变异可能是ZS97与W39水稻分别产生无毛和多毛表型的原因[12]。Zeng等将GL6定位在6号染色体,其编码蛋白GL6位于细胞核内,GL6可与丝氨酸/苏氨酸蛋白激酶OSK3或COP9复合体(CSN)的亚基CSN5相互作用[13-14],尽管OSK3功能尚不明确,但已知COP9信号体复合体在调控基因表达、细胞发育和细胞周期等方面都发挥着重要作用[42],提示GL6蛋白可能在细胞核中与CSN5结合,参与形成CSN复合物,调节表皮毛发育进程。
基于光叶水稻突变体glr2的研究,Wang等[15]将突变基因定位于1号染色体的84.7 kb区间,并对其间的12个候选基因进行qRT-PCR检测分析,结果显示Loc_Os01g70100、Loc_ Os01g70080和Loc_Os01g70110在野生型与突变体中表达水平存在较大差异,其中Loc_Os01g70100编码一个锌指转录因子。由于已知在拟南芥中有4种锌指转录因子(GIS1,GIS2,ZFP5,ZFP8)与表皮毛发生有关[43-44],因而推测Loc_Os01g70100可能与水稻的光叶表型有关。
在籼稻品种R401辐射诱变过程中筛选到一个光叶突变体glr3[16],该突变体表现为叶片无毛且边缘无钩毛、颖壳无毛,该性状受定位于6号染色体上的隐性基因GLR3控制,GLR3属于SBP-box基因家族成员,与OsSPL10为同一个基因。Lan等[17]分别构建了OsSPL10的突变体与过表达水稻发现,OsSPL10功能丧失导致了水稻叶片与颖壳无毛,以及更高的耐盐性,而过表达的OsSPL10则导致水稻表皮毛密度高于野生型,且对盐具有高敏感性,据此推测OsSPL10可能是控制表皮毛发育起始过程中的一个转录因子。
光叶基因gl1-1也是来自辐射诱变水稻品种93-11制备的光叶突变体,该基因定位于5号染色体,序列对比发现,与野生型序列相比,gl1-1基因的序列仅在Os05g0118900(Loc_Os05g02754)的5′UTR区存在一个A→T的点突变,这一突变引起了RNA二级结构发生剧烈变化,导致该突变体表现出颖壳无毛、叶片无宏毛和微毛的表型[18-19]。王启钊[45]等进一步证明gl1-1编码一个叶绿体跨膜蛋白,但迄今该基因与表皮毛发育之间的联系尚未阐明。
还有一些光叶基因的分离来自T-DNA标签技术制备的光叶突变体,如定位在6号染色体上的GLL基因[20],GLL主要在细胞核中表达,属于PEX11基因家族成员。已知PEX11家族编码过氧化物酶体蛋白,而植物中过氧化物酶体是极长链脂肪酸β-氧化的唯一场所[46],所以该基因可能与脂类代谢相关。有研究显示,与长链脂肪酸相关基因的异常表达可提高细胞内极长链脂肪酸的含量,从而导致叶表皮毛细胞的程序性死亡[47],据此推测GLL可能通过参与极长链脂肪酸的代谢过程,影响叶片表皮细胞的分化,并最终决定表皮毛的存亡。
2 水稻表皮毛发育的分子机制
水稻表皮毛的发育是一个十分复杂的过程,尽管一些水稻表皮毛相关基因陆续得到定位与克隆,但水稻表皮毛发育的分子机制很大程度上仍是未知的。对水稻光叶基因的研究显示,表观遗传修饰作用于一些基因可导致光叶表型,如OsWOX3B/GLR1/NUDA/GL-1/dep/ GL5[8-11];一些基因表达水平的改变也可导致光叶表型,如GL6/HL6[12-14];多种转录因子编码基因的突变也可以导致光叶表型,如编码锌指转录因子基因glr2[15]和SBP蛋白编码基因GLR3(OsSPL10)[16-17]。此外,一些细胞器相关基因突变也会导致光叶表型,如编码叶绿体跨膜蛋白的基因gl1[18-19]和编码过氧化物酶体蛋白的基因GLL[20]。与拟南芥类似的是,在水稻中也发现植物激素涉及表皮毛的发育,目前已知的是生长素信号与表皮毛发育相关,如HL6通过诱导生长素相关基因OsYUCCA5、OsPIN1a、OsARF4、OsARF7和OsIAA21的表达,促进表皮毛的伸长,并通过与OsWOX3B物理结合加强这一促进效应[14](图1)。
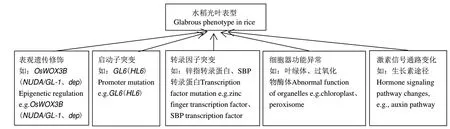
图1 水稻光叶表型获得的主要途径Fig. 1 Main pathways to obtain glabrous leaf phenotype in rice
在拟南芥中,除多种表皮毛发育正向和负向调节因子外,表皮毛的发育还受细胞周期调控因子和赤霉素、茉莉酸等多种植物激素的影响[48-51],为水稻表皮毛发育机制的研究提供了借鉴和参考。值得关注的是,现有的研究显示单子叶植物与双子叶植物的表皮毛调控网络也存在一定的差异,如水稻OsTCL1与拟南芥AtTCL1属于同源基因,AtTCL1过表达拟南芥的表皮毛形成被抑制,但是OsTCL1过表达水稻与对照水稻相比,表皮毛并没有出现明显差异[52]。
3 总结与展望
目前对水稻光叶基因的研究多以光叶突变体为材料,通过经典的图位克隆确定相关QTL,进一步分离突变基因,并采用转基因技术鉴定基因在表皮毛发育中的功能。拟南芥中,激活-抑制模型和激活(底物)-消耗模型得到越来越多的实验结果印 证,在水稻中是否也存在类似的模型来解释表皮细胞分化的命运,并指导水稻表皮毛的形成尚不清楚,因此有必要对水稻表皮毛发育相关基因开展更为系统深入的研究,阐明水稻表皮毛发育的分子机制和调控网络,解析光叶表型形成的分子基础,为光叶稻的育种奠定理论基础。
发掘新的水稻光叶相关基因,并将已知的水稻光叶基因运用到光叶稻育种中进行高效、精准的改良具有重要意义,同时也富有挑战性。随着CRISPR/Cas9基因编辑等技术的发展,水稻功能基因鉴定和应用的步伐加快,如Wang等[53]以籼粳杂交稻春优84作为水稻无融合生殖研究的模式品种,利用CRISPR/Cas9基因编辑技术敲除了其中的REC8,PAIR1,OSD1 和 MTL4个水稻生殖相关基因,建立了水稻无融合生殖体系,成功克隆出杂交稻种子,首次实现杂交稻性状稳定遗传到下一代,不仅证明了杂交稻进行无融合生殖的可行性,而且证明了CRISPR/ Cas9技术在水稻高效精准分子设计育种中的重大理论意义以及广阔的应用前景。近期本实验室通过CRISPR/Cas9技术构建了OsRhoGAP2基因编辑水稻,其中一个纯和株系就出现光叶表型[54]。现有的报道显示,水稻光叶突变体表型复杂多样,同一光叶稻基因不仅可以控制表皮毛的发育,还可控制表皮毛的种类;相同的等位基因在不同的遗传背景下,也可导致水稻产生的不同的光叶表型,因此分离鉴定光叶表型相关基因,深入剖解其作用机制,将有助于充分利用基因资源开展分子设计育种,创制新的光叶水稻品种,服务生产。

