基于信号肽策略提高外源蛋白在枯草芽孢杆菌中的表达
苗华彪 曹艳 杨梦瀚 黄遵锡
(1. 云南师范大学生命科学学院,昆明 650500;2. 生物能源持续开发利用教育部工程中心,昆明 650500)
与大肠杆菌和酵母菌相比,枯草芽孢杆菌表达系统研究起步较晚,但因其具有:安全、蛋白分泌能力强、易于高密度发酵、遗传背景清晰和被认为是安全菌株(generally recognized as safe,GRAS)等优势,使其成为基因表达系统研究热点之一[1-3]。枯草芽孢杆菌作为表达宿主菌可以将蛋白分泌到胞外培养基中,这一过程由位于外源蛋白N末端的信号肽来完成,它可以正确的将外源蛋白导向分泌装置,在蛋白分泌过程中起着不可替代的作用[2,4]。目前,只有少数外源蛋白在枯草芽孢杆菌表达系统中实现了高效表达,但还有大多数外源蛋白的分泌和表达效果不理想。其中枯草芽孢杆菌信号肽的氨基酸组成、类型和分泌途径均会对外源蛋白分泌的效率产生影响,合适的信号肽是保证外源蛋白在枯草芽孢杆菌高效表达的关键因素之一。基于信号肽的策略提高外源蛋白的分泌量是切实可行的,并且往往会取得意想不到的效果[5-6]。虽然科学家们对枯草芽孢杆菌信号肽进行了坚持不懈的探究,但仍然存在许多尚未解决的问题。本文综述了枯草芽孢杆菌信号肽的最新研究进展,重点讨论了一般分泌途径(general secretion pathway,Sec)和双精氨酸分泌途径(twin-arginine traslocation pathway,Tat)信号肽的结构特点、分类、分泌机制及其在提高外源蛋白表达方面的实际应用。同时总结了信号肽在枯草芽孢杆菌表达系统中应用的问题和展望,以期为通过信号肽的策略提高外源蛋白在枯草芽孢杆菌中的高效表达提供一定的参考。
1 信号肽的概述
四十多年前蛋白质合成后的转移与定位是不为人知的,直到1975年Blobel等[7]正式提出信号假说(signal hypothesis)后,才得以解决。其认为游离核糖体是开始合成分泌蛋白的场所,新合成的蛋白质有一个内源性的信号肽,可以与内质网膜识别并结合,紧随其后的新生肽链则不断延伸并通过内质网膜,合成完成后信号肽则被信号肽酶(signal peptidase,SPase)水解[7],此后,信号识别颗粒(signal recognition protein,SRP)及其受体(SRP receptor,SR)的发现完善了该假说[8-9]。随后大量的研究表明信号肽的作用机理普遍存在于动植物和微生物中,进而使其成为一个系统的理论,Blobel也因此获得了1999年的诺贝尔生理学或医学奖[4]。信号肽的提出为研究蛋白质的空间属性这一新领域开辟了道路,也为研究蛋白质的结构和功能奠定了基础[7-9]。
2 枯草芽孢杆菌信号肽分泌途径
由于枯草芽孢杆菌缺乏外膜结构,分泌蛋白会转运到胞外培养基中,保证分泌蛋白的正确定位和转移则由信号肽来完成[2]。枯草芽孢杆菌可以将300多种蛋白分泌到胞外[2-4],至少包含4种类型的蛋白分泌途径,分别为:Sec分泌途径、Tat分泌途径、假菌丝蛋白输出途径(Pseudophilin pathway,Com)和ATP结合盒转运子途径(ATP-binding cassette transporter,ABC)[4]。其中Sec和Tat分泌途径的信号肽占整个枯草芽孢杆菌的90%以上,为此将重点讨论这两种分泌途径的信号肽。
2.1 Sec分泌途径
2.1.1 Sec分泌途径信号肽的类型 Sec分泌途径是枯草芽孢杆菌最主要的分泌途径,主要转运未折叠的蛋白质。由于信号肽预测软件的算法不同,对信号肽的分类也会存在一定的差异。通常根据SPase切割底物特异性不同可分为两类:I型信号肽,是由I型信号肽酶(Lep)进行切割的信号 肽[4,10-11],Tjalsma等[10]总结了这种信号肽有166种,Brockmeier等[12]总结了173种;II型信号肽,是由II型信号肽酶(LspA)进行切割的一类脂蛋白信号肽[11,13],据 Tjalsma等[11]报道有114种。随着对枯草芽孢杆菌信号肽的不断研究,目前可在信号肽数据库(http://www.signalpeptide.de/index.php)中查询到的枯草芽孢杆菌来源的信号肽已有244种,在Tjalsma等[11]报道的基础上新增了61种。
2.1.2 Sec分泌途径信号肽的结构 对Sec分泌途径的信号肽基本性质进行统计,发现I型信号肽长度在17-45 aa之间,平均长度接近28 aa;II型信号 肽 更 短(13-38 aa),平 均 长 度 不 足20 aa(图 1-A)[4-5,11]。虽然信号肽的一级结构之间没有直接相关性,但其二级结构还是有一定的规律可循。利 用SignalP 3.0(http://www.cbs.dtu.dk/services/SignalP-3.0/)和Phobius(http://phobius.sbc.su.se/)信号肽预测网站可将信号肽分为3段不同的结构域:(1)N端结构域,通常含有1-5个带正电的氨基酸残基(R/K),这可能与转运过程中膜脂质双层中带负电荷的磷脂相互作用有关[11]。(2)H端结构域,是由7-15个疏水性氨基酸组成的螺旋结构,这种结构有利于信号肽插入膜中,有助于特定SPase的切割[2-3,11],而且H端结构域疏水性氨基酸占比高达80%左右,其中甘氨酸(G)、脯氨酸(P)、亮氨酸(L)和缬氨酸(V)出现频率最高[4,11]。(3)C端结构域位于信号肽的最末端,包含SPase切割位点,将信号肽从成熟蛋白上切割下来,成熟蛋白则可折叠成天然构象,信号肽则被移除和降解。通常,Lep信号肽的SPase识别位点是AXAA,LspA信号肽是LAAC,它与其他分泌型蛋白信号肽最大差异在于具有一个不变的半胱氨酸(C)残基,有助于脂蛋白的切割和锚定[4-5,11,14]。信号肽能够有效地被SPase识别并剪切的前提条件是C端必须具有一个β片状折叠延伸结构,且C端-2位的氨基酸残基通常具有体积小且无电荷的特点[4]。
2.1.3 Sec途径信号肽的分泌机制 Sec分泌途径一般分为4步完成(图1-B):(1)识别:首先,在核糖体上转录翻译后的基因,生成一条N端带有一段信号肽的多肽链,由SRP来完成对该多肽链的识别,并被膜受体(FtsY)引导至转运子[14]。其中,SRP是一个高度保守的蛋白-核酸复合物,它包括一个细胞质小RNA(scRNA)[15]、两个组蛋白类似物(HBsu)[16]和一个独立蛋白(Ffh)组成[11,16]。(2)易位:前体蛋白主要通过Sec转运酶完成跨膜,它由转运通道(SecYEG)[17]、马达蛋白(SecA)[17-18]和辅助蛋白(SecDF-YrbF)3部分组成[19-20]。其中,SecYEG蛋白是由SecY、SecE和SecG三个单体蛋白形成的膜结合异源三聚体,在蛋白转移中起辅助通道作用,只与蛋白分泌的效率有关[17]。Sec转运酶的能量来源是由马达组件SecA催化ATP的水解来提供,多数情况下SecA是以单体的形式存在,但SecA也存在其他的寡聚体结构形式来发挥同样的功能[21-22]。此外,SecA也可充当伴侣分子,直接将底物从合成位点转运到转运酶上,但这种仅由SecA构成的通道效率较低[21-22]。SecDF与同系物YrbF构成一个异源三聚体的辅助蛋白[23],作用是将前体蛋白从通道中提取出来[2-3],但某些前体蛋白(PhoB和YvaY)的分泌,需要另外一个同型二聚体辅助蛋白CsaA的参与[24]。(3)切除:前体蛋白跨膜转运后,位于N末端的信号肽需要被切除,否则,可能会影响到其他蛋白的易位,信号肽序列的切割是由膜结合蛋白SPase来完成,切除下来的信号肽不会一直存在,由SppA和TepA将其降解[2-4]。枯草芽孢杆菌染色体上存在多种SPase基因,多数情况下,1-2个基因的表达足以满足前体蛋白的加工和细胞活力[2-4],这种基因多样性保证了不同条件下蛋白分泌的灵活性。此外,SPase不仅具有切割功能,也参与枯草芽孢杆菌的产孢和贴壁生物膜的形成等生理反应[11,25]。(4)加工后修饰:转运蛋白的修饰、折叠和后续过程都会受到一些特定分子伴侣的影响。枯草芽孢杆菌具有细胞内和细胞外两种分子伴侣以单独或协同作用的方式加快蛋白质的折叠和组装,可以协助转运蛋白的聚集和维持转运前体蛋白的构象[21,26-28]。如脂蛋白(PrsA)属于细胞外伴侣,可促进成熟蛋白的折叠、稳定正确的蛋白构象[25]。分泌到膜外的蛋白,如果发生了错误折叠则由蛋白酶类进行降解。
2.2 Tat分泌途径
2.2.1 Tat分泌途径信号肽的类型和结构特点 Tat类信号肽作为枯草芽孢杆菌第二大分泌途径,数量少了很多[4,11,32],一般认为有24种这样的信号肽,其中有14种能被Lep信号肽酶所识别[11]。该类信号肽长度要明显大于Sec途径信号肽,N端结构域的长度是Sec途径信号肽的两倍,在N端和H端的连接处具有一个明显的保守序列++RR## (图1-C)[4-5,11];H端相比于Sec途径信号肽长度更长且疏水性要低[11];C端出现频率较高的氨基酸残基也和Sec途径信号肽不同[4-5,11]。
2.2.2 Tat途径信号肽的分泌机制 Tat分泌途径信号肽转运那些折叠迅速或已经在胞内折叠好的蛋白质[29-31],这些蛋白利用Sec分泌途径信号肽很难转运(图1-D)。与Sec分泌途径不同的是,目前,仅鉴定出PhoD、YwnN、QcrA和YkuE这4种底物蛋白是明确按照Tat途径进行分泌[29-31,33-36]。Tat系统可以处理高达150 kD的前体蛋白,但Tat途径中的各组件都比较小,这意味着它们需要组装成较大的复合物,以促进较大前体蛋白的跨膜通过[29,37]。与大肠杆菌相比,枯草芽孢杆菌Tat分泌途径拥有两套相互独立的通道蛋白复合物:由tatAdCd操作子所编码的TatA(230 kD)通道蛋白,它由在膜上成“ L形”排列的TatAd(7.4 kD)蛋白和具有6个跨膜螺旋的TatCd(28 kD)蛋白复合组成;及由tatAyCy操作子所编码的TatC(200 kD)通道蛋白,它由TatAy(6 kD)和TatCy(28.9 kD)两种蛋白组成;底物蛋白的易位,还需要枯草芽孢杆菌TatAc(6.7 kD)蛋白的帮助[37-38]。进行蛋白分泌时,首先转运酶复合物通过两亲性双螺旋结构形成一个比Sec途径孔道要大的直径为5-6 nm的跨膜Tat孔空结构,这也许是已折叠蛋白能够穿过该通道的一个重要原因[29-30]。之后,前体蛋白先与TatA/TatC相连的复合物相互作用,在跨膜pH梯度下,将折叠好的前体蛋白转移到Tat孔外[31],易位后,I型SPase裂解信号肽,成熟的蛋白质分泌到培养基中[29-31]。另外,Walther等[39]基于电区域(DCR)和两亲性螺旋(APH)的互补性,也提出了Tat分泌途径一种可能机制:这种Tat分泌途径的蛋白质被7个盐桥“拉链”,形成了一个易于穿过脂质双层的发夹结构。Tat途径已成为一种日益流行的运输途径,因为它将目标蛋白全折叠分泌到培养基中,从而降低了纯化成本,在生物技术应用方面的研究也越来越受到重视。
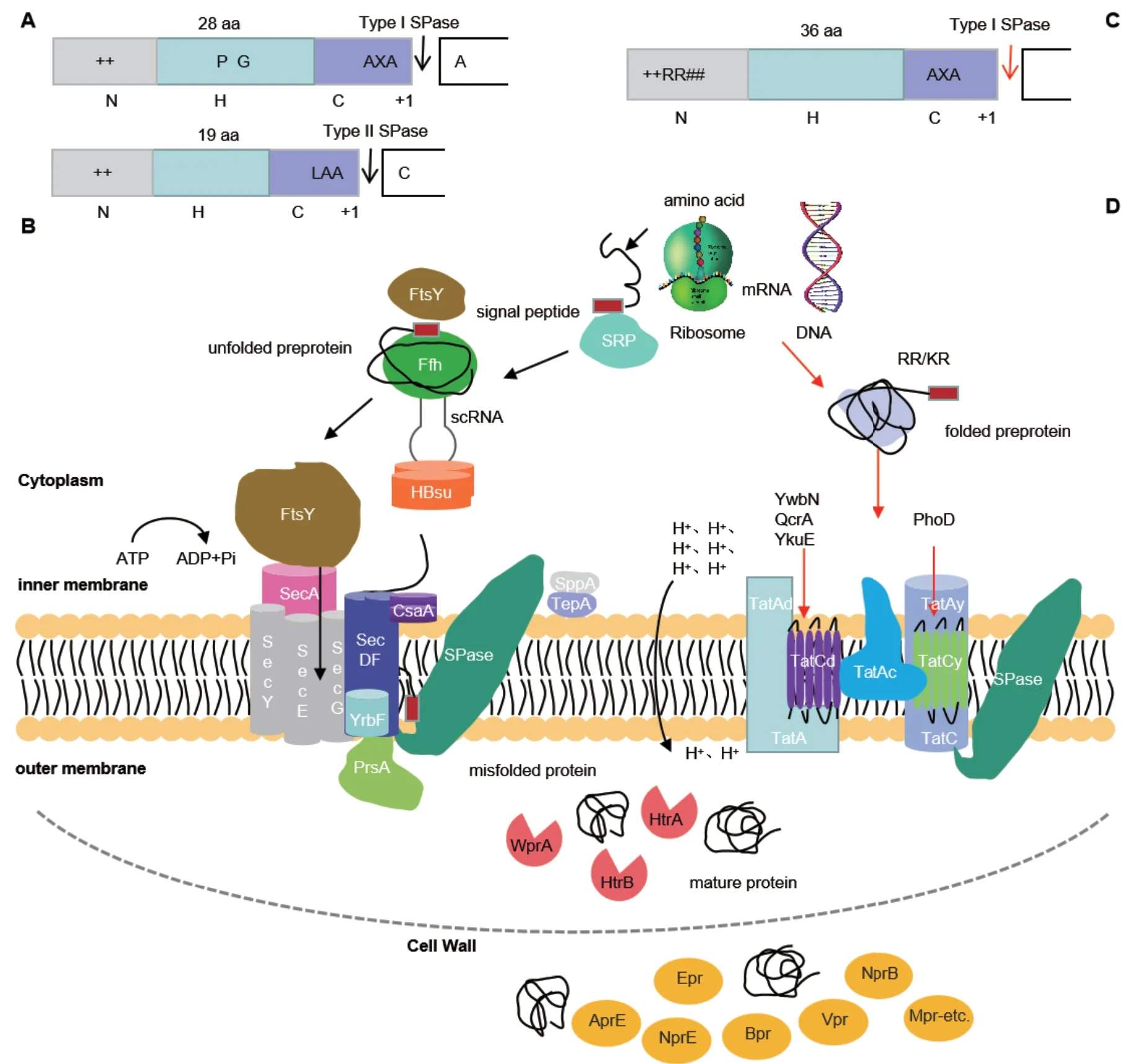
图1 枯草芽孢杆菌Sec和Tat分泌途径信号肽的主要特征和机制示意图(依据参考文献[2,5,21,27,29-31]绘制)Fig .1 Schematic diagram of the main characteristics and mechanism of the signal peptides about the secretory pathways of Bacillus subtilis Sec and Tat(Based on the references[2,5,21,27,29-31])
3 信号肽在提高外源蛋白分泌表达中的应用
3.1 基于对信号肽的直接替换提高外源蛋白的 表达
目前,对信号肽的应用仍然处于探索阶段,由于对分泌机制了解有限,准确预算出一个蛋白的最佳信号肽还较为困难。虽然研究人员开发了有助于信号肽选择的预测工具,但评分和蛋白实际分泌量似乎不相关[12]。为了提高外源蛋白的表达量,学者们开始尝试直接在外源蛋白的N端添加或者替换原有信号肽,详见表1。虽然这种方式工作量较大,且存在一定的随机性,但近年来在提高外源蛋白表达量方面也取得了一定成果,实现了酰胺酶[40]、氨肽酶[41]、碱性丝氨酸蛋白酶[42]、角蛋白酶[43]、L-天冬酰胺酶[44]、β-甘露聚糖酶[45]、碱性果胶酶[46]、果聚糖蔗糖酶[47]、普鲁兰酶[48]、聚对苯二甲酸乙二醇酯水解酶[49]、脂肪酶[50]、β-半乳糖苷酶[51]和淀粉酶[52-56]胞外表达量的提高。通常借鉴被认为能够高效分泌外源蛋白的常用信号肽,如Sec分 泌 途 径 的AmyE[40-42,44,47-49,51-52,55-56]、 AprE[42,46,51-52,55]、NprE[41-43,45,47-48,51-54,56]、NprB[40,42,45,50,54]、SacB[40-42,47-49,52,54,56]和Bpr[41-42,46-47,49,53-55]等外源蛋白的信号肽;Tat分泌途径的PhoD[[42,45,49,51,54,56]、YwbN[42-46,49,51,53]、 LipA[40,42-45,50,54,56]、WapA[42-44,46-47,52-53]等外源蛋白的信号肽,构建几个乃至几十个含有不同信号肽的异源表达载体,分别将其导入枯草芽孢杆菌中,并进行外源蛋白分泌量的比较,进而确定哪种信号肽适合外源蛋白的表达。这种方式筛选到的高表达信号肽,由于筛选范围的狭小,未必就是这种外源蛋白分泌最佳信号肽。有趣的是,我们无法确定哪种类型的信号肽比较适合外源蛋白的分泌表达,甚至,同一类外源蛋白(淀粉酶)由于基因和性质上的差异,导致所筛选的高效表达信号肽也不同[52-56]。虽然Tat分泌途径的信号肽只有24种,但在提高外源蛋白表达方面,似乎概率性更高[43-45,49-51,53]。
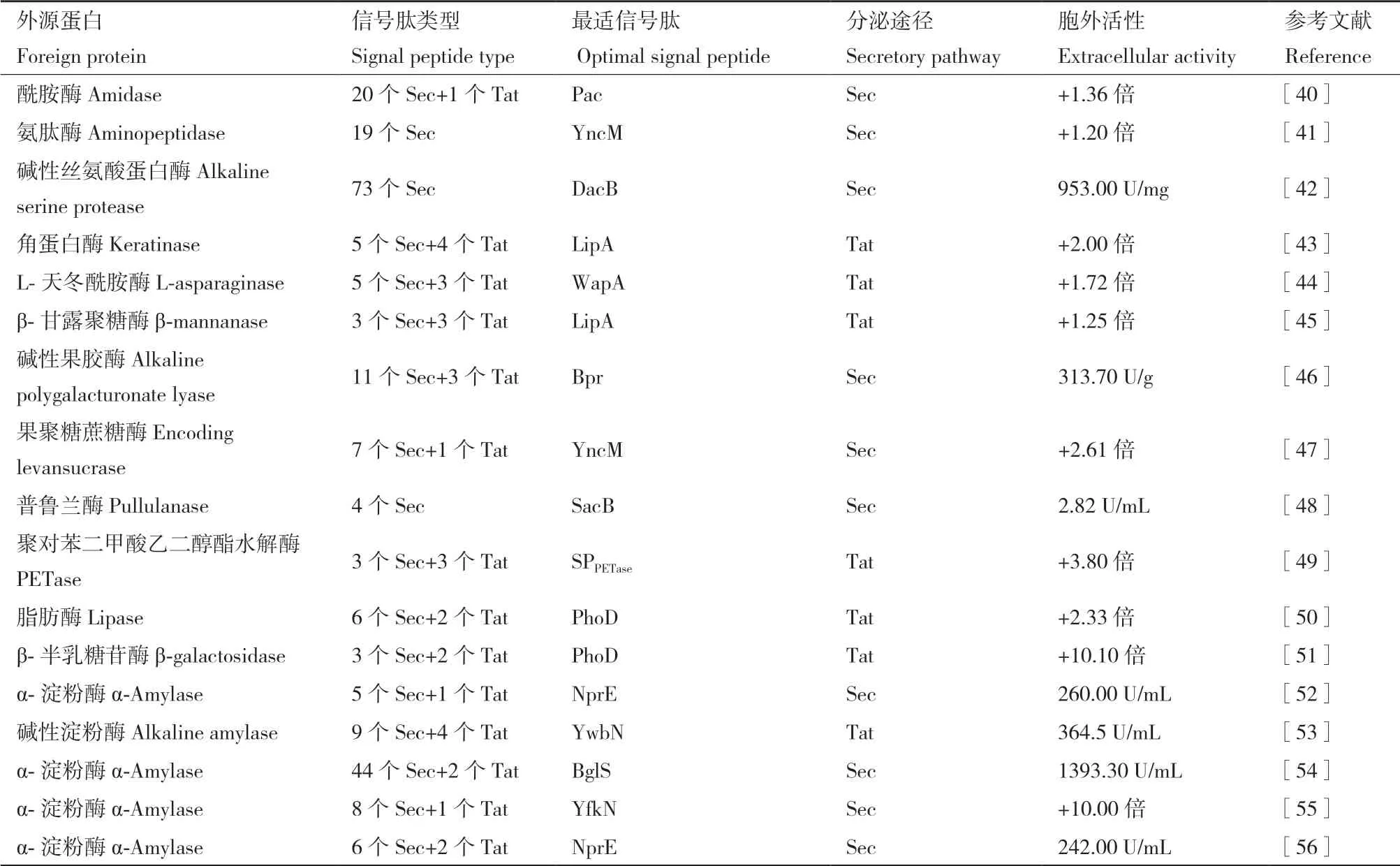
表1 基于对信号肽的直接替换提高外源蛋白表达的研究Table 1 Research on improving the expression of foreign proteins based on direct replacement of signal peptides
3.2 基于对信号肽的突变提高外源蛋白的表达
有报道显示枯草芽孢杆菌信号肽N端带正电荷氨基酸数量和H端疏水性强弱对外源蛋白的分泌有一定影响[2-4],通过对信号肽的突变也能提高外源蛋白的表达量,见表2。一般采用3种方式改造信号肽的N端区域:将原有氨基酸突变成碱性氨基酸(K/R)[50,53,57];在N端直接插入碱性氨基酸 (K/R)[53]和将原有氨基酸进行饱和突变[50,58]。通过对信号肽的N端区域进行改造实现了脂肪酶[50]、淀粉酶[53,55]、地衣聚糖酶[57]和角质酶[58]表达量的提高。此外,也会采用N端和H端相结合的方式提高信号肽的分泌能力,如Fu等[57]和马樱芳等[53]在增加N端正电荷数量基础上,进一步将H端的极性氨基酸突变成非极性氨基酸,从而降低H端的疏水性,实现了提高淀粉酶[53]和地衣聚糖酶[57]的胞外酶活。此外,祝发明等[59]针对信号肽AmyX三个区域的同时突变使β-半乳糖苷酶胞外酶活提高了2.5倍。研究也发现信号肽N端所含正电荷数量也不是越多越好,Fu等[57]在对信号肽H1进行突变时发现,当N端有4个正电荷的碱性氨基酸时,其分泌能力反而大幅度降低,这与周勇[50]、袁林等[55]和马樱芳等[53]对信号肽N端区域突变时所得结论一致。Caspers等[58]在对信号肽(AmyE)N端区域进行饱和突变时,突变体F2D和F2E虽然导致信号肽N端正电荷数量减少,但角质酶胞外酶活却提高了约3倍,也佐证了这一观点。综上,通过对信号肽N端和H端的氨基酸残基进行适当的突变和插入,改变信号肽N端区域的带正电数[50,53,55,57-58]和降低H端的疏水性[50,57],进一步改变了信号肽二级结构和前体蛋白折叠方式,从而提高外源蛋白在枯草芽孢杆菌中的分泌能力[2-4,58]。综合前人[57-58]的研究结果可知信号肽N端的正电荷数量+2或+3比较合适,具体原因有待进一步探究。通过这种方式,较构建信号肽文库大大减少了工作量,相对于直接替换其他类型信号肽,也增加了准确性,作者认为这种方式将是未来对信号肽改造的一个热门趋势。

表2 基于对信号肽的突变提高外源蛋白表达的研究Table 2 Research on improving the expression of foreign protein based on mutation of signal peptide
3.3 基于构建信号肽文库提高外源蛋白的表达
为了构建优化异源蛋白分泌的有力策略,Brocmeier等[12]构建了一个信号肽库,结合高通量筛选的方法,可以筛选到分泌异源蛋白的最佳信号肽,这是目前应用最为广泛且成功的方式,见表3。其步骤总结如下:首先,通过PCR的方式从B. subtilis 168[12,60-65]或B. subtilis 1A427[63]基因组上扩增出173种Sec信号肽目的片段,混合成一个信号肽杂合文库,即使商业化的文库[60,63-64]也是采用这种方式获得;同时,构建一个包含外源蛋白的表达载体骨架,研究表明,信号肽和外源蛋白之间多余的氨基酸(酶切位点),似乎并不影响外源蛋白的分 泌[12,60,66],也可采用融合PCR的方式避免这一问题[65]。其次,通过酶切或PCR的方式将包含外源蛋白的载体骨架线性化,借助于无缝克隆[62-66]进行信号肽文库的构建,这就需要在PCR扩增信号肽片段时在两端预留20 bp用于与载体重组的序列。由于枯草芽孢杆菌的转化效率不如大肠杆菌,构建好的信号肽文库质粒导入枯草芽孢杆菌之前,通常会选择一个大肠杆菌亚文库来介导[12,60,66],这就要求表达载体必然是一个穿梭质粒,至今,只有Fu等[65]实现了将构建好的信号肽文库质粒直接导入枯草芽孢杆菌中。对于信号肽混合质粒导入枯草芽孢杆菌的方式有spizizen法[12,60,62,64-65]、原生质体法[61]和电转化法[63,66]。最后,信号肽文库的筛选,通常结合高通量筛选技术[12,60-61,63,65]或与透明 圈[61,65]一起进行筛选。Tsuji等[62]也报道了直接采用透明圈的方式进行筛选;Zhang等[66]则利用针对每一个信号肽,从构建到筛选均是一一对应,直接比较每一个胞外木聚糖酶活性的方式进行筛选。目前已完成了角质酶[12]、细胞质酯酶[12]、α-麦芽淀粉酶[60]、蛋白酶[61]、植酸酶[62]、α-淀粉酶[63-65]和木聚糖酶[66]的最佳信号肽的筛选。本课题组也对来自解淀粉芽孢杆菌α-淀粉酶最佳信号肽进行了筛选,使其胞外淀粉酶活力提高了3.8倍[63]。由于每一种外源蛋白在枯草芽孢杆菌的分泌方式均不同,构建多种混合信号肽文库的方法虽然复杂且工作量和筛选任务繁重,但能够获得一个真实的外源蛋白分泌最佳信号肽。此外,也有学者报道了利用枯草芽孢杆菌信号肽文库在Escherichia coli[67-69]、Corynebacterium glutamicum[70]和Baclicus lincheniformis[61]宿主菌中实现提高外源蛋白表达量的应用。
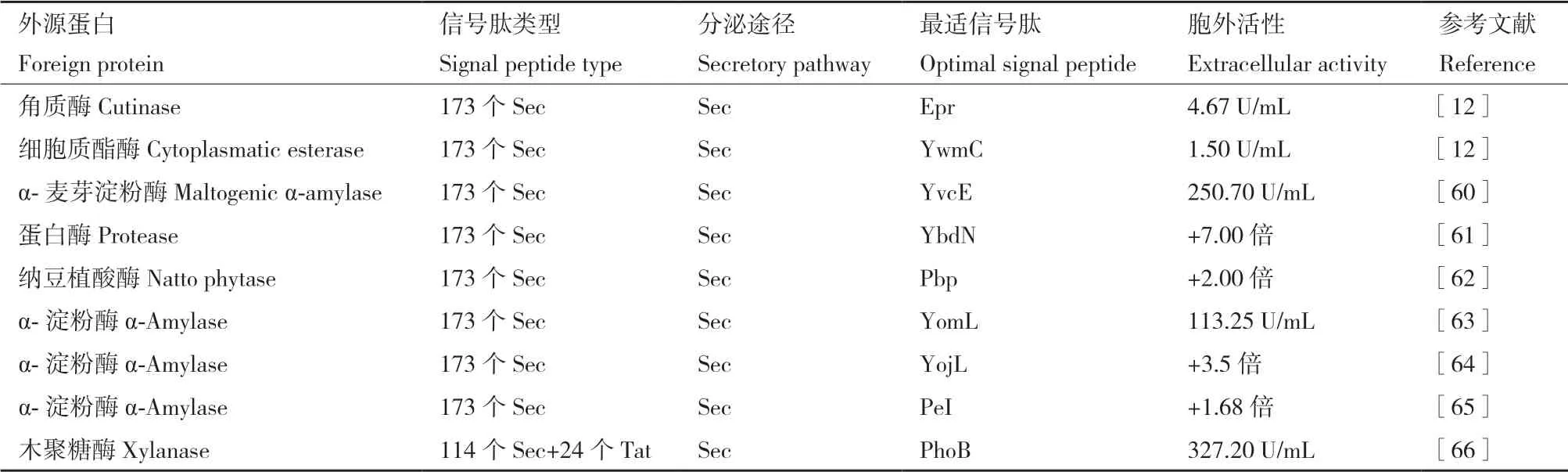
表3 基于构建信号肽文库提高外源蛋白表达的研究Table 3 Research on improving foreign protein expression based on constructing signal peptide library
3.4 基于信号肽中稀有密码子提高外源蛋白的 表达
目前关于外源蛋白基因密码子偏好性的研究主要集中在大肠杆菌和酿酒酵母5′端信号肽区域[71]。研究表明,大肠杆菌中信号肽的第二个氨基酸更偏好能保证高起始翻译的赖氨酸(L)密码子是AAA而不是AAG[72-73];革兰氏阳性菌Streptomyces coelicolor[74]同样也发现稀有密码子在信号肽序列中的高频率使用,甚至信号肽区域使用稀有密码子获得的蛋白质产物是使用普通密码子的数倍[75-76]。通过分析其蛋白质产物二级结构发现信号肽使用不同密码子得到的蛋白质二级结构有显著的差异,可能是由于使用通用密码子时蛋白质翻译速度过快,信号肽序列区域的构象和正常情况不同,导致后续成熟蛋白的折叠也出现错误而被降解[77]。信号肽区域的稀有密码子对保证正确的共翻译折叠具有重要作用[71]。因此,可在分泌蛋白基因5′端信号肽区域使用tRNA适应指数(tRNA adaptation index,tAI)值低的密码子减慢翻译速度以帮助蛋白质的跨膜、加工成熟和折叠[78]。此外,在SRP结合位点下游大约35-40个密码子的区域内存在较多的稀有密码子,通过减缓翻译速度,帮助信号肽序列与SRP的结合[79]。但至今,在枯草芽孢杆菌表达系统中没有报道过改变外源蛋白信号肽中的稀有密码子的方式来提高分泌量的研究。
3.5 基于信号肽分泌系统中相关蛋白的改造提高外源蛋白的表达
枯草芽孢杆菌将外源蛋白分泌到胞外培养基中,除了必须有信号肽引导外,还需要一系列相关蛋白的参与,包括靶向因子、转运酶、信号肽酶、分子伴侣和胞外蛋白酶,通过改造这些相关蛋白也可以提高外源蛋白在枯草芽孢杆菌中的表达[80]。(1)靶向因子是将待分泌蛋白从细胞质内转移至转运酶上的辅助蛋白,在枯草芽孢杆菌表达系统中有FtsY和CsaA这两种辅助蛋白靶向因子[80]。研究表明过表达FtsY和CsaA蛋白,可以提高目标蛋白在枯草芽孢杆菌中的分泌量(US 6410262),相反,抑制了这两种蛋白的表达,目标蛋白在枯草芽孢杆菌中的分泌量也会相应的降低[80-82]。(2)分泌外源蛋白时跨膜是在转运酶复合体帮助下完成的,Kakeshtia等[83]删除了SecA的C末端区域,成功的提高了碱性纤维素酶和干扰素在枯草芽孢杆菌中的胞外分泌量;另外,对SecA的C末端区的点突变也可以提高PhoB蛋白的分泌量(EP 1633873)。过表达转运酶组分中的相关蛋白也是提高外源蛋白分泌量的有效措施之一,如Mulder等[84]首次人工构建了SecYEG操纵子,并最终增加了枯草芽孢杆菌分泌淀粉酶的产量。Genecor公司通过SecA、SecDF和SecG的过表达,发现可以增强某些异源蛋白在枯草芽孢杆菌中的分泌(EP 1003872、US 7807808、US 6258563)。(3)信号肽酶的不足可能会导致信号肽切割效率的下降,研究发现,ClpXP蛋白酶的缺失可以提高sipS、sipT和sipV信号肽酶基因的转录水平,从而提高了信号肽的加工过程并增加了蛋白分泌速率[4],同时还发现,当敲除sipS基因后,AmyQ信号肽的切割效率则有明显提高;另一方面,过表达信号肽酶sipI也增强了宿主切割AmyQ信号肽的能力[85]。所以对信号肽酶进行过表达,或者解除某些信号肽酶相互之间的抑制有望增加某些异源分泌蛋白在枯草芽孢杆菌中的分泌表达量[80]。(4)分子伴侣能够降低待分泌蛋白错误折叠的概率,增加被靶向因子的识别。Wu等[86]失活HrcA导致胞内分子伴侣组成型表达,使得scFV的分泌量增加了60%,另外,过表达胞外分子伴侣prsA也导致了scFV总量增加,进一步共表达胞内和胞外伴侣则导致了scFV分泌量更加明显的增加。这与Kontinen等[87]报道的过表达prsA后,淀粉酶和蛋白酶在枯草芽孢杆菌中的分泌量分别提高了6倍和2倍是一致的。因此,促进外源蛋白在细胞膜外进行快速折叠的手段,有望增加某些分泌蛋白的胞外分泌量。(5)敲除枯草芽孢杆菌宿主菌中的蛋白酶基因也能有效提高外源蛋白的分泌 量[2-4,26]。目前商业化的WB800就是敲除了8个胞外蛋白酶基因,但敲除过多的蛋白酶基因会带来菌株生长活力下降的问题。
4 总结与展望
近年来,枯草芽孢杆菌表达系统因其在蛋白表达纯化和分泌活性蛋白等方面要明显优于大肠杆菌,已成为比较热门的表达体系之一。学者们经过多年的不懈努力,如今虽建立了一套有效的外源蛋白枯草表达系统,并且在外源蛋白表达方面也取得了很大的进展,但相比大肠杆菌表达系统,还是远远滞后的。外源蛋白在枯草芽孢杆菌中能否实现高效表达,信号肽是关键元件之一,适配的信号肽甚至能够提高外源蛋白表达量高达数十倍。目前,国内外学者主要针对枯草芽孢杆菌信号肽的Sec和Tat分泌途径进行研究,基于信号肽的简单替换、突变、构建高通量文库和改造分泌途径中相关蛋白的方式来提高外源蛋白的表达量,虽取得了一定的进展,但仍有上升空间。作者认为未来的研究方向应该集中以下方面:(1)增加枯草芽孢杆菌信号肽的基础研究与应用,证明这种潜在的工业细菌将通过不断优化可成为超级分泌细胞工厂。在信号肽分泌途径研究方面,尤其是Sec和Tat途径,仍然需要进一步研究了解每个信号肽和分泌途径的功能及其相互作用,特别是Tat途径信号肽,虽然在数量上较少,但似乎更能提高外源蛋白分泌量,这可能与其转运途径中参与蛋白有关。(2)可以基于生物信息学,针对信号肽的结构,N端所带正电荷数为+2或+3,降低H端的疏水性,模拟其在分泌途径中的可行性,在一定理论基础上,建立一套实用性的预测平台,降低工作量的同时确保提高外源蛋白分泌效率的准确性。(3)基于信号肽分泌途径中相关蛋白的单个或多种基因的组合过表达,提高其在外源蛋白转运途径中的工作效率,使得外源蛋白的转运、加工、折叠和分泌更加高效,胞外分泌量也会相应提高。 (4)结合其他蛋白表达优化方法:如启动子、稀有密码子、代谢工程技术、转录组学、蛋白组学和基因编辑等技术,通过整体策略提高外源蛋白的分泌表达。总之,从本质上研究分泌途径的机制、信号肽优选方式和影响因素是至关重要的,为未来进一步扩大枯草芽孢杆菌的高效工业应用的范围提供理论和实验依据。

