右归丸对肾阳虚证大鼠肾脏线粒体功能的影响
张巍岚,谭从娥
右归丸对肾阳虚证大鼠肾脏线粒体功能的影响
张巍岚,谭从娥
陕西中医药大学,陕西 咸阳 712046
观察右归丸对肾阳虚证大鼠肾脏线粒体功能的影响,探讨其调节能量代谢的作用机制。30只SD大鼠随机分为正常组(6只)和造模组(24只),造模组后肢肌注氢化可的松注射液,正常组注射2 mL生理盐水。成模后将造模组随机分为模型组和右归丸高、中、低剂量组,每组6只。右归丸高、中、低剂量组给予相应剂量汤剂灌胃,正常组和模型组给予生理盐水灌胃。透射电镜观察肾脏线粒体超微结构,试剂盒检测线粒体三磷酸腺苷(ATP)含量,JC-1荧光探针检测线粒体膜电位,DCFH-DA法检测细胞内活性氧(ROS)水平。与正常组比较,模型组大鼠肾脏线粒体明显肿胀,部分出现空泡,线粒体嵴排列不规则,基质不均匀,核膜不明显,线粒体ATP含量减少、膜电位下降,细胞内ROS水平升高,差异有统计学意义(<0.01);与模型组比较,右归丸各剂量组大鼠肾脏线粒体结构均有改善,线粒体肿胀减轻,线粒体嵴排列较规则,基质均匀,核膜清晰,线粒体ATP含量增加、膜电位升高,细胞内ROS水平降低,其中右归丸高剂量组作用明显,差异有统计学意义(<0.01)。右归丸通过改善大鼠线粒体功能调节能量代谢异常。
右归丸;肾阳虚证;线粒体功能;大鼠
右归丸具有补肾填精、温阳化气功效,可有效改善肾阳虚引发的代谢低下症状。现代药理研究表明,右归丸可降低大鼠血清三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)含量,提高高密度脂蛋白胆固醇(HDL-C)含量,纠正老年大鼠海马和杏仁核氨基酸类神经递质紊乱状态,改善大脑边缘系统,提高肾阳虚大鼠睾酮含量[1-3]。线粒体通过产生三磷酸腺苷(ATP)为机体提供能量,肾脏作为维持机体内环境平衡的重要器官,需要足够的能量维持机体新陈代谢及营养物质的再吸收[4]。本实验从能量代谢角度,通过不同剂量右归丸干预肾阳虚证大鼠,探讨其对大鼠肾脏线粒体功能的调节作用,为肾阳虚证的临床治疗提供思路。
1 实验材料
1.1 动物
清洁级SD雄性大鼠30只,体质量200~230 g,四川成都达硕实验动物有限公司提供,动物许可证号SYXK(111)2015-030。饲养于陕西中医药大学实验研究中心动物房,正常光照,温度25~27 ℃,湿度适宜,自由摄食饮水,适应性喂养1周。
1.2 药物及制备
右归丸,北京同仁堂股份有限公司,9 g/丸,批号19013092,称取不同质量右归丸,分别放入3个烧杯中,45 ℃温水融化至无沉淀,即得右归丸汤剂。氢化可的松注射液,华中药业股份有限公司,批号2018190108;氯化钠注射液,灏洋生物技术有限公司,批号1905190728。
1.3 主要试剂与仪器
苏木素,德国Sigma公司,货号H9627;伊红Y(水溶性)、无水乙醇、二甲苯、盐酸、包埋石蜡、中性树胶,国药集团,货号分别为71014544、10009218、10023418、10011018、69019361、10004160; ATP含量测定试剂盒,南京建成生物工程研究所,货号A095;JC-1线粒体膜电位检测试剂盒,上海碧云天,货号C2006;活性氧(ROS)检测试剂盒,货号E004-1-1;PBS,武汉普诺赛,货号PB180327。微型高速离心机(美国Labnet,C2500-R-230V),电热恒温培养箱(日本ASONE,ICV-450),病理切片机(德国Leica,RM 2016),切片刀(日本羽毛,R3),组织摊烤片机(武汉俊杰,JK-6),FlexStation 3多功能酶标仪(美国Molecular Devices公司),多功能电热锅(广州飞普纳,CRJ-130D-1),台式冷冻高速离心机(湖南湘仪,H1650R),微量移液器(美国Thermo Fisher),超净工作台(苏州安泰,SW-CJ-1FD),CO2恒温培养箱(日本SANYO,MCO-15AC),台式低速离心机(德国Eppendorf,5702R),BD FACSCalibur流式细胞仪(美国BD Biosciences)。
2 实验方法
2.1 分组、造模及给药
实验大鼠随机分为正常组(6只)、造模组(24只)。参考文献[5]方法,造模组大鼠每日后肢肌肉注射氢化可的松注射液(2.5 mg/100 g)制备肾阳虚证模型,正常组每日注射2 mL生理盐水,连续14 d。成模后将造模组大鼠随机分为模型组和右归丸高、中、低剂量组,每组6只。给药剂量根据人和大鼠用药比例换算[6]。右归丸高、中、低剂量组每日13:00-14:00分别予9.5、3.8、1.9 g/kg右归丸汤剂灌胃,给药体积3 mL,连续14 d,正常组和模型组给予生理盐水灌胃(10 mL/kg)。由于部分大鼠对激素耐受性较差,模型组和各给药组均有大鼠死亡,每组最终为3只。
2.2 一般观察
记录大鼠精神状态、毛色、食量、饮水量、小便颜色、大便性状、舌色、耳廓络脉颜色等。
2.3 取材
第14日干预结束后,大鼠空腹过夜,次日上午10%水合氯醛(35 mg/kg)腹腔注射麻醉,置于冰盘,迅速取大鼠肾脏,分离肾皮质,PBS反复冲洗,置于冻存管,-80 ℃冰箱保存备用。
2.4 线粒体超微结构观察
取1 mm3大鼠肾脏,2.5%戊二醛固定液固定4 h,PBS浸洗2 h,1%四氧化锇固定液固定2 h,梯度乙醇脱水,浸透,包埋,切片(1~2 μm),亚甲蓝染色,镜下定位,切片(50~70 nm),醋酸铀和柠檬酸铅双染,透射电镜观察大鼠肾脏线粒体超微结构并拍片。
2.5 线粒体三磷酸腺苷含量测定
取大鼠肾皮质,用预冷生理盐水清洗,按1∶4.5(质量∶体积)比例加预冷的0.25 mol/L蔗糖缓冲液,匀浆,4 ℃、1 000×离心10 min,吸取上清液,4 ℃、10 000×离心10 min,弃上清液,BCA法测定线粒体蛋白浓度。将ATP含量测定试剂平衡至室温,按100 μL/孔加至96孔板,加线粒体上清液50 μL,震荡30 s,室温静置5 min,于波长636 nm处测定各孔吸光度(OD值),根据样品蛋白浓度和各孔OD值计算线粒体ATP含量[(测定OD值-对照OD值)÷(标准OD值-空白OD值)×标准品浓度×样本稀释倍数÷待测样本蛋白浓度]。
2.6 线粒体膜电位测定
取大鼠肾皮质,剪成小块,磨碎,过300目筛网,生理盐水冲洗,将细胞移至15 mL离心管,离心,弃上清液,加入JC-1荧光探针染液,流式细胞仪进行检测[7]。以红绿荧光强度比值计算线粒体膜电位。
2.7 细胞内活性氧水平检测
取大鼠肾皮质,剪成小块,磨碎,过300目筛网,生理盐水冲洗,将细胞转移至15 mL离心管中,反复离心去上清,收集细胞,使用DCFH-DA细胞ROS检测试剂盒经流式细胞仪检测细胞内ROS水平。
3 统计学方法
4 结果
4.1 一般状况
与正常组比较,造模组大鼠1周时食量稍减少,饮水量正常,反应较迟钝,毛色黯淡,耳廓颜色苍白,舌色淡红,二便正常,2周时食量明显减少,饮水量增多,反应迟钝,弓背明显,毛色黯淡无光,耳廓络脉苍白,舌色紫黯,小便增多,大便稀溏;右归丸干预后上述情况改善,且右归丸高剂量组恢复较明显。
4.2 右归丸对模型大鼠线粒体超微结构的影响
正常组大鼠肾脏线粒体超微结构完整,线粒体嵴排列清晰,数量较多,基质均匀,线粒体内无水肿、空泡,内外膜结构清晰;模型组大鼠肾脏线粒体明显肿胀,部分出现空泡,线粒体嵴排列不规则,甚至消失,基质不均匀,核膜不明显;右归丸各剂量组大鼠肾脏线粒体结构有不同程度改善,其中右归丸高剂量组改善最明显。见图1。
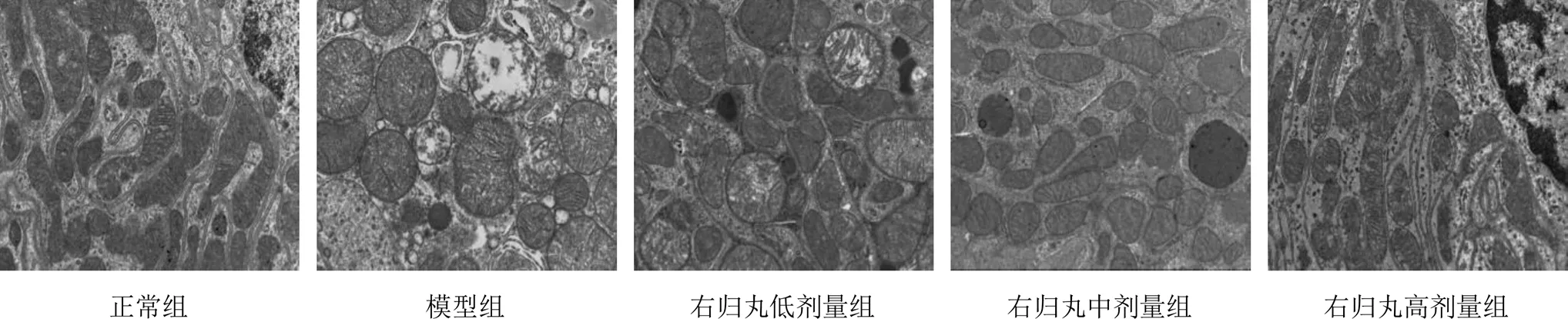
图1 各组大鼠肾脏线粒体超微结构(×8 000)
4.3 右归丸对模型大鼠线粒体三磷酸腺苷含量的影响
与正常组比较,模型组大鼠肾皮质线粒体ATP含量明显减少(<0.01);与模型组比较,右归丸各剂量组大鼠肾皮质线粒体ATP含量增加,其中右归丸高剂量组差异有统计学意义(<0.01)。见表1。
4.4 右归丸对模型大鼠线粒体膜电位的影响
当线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物,呈红色荧光,图中右上象限(UR)表示;当线粒体膜电位较低时,JC-1不能聚集在线粒体基质中,此时JC-1为单体,形成绿色荧光,图中右下象限(LR)表示。与正常组比较,模型组大鼠LR值增加,UR值减少,提示JC-1单体增多,绿色荧光增强,线粒体膜电位明显降低(<0.01);与模型组比较,右归丸各剂量组LR值减少,UR值增加,其中右归丸高剂量组差异有统计学意义(<0.01)。见图2、表2。
表1 各组大鼠肾皮质线粒体ATP含量比较(±s,μmol/g)
注:与正常组比较,##<0.01;与模型组比较,**<0.01
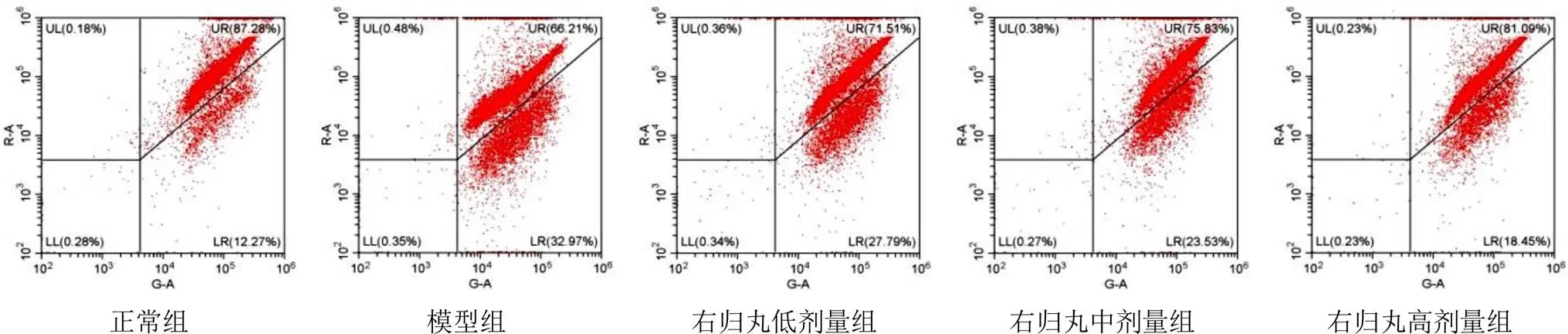
图2 各组大鼠肾皮质线粒体膜电位流式细胞图
表2 各组大鼠肾皮质线粒体膜电位变化比较(±s)
注:与正常组比较,**<0.01;与模型组比较,##<0.01
4.5 右归丸对模型大鼠肾皮质活性氧水平的影响
正常组大鼠曲线位置偏左,DCFH-DA-A均值为36 016.40,count值接近280,波形高尖。模型组大鼠曲线位置居中,DCFH-DA-A均值为99 930.60,count值接近240,波形较正常组低平。右归丸低、中、高剂量组大鼠随剂量增加,DCFH-DA-A均值依次降低,count值逐渐增加,波形趋于高尖,见图3。与正常组比较,模型组大鼠肾皮质ROS荧光强度增强(<0.01),表明ROS水平升高,细胞凋亡明显;与模型组比较,右归丸各剂量组大鼠肾皮质ROS水平降低,其中右归丸高剂量组作用最明显(<0.01)。见表3。
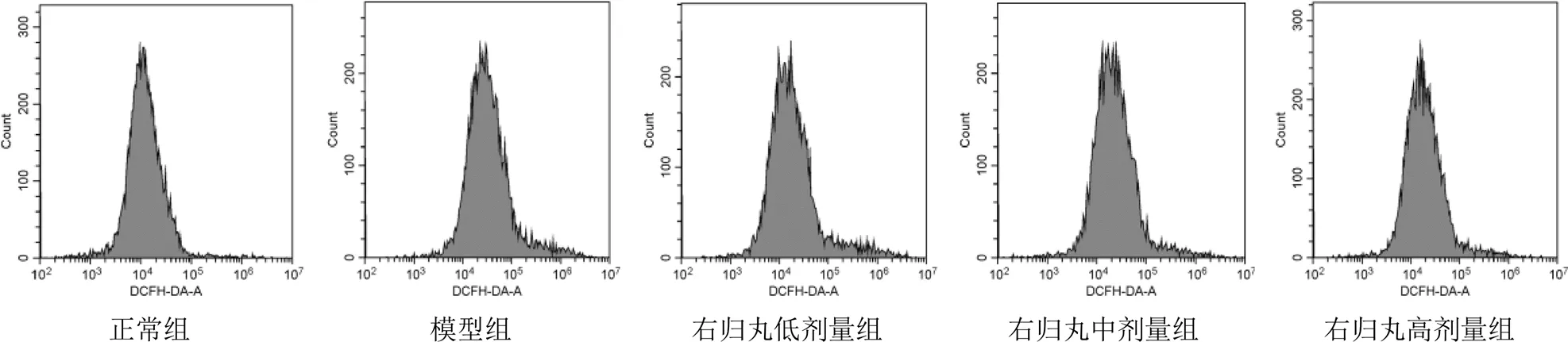
图3 各组大鼠细胞内ROS流式细胞图
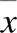
表3 各组大鼠肾皮质细胞内ROS水平比较(±s)
注:与正常组比较,##<0.01;与模型组比较,**<0.01
5 讨论
中医认为,肾主藏精,主生殖,推动和调节脏腑的气化功能。肾精化肾气,肾中精气化为肾阴肾阳,其中,肾阳通过温煦、激发、气化等功能为身体提供能量,若肾阳亏虚,则机体表现出一系列能量代谢低下症状。以右归丸为代表的温补肾阳方剂可通过补肾助阳、温阳化气作用改善机体代谢状态。线粒体为真核生物有氧呼吸的主要场所,机体通过丙酮酸无氧呼吸、乙酰辅酶A氧化、呼吸链运输、氧化磷酸化等环节,最终生成ATP,为细胞提供生长代谢所需能量。因此,通过对线粒体结构观察及内部物质的测定可反映机体能量代谢状态。邱林等[8]研究发现,肾气丸能上调肾阳虚证大鼠肝细胞内磷酸果糖激酶、乳酸脱氢酶、丙酮酸激酶、己糖激酶等酶活性,从而增加线粒体能量合成。咸庆飞等[9]研究发现,线粒体能量代谢障碍是(脾)肾阳虚证艾滋病中晚期患者的病理基础。本实验通过氢化可的松肌肉注射建立肾阳虚证大鼠模型,发现模型大鼠肾脏线粒体肿胀明显,部分出现空泡,线粒体嵴排列不规则,基质不均匀,核膜不明显,ATP含量明显减少,线粒体膜电位下降,细胞内ROS水平升高,表明肾阳虚证大鼠线粒体功能异常。右归丸干预后大鼠肾脏线粒体超微结构有所改善,ATP含量明显增加,线粒体膜电位升高,细胞内ROS水平明显降低,其中,右归丸高剂量组作用最明显(<0.01),提示右归丸能改善肾阳虚证大鼠肾脏线粒体功能,调节能量代谢异常。
[1] 徐安莉,周艳艳,赵敏,等.右归丸对肾阳虚大鼠血脂的影响[J].湖北中医药大学学报,2013,15(6):7-8.
[2] 戴薇薇,金国琴,张学礼,等.左归丸、右归丸对老年大鼠海马、杏仁核氨基酸类神经递质含量变化的影响[J].中华中医药杂志,2005,20(7):397-400.
[3] 刘天成,崔撼难.右归丸对肾阳虚大鼠下丘脑-垂体-性腺轴影响的实验研究[J].吉林中医药,2007,27(4):56-57.
[4] DUANN P, LIN P H. Mitochondria damage and kidney disease[J].Adv Exp Med Biol,2017,982:529-551.
[5] 王孙亚,周兴,宾东华,等.右归丸及其拆方对肾阳虚大鼠血清T、LH和CORT的影响[J].湖南中医药大学学报,2018,38(9):990-993.
[6] 陈叶香,许立,孙帅军,等.右归丸干预肾间质纤维化的作用机制研究[J].中药新药与临床药理,2016,27(1):23-27.
[7] 张杰,刘祯,景鹏,等.细胞线粒体膜电位的测量方法[J].首都医科大学学报,2006,27(1):124-125.
[8] 邱林,赵群菊,李美红,等.从能量代谢角度探讨肾气丸少火生气作用机制及其方证相关性[J].湖南中医杂志,2018,34(6):154-156.
[9] 咸庆飞,刘颖,邹雯,等.温肾健脾法对艾滋病中晚期患者能量代谢的影响探讨[J].中华中医药杂志,2018,33(3):939-941.
Effects ofPills on the Function of Kidney Mitochondria in Rats with Kidney-yang Deficiency Syndrome
ZHANG Weilan, TAN Conge
To observe the effects ofPills on the function of kidney mitochondria in rats with kidney-yang deficiency; To explore its mechanism of action of energy metabolism.Thirty SD rats were randomly divided into normal group (6 rats) and model group (24 rats). The model group was injected with hydrocortisone injection into the hindlimb muscle, while the normal group was injected with 2 mL normal saline. After the successful modeling, they were divided into the model group,Pills high-, medium-, and low-dosage groups, with 6 rats in each group.Pills high-, medium-, and low-dosage groups were given corresponding dosages of decoction for gavage, and the normal group and model group were given normal saline for gavage. The ultrastructure of kiney mitochondria was observed with transmission electron microscope; the kit was used to detect the mitochondrial adenosine triphosphate (ATP) content; the JC-1 fluorescent probe was used to detect the mitochondrial membrane potential; the DCFH-DA method was used to detect the intracellular reactive oxygen species (ROS) level.Compared with the normal group, the mitochondria of the kidneys of the model group were obviously swollen, some vacuoles appeared, the mitochondrial cristae were arranged irregularly, the matrix was uneven, and the nuclear membrane was not obvious; mitochondrial ATP content decreased significantly, membrane potential decreased, and intracellular ROS level increased, with statistical significance (<0.01). Compared with the model group, the mitochondrial structure of kidney rats inPills groups was improved, the swelling of mitochondria was reduced, the mitochondrial cristae arrangement was more regular, the matrix was uniform, and the nuclear membrane was clear; rat mitochondrial ATP content increased, membrane potential increased, and intracellular ROS level decreased. Among them,Pills high-dosage group had a significant effect, with statistical significance (<0.01).Pills can improve rat mitochondrial function and regulate abnormal energy metabolism.
Pills; kidney-yang deficiency syndrome; mitochondrial function; rats
R285.5
A
1005-5304(2021)08-0073-04
10.19879/j.cnki.1005-5304.202008073

国家自然科学基金(81973754)
谭从娥,E-mail:tanzime@163.com
(收稿日期:2020-08-05)
(修回日期:2020-09-01;编辑:华强)

