天然海水中铜离子的添加对EH40钢腐蚀的影响
徐鸣,吴佳佳,张盾
(1.中国科学院海洋研究所,山东 青岛 266071;2.中国科学院海洋大科学研究中心,山东 青岛 266071;3.中国科学院大学,北京 100049)
金属材料的广泛使用推动了科技的快速发展,并为人类生活带来了许多便利。然而因金属腐蚀造成的经济损失和安全问题却始终困扰着人们[1-2]。近年来,人们对影响金属腐蚀的各类环境因子进行了广泛研究,其中铜离子作为一种重要的环境因子,已有部分文献报道了其对某些金属材料腐蚀过程的影响及作用机制。一些研究发现,纯铝及部分铝合金浸泡在含铜离子的介质中时,铝能将铜离子还原为单质铜,并沉积在表面,构成电偶腐蚀池,从而加速阳极铝的溶解[3-6]。黄桂桥等人[7]的研究进一步发现,铜离子对某些型号的铝合金腐蚀影响存在差异,即暴露在海水中的铜试样溶出的铜离子,对周边海水环境中发生点蚀和缝隙腐蚀的铝合金LD2CS的腐蚀过程有显著加速效果,而对未发生局部腐蚀的铝合金LF3M、180YS和LC4CS(BL)的腐蚀过程影响不大。Johnson等人[8]的研究又表明,铜离子能够刺激铝发生点蚀,点蚀坑的形成可能因铝中的富铁颗粒与从水中析出的铜构成腐蚀微电池所致。目前铜离子影响腐蚀的研究对象主要为铝及铝合金,且其影响规律可能因铝合金型号不同而存在差异,而关于铜离子对其他金属材料的腐蚀影响鲜有报道。与铝还原铜离子的性质相似,铁也能够将铜离子还原为单质铜,那么以铁为基体的钢材很可能面临电偶腐蚀的风险。为此,文中选取船舶制造业广泛使用的EH40钢为研究对象,解析其在添加铜离子的天然海水中腐蚀行为的变化,并揭示其腐蚀机制。
1 实验
1.1 材料
实验所用EH40钢的规格为10 mm×20 mm×5 mm、10 mm×10 mm×5 mm,前者用于挂片,后者用于制作电化学测试用电极(工作面为10 mm×10 mm)。将所有试样逐级打磨至600#,再用蒸馏水、乙醇清洗并干燥,经锡纸包裹后,高温高压灭菌,备用。
1.2 方法
选取汇泉湾海水为实验介质,铜离子初始浓度约为 2×10–5mmol/L。向海水中添加不同质量的CuCl2·2H2O(分析纯),获得铜离子添加浓度分别为0、1.5、15 mmol/L的溶液作为实验介质。采用全浸挂片的方式,进行4周浸泡实验,每4~5 d更换实验箱内1/4海水。挂片期间,箱内海水温度为14~17 ℃。海水pH值由pH计(雷磁 PHS‒3C)测得。
利用失重法分析EH40钢的腐蚀质量损失。试样取出后,经除锈液(ISO 8407:2009,IDT)去除产物,再依次用蒸馏水、乙醇洗净,并干燥,最后用电子天平(SHIMADZU AUW220D,±0.1 mg)称量计数。利用电化学工作站(Gamry3000)定期对EH40钢进行电化学测试。工作电极为EH40钢,对电极为铂网电极,参比电极为Ag/AgCl电极。先测试开路电位直至稳定,再进行电化学阻抗谱测试,频率范围为100 kHz~10 mHz,正弦扰动幅度为10 mV。
利用扫描电子显微镜(SEM,HITACHI TM3030)观察EH40钢的腐蚀产物形貌。观察前,将取出的试样在2.5%戊二醛溶液中固定,再依次用30%、50%、70%、90%、100%的乙醇水溶液梯度脱水,干燥后喷金待用。截面观察前,试样需经环氧密封,并打磨至截面露出,抛光后干燥待用。利用X射线衍射光谱(XRD,Rigaku ULTIMA4)和激光拉曼光谱(Raman,Renishaw MZ20-FC)表征腐蚀产物成分。
2 结果和讨论
2.1 腐蚀质量损失结果
EH40钢在添加不同浓度铜离子海水中的腐蚀质量损失及腐蚀速率随时间的变化曲线如图1所示。从图1a可以看出,随浸泡时间的延长,不同海水体系中试样的腐蚀质量损失都呈上升趋势。同一浸泡时间下,未添加铜离子海水中试样的腐蚀质量损失明显小于添加铜离子海水中的试样。从图1b可以看出,随时间的延长,不同海水环境中试样的平均腐蚀速率都略微下降,可能是因为腐蚀产物在试样表面逐渐堆积,对腐蚀过程有一定阻碍作用[9]。同一时间下,添加铜离子海水中试样的平均腐蚀速率始终大于未添加铜离子海水中的试样,且添加15 mmol/L铜离子海水中试样的平均腐蚀速率最大。综上所述,天然海水中添加1.5、15 mmol/L铜离子后,明显促进了EH40钢的腐蚀,且添加15 mmol/L铜离子的腐蚀促进效果最明显。
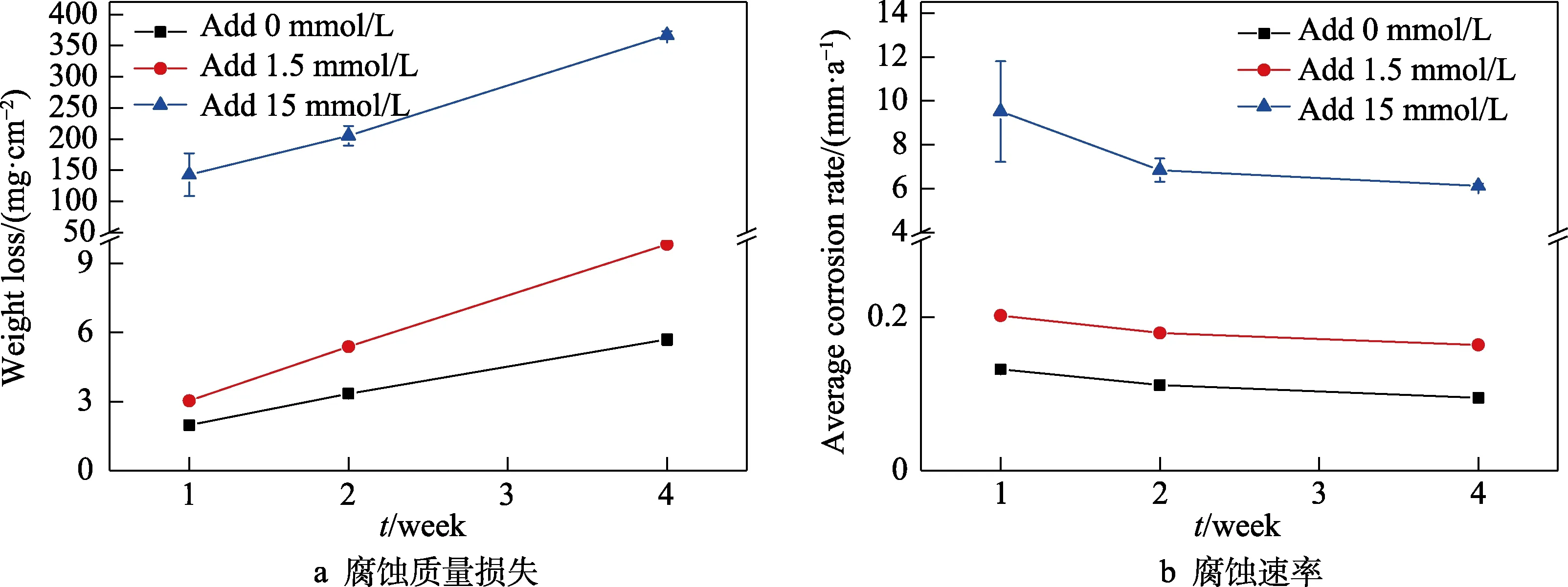
图1 EH40钢在添加不同浓度铜离子海水中的腐蚀质量损失及腐蚀速率随时间的变化曲线Fig.1 Variation curve of (a) corrosion weight loss and (b) corrosion rate of EH40 steel in seawater added different concentrations of copper ions
2.2 腐蚀电化学行为分析
定期对添加不同浓度铜离子海水中的EH40钢进行电化学阻抗谱测试,得到如图2所示的Nyquist图和Bode图。0 d时,不同海水体系中EH40钢的Nyquist图(图2a)显示,低频区的容抗弧半径都很接近,且Bode图中低频区阻抗模值也几乎一致。浸泡1、2、4周时,不同海水体系中EH40钢的Nyquist图和Bode图(图2b—d)显示,未添加铜离子海水中试样Nyquist图低频区的容抗弧半径较0 d时增加;而添加铜离子海水中试样Nyquist图低频区的容抗弧半径较0 d时明显减小,且始终低于同一时间下未添加铜离子海水中的试样。对应试样Bode图低频区的阻抗模值也明显下降,且一直小于同一时间下未添加铜离子海水中的试样。
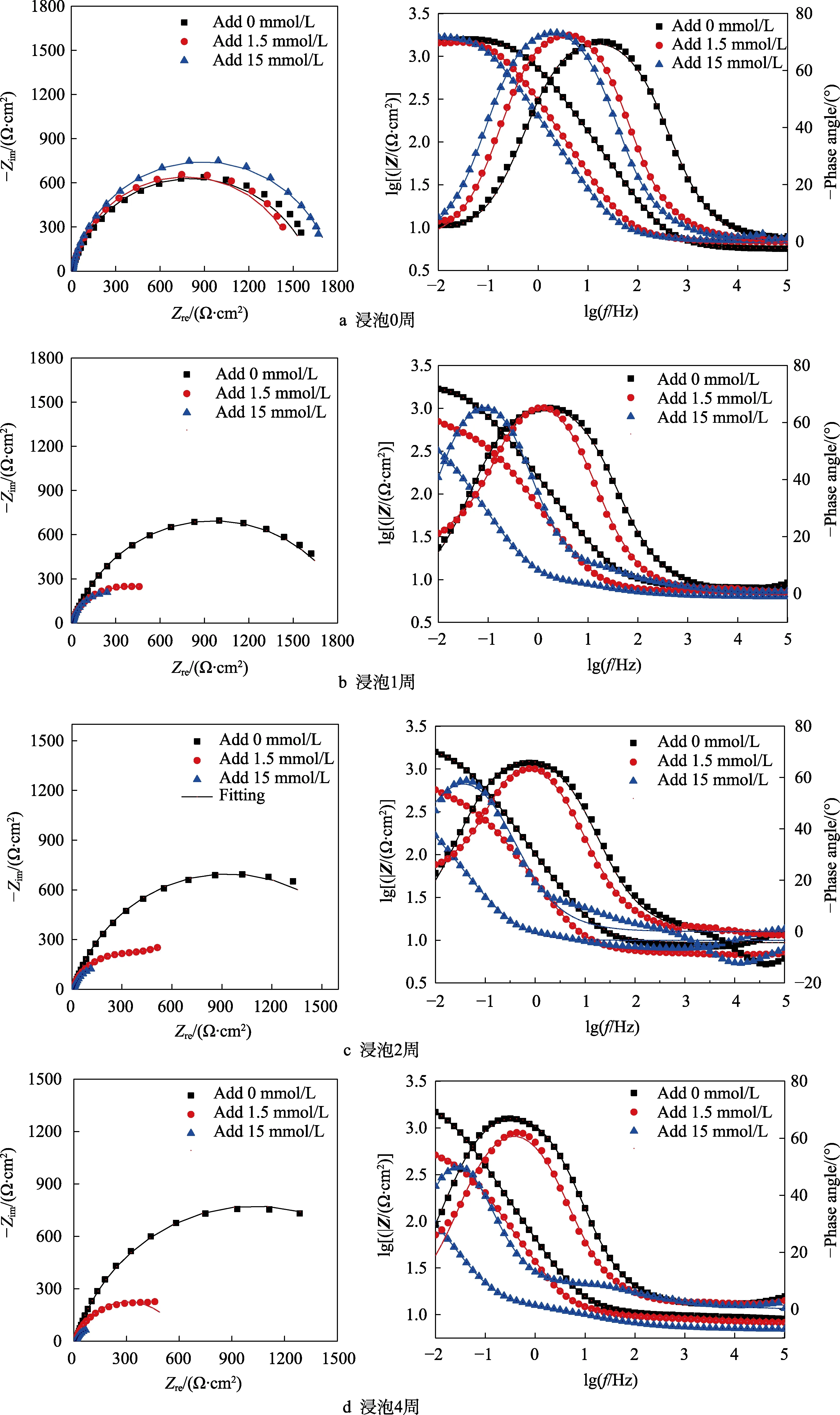
图2 EH40钢在添加不同浓度铜离子海水中浸泡不同时间的电化学阻抗谱Fig.2 Electrochemical impedance spectra of EH40 steel immersed in seawater added different concentrations of copper ions for different time: a) immersed for 0 week; b) immersed for 1 week; c) immersed for 2 weeks; d) immersed for 4 weeks
选取图3的等效电路拟合EIS数据,其中Rs对应溶液电阻;Rf和Qf对应表面锈层的电阻和电容;Rct和Qdl对应电荷转移电阻和双电层电容。拟合得到如图4所示的EH40钢电荷转移电阻(Rct)随时间的变化曲线,而Rct值通常与电极试样耐蚀性呈正比[10-11]。0~1周时,未添加铜离子海水中试样的Rct值上升,腐蚀速率减小;而添加1.5 mmol/L铜离子海水中试样的Rct值呈下降趋势,腐蚀速率增加;添加15 mmol/L铜离子海水中试样的Rct值明显下降,且下降值较大,腐蚀速率最快。同一时间下,添加铜离子海水中试样的Rct值始终小于未添加铜离子海水中的试样。综上所述,天然海水中添加1.5、15 mmol/L铜离子时,EH40钢的腐蚀速率显著提高,与质量损失结果一致。
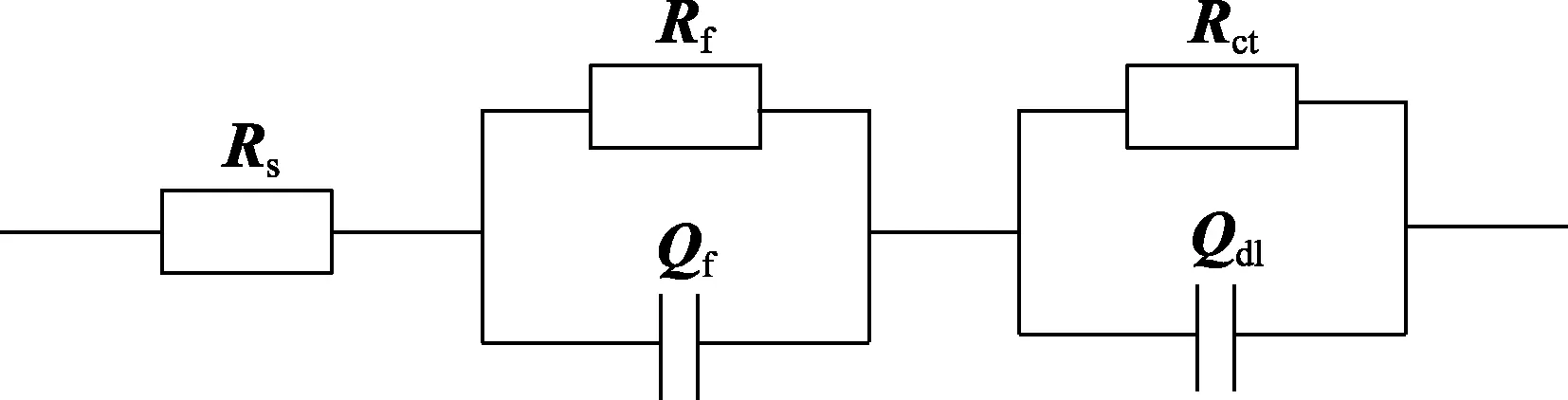
图3 等效电路Fig.3 Equivalent circuit diagram

图4 EH40钢在添加不同浓度铜离子的海水中的电荷转移电阻(Rct)随时间的变化曲线Fig.4 Variation curve of charge transfer resistance (Rct) vs.time of EH40 steel in seawater added different concentrations of copper ions
2.3 腐蚀产物形貌分析
不同海水环境中浸泡4周的EH40钢表面的宏观形貌如图5所示。未添加铜离子的海水中,EH40钢表面主要为团簇状的疏松产物,呈深棕褐色;添加1.5 mmmol/L铜离子的海水中,EH40钢表面产物分布较均匀,呈棕褐色;添加15 mmol/L铜离子的海水中,EH40钢表面产物均匀平整,呈玫瑰粉色。进一步观察不同海水环境中浸泡不同时间的EH40钢腐蚀产物微观形貌,结果如图6所示。浸泡1周时,添加15 mmol/L铜离子海水中的试样表面已被平整的产物均匀覆盖(图6a)。2周时,未添加铜离子海水中的试样表面,还未被簇状产物完全覆盖(图6b),而添加1.5 mmol/L铜离子海水中的试样,表面几乎被疏松的簇状产物完全覆盖(图6b)。4周时,添加0、1.5 mmol/L铜离子海水中,EH40钢表面产物多为树枝晶状,较疏松;添加15 mmol/L铜离子海水中,EH40钢表面产物较平整致密(图6c)。

图5 EH40钢在添加不同浓度铜离子的海水中浸泡4周的腐蚀产物宏观形貌Fig.5 Images of corrosion products of EH40 steel immersed in seawater added different concentrations of copper ions for 4 weeks

图6 EH40钢在添加不同浓度铜离子的海水中浸泡不同时间的腐蚀产物SEM形貌Fig.6 SEM images of corrosion products of EH40 steel immersed in seawater added different concentrations of copper ions for different time: a) immersed for 1 week; b) immersed for 2 weeks; c) immersed for 4 weeks
2.4 腐蚀产物成分分析
对不同海水体系中浸泡4周的EH40钢的腐蚀产物进行宏观剥落处理,将取出的试样用氮气吹干后,轻轻刮去表层产物,直至露出下层不同颜色的产物,重复此操作,直至裸露EH40钢基体,得到的试样不同产物层的宏观图像见图7。未添加铜离子海水中的试样,剥落表层腐蚀产物后,观察到大面积的裸露基体,未有明显分层现象。添加1.5 mmol/L铜离子海水中的试样,剥落表层产物后,裸露出浅粉色产物,类似于添加15 mmol/L铜离子海水中试样最外层的粉色腐蚀产物。继续去除粉色产物,观察到最内层的黑色产物,与添加15 mmol/L铜离子海水中试样剥去表层产物后露出的黑色产物一致。

图7 EH40钢在添加不同浓度铜离子的海水中浸泡4周的腐蚀产物宏观形貌Fig.7 Images of corrosion products of EH40 steel immersed in seawater added different concentrations of copper ions for 4 weeks: a) surface products; b) after exfoliation of the first layer products; c) after exfoliation of the second layer products; d) after exfoliation of the third layer products
对不同海水体系中浸泡4周的EH40钢表面不同颜色的产物层进行XRD和Raman表征,得到如图8所示的分析结果。试样外层产物成分分析结果如图8a、b所示,添加0、1.5 mmol/L铜离子海水中的EH40钢外层产物的XRD谱图相似,分析得出二者外层产物主要成分皆为FeOOH和Fe2O3[12-14]。二者的Raman图谱也很接近,同样得出FeOOH和Fe2O3为表层产物主要成分[15]。添加15 mmol/L铜离子海水中的EH40钢,表层产物无明显Raman信号,XRD的分析结果显示,其为铜单质[16],由试样中的铁与体系中的铜离子发生置换反应生成(Fe+Cu2+=Fe2++Cu)[17]。试样内层产物成分分析结果如图8c、d所示,添加1.5 mmol/L铜离子海水中的试样,粉色内层产物为铜单质[16],黑色内层产物为Fe3O4[15,18];添加15 mmol/L铜离子海水中的试样,黑色内层产物同样为Fe3O4[15,18]。进一步利用EDS能谱分析不同海水体系中浸泡4周的EH40钢截面形貌,得到如图9所示的形貌及元素分布。添加1.5 mmol/L铜离子海水中的试样腐蚀产物最外层主要为疏松的铁氧化物,下层为铜元素、铁元素和氧元素的混合层(~40 μm),如图9a所示。这是因铜层和Fe3O4层较薄,在能谱结果中难以区分所致。添加15 mmol/L铜离子海水中的试样包含明显的以铜元素为主的较薄外层产物,即铜层(~62 μm)。较厚的内层产物为铁氧化物,即Fe3O4层(~500 μm),如图9b所示。添加1.5、15 mmol/L铜离子海水中试样的腐蚀产物存在相似的分层现象,但略有差异。相同之处在于,二者都存在铜层和Fe3O4层,且相对位置一致。不同之处在于,添加1.5 mmol/L铜离子海水中试样的最外层以棕褐色的FeOOH和Fe2O3为主,以及二者的Fe3O4层厚度差异明显。根据EH40钢产物层的成分及截面形貌特征,最终绘制出如图10所示的截面模拟图。
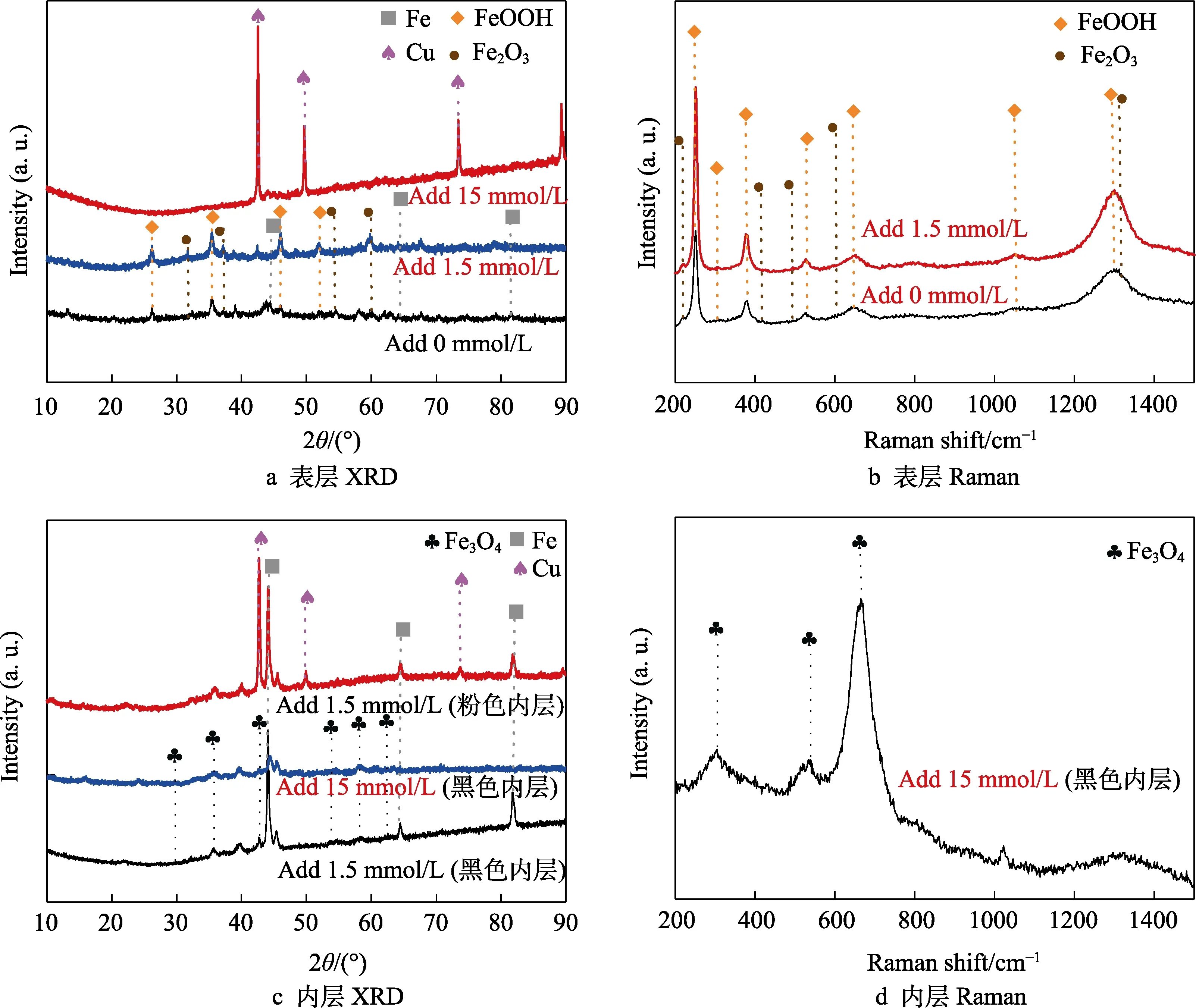
图8 EH40钢在添加不同浓度铜离子的海水中浸泡4周的腐蚀产物XRD及Raman分析结果Fig.8 XRD and Raman analysis results of corrosion products of EH40 steel immersed in seawater added different concentrations of copper ions for 4 weeks: a) surface XRD; b) surface Raman; c) inner XRD; d) inner Raman

图9 EH40钢在添加不同浓度铜离子的海水中浸泡4周的截面EDS分析结果Fig.9 Section EDS analysis results of EH40 steel immersed in seawater added different concentrations of copper ions for 4 weeks
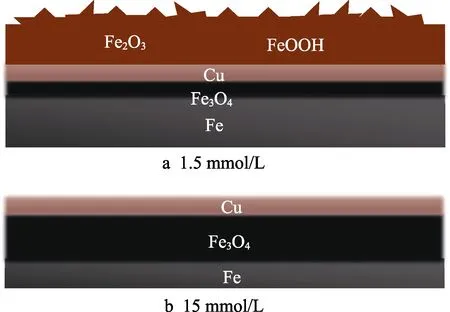
图10 EH40钢在添加不同浓度铜离子的海水中浸泡4周的截面Fig.10 Sectional drawing of EH40 steel immersed in seawater added different concentrations of copper ions for 4 weeks
2.5 环境因子变化
浸泡期间添加不同浓度铜离子海水的pH值变化曲线如图11a所示。总体上海水pH值随时间的变化不大,但不同海水体系的pH值差异明显。未添加铜离子海水的pH值约为8.00,添加1.5 mmol/L铜离子海水的pH值约为6.25,而添加15 mmol/L铜离子海水的pH值约为4.50。为分析添加铜离子造成海水pH值下降的原因,定期监测实验箱内无EH40钢时海水的pH值变化,结果如图11b所示。添加铜离子海水无试样时的pH值接近有试样时的pH值,即海水pH值下降与腐蚀过程关系不大,主要由添加的铜离子造成。铜离子作为弱碱阳离子,其水解过程产生的H+(Cu2++2H2O=Cu(OH)2↓+2H+),使海水呈酸性。在这种酸性环境中,EH40钢不断腐蚀溶解,与质量损失结果相符。同时,FeOOH和Fe2O3在pH值约为4.50的酸性环境中易溶解,铜则较稳定,这可能是添加15 mmol/L铜离子海水中EH40钢最外层产物为铜层的原因。
2.6 腐蚀机制分析
根据上述结果得出,海水中添加1.5、15 mmol/L铜离子加剧EH40钢腐蚀的主要机制为:形成了酸性腐蚀环境;铁和铜离子的置换反应;Fe-Cu电偶腐蚀。首先海水中添加1.5、15 mmol/L铜离子时,由于铜离子的水解作用,pH值降低,海水呈酸性,EH40 钢在酸性环境中溶解,腐蚀加剧。EH40钢腐蚀产物成分分析结果显示,添加铜离子海水中试样的表面存在由铁置换出的铜层[17],铜的生成伴随着EH40钢的腐蚀溶解,也在一定程度上促进了腐蚀。同时,该反应生成的铜在海水中的腐蚀电位明显高于EH40钢,因此当铜层通过导电性良好的Fe3O4层与EH40钢连接时,这两种开路电位不同的金属将发生电偶腐蚀[19-20],进一步加速阳极EH40钢的腐蚀溶解。又由于酸性腐蚀环境的形成,铁和铜离子的氧化还原反应,Fe-Cu电偶腐蚀过程都与铜离子浓度相关,因此铜离子添加浓度由1.5增至15 mmol/L时,这三方面的腐蚀促进作用增强。
3 结论
文中通过多项表征手段研究了EH40钢在添加铜离子的海水中腐蚀行为的变化,并解析其腐蚀机制,得出以下结论:
1)天然海水中添加1.5、15 mmol/L铜离子时,EH40钢的腐蚀速率增加,且添加15 mmol/L铜离子海水中EH40钢的腐蚀速率最大。
2)天然海水中添加1.5、15 mmol/L铜离子时,EH40钢的腐蚀产物出现分层现象。添加1.5 mmol/L铜离子海水中的EH40钢最外层腐蚀产物的主要成分为FeOOH和Fe2O3,中间层产物为铜单质,最内层产物为Fe3O4。对于添加15 mmol/L铜离子海水中的EH40钢,由于所处的海水环境酸性较强(pH值约为4.5),其最外层则为铜单质,内层为Fe3O4。
3)天然海水中添加1.5、15 mmol/L铜离子促进EH40钢腐蚀的机制主要有三方面:海水中铜离子水解形成酸性腐蚀环境;铁和铜离子的氧化还原反应消耗EH40钢基体;Fe-Cu电偶腐蚀池加剧阳极铁的腐蚀溶解。

