手性噁唑啉的不对称催化合成研究进展
潘永凯,陈运荣
手性噁唑啉的不对称催化合成研究进展
潘永凯1,陈运荣2
(1.辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001; 2.上海科技大学 物质科学与技术学院,上海 201210)
手性噁唑啉是一种重要的手性杂环化合物,该类结构不但广泛存在于具有生理活性的天然产物和药物小分子之中,还是手性合成中经常使用的手性辅基和手性配体。目前,手性噁唑啉的合成通常依赖于利用手性氨基醇作为起始原料与羧酸衍生物的缩合反应制备。然而,由于手性氨基醇的来源有限、合成步骤冗长等限制,发展更为高效、直接的不对称催化合成手性噁唑啉的方法具有重要的合成意义。总结了近年来发展的各种过渡金属催化和有机小分子催化的不对称合成手性噁唑啉衍生物的方法,包括不对称Aldol反应、不对称环化反应等。
不对称催化; 手性噁唑啉; 过渡金属催化; 有机小分子催化
2-噁唑啉是一种含有环状亚胺酯结构的五元杂环化合物,可以看作是一种掩蔽的羧酸衍生物;同时,该类化合物具有丰富的反应活性,被广泛应用于有机合成中[1-4]。当该类化合物4-位或5-位连有不同的取代基时,该类杂环化合物即具有手性。
手性噁唑啉结构广泛存在于一些具有生理活性的天然产物[5-6]、小分子药物[7-8]以及农药分子[9-10]中(见图1)。例如,环肽1是从一种海鞘中分离得到的具有手性噁唑啉以及噻唑、噻唑啉等杂环的环状七肽或者八肽,该类化合物对成纤维细胞和癌细胞具有细胞毒活性[11-12]。从双歧杆菌和蓝藻中分离出来的环肽2,也被称为“环噁唑啉”,它是一类具有3对称性的三噁唑啉环肽化合物[13],该天然产物除了对多种肿瘤细胞具有细胞毒活性外,还可以与多种金属离子(Ag+等)紧密络合,实现对这些金属离子的检测[14]。化合物3是从巴西诺卡氏菌中分离的铁载体,对鼠白血病(25 nmol)和人表皮样癌KB细胞(50 nmol)表现出有效的细胞毒性,该化合物中也含有一个手性噁唑啉的特征结构[15]。
手性噁唑啉在不对称合成领域也有广泛的应用,如图2所示。作为掩蔽的羧酸,手性噁唑啉被用作手性辅基应用于羧酸及其衍生物的α-不对称官能团化反应中[16]。自20世纪90代初起,具有2对称性的手性双噁唑啉配体4由于其优异的不对称诱导能力,已经成为不对称催化领域最受欢迎的手性配体之一[17-19]。此外,其他一些含有手性噁唑啉骨架的手性配体也被广泛地应用于过渡金属催化的不对称反应中[20-23],例如含有手性噁唑啉环的手性氮磷配体5[24]。
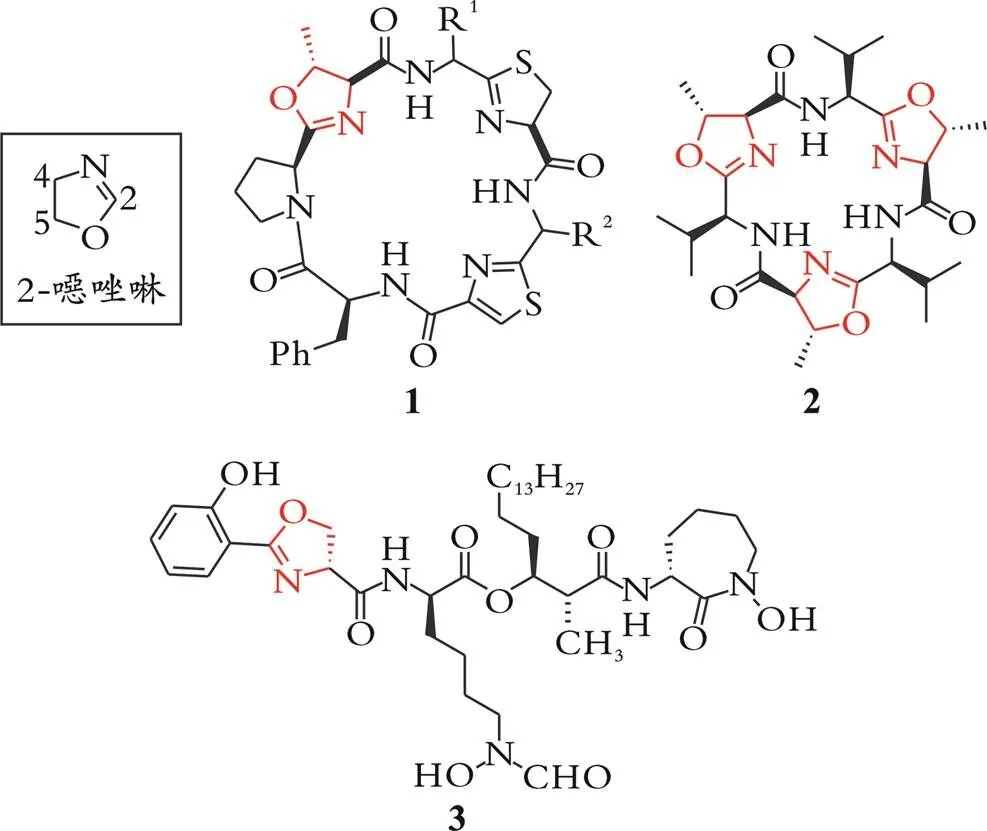
图1 含有手性噁唑啉结构的天然产物
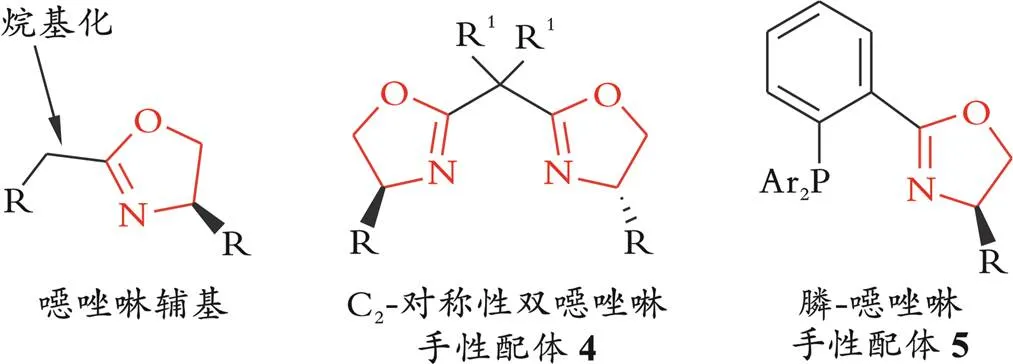
图2 含手性噁唑啉结构的手性辅基及手性配体
传统合成手性噁唑啉的方法如图3所示,利用手性氨基醇与羧酸或者羧酸衍生物缩合得到酰胺,在促进剂作用下实现分子内环化合成手性噁唑啉。通常手性氨基醇是由手性氨基酸的还原或者加成反应得到。然而,由于手性氨基醇的来源较为有限,合成步骤也较为繁琐,利用这一方法高效合成具有结构多样性的手性噁唑啉产物仍具有局限性,所以发展更为高效的不对称催化合成手性噁唑啉的方法具有重要的合成意义。本文按反应的不同类型总结近年来发展的利用不对称催化策略实现手性噁唑啉合成的方法。

图3 传统合成手性噁唑啉的方法
1 不对称Aldol反应
1986年,Y.Ito等[25]报道了手性二茂铁基膦8-金(I)配合物催化醛与α-异氰基乙酸酯7的不对称羟醛缩合(Aldol)反应,以良好的对映选择性和非对映选择性得到反式手性5-烷基-2-噁唑啉-4-羧酸酯产物9,该产物是合成手性β-羟基氨基酸及其衍生物的重要中间体,如图4所示(图中百分数均为摩尔分数,ee为对映体过量,dr为非对映体比例,下同)。1989年,S.D.Pastor等[26]的研究结果表明,该反应中二茂铁双膦配体中侧链的中心手性对反应的立体选择性也有非常重要的影响,该侧链手性中心可能与平面手性起着协同催化的作用。这一系列研究为后续科研人员带来很大启发,利用异氰基乙酸酯与羰基化合物的不对称Aldol反应合成手性噁唑啉产物的方法也迎来快速的发展。

图4 金催化α-异氰基乙酸酯与醛不对称Aldol反应
2011年,K.Oh课题组报道了一种单独使用过渡金属催化的方法,利用手性过渡金属催化剂和非手性有机催化剂协同催化,进行α-异氰基乙酸酯与醛的高非对映选择性和对映选择性Aldol反应,得到手性噁唑啉产物,如图5所示[27]。成功进行立体选择性控制的关键是异氰基乙酸酯和硫脲之间的强阴离子结合作用,该作用可以减少金属与异氰基之间的络合作用。

图5 手性钴催化α-异氰基乙酸酯与醛的不对称Aldol反应
2011年,D.J.Dixon课题组开发了一种基于金鸡纳生物碱衍生的手性氨基膦类配体11和12,并与适当过渡金属结合使用,可作为有效的布朗斯特碱/路易斯酸协同催化剂[28]。该催化剂成功应用于异氰基乙酸酯与醛的不对称Aldol反应中,以高反式非对映选择性和对映选择性得到噁唑啉产物14,如图6所示。利用α-取代的异氰基乙酸酯15作原料实现其与醛的不对称Aldol反应,构建具有手性季碳中心的噁唑啉产物16,而且该反应中得到的主要非对映异构体的酯基与醛中的基团R1处于顺式。
2015年,D.J.Dixon课题组报道了未活化的酮18与异氰基乙酸酯的直接不对称Aldol反应,该反应利用奎宁衍生的氮磷配体20和氧化银配位的二元催化剂体系,以良好的非对映选择性和优异的对映选择性得到具有5-位完全取代立体中心的手性噁唑啉产物19,如图7所示[29]。此反应为在β位上具有手性叔醇结构的α-氨基酸衍生物的不对称合成提供了可行的方法。

图6 手性银催化的α-异氰基乙酸酯与醛的不对称Aldol反应

图7 手性银催化的α-异氰基乙酸酯与酮的不对称Aldol反应
2018年,G.Blay课题组利用手性Brønsted碱-方酰胺有机催化剂和Ag2O作为Lewis酸的协同催化策略,也实现了异氰基乙酸酯与未活化酮之间的不对称Aldol反应,以良好的非对映选择性和优异的对映选择性合成具有5位手性季碳中心的手性噁唑啉产物[30]。随后,该课题组也进一步利用这一策略,实现了异氰基乙酸酯与三氟甲基取代的酮之间的不对称Aldol反应,成功构建具有含三氟甲基取代手性季碳中心的手性噁唑啉产物[31]。
2018年,D.J.Dixon课题组又报道了一种利用异氰基乙酸酯与α-羟基和α-氨基酮21之间高立体选择性的串联反应,合成具有完全取代的β-碳原子的稠合并环γ-内酯或γ-内酰胺噁唑啉产物22,如图8所示[32]。课题组设想手性银/配体络合物首先催化对映选择性的Aldol反应,生成手性噁唑啉中间产物23,紧接着侧链的亲核基团与相邻的酯基发生内酯化或内酰胺化反应,生成并环噁唑啉产物。

图8 不对称串联反应合成手性并环噁唑啉
除过渡金属催化外,手性有机催化剂也可以很好地催化异氰基乙酸酯与羰基化合物的不对称Aldol反应。 2009年,龚流柱课题组报道了α位取代的异氰基乙酸甲酯与苯基醛的不对称Aldol反应,该反应使用金鸡纳碱衍生物为催化剂,得到4,4,5-三取代的手性噁唑啉产物[33]。2010年,王锐课题组报道α-异硫氰基取代的酰胺25与靛红24在叔胺硫脲催化剂26的催化下,通过Aldol环化反应得到螺环硫代氨基甲酸内酯[34]。产物经过甲基化反应得到硫代噁唑啉和氧化吲哚构成的手性螺环产物27,如图9(a)所示。如果底物使用α-异硫氰基内酯28,反应以高立体选择性得到双螺手性中心噁唑啉产物29,如图9(b)所示。硫代噁唑啉氧化吲哚螺环结构存在于天然抑菌物质植物保卫素中,通过对一部分螺环噁唑啉产物进行抗菌研究发现,一些产物可以显著减缓使用急性神经炎模型的细菌内毒素引起的发热。
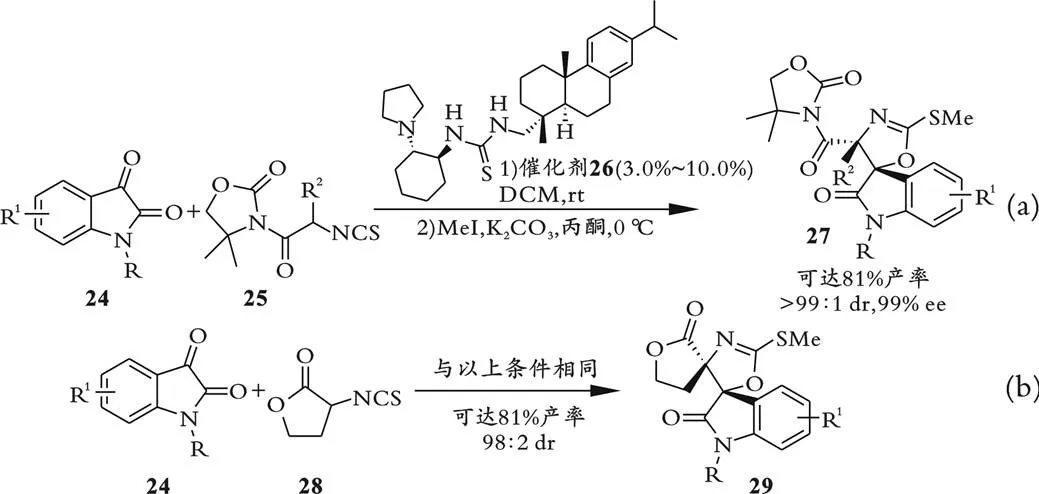
图9 手性叔胺硫脲催化的α-异硫氰酰胺、酯与靛红的不对称Aldol反应
2011年,袁伟成课题组研究发现,如果使用异硫氰基移到氧化吲哚的3位的底物30,在叔胺硫脲31的催化下,可以与酮进行不对称Aldol反应得到手性螺环硫代氨基甲酸内酯32,如图10(a)所示[35]。产物33经过甲基化反应,可以高效转化为甲硫基螺环噁唑啉化合物34,原料的绝对构型保持且不消旋化,如图10(b)所示,其他Aldol反应产物也可以经过类似转化得到相应的螺环噁唑啉类化合物。

图10 手性叔胺硫脲催化的异硫氰基氧化吲哚与酮的不对称Aldol反应
2013年,施敏课题组报道了奎宁衍生的双官能团手性磺酰胺-硫脲催化剂36催化的α取代异氰基乙酸酯35与靛红的不对称Aldol反应,构建具有季碳手性中心的螺环噁唑啉产物37,如图11所示[36]。底物中的R2基团可以是取代苯基和苄基,反应具备中等到优异的产率和立体选择性。
2015年,冯小明课题组使用手性胍和银离子协同催化α取代异氰基乙酸酯与靛红之间的不对称Aldol反应,得到手性螺环噁唑啉产物[37]。2016年,李珅课题组使用金鸡纳碱衍生的大位阻季铵盐作为手性相转移催化剂,催化异氰乙酸叔丁酯和醛的Aldol反应,得到手性噁唑啉产物,但反应的效果不太理想[38]。

图11 手性胺-硫脲双官能团催化剂催化α-取代异氰基乙酸酯与靛红的不对称Aldol反应
以上反应的噁唑啉产物都是用异氰基乙酸酯或异硫氰基底物转化而来的,2001年,D.A.Evans等[39]报道了一种新的途径,利用手性铝配合物39作为Lewis酸,催化醛与5-烷氧基噁唑38的不对称Aldol反应,以优异的对映选择性合成手性噁唑啉产物40,如图12所示。该反应主要得到顺式的产物,这与异氰基乙酸酯与醛的不对称Aldol反应的非对映选择性不同。同时,该反应不限于手性铝Lewis酸催化剂,二价铜与手性双噁唑啉形成的配合物43也是该类反应的有效催化剂,此类催化剂可以催化5-烷氧基噁唑41与乙醛酸乙酯42的不对称Aldol反应,同样以高顺式非对映选择性和对映选择性得到手性噁唑啉产物44。
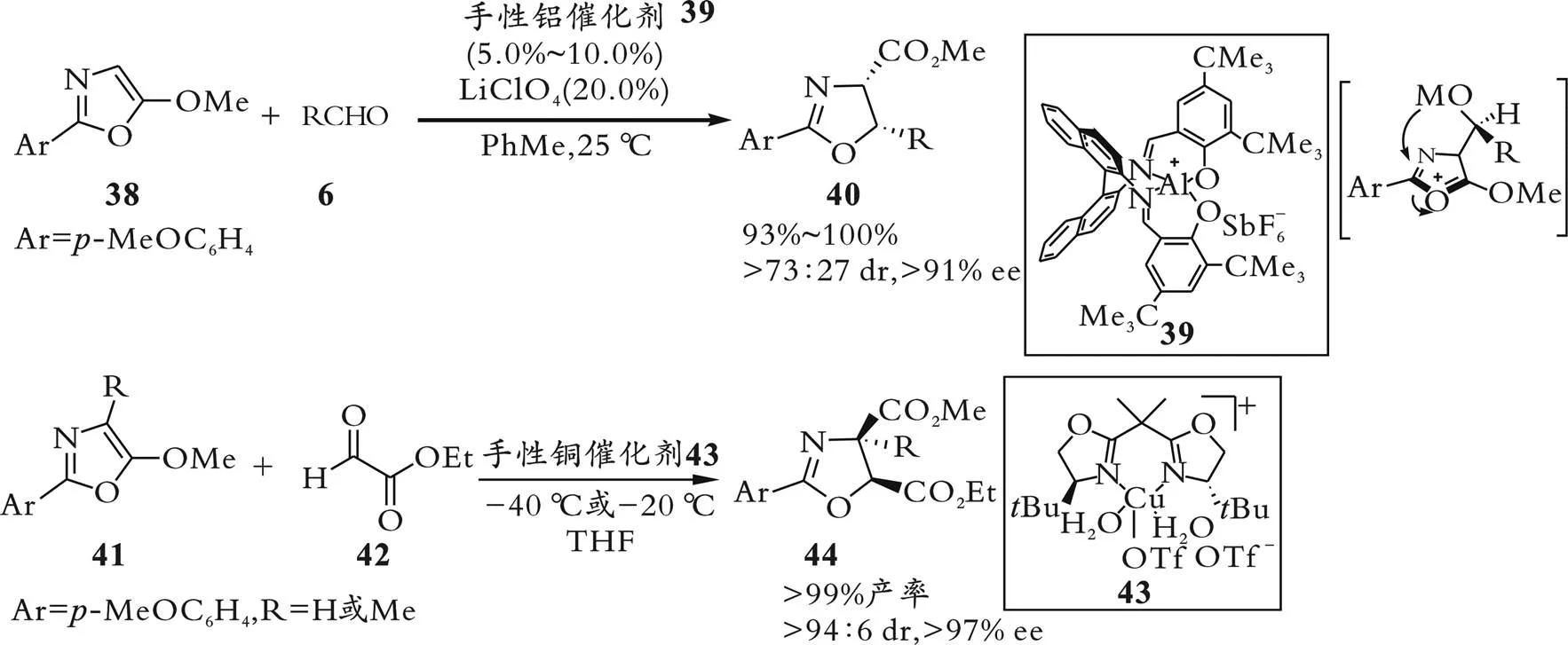
图12 5-烷氧基噁唑与醛的不对称Aldol反应
2 不对称环化反应
在手性噁唑啉的合成方法中,-烯丙基酰胺的不对称亲电环化反应是直接构建取代的手性噁唑啉衍生物的有效途径之一,特别是通过有机催化的不对称卤环化反应。
2011年,F.D.Toste课题组报道了一类手性磷酸阴离子相转移催化亲电氟化反应。在手性磷酸47作为催化剂、选择性氟试剂作为亲电氟代试剂的条件下,六元环烯醇醚酰胺45通过高效、高立体选择性亲电氟化环化反应得到手性氟代螺环噁唑啉产物46,如图13(a)所示[40]。使用苯并六元环烯基酰胺底物48则可以得到手性氟代苯并螺环噁唑啉49,反应也有良好的产率和优异的立体选择性,如图13(b)所示。如果把底物的六元环烯基改为2-苯并噻吩基,该反应可以打开噻吩环的碳碳双键,高立体选择性产生氟代硫杂环和噁唑啉构成的手性螺环产物。然而对于开链烯类底物,反应效果并不理想。对于这一系列反应,提出了一种新颖的手性阴离子相转移催化不对称催化策略,该策略利用手性磷酸阴离子良好的脂溶性,将不溶于非极性溶剂的氟代试剂选择性氟试剂通过阴离子交换转移至有机相中参与反应,从而有效抑制背景反应,取得了优异的对映选择性控制。

图13 手性阴离子相转移催化不对称氟环化反应
2011年,B.Borhan课题组报道了一种高对映选择性的-烯丙基酰胺50催化不对称氯环化反应,构建一系列取代的手性噁唑啉产物51,如图14所示[41]。在该反应中,DCDPH被用作亲电性的氯源,商品化的二氢奎宁定衍生物((DHQD)2PHAL)作为手性催化剂。2014年,B.Borhan课题组又报道了利用更加便宜易得的氯磺酰胺钠盐作为亲电性氯源,结合之前使用的有机催化剂,也可以很好地实现这一不对称催化反应,而且该反应可以在室温下进行,不会影响反应的对映选择性[42]。2018年,该课题组通过核磁、衍生化、同位素标记以及计算化学等手段对该反应机理的深入研究,提出了该反应立体化学形成的分析模型[43]。
2012年,O.Onomura课题组报道了在手性铜催化剂54的存在下,通过1,3-二醇52的去对称化反应,成功地实现了具有4-位季碳立体中心的手性噁唑啉53的高效合成,如图15所示[44]。该方法具有操作简便、反应条件温和以及对映选择性高的优点。最近,该课题组又通过相同的策略实现了三(羟甲基)取代的甲胺衍生物55的不对称去对称化反应合成手性多取代噁唑啉产物56[45]。

图15 手性铜络合物催化二醇和三醇的去对称化反应
2015年,Y.Hamashima课题组报道了用BINAP衍生物59催化不饱和酰胺57不对称溴环化的方法,如图16所示[46]。以DTBM-BINAP为催化剂,建立了使用-溴代琥珀酰亚胺(NBS)对-烯丙基酰胺进行高对映选择性溴环化的方法,该方法可高收率地给出具有四取代不对称碳立体中心的手性噁唑啉产物58,ee最高可达99%。通过一系列控制实验和核磁实验研究发现,该反应的真正催化剂是手性双膦部分氧化的物种,使在反应中存在两种Lewis碱位点(P和P=O)[47]。2017年,该课题组进一步报道了双烯丙基酰胺通过不对称溴环化反应实现去对称化合成手性噁唑啉,该反应的催化剂是BINAP单氧化合物[48-49]。此反应也被应用到HIV-蛋白酶抑制剂nelfinavir的不对称合成中,在关键步骤中构建手性1,2-氨基醇骨架[50]。

图16 手性膦催化不对称溴环化反应
2018年,麻生明课题组报道了手性配体62/钯络合物催化的联烯酰胺60与芳基或烯基碘化物的高对映选择性偶联-环化反应,用于手性噁唑啉衍生物61的高效不对称构建,如图17所示[51]。该反应中,两种起始材料的易得性和多样性以及手性噁唑啉产物中C=C的合成潜力,使该方法在有机化学和药物化学领域具有很大的吸引力。2019年,赵晓丹课题组报道了-烯丙基酰胺在手性硒催化剂的作用下实现对映选择性环化三氟甲硫基化反应[52],构建具有三氟甲硫基的手性噁唑啉产物。

图17 手性钯络合物催化不对称偶联-环化反应
3 其他反应
2004年,H.G.Park课题组报道了噁唑啉-4-羧酸酯底物63在相转移催化剂65作用下对映选择性烷基化反应合成手性噁唑啉产物64的方法,并将该反应应用到手性α-烷基丝氨酸衍生物的合成中,如图18(a)所示[53]。然而,手性季铵盐催化剂65的合成步骤较为冗长、价格较为昂贵,限制了该方法的进一步应用。2005年,该课题组又发现对于2-苯基噁唑啉-4-羧酸酯底物66,可以使用合成更为方便、价格也更为便宜的手性季铵盐催化剂68,此不对称烷基化反应也能取得优异的对映选择性,得到手性噁唑啉产物67,如图18(b)所示[54]。该不对称相转移催化策略也进一步被应用于噁唑啉-4-羧酸酯与丙烯酸酯的不对称Michael加成反应中,用于合成一种潜在的代谢受体HMG[55]。
2011年,R.Kuwano等[56]报道了通过Ru(3-methallyl)2(cod)和反式螯合的手性双膦配体PhTRAP(71)合成手性钌催化剂,催化2,4-取代噁唑69的不对称催化氢化反应,合成手性噁唑啉产物70,ee最高可达99%,如图19所示。该方法也可应用于咪唑的不对称氢化反应,得到手性咪唑啉产物。同时,这是第一例成功地应用于含两个或多个杂原子的五元芳环的不对称氢化方法。

图18 噁唑啉-4-羧酸酯的不对称相转移催化烷基化反应
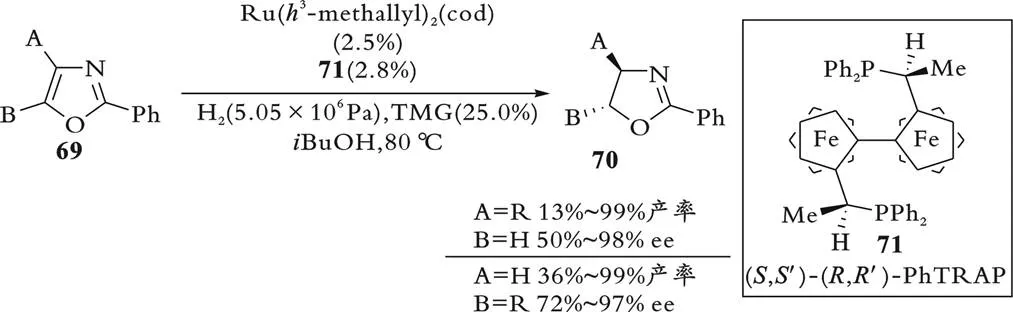
图19 取代噁唑的不对称氢化反应
2016年,J.B.Morgan课题组报道了钯(II)-手性双膦74配合物催化的内消旋--酰基氮丙啶72通过扩环重排反应(Heine反应)合成手性噁唑啉产物73的方法,如图20所示[57]。底物中的异噁唑基团在该反应中起着导向作用,而该反应的产物有望作为一类新型的手性双氮配体应用于不对称催化反应中。

图20 内消旋-N-酰基氮丙啶通过不对称扩环重排反应
4 结 论
手性噁唑啉不仅是合成一些重要的生理活性分子的关键砌块,更是手性合成中重要的手性辅基以及手性配体。由于该类手性化合物的重要性,除了传统的从手性氨基醇出发的合成路线外,近年来更为高效、多样性的不对称催化合成手性噁唑啉的报道不断涌现,成为有机化学研究的一个热门领域。本文总结了近年来发展的一系列不对称催化合成手性噁唑啉的策略及方法,包括不对称Aldol反应、不对称环化反应以及其他一些反应。其中,异氰基乙酸酯和活化的或未活化的醛酮的不对称Aldol反应主要构建2-位无取代的手性噁唑啉产物,而不对称环化主要生成5-位具有手性季碳中心的手性噁唑啉产物,而构建具有其他不同取代类型的手性噁唑啉的催化合成方法还较为有限。鉴于手性噁唑啉在有机合成领域的重要性,期待更多的高效、高选择性、能够实现手性噁唑啉多样性合成的新不对称催化合成方法的出现。
[1]Gant T G, Meyers A I. The chemistry of 2-oxazolines (1985-present)[J]. Tetrahedron, 1994, 50(8): 2297-2360.
[2]Wiley R H, Bennett L L. The chemistry of the oxazolines[J]. Chemical Reviews, 1949, 44(3): 447-476.
[3]Reuman M, Meyers A I. The synthetic utility of oxazolines in aromatic substitution[J]. Tetrahedron, 1985, 41(5): 837-860.
[4]Meyers A I, Mihelich E D. The synthetic utility of 2-oxazolines[J]. Angewandte Chemie International Edition, 1976, 15(5): 270-281.
[5]Hoshino S, Ozeki M, Awakawa T, et al. Catenulobactins A and B, heterocyclic peptides from culturing catenuloplanes sp. with a mycolic acid-containing bacterium[J]. Journal of Natural Products, 2018, 81(9): 2106-2110.
[6]Nelson K M, Salomon C E, Aldrich C C. Total synthesis and biological evaluation of transvalencin Z[J]. Journal of Natural Products, 2012, 75(6): 1037-1043.
[7]Guariento S, Tonelli M, Espinoza S, et al. Rational design, chemical synthesis and biological evaluation of novel biguanides exploring species-specificity responsiveness of TAAR1 agonists[J]. European Journal of Medicinal Chemistry, 2018, 146: 171-184.
[8]Marson C M, Matthews C J, Atkinson S J, et al. Potent and selective inhibitors of histone deacetylase-3 containing chiral oxazoline capping groups and a N-(2-aminophenyl)-benzamide binding unit[J]. Journal of Medicinal Chemistry, 2015, 58(17): 6803-6818.
[9]Yu X, Liu Y, Li Y, et al. Design, synthesis, acaricidal/insecticidal activity, and structure-activity relationship studies of novel oxazolines containing sulfone/sulfoxide groups based on the sulfonylurea receptor protein-binding site[J]. Journal of Agricultural and Food Chemistry, 2016, 64(15): 3034-3040.
[10] Li Y, Li C, Zheng Y, et al. Design, synthesis, acaricidal activity, and mechanism of oxazoline derivatives containing an oxime ether moiety[J]. Journal of Agricultural and Food Chemistry, 2014, 62(14): 3064-3072.
[11] Degnan B M, Hawkins C J, Lavin M F, et al. New cyclic peptides with cytotoxic activity from the ascidian Lissoclinum patella[J]. Journal of Medicinal Chemistry, 1989, 32(6): 1349-1354.
[12] Wasylyk J M, Biskupiak J E, Costello C E, et al. Cyclic peptide structures from the tunicate Lissoclinum patella by FAB mass spectrometry[J]. The Journal of Organic Chemistry, 1983, 48(24): 4445-4449.
[13] Prinsep M R, Moore R E, Levine I A, et al. Westiellamide, a bistratamide-related cyclic peptide from the blue-green alga westiellopsis prolifica[J]. Journal of Natural Products, 1992, 55: 140-142.
[14] Wipf P, Wang C. Synthesis and Ag(I) complexation studies of tethered westiellamide[J]. Organic Letters, 2006, 8(11): 2381-2384.
[15] Tsuda M, Yamakawa M, Oka S, et al. Brasilibactin A, a cytotoxic compound from actinomycete nocardia brasiliensis[J]. Journal of Natural Products, 2005, 68(3): 462-464.
[16] Meyers A I, Knaus G, Kamata K. Synthesis via 2-oxazolines. IV. Asymmetric synthesis of 2-methylalkanoic acids from a chiral oxazoline[J]. Journal of the American Chemical Society, 1974, 96(1): 268-270.
[17]Desimoni G, Faita G, Jørgensen K A. C2-symmetric chiral bis(oxazoline) ligands in asymmetric catalysis[J]. Chemical Reviews, 2006, 106(9): 3561-3651.
[18] Desimoni G, Faita G, Jørgensen K A. Update 1 of: C2-symmetric chiral bis(oxazoline) ligands in asymmetric catalysis[J]. Chemical Reviews, 2011, 111(11): 284-437.
[19] O'Reilly S, Guiry P J. Recent applications of C1-symmetric bis(oxazoline)-containing ligands in asymmetric catalysis[J]. Synthesis, 2014, 46(6): 722-739.
[20] Mantilli L, Gérard D, Torche S, et al. Iridium-catalyzed asymmetric isomerization of primary allylic alcohols[J]. Angewandte Chemie International Edition, 2009, 48(28): 5143-5147.
[21] Yang G, Zhang W. Renaissance of pyridine-oxazolines as chiral ligands for asymmetric catalysis[J]. Chemical Society Reviews, 2018, 47(5): 1783-1810.
[22] Li W, Wang G, Lai J, et al. Multifunctional isoquinoline-oxazoline ligands of chemical and biological importance[J]. Chemical Communications, 2019, 55(42): 5902-5905.
[23] Shao Q, Wu Q F, He J, et al. Enantioselective γ-C(sp3)- H activation of alkyl amines via Pd(II)/Pd(0) catalysis[J]. Journal of the American Chemical Society, 2018, 140(16): 5322-5325.
[24] Von Matt P, Pfaltz A. Chiral phosphinoaryldihydrooxazoles as ligands in asymmetric catalysis: Pd-catalyzed allylic substitution[J]. Angewandte Chemie International Edition in English, 1993, 32(4): 566-568.
[25] Ito Y, Sawamura M, Hayashi T. Catalytic asymmetric aldol reaction: Reaction of aldehydes with isocyanoacetate catalyzed by a chiral ferrocenylphosphine-gold(I)complex[J]. Journal of the American Chemical Society, 1986, 108: 6406-6407.
[26] Pastor S D, Togni A. Asymmetric synthesis with chiral ferrocenylamine ligands: The importance of central chirality[J]. Journal of the American Chemical Society, 1989, 111(6):2333-2334.
[27] Kim H Y, Oh K. Highly diastereo- and enantioselective aldol reaction of methyl α-isocyanoacetate: A cooperative catalysis approach[J]. Organic Letters, 2011, 13(6): 1306-1309.
[28] Sladojevich F, Trabocchi A, Guarna A, et al. A new family of cinchona-derived amino phosphine precatalysts: Application to the highly enantio- and diastereoselective silver-catalyzed isocyanoacetate aldol reaction[J]. Journal of the American Chemical Society, 2011, 133(6): 1710-1713.
[29] de la Campa R, Ortin I, Dixon D J. Direct catalytic enantio- and diastereoselective ketone aldol reactions of isocyanoacetates[J]. Angewandte Chemie International Edition, 2015, 54(16): 4895-4898.
[30] Martínez-Pardo P, Blay G, Muñoz M C, et al. Enantioselective synthesis of chiral oxazolines from unactivated ketones and isocyanoacetate esters by synergistic silver/organocatalysis[J]. Chemical Communications, 2018, 54(23): 2862-2865.
[31] Martínez-Pardo P, Blay G, Vila C, et al. Enantioselective synthesis of 5-trifluoromethyl-2-oxazolines under dual silver/organocatalysis[J]. The Journal of Organic Chemistry, 2019, 84(1): 314-325.
[32] de la Campa R, Manzano R, Calleja P, et al. Enantioselective silver-catalyzed cascade synthesis of fused lactone and lactam oxazolines[J]. Organic Letters, 2018, 20(19): 6033-6036.
[33] Xue M X, Guo C, Gong L Z. Asymmetric synthesis of chiral oxazolines by organocatalytic cyclization of α-aryl isocyanoesters with aldehydes[J]. Synlett, 2009, 2009(13): 2191-2197.
[34] Jiang X, Cao Y, Wang Y, et al. A unique approach to the concise synthesis of highly optically active spirooxazolines and the discovery of a more potent oxindole-type phytoalexin analogue[J]. Journal of the American Chemical Society, 2010, 132(43): 15328-15333.
[35] Chen W B, Wu Z J, Hu J, et al. Organocatalytic direct asymmetric aldol reactions of 3-isothiocyanato oxindoles to ketones: stereocontrolled synthesis of spirooxindoles bearing highly congested contiguous tetrasubstituted stereocenters[J]. Organic Letters, 2011, 13(9): 2472-2475.
[36] Zhao M X, Zhou H, Tang W H, et al. Cinchona alkaloid-derived thiourea-catalyzed diastereo- and enantioselective [3+2] cycloaddition reaction of isocyanoacetates to isatins: A facile access to optically active spirooxindole oxazolines[J]. Advanced Synthesis & Catalysis, 2013, 355(7): 1277-1283.
[37] Lu Y, Wang M, Zhao X, et al. Cooperative chiral guanidine/AgPF6 catalyzed asymmetric isocyanoacetate aldol reaction with isatins[J]. Synlett, 2015, 26(11): 1545-1548.
[38] Diao R C, Zhao W T, Li S. Diastereo- and enantioselective preparation of oxazolines via the base-catalysed aldol reaction of isocyanoacetates with aldehydes using cinchona alkaloids[J]. Journal of Chemical Research, 2016, 40(9): 521-525.
[39] Evans D A, Janey J M, Magomedov N, et al. Chiral salen-aluminum complexes as catalysts for enantioselective aldol reactions of aldehydes and 5-alkoxyoxazoles: An efficient approach to the asymmetric synthesis of syn and anti β-hydroxy-α-amino acid derivatives[J]. Angewandte Chemie International Edition, 2001, 40(10): 1884-1888.
[40] Rauniyar V, Lackner A D, Hamilton G L, et al. Asymmetric electrophilic fluorination using an anionic chiral phase-transfer catalyst[J]. Science, 2011, 334: 1681-1684.
[41] Jaganathan A, Garzan A, Whitehead D C, et al. A catalytic asymmetric chlorocyclization of unsaturated amides[J]. Angewandte Chemie International Edition, 2011, 50(11): 2593-2596.
[42] Jaganathan A, Borhan B. Chlorosulfonamide salts are superior electrophilic chlorine precursors for the organocatalytic asymmetric chlorocyclization of unsaturated amides[J]. Organic Letters, 2014, 16(14): 3616-3619.
[43] Marzijarani N S, Yousefi R, Jaganathan A, et al. Absolute and relative facial selectivities in organocatalytic asymmetric chlorocyclization reactions[J]. Chemical Science, 2018, 9(11): 2898-2908.
[44] Tsuda Y, Kuriyama M, Onomura O. Synthesis of optically active oxazoline derivatives via catalytic asymmetric desymmetrization of 1,3-diols[J]. Chemistry-A European Journal, 2012, 18(9): 2481-2483.
[45] Yamamoto K, Tsuda Y, Kuriyama M, et al. Copper-catalyzed enantioselective synthesis of oxazolines from aminotriols via asymmetric desymmetrization[J]. Chemistry-An Asian Journal, 2020, 15(6): 1-6.
[46] Kawato Y, Kubota A, Ono H, et al. Enantioselective bromocyclization of allylic amides catalyzed by BINAP derivatives[J]. Organic Letters, 2015, 17(5): 1244-1247.
[47] Kawato Y, Ono H, Kubota A, et al. Highly enantioselective bromocyclization of allylic amides with a P/P=O double-site lewis base catalyst[J]. Chemistry-A European Journal, 2016, 22(6): 2127-2133.
[48] Nagao Y, Hisanaga T, Egami H, et al. Desymmetrization of bisallylic amides through catalytic enantioselective bromocyclization with BINAP monoxide[J]. Chemistry-A European Journal, 2017, 23(66): 16758-16762.
[49]Kawato Y, Hamashima Y. Enantioselective bromocyclization of allylic amides mediated by phosphorus catalysis[J]. Synlett, 2018, 29(10): 1257-1271.
[50] Nagao Y, Hisanaga T, Utsumi T, et al. Enantioselective synthesis of nelfinavir via asymmetric bromocyclization of bisallylic amide[J]. The Journal of Organic Chemistry, 2018, 83(13): 7290-7295.
[51] Luo H, Yang Z, Lin W, et al. A catalytic highly enantioselective allene approach to oxazolines[J]. Chemical Science, 2018, 9(7): 1964-1969.
[52] Qin T, Jiang Q, Ji J, et al. Chiral selenide-catalyzed enantioselective synthesis of trifluoromethylthiolated 2,5-disubstituted oxazolines[J]. Organic & Biomolecular Chemistry, 2019, 17(7): 1763-1766.
[53] Jew S S, Lee Y J, Lee J, et al. Highly enantioselective phase-transfer-catalytic alkylation of 2-phenyl-2-oxazoline-4-carboxylic acid tert-butyl ester for the asymmetric synthesis of alpha-alkyl serines[J]. Angewandte Chemie International Edition, 2004, 43(18): 2382-2385.
[54] Lee Y J, Lee J, Kim M J, et al. Highly enantioselective synthesis of (R)-α-alkylserines via phase-transfer catalytic alkylation of o-biphenyl-2-oxazoline-4-carboxylic acid tert-butyl ester using cinchona-derived catalysts[J]. Organic Letters, 2005, 7(8): 1557-1560.
[55] Lee Y J, Lee J, Kim M J, et al. Highly enantioselective synthesis of (2S)-α-(hydroxymethyl)-glutamic acid by the catalytic michael addition of 2-naphthalen-1-yl-2-oxazoline-4-carboxylic acid tert-butyl ester[J]. Organic Letters, 2005, 7(15): 3207-3209.
[56] Kuwano R, Kameyama N, Ikeda R. Catalytic asymmetric hydrogenation of N-boc-imidazoles and oxazoles[J]. Journal of the American Chemical Society, 2011, 133(19): 7312-7315.
[57] Punk M, Merkley C, Kennedy K, et al. Palladium-catalyzed, enantioselective heine reaction[J]. ACS Catalysis, 2016, 6(7): 4694-4698.
Advances in Asymmetric Catalytic Synthesis of Chiral Oxazolines
Pan Yongkai1, Chen Yunrong2
(1.School of Petrochemical Engineering, Liaoning Petrochemical University, Fushun Liaoning 113001, China;2.School of Physical Science and Technology, ShanghaiTech University, Shanghai 201210, China)
Chiral oxazolines are a type of important chiral heterocycles compound, which are not only present in many biologically active natural products and drug small molecules with physiological activity, but also in chiral cofactors and chiral ligands often used in chiral synthesis. Currently, the asymmetric synthesis of chiral oxazolines still relies on the condensation between chiral amino alcohols and carboxylic acid derivatives. However, due to the limited availability of chiral amino alcohols and the tedious synthetic route, the development of highly efficient and straightforward methods for chiral oxazolines synthesis via asymmetric catalysis is of significant synthetic value. In this paper, we have summarized the recent advances in the asymmetric catalytic synthesis of chiral oxazoline derivatives through transition metal catalysis and organocatalysis, including asymmetric Aldol reactions, asymmetric clizations and others.
Asymmetric catalysis; Chiral oxazolines; Transition metal catalysis; Small-molecule organocatalysis
O621.25+6.7
A
10.3969/j.issn.1672-6952.2021.04.002
1672-6952(2021)04-0009-08
http://journal.lnpu.edu.cn
2020-03-10
2020-04-07
国家自然科学基金青年科学基金项目(21901162)。
潘永凯(1993-),男,硕士研究生,从事不对称小分子催化方面的研究;E-mail:yongkaipan@outlook.com。
陈运荣(1985-),男,博士,助理研究员,从事不对称小分子催化方面的研究;E-mail:chenyr@s
(编辑 宋官龙)

