利用CRISPR/Cas 9基因编辑技术改良大粒香稻瘟病抗性
吴 娴, 李佳丽, 曾庆鸿, 张大双, 徐海峰, 姜 雪, 宋 莉, 彭 强, 朱速松
(1.贵州大学生命科学学院/山地植物资源保护与种质创新教育部重点实验室/贵州省农业生物工程重点实验室, 贵阳 550025;2.贵州省农业科学院水稻研究所, 贵阳 550006; 3.贵州省农业科技发展中心, 贵阳 550001)
水稻(OryzasativaL.)是世界上最主要的粮食作物之一[1]。但其产量每年都会受制于稻瘟病的暴发,严重时整穗枯死,造成绝收[2]。因此,提高稻瘟病抗性,对提高水稻产量有重要意义。稻瘟病是由稻瘟病原菌(Magnaportheoryzae)侵染引起的病害,在水稻整个生育期都可发生。目前,除了第3号染色体没有发现抗性基因之外,其余染色体上都有抗性基因分布,现已有二十多个稻瘟病抗性基因得到克隆且进行功能验证[3]。Pid3基因是Shang等[4]通过设计特异于日本晴NBS-LRR假基因等位基因的PCR分子标记,比较籼稻和粳稻假基因化差异,从籼稻品种地谷中鉴定出来的一个主效稻瘟病抗性基因。Chen等[5]从籼稻品种谷梅2号中利用图位克隆方法分离出一个新的稻瘟病抗性等位基因Pi25,分析表明与Pid3蛋白的基因序列完全一致。Pid3位于第6号染色体上,其cDNA全长为2 970 bp,包含两个外显子,编码923个氨基酸,含有NBS-LRR结构域和MHD基序的蛋白产物[6]。
近年来,CRISPR/Cas 9基因编辑技术发展较为迅速,该系统已逐渐发展为遗传育种中改良作物的有效手段,可针对某些存在不良性状的优质稻材料进行基因位点编辑,从而获得兼并优良品质与性状的新品种。Xu等[7]利用CRISPR/Cas 9敲除了有关水稻千粒重的基因GW2、GW5及TGW6,发现突变体粒重、粒长和粒宽均显著增加。郭洪刚等[8]定点编辑水稻株高基因OsGA20ox2,突变体植株株高降低了29.6%。蔡梦颖等[9]靶向编辑了水稻中SSSIIb基因,降低了SSS 2-Q家系直链淀粉含量,其品质得到改善。周文甲等[10]对绥粳14的香味基因Badh2进行编辑,其突变体香味物质含量是原来的近两倍,成功对野生型材料进行了香味改良。
大粒香是贵州省农业科学院水稻研究所采用粳籼杂交方法育成的香稻品系[11],其稻米品质优异,粒形大,色泽晶莹透亮,粒粒醇香,农业部检测中心检测为一级稻米,自2003年以来连续5次荣获中国十大金奖大米[12],但受其稻瘟病抗性差的影响,限制了其大规模推广应用。因此,本研究利用CRISPR/Cas 9技术对大粒香中的目标基因pid3进行编辑,获得具有稻瘟病抗性的大粒香改良品种,攻克优质稻大粒香不抗稻瘟病的生产应用难题,为贵州省抗稻瘟病品种选育提供新的思路和方法。
1 材料与方法
1.1 材 料
本研究以稻瘟病感病品种大粒香为转基因受体材料,由贵州省水稻研究所育成,大肠杆菌(Escherichiacoli)菌株 DH 5 α、农杆菌(Agrobacteriumtumefaciens)菌株 EHA 105、试验所用pYLgRNA-OsU 3、pYLgRNA-OsU 6 a及pYLCRISPR/Cas 9-MH双元载体由华南农业大学刘耀光院士提供。
1.2 gRNA 靶点接头设计及载体构建
通过MSU-RGAP(http://rice.plantbiology.msu.edu/)获得pid3(LOC_Os 06 g 22460)的基因序列,利用CRISPRGE在线网站(http://skl.scau.edu.cn/)设计适用于水稻基因突变gRNA序列。利用NCBI 对水稻基因组进行BLAST来分析确认靶位点的特异性,排除潜在脱靶序列,靶点接头引物为Pid 3-U 3-F/Pid 3-U 3-R,Pid 3-U 6 a-F/Pid 3-U 6 a-R。
载体构建参照Ma等[13]的试验方法进行,将所连接好的产物通过热激法转入大肠杆菌DH5α感受态细胞中,进行PCR扩增筛选阳性菌落。

表1 本研究中使用的引物
1.3 T0代植株获得与验证
采用电击法转化农杆菌,参考周文甲[14]的方法。将含有基因编辑系统的菌液转化到大粒香愈伤组织中。采用质量浓度为50 mg·L-1的潮霉素进行筛选,通过共培养、水洗、筛选、预分化、分化、生根等步骤获得再生组培苗,之后移栽到土壤中,在温室内进行培养。
采用CTAB法[15]抽提叶片组织DNA,设计载体引物SP-ML/SP-R进行阳性鉴定。同时,分别在pid3靶序列两侧设计扩增引物CR-d 3-F/CR-d 3-R来扩增T0代阳性植株的目的条带,观察其编辑情况。其扩增条件为:95 ℃变性45 s,57 ℃退火40 s,72 ℃延伸70 s,32个循环,1%琼脂糖凝胶电泳检测PCR产物。
1.4 无Csa 9位点纯合编辑株系的筛选
将T0代突变的crispr-pid 3双靶点材料进行自交,筛选出具有突变但已经不含Cas 9基因的稳定性突变植株。利用载体引物SP-ML/SP-R扩增T1代突变体基因组序列,扩增不出条带的为无转基因成分的突变体植株。采用20 μL rTaqPCR体系,对crispr-pid 3双靶点材料用CR-d 3-F/CR-d 3-R引物扩增外源,送公司双向测序。利用序列比对软件Sequencher 4.9分析crispr-pid 3材料靶基因编辑情况。
1.5 突变体稻瘟病抗性鉴定
在稻瘟病抗性鉴定区试点种植T1代纯合突变的crispr-pid3双靶点材料,用大粒香作对照。参照水稻品种试验稻瘟病抗性鉴定与评价技术规程(NY/T 2646-2014),对每个株系的每个单株进行单株种植,对于苗叶瘟,每株调查发病最重的叶片,取发病最重的3株平均数作为评价的依据,而穗瘟在水稻黄熟初期,即80%小穗尖端谷粒成熟时,调查发病最重的稻穗,进行田间病圃稻瘟病病情鉴定。即采用自然诱发法测定叶瘟和穗瘟,抗性综合评价分级划分为高抗(HR)、抗(R)、中抗(MR)、中感(MS)、感(S)和高感(HS)共6个标准。
2 结果与分析
2.1 水稻pid3基因编辑载体的构建
根据CRISPR/Cas 9靶点设计要求,在pid3第一外显子上设计靶位点序列,其PAM序列为NGG。为了提高突变效率,设计两个靶点(target 1:AAGAACCTTTCGTATCAAGG;target 2:GTCTGCCTAGATCCCAAGACGGG)(图1 A)。将带有两个靶点的gRNA表达盒连接到pYLCRISPR/Cas 9-MH载体骨架上(图1 B),构建好的载体为crispr-pid 3。
通过Overlaping PCR方法进行的靶位点sgRNA表达盒的连接,其对应sgRNA表达盒的构建片段U 3-sgRNA及U 6 a-sgRNA扩增产物长度分别为767 bp及629 bp,证明了构建的不同载体的sgRNA表达盒都正确(图2 A)。构建好的Cas 9/sgRNA表达载体经过电激转化后挑取单克隆,将连有靶点的gRNA 表达盒胶回收产物采用边切边连法组装到载体骨架上,比对所有靶点序列及启动子序列,均为阳性克隆(图2 B、C)。
2.2 转基因植株的获得
CRISPR/Cas 9编辑载体经测序及酶切验证无误后,转入农杆菌EHA 105菌株。侵染大粒香愈伤组织,将愈伤组织转移到潮霉素筛选培养基上进行筛选(图3 A),选择培养两次,一次2周,将经筛选得到的抗性愈伤转到带抗性的预分化培养基中,再转移到三角瓶里的分化培养基进行培养(图3 B),待苗长到3~4 cm时,转入生根培养基中培养(图3 C)。最后获得45株T0代植株,编号为A 1~A 45。
2.3 T0代转基因植株检测
利用载体引物SP-ML/SP-R检测转基因苗中T-DNA区,筛选转基因阳性植株。结果表明,45株转基因苗中有30株阳性苗(图4 A、B)。利用引物CR-d 3-F/CR-d 3-R检测crispr-pid 3双靶点材料pid3基因靶位点编辑情况,发生大片段编辑事件的有19株(图4 C、D)。其中发生大片段编辑的且为单一条带的材料有3株,单株编号分别为A 42、A 43和A 45。
2.4 T1代不含Cas 9编辑位点的突变体筛选及靶位点检测
将T0代基因突变植株(A 42、A 43、A 45)自交繁殖获得T1代植株,利用载体引物筛选出9株无Cas 9编辑位点的植株(图5 A),再通过CR-d 3-F/CR-d 3-R进行扩增,对比材料靶基因编辑情况(图5 B)。试验共得到B 1~B 9共9株所需突变材料,9株材料通过靶位点引物进行扩增并测序检验均为纯合突变(表2)。9株T1代纯合突变的crispr-pid 3双靶点材料,靶基因发生大片段缺失,测序结果表明编号为B 7、B 8号缺失69 bp外,其余均缺失70 bp(B 1~B 6、B 9),初步观察田间表型(图5 C),可以观察到稻瘟病有所改善。

表2 T1代基因靶位点检测
2.5 纯合突变株系的稻瘟病抗性鉴定
为了鉴定CRISPR/Cas 9基因编辑技术创制的纯合突变株系对稻瘟病菌的抗性,以原种大粒香作为对照,种植9株T1代突变的crispr-pid 3双靶点材料。针对叶瘟来说,对照大粒香表现为高感,叶枯死面积占叶面积的50.1%~75.0%,T1代中有6株(B 1~B 4、B 6、B 8)抗性类型表现为感,枯死面积占叶面积的25.1%~50.0%,其余3株(B 5、B 7、B 9)为害面积占叶面积的10.1%~25.0%。而对于穗瘟来说,虽然其发病率均>50%,表现为高感,但损失率下降了2~4个等级(B 2除外),尤其是B 7和B 8,损失率显著下降。综合各项鉴定指标,原种大粒香表现为高感(≥7.6),其余编辑成功材料表现为感(6.1~7.5)。
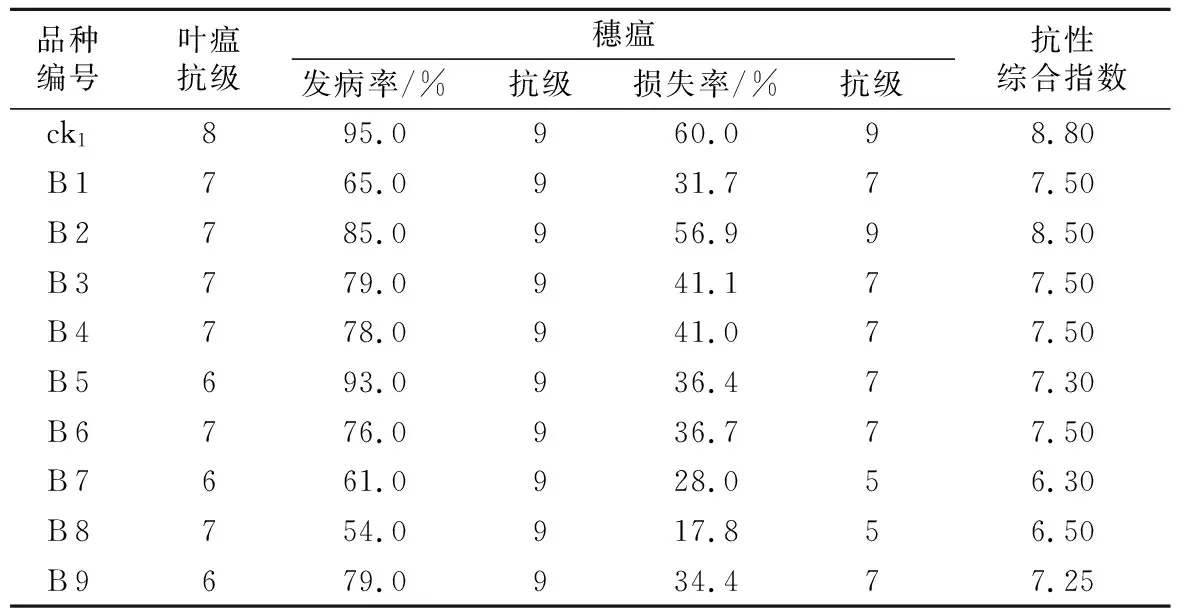
表3 稻瘟病抗性鉴定结果
2.6 米质分析
为了考察本试验在敲除pid3基因的同时是否影响大粒香的米质,因此挑选T1代中CRISPR/Cas 9基因成功编辑的两个材料,即具有代表性的突变体B 5(缺失70 bp)和B 7(缺失69 bp)进行米质分析。依据NY/T 593-2013的衡量标准,对改良株系B 5和B 7与对照组大粒香进行稻米品质鉴定。
综合分析大粒香、改良株系B 5及B 7可知,改良株系其理化品质如出糙率、精米率、整精米率、垩白粒率、垩白度、直链淀粉含量、胶稠度、碱消值级、透明度、水分等性状并未发生显著改变,由万深SC-G考种仪所测量的米粒长、宽及千粒重等性状也无明显改变。说明本试验在编辑抗稻瘟病基因的同时并没有影响其他基因的表达,改良株系的米质并未因pid3基因的编辑而受到影响。
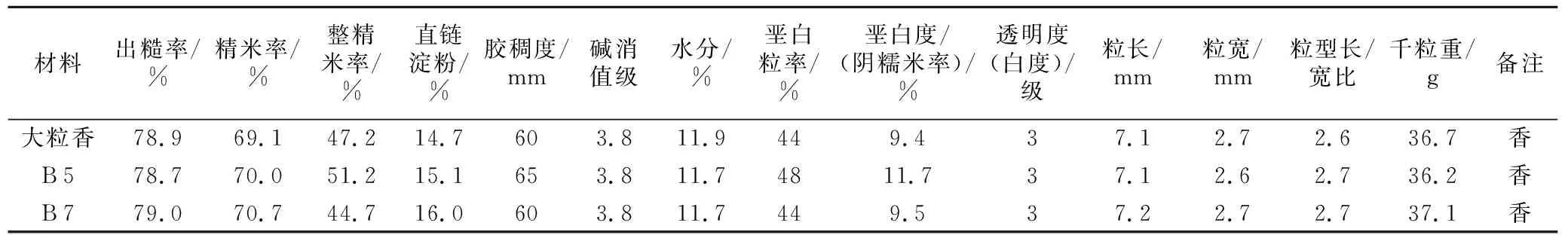
表4 米质分析结果
3 讨 论
稻瘟病是水稻最严重的病害之一,被稻瘟病侵染会造成不同程度的减产,有的地区甚至颗粒无收。稻瘟病的危害不仅表现在产量损失严重,也会严重影响稻米品质[16]。常规育种主要是依靠抗性表型来进行选择,但高度依赖水稻品种、致病小种等因素,选育效率不高,且耗时长[17]。而CRISPR/Cas 9基因编辑技术与传统育种相比,操作简便,成本低等优点。杨海河等[18]基于CRISPR/Cas 9技术对粳稻感病品种日本晴的pi21基因进行定点编辑,提高了稻瘟病抗性水平。徐鹏等[19]利用CRISPR/Cas 9基因编辑技术,构建以Pita、pi21和ERF922为靶基因的共编辑载体,获得了能够稳定遗传且具有较高稻瘟病抗性的纯合突变株系。研究表明,利用CRISPR/Cas 9基因编辑技术可改良水稻稻瘟病抗性,加快抗稻瘟病的水稻新品系培育。
在本研究中,利用CRISPR/Cas 9基因编辑系统,在获得的45株转基因苗中,有19株发生了大片段编辑,从中选择3株材料(A 42、A 43和A 45),自交获得T1代,在T1代中筛选出9株无外源Cas 9位点的突变材料(B 1~B 9),其突变类型具有两大类,一类缺失69 bp,另一类缺失70 bp。对9株编辑材料进行田间病圃稻瘟病病情鉴定,与原种大粒香相比,稻瘟病抗性均有一定程度提高。且通过对T1代米质分析,突变株重要性状与野生型大粒香相比并没有显著差异,说明编辑pid3基因时没有导致其他品质基因序列的改变。因此利用CRISPR/Cas 9基因编辑技术可以有效定向改良优质稻稻瘟病抗性。研究结果也为攻克优质稻大粒香不抗稻瘟病的生产应用难题提供了一个范例。

