睡眠剥夺对2型糖尿病患者糖脂代谢、炎性因子及褪黑素含量的影响研究
廖斌 李强翔 周艳 周洪 李文静 彭友 李华桦
【摘要】 目的 探讨睡眠剥夺对2型糖尿病患者糖脂代谢、炎性因子及褪黑素(MT)含量的影响。
方法 选取2019年1月~2020年10月150例2型糖尿病患者设为研究组,根据睡眠剥夺情况分为正常睡眠组、轻度睡眠剥夺组、重度睡眠剥夺组,各50例,另选取同期50名健康体检者设为健康对照组。抽取各组血液样本,测定血清炎性因子[白细胞介素6(IL6)、肿瘤坏死因子α(TNFα)]、内皮素1(ET1)、MT水平、血脂[高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TC)、甘油三酯(TG)]、血糖[糖化血红蛋白(HbA1c)、空腹血糖(FPG)、餐后2 h血糖(2 hPG)]水平,并对轻度睡眠剥夺组、重度睡眠剥夺组患者进行睡眠时间纠正。
结果 研究组IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1水平高于健康对照组,HDL、MT水平低于健康对照组(P<0.001);轻度睡眠剥夺组IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1水平高于正常睡眠组,HDL、MT水平低于正常睡眠组(P<0.05);重度睡眠剥夺组IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1水平高于轻度睡眠剥夺组,HDL、MT水平低于轻度睡眠剥夺组(P<0.05)。睡眠时间纠正后轻度睡眠剥夺组、重度睡眠剥夺组IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1、HDL、MT水平较干预前改善(P<0.001),組间比较差异无统计学意义(P>0.05)。
结论 2型糖尿病患者存在糖脂代谢紊乱及不同程度炎性反应,而睡眠剥夺可影响2型糖尿病患者糖脂代谢状态,加剧炎性反应程度,降低MT含量,纠正睡眠时间后可有效逆转上述现象。
【关键词】 睡眠剥夺;2型糖尿病;糖脂代谢;炎性因子;褪黑素
中图分类号:R587. 文献标志码: DOI:10.3969/j.issn.10031383.2021.06.005
Effects of sleep deprivation on glucose and lipid metabolism, inflammatory factors and melatonin in patients with type 2 diabetes mellitus
LIAO Bin1,3, LI Qiangxiang2,3▲, ZHOU Yan1, ZHOU Hong1, LI Wenjing1, PENG You1, LI Huahua1
(1. Department of Geriatrics, The People's Hospital of Hunan Province, Changsh410016, Hunan, China; 2. The Geriatrics Institute of Hunan Province, Changsha 410016, Hunan, China; 3. Clinical Research Center oGeriatric Diseases, Yinchuan 750001, Ningxia, China)
【Abstract】 Objective To investigate the effects of sleep deprivation on glucose and lipid metabolism, inflammatory factors and melatonin (MT) in patients with type 2 diabetes mellitus.
Methods 150 patients with type 2 diabetes mellitus in our hospital from January 2019 to October 2020 were selected as study group, and they werdivided into normal sleep group, mild sleep deprivation group and severe sleep deprivation group according to the sleep deprivation situation, with 50 cases in each group. Another 50 healthy people in the same period were selected as healthy control group. Blood samples were collected from each group to detect the levels of inflammatory factors (interleukin[IL6]tumor necrosis factorα [TNFα]), endothelin1 (ET1), MT, blood lipids (high density lipoprotein [HDL], low density lipoprotein [LDL], total cholesterol [TC], triglyceride [TG]), and blood glucose (glycosylated hemoglobin [HbA1c]fasting plasma glucose [FPG], 2 h postprandial blood glucose [2 hPG]). And the sleep time of patients in the mild sleep deprivation group and the severe sleep deprivation group was corrected.
Results The IL6, TNFα, LDL, TC, TG, HbA1c, FPG, 2 hPG, ET1 levels in thstudy group werhigher than those in thhealthy control group, while the HDL and MT levels were lower than those in the healthy control group (P < 0.001)The levels of IL6, TNFα, LDL, TC, TG, HbA1c, FPG, 2 hPG and ET1 in the mild sleep deprivation group were higher than those in the normal sleep group, while the levels of HDL and MT were lower than those in the normal sleep group (P < 0.05). The levels of IL6, TNFα, LDL, TC, TG, HbA1c, FPG, 2 hPG and ET1 in the severe sleep deprivation group were higher than those in the mild sleep deprivation group, while the levels of HDL and MT were lower than those in the mild sleep deprivation group (P < 0.05). After sleep time correction, the levels of IL6, TNFα, LDL, TC, TG, HbA1c, FPG, 2 hPG, ET1, HDL and MT among the mild sleep deprivation group and the severe sleep deprivation group significantly improved while comparing while those before sleep time correction (P < 0.001), but difference between groups was not statistically significant (P > 0.05).
Conclusion Patients with type 2 diabetes mellitus have glucose and lipid metabolism disorder and different degrees of inflammatory reaction. Sleep deprivation can affect the glucose and lipid metabolism of them, aggravate the degree of inflammatory reaction, reduce the content of MT, and sleep time correction can effectively reverse the abovementioned phenomenon.
【Key words】 sleep deprivation; type 2 diabetes mellitus; glucose and lipid metabolism; inflammatory factor; MT
2型糖尿病具有較高发病率,同时,受疾病自身、社会压力及生活压力增大等影响,患者睡眠习惯发生改变,存在不同程度睡眠剥夺[1]。研究表明,睡眠剥夺可造成神经内分泌功能紊乱、内源性激素分泌紊乱、交感神经兴奋,且睡眠剥夺不仅是糖尿病发病的危险因素,且可影响血糖控制效果,并增加并发症发生风险,加重患者经济负担[2]。此外,糖脂代谢状态及炎性因子表达在2型糖尿病发病及进展中具有重要作用,而褪黑素(MT)具备抗炎、抗氧化应激、抗凋亡等广泛的生物学功能,且褪黑素对糖尿病等代谢性疾病并发神经系统病变、视网膜病变具有一定保护作用[3]。因此,明确睡眠剥夺对2型糖尿病患者糖脂代谢、炎性因子及褪黑素含量的影响具有重要意义,利于指导临床采取针对性干预方案提升疾病控制效果。基于此,本研究特选取我院2型糖尿病患者150例进行分组研究,报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月~2020年10月我院2型糖尿病患者150例设为研究组,根据睡眠剥夺情况分为正常睡眠组(日睡眠时间7~9 h)、轻度睡眠剥夺组(日睡眠时间3~6 h)、重度睡眠剥夺组(日睡眠时间<3 h),各50例,另选取同期50名健康体检者设为健康对照组。正常睡眠组男26例,女24例;年龄34~58(49.98±6.01)岁;病程1.6~4.9(3.25±1.61)年;体重指数(BMI)18.4~26.9(22.65±1.91)kg/m2。轻度睡眠剥夺组男29例,女21例;年龄31~59(51.04±5.82)岁;病程1.2~4.6(3.56±1.38)年;BMI 17.9~27.7(24.01±2.01)kg/m2。重度睡眠剥夺组男31例,女19例;年龄32~58(50.56±5.57)岁;病程0.9~4.8(3.62±1.19)年;BMI 17.6~29.1(23.38±1.97)kg/m2。健康对照组男28人,女22人;年龄30~59(51.59±6.44)岁;BMI 16.9~28.8(23.70±2.04)kg/m2。四组性别、年龄、BMI等资料均衡可比(P>0.05),且本研究经我院伦理委员会审批通过。
1.2 选取标准
1.2.1 纳入标准
(1)研究组符合2型糖尿病诊断标准[4];(2)年龄30~60岁;(3)知情同意本研究;(4)具有良好依从性,可配合完成调查研究;(5)研究组病程<5年。
1.2.2 排除标准
(1)继发性糖尿病;(2)寡居、离异者;(3)存在精神分裂症、双相情感障碍者;(4)具有酗酒史或药物依赖史,可能会影响睡眠剥夺试验者;(5)存在认知功能障碍无法配合完成调查研究者;(6)合并其他脑部器质性病变者;(7)合并全身性重度躯体病变者;(8)合并糖尿病急性、慢性并发症者。
1.3 方法
抽取所有受检者血液样本4 mL,离心(3000 r/min,10 min,离心半径为7.5 cm)取上清液,置于-20℃环境中储存待检;以酶联免疫吸附法测定血清炎性因子(IL6、TNFα)、内皮素1(ET1)、MT水平,试剂盒购于广州鑫泉科技有限公司;经日本日立7600型全自动生化分析仪测定血脂指标[高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TC)、甘油三酯(TG)]、血糖指标[糖化血红蛋白(HbA1c)、空腹血糖(FPG)、餐后2 h血糖(2 hPG)]水平。研究期间研究组患者降糖方案不变,对轻度睡眠剥夺组、重度睡眠剥夺组患者进行睡眠时间纠正,试验期间,受试者被安排在地下约 6 m的睡眠剥夺实验室,面积约6 m2,屏蔽外界光、声音、手机信号和互联网通信,温湿度控制在适宜范围,实验室内饰颜色为淡绿色,有卫生设施,使用2只普通30 W的日光灯管照明,睡眠困难的患者睡前服用阿普唑仑片0.4 mg,达到睡眠时间连续正常4周后再次检测上述指标水平。
1.4 观察指标
(1)统计研究组与健康对照组炎性因子(IL6、TNFα)、糖脂代谢指标(HDL、LDL、TC、TG、HbA1c、FPG)、ET1、MT水平。(2)统计研究组各亚组炎性因子(IL6、TNFα)、糖脂代谢指标(HDL、LDL、TC、TG、HbA1c、FPG)、ET1、MT水平。(3)统计睡眠时间纠正后研究组两个亚组炎性因子(IL6、TNFα)、糖脂代谢指标(HDL、LDL、TC、TG、HbA1c、FPG、2 hPG)、ET1、MT水平。
1.5 统计学方法
采用SPSS 22.0处理数据,计量资料采取Bartlett方差齐性检验与KolmogorovSmirnov正态性检验,均确认具备方差齐性且近似服从正态分布,以(±s)表示,组间比较行独立样本t检验,组内比较行配对t检验,多组间比较采用单因素方差分析,多重比较采用LSDt检验,计数资料用[n(%)]表示,当总例数小于40或理论频数T≤1时采用确切概率法,当例数≥40且理论频数T>5或1
2 果
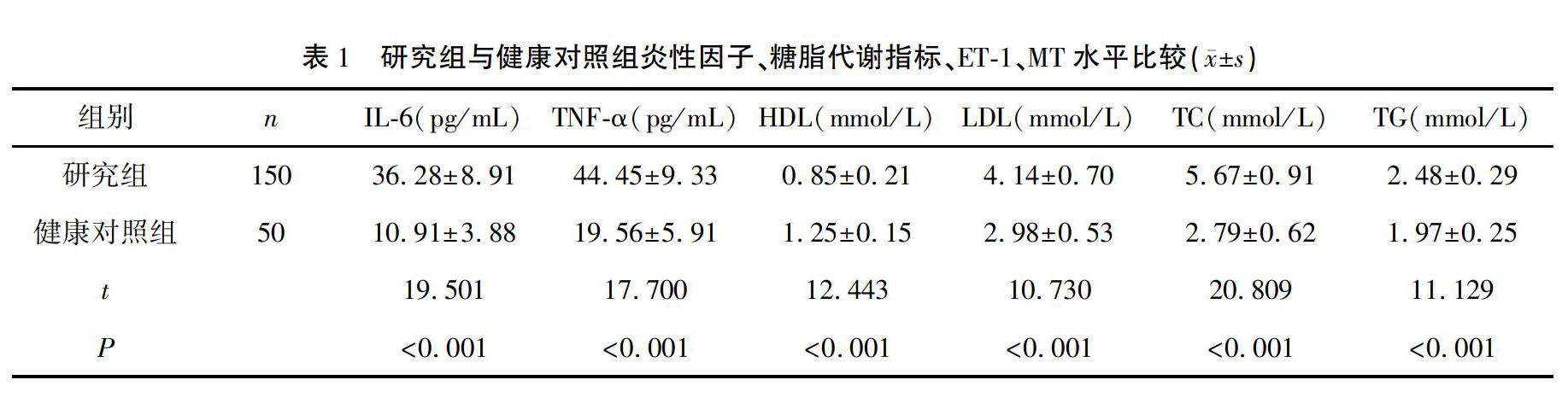
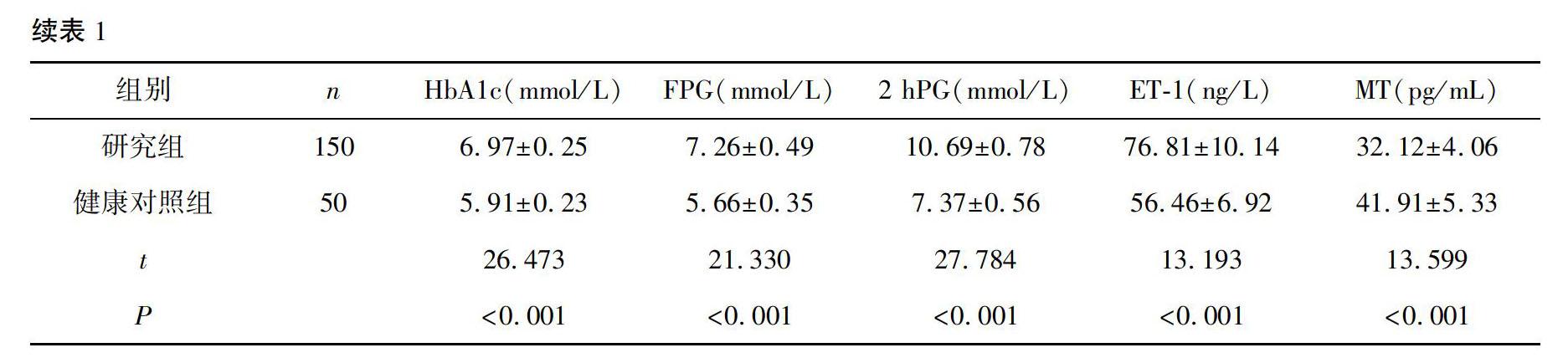
2.1 研究组与健康对照组炎性因子、糖脂代谢指标、ET1、MT水平比較
研究组IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1水平高于健康对照组,HDL、MT水平低于健康对照组(P<0.001)。见表1。
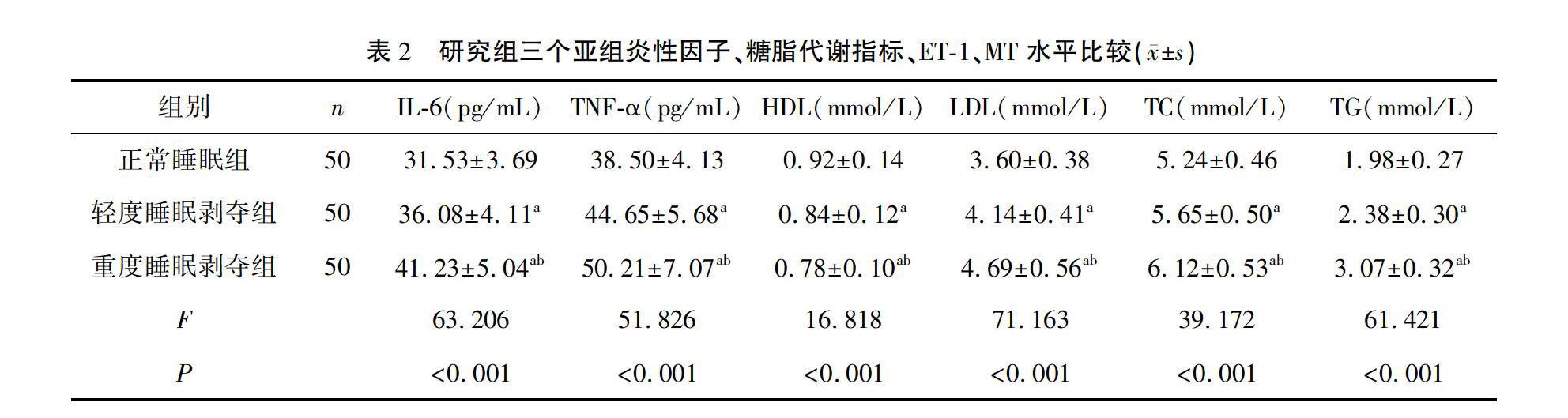
2.2 研究组三个亚组炎性因子、糖脂代谢指标、ET1、MT水平比较
轻度睡眠剥夺组IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1水平高于正常睡眠组,HDL、MT水平低于正常睡眠组(P<0.05);重度睡眠剥夺组IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1水平高于轻度睡眠剥夺组,HDL、MT水平低于轻度睡眠剥夺组(P<0.05)。见表2。
2.3 睡眠时间纠正后两亚组炎性因子、糖脂代谢指标、ET1、MT水平比较
睡眠时间纠正后轻度睡眠剥夺组、重度睡眠剥夺组IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1、HDL、MT水平较干预前改善(P<0.001),且组间比较差异无统计学意义(P>0.05)。见表3。
3 论充足睡眠为心理及生理健康的重要保证,记忆巩固、新突触形成、神经元再生均发生于睡眠各个阶段,而睡眠剥夺主要是受外界因素导致睡眠不足,其可使机体呈疲劳状态,若未及时恢复,会引起免疫力下降、内分泌紊乱,甚至可引发器质性病变,威胁患者生命健康[5]。而2型糖尿病患者多存在不同程度炎性应激反应、四肢麻木疼痛、夜尿增多、糖脂代谢异常等,极易造成睡眠障碍,而睡眠障碍可作为应激因素,不同程度影响机体各个系统,加剧体内炎性应激反应,造成交感神经张力增大、下丘脑垂体肾上腺轴功能异常,增加儿茶酚胺、糖皮质激素及其他“升糖激素”分泌量,进一步升高血糖,加剧病情,使疾病转归难度加大[6]。MT为调节昼夜节律的重要激素,其表达异常可引起或加剧胰岛素抵抗,引发或加重2型糖尿病。研究发现,血清MT分泌周期随日照周期改变而变化,夜间处于分泌高峰,白天则降至低谷,胰岛素分泌规律则与其相反,且相关研究还指出,2型糖尿病患者MT含量发生异常,且存在睡眠障碍者MT含量异常增加明显,而通过补充外源性MT则能调节胰岛素抵抗,对下丘脑垂体肾上腺功能产生负向调节,下调皮质醇及炎性因子等含量,进而改善睡眠状态[7~8]。
研究组与健康对照组炎性因子、糖脂代谢指标、ET1、MT水平存在显著差异,表明2型糖尿病患者存在糖脂代谢紊乱及不同程度炎性反应,但当前临床关于睡眠剥夺对血糖影响的研究多是动物实验,而对2型糖尿病患者的直接研究较少,且尚未明确睡眠剥夺的2型糖尿病患者干预治疗后相关指标变化情况[9~10]。而本研究对不同睡眠情况患者糖脂代谢指标、血清炎性因子、MT等水平进行检测分析后发现,正常睡眠组、轻度睡眠剥夺组、重度睡眠剥夺组上述指标水平均存在显著差异,且随着睡眠剥夺的严重程度增加,IL6、TNFα、LDL、TC、TG、HbA1c、FPG、2 hPG、ET1水平持续增高,HDL、MT水平持续降低,表明睡眠剥夺可影响2型糖尿病患者糖脂代谢状态、体内炎性反应程度及内皮功能、MT含量[11~14]。同时,本研究对睡眠剥夺2型糖尿病患者进行睡眠时间纠正后发现,患者糖脂代谢状态、体内炎性反应及内皮功能、MT含量均较干预前改善,而组间比较无显著差异,提示临床应对睡眠剥夺的2型糖尿病患者进行积极睡眠干预,以此调节患者糖脂代谢及体内炎性反应程度等,避免病情进展,保证疾病良好转归[15]。
综上所述,2型糖尿病患者存在糖脂代谢紊乱及不同程度炎性反应程度,而睡眠剥夺可影响2型糖尿病患者糖脂代谢状态,加剧炎性反应程度,降低MT含量,纠正睡眠时间后可有效逆转上述现象。
参 考 文 献
[1袁毅.住院老年糖尿病睡眠障碍患者睡眠的护理干预效果及干预价值体会[J].世界睡眠医学杂志,2019,6(4):471473.
[2蔡璇,程宁,呼延天如,等.2型糖尿病与睡眠障碍[J].中国药理学通报,2019,35(6):745747.
[3沙尔娜.短期胰岛素强化治疗对新诊断2型糖尿病伴睡眠障碍患者的睡眠障碍及褪黑素水平的影响[D].乌鲁木齐:新疆医科大学,2019.
[4中华医学会,中华医学会杂志社,中华医学会全科医学分会,等.2型糖尿病基层诊疗指南(实践版·2019)[J].中华全科医师杂志,2019,18(9):810818.
[5邓宁,陈方,张珑维,等.睡眠障碍对糖尿病患者血糖变化的影响[J].世界睡眠医学杂志,2019,6(6):702704.
[6热娜古丽·斯迪克,张洁,张丽,等.2型糖尿病患者主客观睡眠质量与血糖控制的相关性分析[J].山东医药,2019,59(14):4345.
[7崔刚,张东东,韩雪,等.褪黑素对糖尿病大鼠非酶糖基化产物及受体表达和心脏功能变化的影响[J].中国老年学杂志,2020,40(18):39333937.
[8鄞莹,刘佳.褪黑素对2型糖尿病患者HPA轴功能及糖脂代谢水平的影响研究[J].江西医药,2020,55(6):713715.
[9BRIANONMARJOLLET A,WEISZENSTEIN M,HENRI M,et al.The impact of sleep disorders on glucose metabolism:endocrine and molecular mechanisms[J].Diabetol Metab Syndr,2015,7:25.
[10REN H Z,XU Y G,CHANG B C,et al.Association between retinopathy and sleep disorder in patients with type 2 diabetes mellitus[J].Zhonghua Yi Xue Za Zhi,2015,95(32):25792583.
[11TAHRANI A A,ALI A,RAYMOND N T,et al.Obstructive sleep apnea and diabetic neuropathy:a novel association in patients with type 2 diabetes[J].Am J Respir Crit Care Med,2012,186(5):434441.
[12BARONE M T U,WEY D,SCHORR F,et al.Sleep and glycemic control in type 1 diabetes[J].Arch Endocrinol Metab,2015,59(1):7178.
[13PLANTINGA L,RAO M N,SCHILLINGER D.Prevalence of selfreported sleep problems among people with diabetes in the United States,20052008[J].Prev Chronic Dis,2012,9:E76.
[14VAN DIJK M,DONGA E,VAN DIJK J G,et al.Disturbed subjective sleep characteristics in adult patients with longstanding type 1 diabetes mellitus[J].Diabetologia,2011,54(8):19671976.
[15MANIN G,PONS A,BALTZINGER P,et al.Obstructive sleep apnoea in people with Type 1 diabetes:prevalence and association with micro and macrovascular complications[J].Diabet Med,2015,32(1):9096.
(收稿日期:2021-03-20 修回日期:2021-05-18)
(編辑:潘明志)

