滁菊总黄酮抗大鼠局灶性脑缺血再灌注损伤作用研究
王 琮, 陈 浩, 李飞跃, 俞 浩
(安徽科技学院 生命与健康科学学院,安徽 凤阳 233100)
局灶性脑缺血再灌注损伤(Focal cerebral ischemia-reperfusion injury,FCIRI)是神经功能丧失和神经元死亡的主要原因。许多临床研究和动物实验已经证实了FCIRI发病机理的复杂性相对较高,涉及多个病理生理过程的相互作用,其中氧化应激在整体发病机理中起到至关重要的作用,当前常用药有溶栓药、抗炎药、抗凝血药等,作用机制单一,临床治疗效果受到一定程度的限制。早在几千年前,医方就记载了许多治疗FCIRI相关疾病的珍贵中药和经典方剂,近年来,中药在治疗FCIRI方面显示了较好临床的效果表现,越来越多的缺血性脑血管疾病的探索性实验使用中药开展。菊花栽培已有3 000多年的历史,由于其不同的生境和品种,在我国的不同地区都有分布,菊花植物的形状和化学成分也各不相同。其中滁菊是安徽滁州产道地药材,《本草害利》记载了滁州菊作为药菊应用的历史。药理实验研究表明,滁菊的黄酮类成分具有抗心肌缺血、降血糖、镇痛、抗炎、抗氧化等多种作用。本项目组研究发现,滁菊总黄酮(Total flavonoids of Chuju,TFCJ)具有抗大鼠急性心肌缺血和心肌缺血再灌注损伤作用。本研究在前期研究的基础上,观察TFCJ抗大鼠FCIRI作用。
1 材料与方法
1.1 药品与试剂
使用的TFCJ粉末由项目组于安徽科技学院药学综合实验室制备,经紫外可见分光光度法(UV-VIS)检测,总黄酮含量为60.21%,相关检测指标所用的SOD试剂盒、GSH-Px试剂盒、MDA试剂盒、CAT试剂盒购于南京建成生物工程研究所,其他常规试剂购于国药集团化学试剂有限公司。
1.2 实验动物
雄性SD大鼠,体重(180±20) g,购自郑州市惠济区华兴实验动物养殖场,动物合格证号:0013260,动物生产许可证号:SCXK(豫)2019-0002。将大鼠置于(23±2) ℃,55%±5%湿度,每12 h明暗循环一次的环境下。
1.3 分组与给药
120只大鼠随机分成6组(n=20):假手术组:每日灌胃10 mL/kg 0.5%羧甲基纤维素(CMC)溶液,手术仅分离血管;模型组:每日灌胃10 mL/kg 0.5%CMC溶液,进行大脑中动脉阻塞(Middle cerebral artery occlusion,MCAO)手术;TFCJ高剂量组:每日灌胃40 mg/kg TFCJ,用0.5%CMC溶液配制,进行MCAO手术;TFCJ中剂量组:每日灌胃20 mg/kg TFCJ,用0.5%CMC溶液配制,进行MCAO手术。TFCJ低剂量组:每日灌胃10 mg/kg TFCJ,用0.5%CMC溶液配制,进行MCAO手术。血塞通组:每日灌胃25 mg/kg血塞通,用0.5%CMC溶液配制,进行MCAO手术;以上全部大鼠每日灌胃1次,周期为7 d。
1.4 TFCJ的提取与纯化
滁菊粉末与60%乙醇按照料液比20∶1混合后,70 ℃超声提取2次,每次40 min。收集所有提取液,趁热抽滤后旋转蒸发回收乙醇,浓缩至无乙醇味,浓缩液4 200 r/min离心15 min,取上清液,用70%乙醇以1 BV/h的流速通过D-101大孔树脂柱洗脱,收集洗脱液并置旋转蒸发仪中回收乙醇,剩余液体置冷冻干燥机中冷冻干燥,得TFCJ粉末,通过UV-VIS测定其含量为60.21%。
1.5 FCIRI模型制备
FCIRI模型的制备方法为,从颈外动脉(Carotid artery,CA)剪口插线,沿颈总CA插入颈内CA直至大脑中CA,插入长度约20 mm,缺血2 h,拔线恢复血供,再灌注24 h。
1.6 检测指标
1.6.1 神经损伤程度评价 采用双盲法对模型大鼠神经损伤症状进行评分,判断损伤等级。Ⅰ级:无神经损伤症状;Ⅱ级:不能完全伸展左侧前爪; Ⅲ级:不能完全伸展左侧前爪,行走时向左侧绕圈 ;Ⅳ级:不能完全伸展左侧前爪,行走时向左侧偏瘫 ;Ⅴ级:意识丧失,失去知觉,无法自发行走。
1.6.2 指标测定 脑指数测定:大鼠再灌注24 h时称重后,处死取脑。脑组织使用生理盐水冲洗3次,每次3 mim,去除嗅球、小脑等组织,仅保留完整大脑。清理大脑表面异物,如软脑膜、表面血管等组织。避免影响称重结果,吸去表面多余水分,最终记录脑重量;脑梗死面积测定:各组大鼠再灌注24 h时立刻处死并收集脑组织,将收集的脑组织稍微冻硬表面并沿冠状面的切片(厚度约2 mm),平放入避光处理的容器,倒入一定量的2%TTC溶液,放入设置37 ℃培养箱孵育15 min,拍照并分析梗死面积;血清及脑组织SOD、GSH-PX、CAT及MDA含量测定:大鼠腹主动脉取血,9 000 r/min离心10 min,取血清;取脑组织匀浆9 000 r/min离心10 min,取上清。取血清和脑组织匀浆测定SOD、GSH-Px、CAT和MDA;病理组织学检查:各组大鼠再灌注24 h时立刻处死并收集脑组织,将收集的脑组织固定于4%多聚甲醛溶液24 h,脱水、透明、包埋并制成4 μm冠状面脑片,并用HE染色。
1.7 统计学处理方法
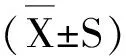
2 结果与分析
2.1 对FCIRI大鼠神经损伤的影响
模型组大鼠神经损伤症状均高于假手术组(P
<0.01),但并未出现严重程度达到Ⅴ级。与模型组比较,TFCJ高、中剂量神经功能缺损评分显著降低(P
<0.05)(表1)。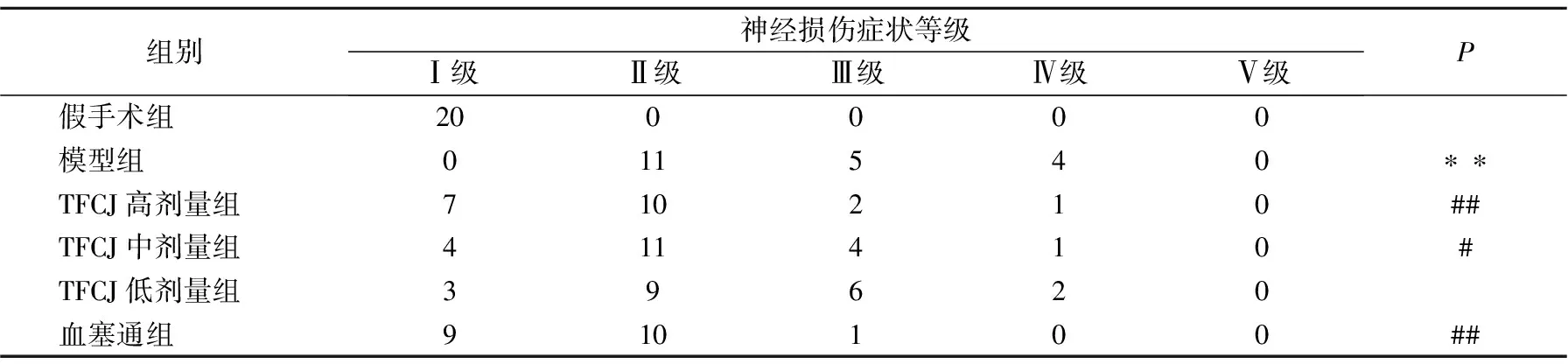
表1 TFCJ对FCIRI大鼠神经损伤症状的影响
2.2 对FCIRI大鼠脑指数及脑梗死面积的影响
与假手术相比,模型组的脑指数和脑梗死面积均显著增加(P
<0.01)。与模型组相比,TFCJ各剂量组的脑指数和脑梗死面积均显著降低(P
<0.01)(表2)。
表2 TFCJ对FCIRI模型大鼠脑指数及脑梗死面积的影响
2.3 对FCIRI大鼠血清氧化应激的影响
由表3可知,与假手术组相比,模型组血清SOD、GSH-Px、CAT活性显著降低,MDA含量显著增加(P
<0.01)。与模型组比较,TFCJ显著提高血清SOD、GSH-Px、CAT活性,降低MDA含量(P
<0.01)。
表3 TFCJ对FCIRI大鼠血清氧化应激的影响
2.4 对FCIRI大鼠脑组织氧化应激的影响
由表4可知,与假手术组相比,模型组脑组织SOD、GSH-Px、CAT活性显著降低,MDA含量显著提高,具有显著性差异(P
<0.01)。与模型组比较,TFCJ高、中剂量组脑组织SOD、GSH-Px活性显著提高(P
<0.01);TFCJ各剂量组脑组织CAT活性明显提高,MDA含量明显降低(P
<0.05)。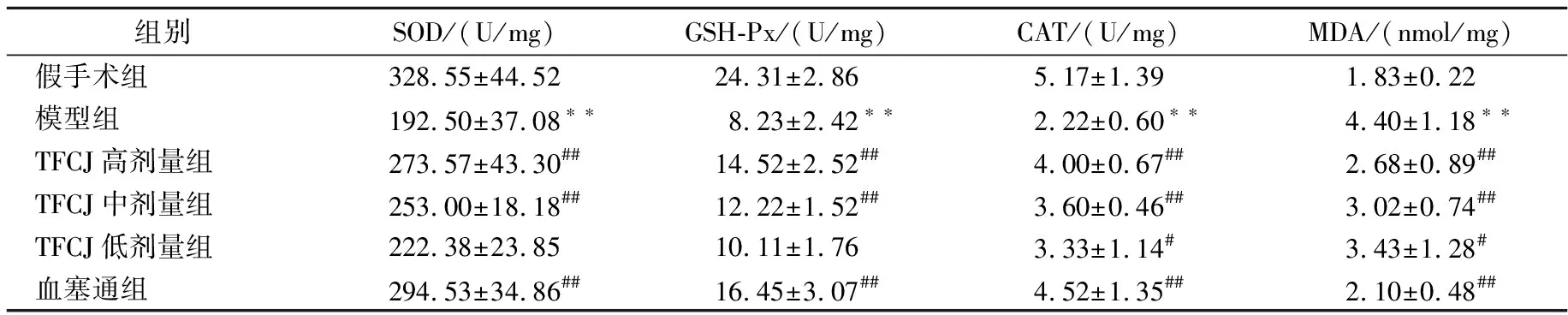
表4 TFCJ对FCIRI大鼠脑组织氧化应激的影响
2.5 对FCIRI大鼠脑组织病理变化的影响
假手术组大鼠脑组织未见明显损伤,海马区神经细胞结构完整,细胞核无固缩,包膜完整,细胞间隙正常(图1 A),模型组脑组织明显损伤,结构疏松,细胞排列杂乱,细胞核固缩,半影区组织肿胀(图1 B)。与模型组比较,随着TFCJ剂量增加,脑组织损伤程度明显减轻,细胞排列相对规则,海马区神经细胞水肿和细胞核固缩逐渐减轻。
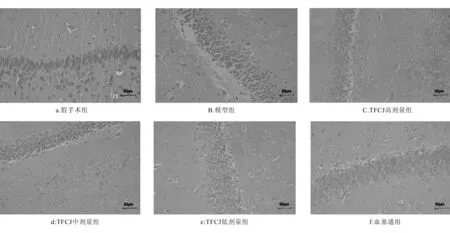
图1 TFCJ对FCIRI大鼠脑组的形态和结构变化的保护作用Fig.1 The protective effects of TFCJ on MCAO inducing morphological and structural changes
3 结论与讨论
我国缺血性脑血管疾病高发,每年约450万人发病,并呈逐年上升之势,每年约有210万人死于该病。目前已经开发了使用重组组织纤溶酶原激活剂(rt-PA)进行早期恢复血管再通以治疗急性缺血性中风的方法。MCAO涉及缺血和再灌注两个过程,再灌注早期自由基的蓄积、级联反应和神经细胞内钙超载是导致脑组织缺血损伤的主要原因,再灌注中后期增加脑出血的风险,促进脑水肿的发展,并对血脑屏障造成更严重的损害,尚不清楚由再灌注本身引起的FCIRI额外伤害的潜在机制。本研究采用线栓法复制模型,其是FCIRI的经典且常用的动物模型。它在很多方面都具有优势:易于操作,给动物带来小的伤口;具有高重复性,并产生严重的血脑屏障破坏和明显的脑水肿的脑缺血性损伤。因此,MCAO模型适合FCIRI研究。结果显示模型组神经功能损伤评分提高,往往与神经损伤成比例;脑指数增加,说明脑组织含水量增高;脑梗死面积增大,说明MCAO导致缺血区域梗死。TFCJ能够有效降低脑梗死面积,改善神经功能评分,减轻脑指数。结果表明,TFCJ具有明确的脑组织保护作用。
氧化应激是脑损伤加重的重要原因,其与活性氧(ROS)的逐渐增加有关,因为缺血再灌注后迅猛诱导细胞内ROS产生,导致脑组织中氧化因子和抗氧化因子间比例失衡。再灌注后ROS产生增加会增加出血性梗塞,脑水肿和梗塞面积。因此,增加抗氧化因子水平是治疗FCIRI的有效方法。SOD是一种在体内细胞不可或缺的活性蛋白酶,催化超氧自由基转化为HO和分子氧,进而减轻因体内的氧自由基至损伤的作用,保护人体免受过氧化和组织损伤。GSH-Px可以清除HO,由于HO有可能转化为其他自由基,因此其可减轻氧化应激程度,脑组织缺血缺氧坏死的程度与GSH-Px组织水平有关,GSH-Px水平升高可抑制FCIRI。CAT是生物体中都发现的一种常见酶,并且是所有酶中周转率最高的酶之一,其作用是分解氧自由基经SOD歧化产生HO,避免遭受细胞毒害。MDA是脂质过氧化作用最终有毒产物,也是氧化损伤的重要标志,MDA含量的增加与细胞的坏死和凋亡有关,可反映机体消除自由基的能力。
因此,使用具有抗氧化特性且安全有效的治疗药剂干预氧化损伤提供了行之有效的治疗策略。本研究中测量了SOD、GSH-Px、CAT和MDA,以评估氧化应激水平。模型组大鼠血清和脑组织中SOD、GSH-Px和CAT活性显著降低,而MDA水平升高,说明MCAO抑制抗氧化因子的活性,氧化因子得不到及时的清理,整体的动态平衡被打破,氧化因子的蓄积从而导致氧化应激程度逐渐加重,进一步发展严重导致脑组织区域性缺血缺氧,造成局灶性的组织不可逆的坏死。我们发现TFCJ可增加MCAO大鼠SOD、GSH-Px和CAT的活性并减少MDA,氧化因子和抗氧化因子的动态平衡逐渐恢复,一定程度上逆反氧化应激的程度。这些结果表明,TFCJ能够抑制 MCAO引起的氧化应激。
为进一步探究TFCJ对脑组织病理变化的影响,HE染色实验结果表明,模型组大鼠海马神经细胞排列紊乱,且细胞核浓缩;经TFCJ治疗模型大鼠马神经细胞更整齐也更紧密。结果表明,TFCJ具有改善脑组织病理形态作用。
杜鹃总黄酮通过激活血管TRPV4诱导内皮源性超极化因子介导的反应改善脑缺血损伤。香青兰总黄酮通过下调AMPK信号通路,抑制与细胞凋亡相关的炎性介质释放,以保护MCAO模型动物。秋葵花总黄酮升高SOD含量,降低一氧化氮和MDA含量降低,上调Nrf2、HO-1和NQO1的表达,表明其通过清除自由基和激活Nrf2-ARE途径来保护FCIRI。本文主要检测氧化应激指标以及脑组织形态学病理变化来证明TFCJ具有抗FCIRI作用,下一步准备对抗氧化应激通路相关蛋白进行检测。
本研究对TFCJ治疗FCIRI的药理作用提供了基础的理论依据,为临床清热解毒药物治疗FCIRI的深入研究提供了研究方向,同时为今后滁菊中药材及产品的开发提供了实验依据。发挥脑保护和神经保护功能的途径具有多样性,TFCJ具体发挥抗氧化应激的生物学机制仍存在许多问题需要研究解决。

