真姬菇交配型的遗传学鉴定
余梅 杜军华 张宝静 陈群


摘 要:真姬菇是一种优质珍稀食用菌,已实现工厂化栽培,营养和保健价值较高。以真姬菇1个菌株B5为材料,用原生质体单核化和单孢分离的方法分别分离原生质体单核体和孢子单核体,进行四极性交配型的遗传学分析,在此基础上,结合核迁移试验,对4种交配型的孢子单核体进行交配型的准确鉴定。通过原生质体单核化获得567个原生质体单核体,采用标准测交菌株法,确定测交菌株T1、T2的交配型为A1B1、A2B2;通过单孢分离获得94个孢子单核体,常规鉴定出T1、T2、T3和T4 4种交配型的数量分别为24、27、25和17,另外还鉴定出1个重组交配型T5(ArBr);通过核迁移试验,准确鉴定出4种交配型分别为A1B1、A2B2、A1B2和A2B1;χ2检验同时证实真姬菇是四极性异宗结合担子菌。
关键词:真姬菇;交配型;核迁移;原生质体
中图分类号:S646 文献标识码:A
Genetic Determination of Mating Type in Hypsizygus marmoreus
YU Mei1, DU Junhua2*, ZHANG Baojing1, CHEN Qun3*
1. Life Science School, Anhui Agricultural University, Hefei, Anhui 230036, China; 2. Life Science School, Qinghai Normal University, Xining, Qinghai 810008, China; 3. School of Biology Food and Environment, Hefei University, Hefei, Anhui 230601, China
Abstract: Hypsizygus marmoreus is a large-scale high-quality raise edible fungus with rich nutrition and health care value. In this paper, many protoplast monokaryons and spore monokaryons were isolated by protoplast mononuclearization and single spore isolation using B5 of a strain of H. marmoreus. After genetic analysis of the mating type of tetrapolar bacteria, the four mating types of spore monokaryons were accurately identified by the nuclear migration assay. 567 protoplast monokaryons were obtained by protoplast mononuclearization, and the mating types of the test strains T1 and T2 were determined to be A1B1 and A2B2 by the standard test strain method. 94 spore monokaryons were obtained by single spore isolation. The number of the four mating types of T1, T2, T3 and T4 was routinely identified as 24, 27, 25 and 17, respectively. And a recombinant mating type T5 (ArBr) was also identified. Through the nuclear migration test, the four mating types were accurately identified as A1B1, A2B2, A1B2, and A2B1. It was confirmed that H. marmoreus was a quaternary heterozygous combination basidiomycete by the chi-square test.
Keywords: Hypsizygus marmoreus; mating type; nuclear migration; protoplast
DOI: 10.3969/j.issn.1000-2561.2021.07.012
真姬菇(Hypsizygus marmoreus)近年来风靡日、韩等国家,具有广阔的市场,其年产量仅次于杏鲍菇和金针菇。真姬菇有丰富的营养和保健价值,值得深入开发。但我国对真姬菇的研究起步较晚,研究领域比较片面,尤其在分子遗传学方面研究甚少。已有研究报道真姬菇是一种四极性异宗结合食用菌,子实体可产生4种不同交配型孢子,其交配系统由两个非连锁A、B交配型位点控制[1]。只有交配位点均不同,即A≠B≠时才能配对杂交形成双核体,从而完成整个有性生活史。20世纪80年代,建立了四极性食用菌交配型常规鉴定程序,即通过三轮配对初步区分同一菌株的4种交配型[2],但无法准确分析每个交配型具体的A、B位点构成,也无法区分亲本型和重组型,因此,无法进行交配型的深入研究[3]。直到原生质体单核化技术的出现,使交配型的常规鉴定程序更为简便可靠,可以直接确定两个亲本型的交配型,極大地减少工作量[4-5],再结合核迁移试验,即可准确鉴定4种交配型[6]。在食用菌遗传育种研究中,交配型研究与育种实践有着密切的关系,本研究在利用原生质体单核化和单孢分离的方法对真姬菇进行交配型常规分析的基础上,结合核迁移试验,对4种交配型孢子单核体进行交配型的准确鉴定,为今后深入研究真姬菇的遗传规律和育种工作奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 本研究所用真姬菇菌株B5,由上海市农业科学院食用菌研究所提供。
1.1.2 试剂与培养基 麦芽糖、酵母粉为Oxoid Limited产品,蔗糖、葡萄糖为国药集团化学试剂有限公司产品,琼脂粉为Yeasen Biotech Company Limited产品,溶壁酶为广东省微生物研究所广东博沃特生物科技有限公司产品。
稳渗剂:称取蔗糖17.1 g,加ddH2O定容至100 mL,自然pH下,121 ℃、20 min高温灭菌;溶壁酶溶液:每管称取0.075 g溶壁酶,加入5 mL稳渗剂配成溶壁酶溶液,使用前用0.22 μm微孔细菌过滤器过滤灭菌。
PDA培养基(土豆200 g、葡萄糖20 g、琼脂20 g)、YMG液体培养基(酵母粉4 g、麦芽糖10 g、葡萄糖4 g)、YMGS再生培养基(酵母粉4 g、麦芽糖10 g、葡萄糖4 g、蔗糖171 g、琼脂粉15 g)均各自加蒸馏水定容至1 L,自然pH下,121 ℃、20 min高温灭菌;PDA+Amp(氨苄青霉素)培养基在PDA高温灭菌后冷却到60 ℃加入1 mL过滤灭菌的Amp(10万单位)。
1.1.3 仪器与设备 ZHJH-C1112B智城超净工作台、ZHWY-100C摇床、ZXSD-B1270生化培养箱、ZHWY-2102恒温培养振荡器,上海智城分析仪器制造有限公司;Centrifuge 5810 R台式高速冷冻离心机,艾本德中国有限公司;OLYMPUS BX60荧光显微镜,Olympus Inc.;FB224自动内校电子分析天平,上海舜宇恒平科学仪器有限公司;SX-500自動高压灭菌锅,Gene Company Limited。
1.2 方法
1.2.1 原生质体单核体分离及交配型鉴定 (1)菌种活化与菌丝培养。将供试菌种接种到PDA平板上活化,置于22 ℃恒温培养箱中黑暗培养12~14 d,直至菌丝长满整个平板。从活化好的菌丝平板挖取菌块10~12块放于YMG液体培养基内,25 ℃、150 r/min振荡培养4~8 d,形成一个个小菌丝球,即可进行原生质体的制备。
(2)原生质体制备。原生质体制备步骤参考林芳灿等[7]、刘海英等[8]的方法,做出少许改进:把0.075 g溶壁酶加入5 mL、0.5 mol/L蔗糖溶液,用枪吹打后置于摇床充分混匀。用4层无纺布过滤菌丝球,用0.5 mol/L蔗糖溶液洗涤2次,挖取少许菌丝置入50 mL离心管中。通过0.22 μm过滤器将溶壁酶溶液注入离心管内,轻轻搅拌混匀,置于摇床振荡酶解3 h(31 ℃、70~80 r/min),即可获得原生质体粗提液。制备过程中应注意酶解时间的控制,过度酶解会影响原生质体的再生率,经常镜检以及时查看原生质体的获得情况[9]。粗提液用4层无纺布过滤、0.5 mol/L蔗糖溶液配平后离心10 min(4 ℃、3000 r/min),沉淀用蔗糖溶液洗涤1次后加入蔗糖溶液混匀,即得到纯化原生质体悬浮液,血球计数板计数。
(3)原生质体再生及单核体确定。稀释原生质体悬浮液至适宜浓度(104~105个/mL),分别吸取50、100、200 μL等梯度置于90 mm的YMGS再生培养基上,涂布棒轻轻涂匀,封口,置于22 ℃的生化培养箱培养。约5~7 d后有放射星芒状的微小菌落出现,直至平板内出现菌落大小差异。挑取较小的菌落、编号,放在60 mm PDA平板上,22 ℃传代培养,较大的菌落弃去。等到挑取的单菌落长到直径大于0.5 cm时即可镜检,将没有锁状联合的单核菌丝转接到新PDA平板上培养,备用。
(4)测交菌株T1、T2确定。选取长势最好的单核体作为测交菌株T1,指定其交配型为A1B1,和剩下单核体两两配对,即在PDA平板上,分别接入T1和待测单核体的接种块,每个平板只接1对,二者相距0.5~1.0 cm,封口,于22 ℃培养箱黑暗培养约7 d后,两菌落生长交接在一起时,挑取交接处的菌丝镜检。有锁状联合的为亲和反应(+),表示待测菌株交配型与T1不同,记为T2,其交配型为A2B2;没有锁状联合的为不亲和反应(–),表示待测菌株交配型与T1相同。
1.2.2 孢子单核体分离及交配型鉴定 (1)单孢分离培养及单核体确定。采用文献[10-11]的方法收集孢子,选择供试亲本双核菌株生长良好的子实体收集孢子,以无菌水稀释孢子至适宜涂布浓度(104~105个/mL),吸取150 μL孢子悬浮液在90 mm的PDA+Amp平板上涂布均匀,22 ℃恒温培养约10 d后,挑选单菌落、编号,在60 mm的PDA+Amp平板上传代培养。孢子单核体的确定方法同1.2.1(3),将确定的单核体转接到新的PDA平板上培养,备用。
(2)孢子单核体交配型常规鉴定。采用三轮杂交法、按照常规交配型分析程序进行单核体交配型鉴定[12]。首先使用原生质体单核化确定的标准测交菌株T1(A1B1)、T2(A2B2)分别和单孢分离得到的所有单核体配对,与T1发生亲和反应(锁状联合)的孢子单核体交配型为A2B2;与T2发生亲和反应的孢子单核体交配型为A1B1。再从剩下的与T1、T2都不亲和的孢子单核体内随机取1个作为测交菌株T3,其交配型为A1B2或A2B1。用T3和与T1、T2均不亲和的所有孢子单核体进行配对,镜检发生亲和反应的孢子单核体为T4,交配型为A2B1或A1B2,不亲和的则为T3。
1.2.3 核迁移试验 核迁移试验来帮助准确鉴定交配型,参考程莉等[13]的方法,具体操作步骤如下:在T1、T2、T3和T4四种交配型所在的组别,每组取数个单核体进行核迁移试验。首先进行T2×T3和T2×T4的第1次配对,配对在90 mm PDA平板上进行,两接种块之间相距2 cm,待菌丝交接后,在两配对块外侧,各取1个菌块分别与T4、T1和T3、T1单核体进行第2次配对。镜检第2次配对是否亲和,以此判断第1次配对组有无发生核迁移。
1.2.4 交配型比例及χ2检验 根据公式χ2 = ∑[(O-E)2/E](O为每种交配型数量的实测值,E为该种交配型数量的理论值)计算χ2值,分析真姬菇孢子单核体4种交配型的分离规律是否符合孟德尔1∶1∶1∶1分离定律[14]。
2 结果与分析
2.1 原生质体单核体分离及交配型鉴定
2.1.1 原生质体单核体鉴定 显微镜下原生质体单核菌丝没有锁状联合,分枝较少,细胞比较狭长;菌落颜色浓白,平滑细直,呈放射状丝状脉络。同一个双核菌株经过原生质体单核化后,不同交配型间的单核体再生能力存在差异[15]。本研究将初次原生质体单核化获得的单核体进行交配型鉴定,未獲得成功配对,最终在重复原生质体单核化15次,获取567个原生质体单核体后,才成功得到两种交配型的单核体。由此可见,经过原生质体单核化后,原来处于1∶1平衡状态的双核菌丝体的两种核在分离过程中出现了偏离,导致原生质体单核体的交配型比例不符合,甚至严重偏离1∶1。
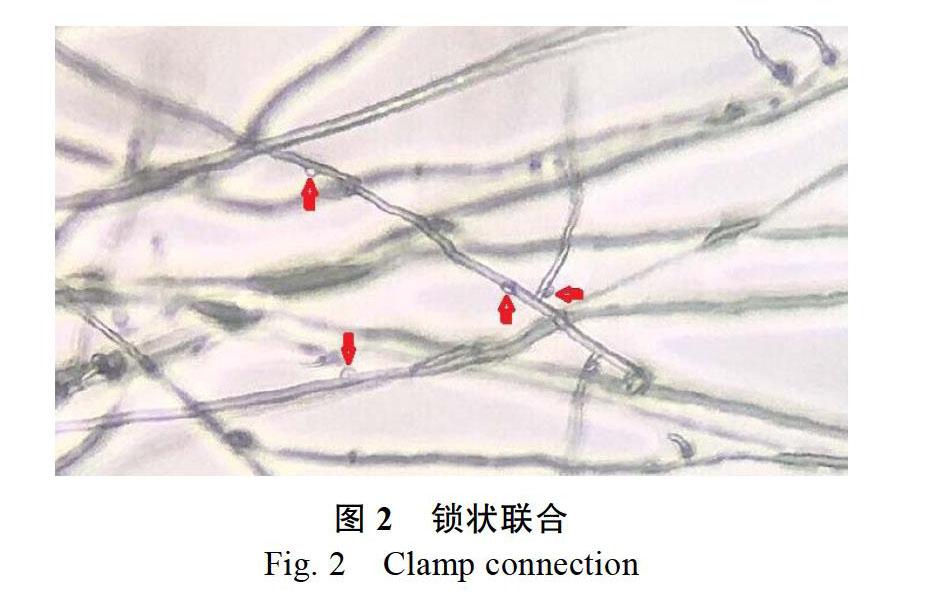
2.1.2 测交菌株T1、T2的确定 两原生质体单核体菌株发生亲和反应的鉴定标准为:菌落的菌丝交接处出现扇形生长现象(图1),并且在显微镜下能观察到大量锁状联合(图2)。
获得的两种交配型的单核体,把其中一种命名为T1,指定其交配型为A1B1;另一种交配型命名为T2,则其交配型为A2B2,T1、T2即为用于孢子单核体交配型鉴定的标准测交菌株。
2.2 孢子单核体分离及交配型鉴定
2.2.1 孢子单核体分离及鉴定 孢子涂布培养约10 d后开始萌发,分批挑取单菌落,进行镜检,以确定为单核菌株,共获得94个孢子单核体。
2.2.2 孢子单核体交配型常规鉴定 T1、T2标准测交菌株分别与94个孢子单核体进行配对(图3),与T1亲和的有28株,与T2亲和的有25株,编号58号既与T1亲和,又与T2亲和。在与T1、T2均不亲和的42株单核菌株里随机挑取7号作为测交菌株T3,与剩下的41株进行配对,亲和的T4有17株,不亲和的24株,即T3有25株。
最后将58号和T3、T4分别进行配对,发现58号和T3、T4均为亲和。因此,除了常见的4种交配型外,还发现1个与这4种交配型都亲和的菌株T5(58号),由此可见A位点和B位点之间发生了重组,重组率为1.1%。
2.3 核迁移试验准确分析交配型
随机选用孢子单核体中编号3(T1)、44(T2)、79(T3)、2(T4)以及 50(T1)、14(T2)、83(T3)、61(T4)进行核迁移试验。
首先用44×79(T2×T3)、14×61(T2×T4)进行第1次配对,当两组配对的接种块菌丝充分交接在一起时,在44×79配对菌块两侧各取一个菌块分别与2和3进行第2次配对,在14×61配对菌块两侧取菌块分别与83和50进行第2次配对,镜检第2次配对结果,过程、结果见图4。
在四极性交配系统中,A位点基因控制锁状联合的形成,B位点基因控制核的迁移,两个单核菌株只有B位点的构成不同时才能发生核迁移现象[16]。从图4中可以看出,44×79配对组合的第2次配对没有形成锁状联合,说明44和79之间没有发生核迁移;14×61配对组合的第2次配对有锁状联合的形成,说明14和61之间发生了核迁移。由此可以得出,44(T2,A2B2)和79(T3)的交配型关系为A≠B=;14(T2,A2B2)和61(T4)的交配型关系为A=B≠。综上可以确定T3、T4的交配型分别为A1B2和A2B1,孢子单核体的4种交配型得到准确鉴定(表1)。
2.4 交配型比例χ2检验
从表2可以看出,减数分裂后形成的子代孢子中,4种交配型孢子单核体的实际比例与预期的1∶1∶1∶1相符,说明4种交配型的分离规律符合孟德尔分离定律,证实真姬菇的交配系统是四极性异宗结合。
3 讨论
在四极性担子菌的交配型鉴定中,两两配对法最为可靠。这种方法在样本容量很小时可实施性较高,但若样本容量大,该方法的工作量尤其大。例如本实验中的孢子单核体有94个,如果通过两两配对法就需要配对942个,即8836个,而用标准测交菌株法,就大大减少工作量。原生质体单核化的方法确保再生的原生质体没有发生重组的可能性,可以准确获得与亲本双核体交配型相同的标准测交菌株 T1、T2。
本文真姬菇交配型的鉴定结果证明真姬菇为四极性异宗结合菌,有趣的是,除了常规4种交配型外,还鉴定出一个重组型交配型T5(用ArBr表示)。Papazian认为这种现象是因为A、B两个交配位点的亚单位(α、β)构成不同[17]。本研究发现真姬菇的担子在减数分裂过程中由于次级重组形成了交配型为ArBr的孢子,其中不但B位点发生重组,A位点也发生重组,这种现象极为罕见。由于这种重组型交配型与其他4种交配型的配对都是亲和的,因此,通过配对杂交都可形成生物学性状优良的子实体。鉴于这种特殊现象,对此进一步研究,为今后孢子单核体育种提供便利,未来定会分离出更多的次级重组型后代,进而获得更为详尽的关于交配型因子的数据,建立一个完整的真姬菇交配型构成模型。
在四极性担子菌交配型常规鉴定中,第三轮配对中测交菌株T3的选择是随机的,其交配型可能是A1B2,也可能是A2B1,没有明确的形态差异,难以区分,需要补充核迁移实验加以区分。核迁移的发生是由B位点基因的特定功能决定,只有B位点不相同的配对,核迁移的现象才会发生。因此要想验证两个不亲和单核体间的交配型关系,可以根据有无核迁移的发生,即第2次配对有无形成锁状联合,来判断二者之间的交配型关系具体是A=B≠,还是A≠B=。值得注意的是,在核迁移试验中,偶尔会出现第1次配对组合只有一侧发生第2次配对的锁状联合情况,但目前尚未明确原因,有待进一步研究。
真姬菇交配型的准确鉴定,为今后的育种工作打下了扎实的理论基础,通过配对杂交产生的杂交菌株,可为下一轮优良菌株的筛选提供材料。
参考文献
[1] 刘明广, 冯志勇, 霍光华, 等. 真姬菇交配型研究[J]. 食用菌学报, 2008, 15(1): 11-13.
[2] 李安政, 林芳灿. 香菇交配型因子次级重组体的鉴定[J]. 菌物研究, 2006, 4(3): 20-26.
[3] 曹 梅, 曹 晖, 张兴群, 等. 翘鳞香菇信息素受体编码基因的克隆及其进化分析[J]. 工业微生物, 2010, 40 (6): 12-17.
[4] Byong K K, Ju H K, Mirim J, et al. Mycelial protoplast isolation and regeneration of Lentinus lepideus[J]. Life Sciences, 2000, 66(14): 1359-1367.
[5] 王春晖. 食用菌领域原生质体技术研究应用浅析[J]. 中国食用菌, 2011, 30(3): 3-5.
[6] 柯斌榕, 卢政辉, 吴小平, 等. 赤芝担孢子交配型因子鉴定及多样性分析[J]. 热带作物学报, 2018, 39(1): 145-150.
[7] 林芳灿, 张树庭. 中国香菇栽培菌株不亲和性因子的分析[J]. 华中农业大学学报, 1995(5): 459-466.
[8] 刘海英, 张运峰, 范永山, 等. 紫外线对杏鲍菇原生质体的诱变作用[J]. 核农学报, 2011, 25(4): 719-723.
[9] 孙晓瑞, 陈博文, 张小林, 等. 秀珍菇单孢子菌株原生质体制备条件的优化[J]. 生物技术通报, 2018, 34(4): 70-76.
[10] Cheng S M, Lin F X, Xu C. Implication of mating type and cytoplasm factors in asymmetric distribution of two types of monokaryons recovered from dikaryons in Lentinula edodes[J]. Journal of Biotechnology, 2008, 136: 309.
[11] 馮伟林, 蔡为明, 金群力, 等. 杏鲍菇单核体菌株及其杂交后代筛选和鉴定[J]. 核农学报, 2012, 26(2): 275-279.
[12] 胡 欣, 姚方杰, 张友民, 等. 珊瑚猴头担孢子萌发及其菌丝生长特性[J]. 食用菌学报, 2016, 23(2): 23-24.
[13] 程 莉, 李安政, 林范学, 等. 糙皮侧耳担孢子交配型的鉴定[J]. 微生物学通报, 2007, 34(6): 1086-1089.
[14] 董洪新, 蔡德华, 李 玉. 猪肚菇担孢子交配型的分析[J]. 微生物学通报, 2010, 37(11): 1617-1620.
[15] Raper C A. B-Mating-type genes influence survival of nuclei separated from heterokaryons of Schizophyllum[J]. Experimental Mycology, 1985, 9(2): 149-160.
[16] 陈躬国, 林 原, 刘新锐, 等. 秀珍菇遗传育种研究进展[J]. 热带作物学报, 2017, 38(7): 1377-1381.
[17] Papazian H P. The incompatibility factors and a related gene in schizophyllum commune[J]. Genetics, 1951, 36 (5): 441-459.
责任编辑:沈德发

