低温胁迫对木薯‘F200’幼苗叶片亚显微结构及其叶绿素荧光参数变化的影响
王馨 易拓 朱杰辉 宋勇


摘 要:為探究低温胁迫对木薯显微结构和光合效率的影响,对木薯耐寒品种‘F200和常栽低温敏感型品种‘华南8号(‘SC8)在人工低温条件下进行4 ℃低温处理,观察处理前和处理3、6、12、24 h下幼苗叶片的扫描电镜、透射电镜及叶绿素荧光参数变化情况,并比较两品种间的差异。结果表明:(1)与‘SC8相比,随着气温的降低‘F200的叶片气孔会逐渐关闭且叶片蜡质形成自我保护机制;(2)低温胁迫状态24 h后,‘F200叶肉细胞内细胞器仍维持工作状态,而‘SC8叶肉细胞基本死亡;(3)2个品种最大叶绿素荧光强度下降且达到最大荧光所需时间均增加,‘F200的最大荧光值高于‘SC8;(4)低温胁迫下,‘F200的各项叶绿素荧光参数应急反应强度低于‘SC8,说明‘F200对于在低温逆境环境中生长的能力强于‘SC8。
关键词:木薯;低温;显微;叶绿素荧光
中图分类号:S533 文献标识码:A
Effect of Low Temperature Stress on Leaf Submicroscopic Structure and Chlorophyll Fluorescence Parameters of Cassava ‘F200 Seedlings
WANG Xin1, YI Tuo1, ZHU Jiehui1,5*, SONG Yong1,2,3,4*
1. College of Horticulture, Hunan Agricultural University, Changsha, Hunan 410128, China; 2. Potato Center of Hunan Province, Changsha, Hunan 410128, China; 3. Engineering Research Center for Horticultural Crop Germplasm Creation and New Variety Breeding, Ministry of Education, Changsha, Hunan 410128, China; 4. Key Labortory for Vegetable Biology of Hunan Province, Changsha, Hunan 410128, China; 5. Orient Science &Technology College of Hunan Agricultural University, Changsha, Hunan 410128, China
Abstract: In order to investigate the effects of low temperature stress on the microstructure and photosynthetic efficiency of cassava, cold resistant cassava variety ‘F200 and low-temperature sensitive cassava variety ‘Huanan 8 (‘SC8) were treated at 4 ℃ under artificial low temperature condition. Scanning electron microscopy (SEM), transmission electron microscopy (TEM) and chlorophyll fluorescence parameters were observed before and after 3 h, 6 h, 12 h and 24 h treatment, and the differences between the two varieties were compared. The results showed that: Compared with ‘SC8, with the decrease of air temperature, the stomata of ‘F200 leaves gradually closed and the wax in leaves formed a self-protection mechanism. After 24 h of low temperature stress, the organelles in ‘F200 mesophyll cells maintained functioning, while the mesophyll cells of ‘SC8 basically died. The maximum chlorophyll fluorescence intensity of the two cultivars decreased and the time required to reach the maximum fluorescence increased. The maximum fluorescence value of ‘F200 was higher than that of ‘SC8. Under low temperature stress, the emergency response intensity of various chlorophyll fluorescence parameters of ‘F200 was lower than that of ‘SC8, indicating that ‘F200 had a stronger ability to grow in low temperature adversity environment than ‘SC8.
Keywords: cassava; low temperature; microscopy; chlorophyll
DOI: 10.3969/j.issn.1000-2561.2021.07.015
木薯(Manihot esculenta Crantz)大戟科植物[1],适宜生长在平均温度约为18 ℃以上且全年无霜期最低8个月的地区,当气温低于15 ℃时生长发育逐渐受到抑制,温度低于4 ℃便停止生长[2-3]。中国完全适合木薯生长的地区较少,为扩大木薯的种植面积,保证我国的粮食安全,国家陆续多次出台相关政策,例如:“木薯北移”战略,将湖南等多省份作为适宜木薯种植的北移区域[4]。
不同环境下叶片相应的形态和结构会发生不同的变化[5]。低温的状态下叶片中的细胞器和膜结构反应尤为明显[6]。气孔作为植物与外界进行气体交换和水汽蒸腾的通道与叶片正常的功能运转有着密切的联系[7]。叶绿素对低温较敏感,其含量直接影响光合作用效率和光合产物的合成[8]。叶绿素荧光有着广泛的研究,作为光合作用研究的探针,可以用来检测植物光合作用受環境的影响程度[9]。叶绿素荧光技术可以灵敏地探测外界环境因子对植物光合作用造成的影响,在植物逆境研究方面显示出较好的应用前景[10]。快速叶绿素荧光诱导动力学曲线是一种快速获得PSⅡ光化学活性、电子传递和光合器官结构和状态等信息的方法[11]。Strasser等[12]在生物膜能量流动的基础上,建立了针对快速叶绿素荧光诱导曲线的数据分析和处理方法,并通过计算能量流和能量比率衡量在给定物理状态下样品内部变化,建立了高度简化的能量流动模型图。这些能量包括ABS(吸收的光能)、TR(捕捉的光能)、ET(电子传递)、DI(热耗散)[11,13]。
湖南等地的年平均气温较低,对木薯的正常生长有或多或少的抑制,本研究在人工气候室模拟湖南的温度进行试验,以木薯‘SC8为对照,研究木薯耐寒品种‘F200在低温状态下的叶片结构及叶绿素荧光参数,旨在揭示木薯耐低温机制在形态结构上的理论依据。
1 材料与方法
1.1 材料
1.1.1 供试材料 试验材料木薯品种‘F200以及对照材料木薯品种‘华南8号均来自中国热带农业科学院热带作物品种资源研究所。
1.1.2 材料处理 试验时间为2019年7月,试验地点:湖南农业大学园艺学院实验中心人工气候室,试验品种:‘F200和‘华南8号,截取15 cm左右长度的木薯茎段,选取芽点完好且粗细和重量一致的茎段各70根,在直径17 cm的育苗盆中基质培养。放入FYS-1010W型室内高照度人工气候室中培养60 d(白天温度/光强:28 ℃/7500 lx,晚上22 ℃/0 lx),当木薯长到7~8片叶片后,2个品种各取生长势一致的木薯30株进行(4±1) ℃处理0、3、6、12、24 h,28 ℃为对照。叶绿素荧光试验叶片和取样叶片均为从基部向上第三片成熟叶,进行扫描电镜和透射电镜的试验。
1.2 方法
扫描电镜方法[14]观察木薯叶片表面显微结构,透射电镜方法[15]观察木薯叶片细胞超微结构,叶绿素荧光方法[16]用Fluorpen便携式叶绿素荧光仪测定各处理的木薯苗功能叶片的叶绿素荧光动力学曲线(OJIP)和非光化学淬灭曲线(NPQ)。
2 结果与分析
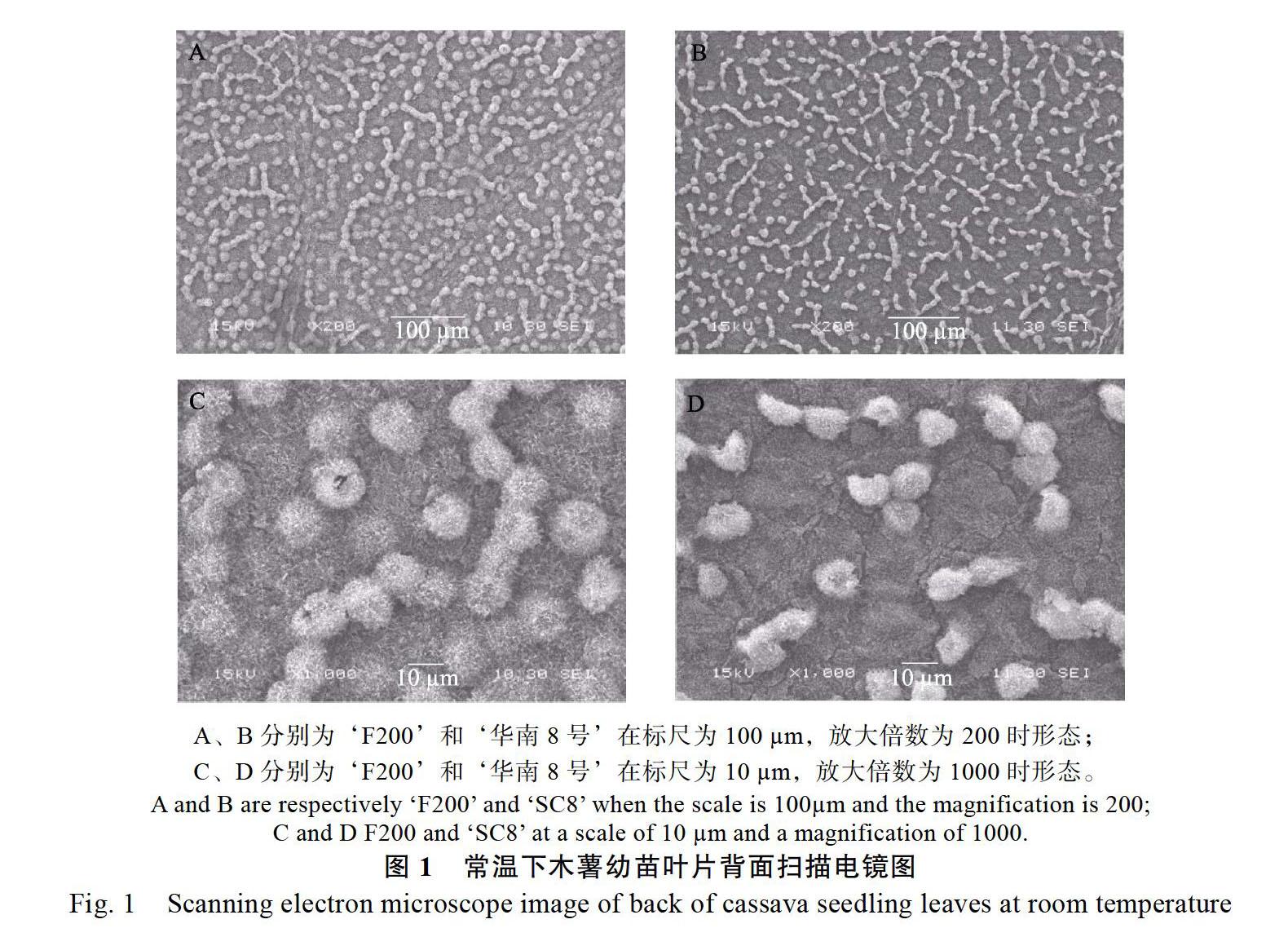
2.1 常温下木薯叶表面显微结构
‘F200和‘华南8号成熟叶片在结构上有一定的差异,如图1所示,2个品种木薯的下表皮气孔分布为规则型,气孔下陷形成气孔窝,气孔器均为长椭圆形,表面蜡被和表茸毛十分丰富。如图1A、图1B所示,在相同面积、相同放大倍数的情况下,‘F200的木薯叶片气孔密度比‘华南8号的大,且‘F200的气孔周围的蜡被和叶片表面的茸毛更丰富,如图1C、图1D所示。
2.2 低温胁迫下不同木薯叶片气孔开闭情况
王颖等[17]的研究表明,温度对气孔的开放率有显著影响,在其他条件相同的情况下,随着温度的降低,植物气孔开放也呈现下降的趋势。如图2所示,放大5000倍,在常温情况下,‘F200气孔周围密布着絮状、松针状蜡质,气孔处于张开状态,低温胁迫3 h,气孔关闭,气孔周围的蜡质晶体熔融成片,覆盖在气孔口,这在一定程度上起到了阻隔低温的作用,同时减少水分损失,低温胁迫6、12、24 h,气孔仍保持关闭状态,气孔周围的蜡质由成片熔融状变为小树枝状再变为松针状。如图3所示,放大5000倍,在常温情况下,‘华南8号气孔张开,周围蜡质呈絮状,胁迫3、6、12、24 h、后,‘华南8号木薯气孔依旧张开,但随着时间的增加,开度逐渐减小,表面蜡质由絮状变为小树枝状再熔融成片状。
2.3 常温下木薯叶片细胞超微结构
透射电镜下木薯叶片细胞常温超微结构如图4所示,常温下,细胞内结构完整,叶绿体紧贴细胞质膜,呈梭型在细胞多处分布,叶绿体基粒片层垛叠清晰可见,呈平行排列,叶绿体内有少量质体小球和淀粉粒,线粒体在叶绿体周围分布,细胞核完整,核膜清晰可见,高尔基体的双层膜清晰可见,在高尔基体旁有合成的蛋白质颗粒,液泡占据细胞内大部分空间,将细胞器挤向四周,液泡内还有其他小颗粒物质。
2.4 低温胁迫下木薯叶片细胞超微结构
如图5,‘F200中A所示,低温胁迫3 h后,‘F200木薯叶肉细胞结构完整,细胞壁结构清晰完整。叶绿体与原生质膜出现小间隙,叶绿体的基粒片层较常温下有些溶解,合成的淀粉粒增加,质体小球数目也有所上升。开始出现细胞间隙,高尔基体和线粒体变得模糊,核膜不再清晰可见,液泡的界线不明显。与‘F200相比(‘SC8图A)处理3 h后,‘华南8号木薯叶片叶绿体中质体小球数量和体积都超过‘F200,能够看到清晰的液泡膜,同时细胞核膜有降解的现象。低温胁迫6 h后,如图‘F200B所示,细胞间隙继续扩大,有轻微的质壁分离现象,叶绿体与原生质体的间隙消失,叶绿体的基粒层垛叠结构能较清晰的识别,叶绿体内的质体小球数目明显减少,液泡内蛋白质、淀粉等渗透物质增加。反观‘华南8号(图‘SC8 B),‘华南8号叶肉细胞间的间隙明显增大,几乎见不到叶绿体的基粒层,叶绿体内的质体小球数目几乎占据了整个叶绿体,未见到较大体积的蛋白质和淀粉颗粒,细胞质内较混沌,细胞核缩小。低温胁迫12 h后,如图‘F200C所示,细胞间的间隙继续扩大,细胞结构完整,细胞体积逐渐减小,叶绿体内几乎见不到基粒片层,叶绿体内有一些质体小球和较多明显可见的淀粉颗粒,液泡内蛋白质等渗透物质较多,细胞核缩小。处理12 h后,‘华南8号(图‘SC8C)叶肉细胞间隙增大,质壁分离现象较为明显,叶绿体内的基粒片层溶解,叶绿体内合成淀粉颗粒,仍有较多的质体小球存在于叶绿体内,细胞核从内至外开始缓慢溶解。处理24 h后,如图‘F200D所示,叶肉细胞之间有着明显的间隙,叶绿体内基本见不到基粒片层,同时,叶绿体内的淀粉合成仍在继续,质体小球体积,数目增加,液泡内的渗透物质明显增加,细胞体积继续缩小。如图‘SC8D所示,处理24 h后,‘华南8号叶肉细胞细胞壁出现破损的伤口,细胞内的叶绿体内没有合成淀粉,细胞液内渗透物质较少,找不出明显的细胞核结构,细胞几乎处于“死亡”状态。
2.5 低溫胁迫对木薯幼苗快速叶绿素荧光诱导动力曲线的影响
采用Fluorpen便携式叶绿素荧光仪测量木薯叶片叶绿素荧光快速诱导动力学曲线。如图6所示,FK、FJ和FI分别是300 μs、1 ms和30 ms时的荧光强度,Fm=FP即最大荧光强度。常温情况下、‘F200(CK)和‘华南8号木薯叶片的OJIP曲线基本重合,4 ℃低温胁迫下,OJIP曲线发生形变,2个品种最大叶绿素荧光强度下降,‘F200的最大荧光高于‘华南8号,同达到最大荧光所需时间增加。
2.6 低温胁迫对木薯幼苗叶绿素荧光参数的影响
采用Strasser等[18]的方法计算以下荧光参数。以有活性的反应中心(RC)为基础,在受到低温等逆境胁迫时,单位有活性反应中心吸收的光能(ABS/RC)、捕获的光能(TRo/RC)和热耗散的光能(DIo/RC)显著增加,用于电子传递的能量(ETo/TRo)明显减小,叶片通过减少电子传递所耗能量份额,增加热耗散的能量份额以减少低温等逆境引起的伤害。如表1所示,低温胁迫下,‘华南8号木薯叶绿素荧光参数:ABS/RC、TRo/RC和DIo/RC均显著增加,ETo/TRo显著减小;而‘F200木薯叶绿素荧光参数:ABS/RC、TRo/RC和DIo/RC三者增加速度和幅度远小于‘华南8号,ETo/TRo减小程度小于‘华南8号。
低温胁迫下,‘华南8号木薯叶片中电子传递到下游电子受体的概率φo、电子传递所需的量子产额φEo和PSⅠ受体侧末端电子受体的量子产额φRo均随着胁迫时间的增加大幅减小,热耗散的量子比率φDo大幅度上升,这说明低温胁迫严重抑制了其电子传递,使得光反应活性和PSⅠ的相对活性显著下降。反观‘F200木薯在低温胁迫下对其φo、φEo、φRo三个叶绿素荧光参数的影响程度弱,能够较好地维持其正常的电子传递。
3 讨论
植物叶片细胞显微结构变化能够明显且直观的反映出植物对环境的适应情况[19]。常温情况下2个品种在结构上有细微的差异:‘F200木薯幼苗蜡质厚度更厚,气孔数量也多于‘华南8号,这一结构特点也反映出‘F200耐低温的特征。低温胁迫之后,‘F200气孔迅速关闭,表面蜡质晶体出现熔融现象将气孔包裹住,这一特征与倪郁等[20]对低温下拟南芥表皮蜡质变化情况一致,而‘华南8号在应对低温胁迫时反应速度远小于‘F200,其受伤程度也更高。质体小球在非生物或生物胁迫过程有参与适应过程[21]。有研究表明,在遭受胁迫的情况下,大部分的质体小球来源于类囊体的溶解[22]。在本试验中,随着低温胁迫时间的增加,‘华南8号叶绿体内质体小球数量剧增且远大于‘F200叶绿体内质体小球数量,这表明‘F200植物特性可以缓解类囊体的解体,维持叶绿体的正常功能。并且随着胁迫时间的增加,‘F200淀粉粒合成数量明显增多,主要用于缓解细胞失水,反作用于细胞的低温耐性。在胁迫24 h后,‘F200细胞结构仍较为完整,能观察到正在合成淀粉颗粒的线粒体,而‘华南8号木薯叶肉细胞出现死亡现象。正常生长状态下,2个品种木薯幼苗的叶绿素荧光参数没有明显差异,而在低温胁迫下,2个品种木薯叶绿素荧光参数发生变化,其中,ABS/RC、TRo/RC和DIo/RC显著增加且‘SC8增幅大于‘F200,ETo/TRo明显减小且‘F200明显小于‘SC8,这与彭晨等[23]的结果一致,说明‘F200在缓解低温胁迫对光和器官和功能上强于‘华南8号。同时,低温胁迫导致与电子传递能力有关的叶绿素荧光参数φo、φEo和φRo均下降,其中‘华南8号比‘F200下降幅度更大,有研究表明,其原因可能是低温导致类囊体膜的流动性减小,从而导致类囊体膜上的反应中心、捕光天线、电子传递体等蛋白的结构或构象发生变化[24],这与本研究中透射电镜图中‘华南8号类囊体的溶解情况基本一致。
综上所述,本研究通过低温下木薯叶片结构和叶绿素荧光参数的变化,从这2个角度阐释了‘F200在低温耐性的深层原理。‘F200木薯气孔周围具备更浓密的绒毛结构、各细胞器在应对低温逆境有更强的抗压能力、电子传递所耗能量份额较‘SC8小、热耗散的能量份额较‘SC8大,具备耐低温的潜力,对于打破种植区域温度条件的限制有重大作用,具有很大的发展潜力。
参考文献
[1] 易 拓, 黄 娟, 雷雅杰, 等. 木薯食品研究进展[J]. 美食研究, 2019, 36(2): 23-27.
[2] 周玉飞, 曾长英, 陈 新, 等. 低温驯化对木薯耐寒性形态、生理特性的影响[J]. 热带农业科学, 2011, 31(6): 31-36.
[3] 王惠君, 王文泉, 李文彬, 等. 木薯的抗寒性及北移栽培技术研究进展综述[J]. 热带作物学报, 2016, 37(7): 1437-1443.
[4] 宋 勇, 熊兴耀, 吴秋云, 等. 湖南发展木薯产业可行性分析与建议[J]. 湖南农业科学, 2012 (1): 35-38.
[5] Dagmar V, Elena G, Stanislav G. Hierarchical organisation of the trap in the protocarnivorous plant Roridula gorgonias (Roridulaceae)[J]. The Journal of Experimental Biology, 2009, 212(19): 3184-3191.
[6] 史鹏辉, 孙万仓, 赵彩霞. 低温下抗氧化酶活性与冬油菜根细胞结冰关系的初步研究[J]. 西北植物学报, 2013, 33(2): 329-335.
[7] 慕 芳, 冯佰利, 王鹏科, 等. 糜子叶表面抗旱结构的扫描电镜观察[J]. 河北农业科学, 2010, 14(11): 65-67.
[8] 安飞飞, 陈 霆, 杨 龙, 等. 木薯叶片显微结构及叶绿素荧光参数比较[J]. 生物技术通报, 2018, 34(1): 104-109.
[9] Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis: The basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991(42): 313-349..
[10] Murchie E H, Lawson T. Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications[J]. Journal of Experimental Botany, 2013, 64(13): 3983-3998.
[11] Brestic M, Zivcak M, Kalaji H M , et al. Photosystem II thermostability in situ: Environmentally induced acclimation and genotype-specific reactions in Triticum aestivum L.[J]. Plant Physiology and Biochemistry, 2012, 57: 93-105.
[12] Strasser R, Tsimilli-Michael M, Srivastava A. Analysis of the chlorophyll a fluorescence transient[J]. Chlorophyll A Fluorescence A Signature of Photosynthesis, 2004: 321-362.
[13] Mehta P, Allakhverdiev S I, Jajoo A. Erratum to: Characterization of photosystem II heterogeneity in response to high salt stress in wheat leaves (Triticum aestivum )[J]. Photosynthesis Research, 2011, 107(3): 249-255.
[14] 张友玉, 陈良碧. 烟草叶片组织结构的扫描电镜观察方法[J]. 电子显微学报, 2000(2): 154-157.
[15] 张红梅, 王明艳, 韩秀玲, 等.刺五加叶片的透射电镜观察[J]. 河北联合大学学报(医学版), 2013, 15(2): 146-147.
[16] 杨一璐. 基于叶绿素荧光的作物信息快速获取与检测方法研究[D]. 南京: 南京农业大学, 2017.
[17] 王 颖, 许 艺, 陈秉初, 等. 探究环境因素对植物气孔开闭的影响[J]. 生物学通报, 2019, 54(1): 39-42.
[18] Strasser R J, Srivastava A, Tsimilli-Michael M. The fluorescence transient as a tool to characterize and screen photosynthetic samples[J]. Probing Photosynthesis Mechanisms Regulation and Adaptation, 2000: 445-483.
[19] Sáez P L, Bravo L A, Sáez K L, et al. Photosynthetic and leaf anatomical characteristics of Castanea sativa: a comparison between in vitro and nursery plants[J]. Biologia Plantarum, 2012, 56(1): 15-24.
[20] 倪 郁, 宋 超, 王小清. 低温胁迫下拟南芥表皮蜡质的响应机制[J]. 中国农业科学, 2014, 47(2): 252-261.
[21] Roberto E C, Steffen H, Andreas K, et al. Plastoglobular protein 18 is involved in chloroplast function and thylakoid formation[J]. Journal of Experimental Botany, 2019, 70(15): 3981-3993.
[22] 商 静, 许嘉阳, 王小东, 等. Cl~-通道抑制剂对高氯条件下烤烟叶片超微结构和生理指标的影响[J]. 中国农业科技导报, 2017, 19(2): 20-27.
[23] 彭 晨, 苏晓琼, 杜 静, 等. 外源亚精胺对高温胁迫下黄瓜幼苗快速叶绿素荧光诱导动力学特性的影响[J]. 西南农业学报, 2016, 29(2): 260-265.
[24] 卢广超, 许建新, 薛 立, 等. 低温胁迫对4种幼苗的叶绿素荧光特性的影响[J]. 中南林业科技大学学报, 2014, 34(2): 44-49.
責任编辑:白 净

