性类固醇激素雌二醇、睾酮对半滑舌鳎雌、雄、伪雄鱼生长性能的影响
王佳林,杨英明,杨 倩,王 娜,陈松林
(1. 中国水产科学研究院黄海水产研究所/青岛海洋科学与技术国家实验室/海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071; 2. 上海海洋大学水产与生命学院,上海 201306; 3. 农业农村部海洋渔业可持续发展重点实验室,山东 青岛 266071)
自然界中许多鱼类存在性别大小异形现象,即雌雄个体的生长速度不同导致的个体大小差异,并且这种现象在鱼类性腺开始发育直至成熟这一阶段尤为明显。例如尼罗罗非鱼 (Oreochromis niloticus)、黄颡鱼 (Pelteobagrus fulvidraco)、斑点叉尾鮰(Ictalurus punctatus) 等鱼类的雄性个体比雌性个体大,而鲤 (Cyprinus carpio)、虹鳟 (Oncorhynchus mykiss)、牙鲆 (Paralichthys olivaceus)、半滑舌鳎(Cynoglossus semilaevis) 等鱼类的雌性个体则表现出生长速度快、个体大的特点[1]。
半滑舌鳎属于鲽形目、舌鳎科、舌鳎属,俗称鳎米、鳎目,是一种近海温水大型底栖鱼类,主要分布于我国渤海、黄海沿岸[2]。半滑舌鳎由于味道鲜美、肉质细嫩、营养丰富,深受消费者欢迎,市场价值极高,已成为我国海水鲆鲽鱼类三大养殖品种之一,其养殖前景非常广阔[3]。近年来的养殖实践和研究发现,半滑舌鳎雌雄个体在生长速率上存在很大差别,21月龄时,半滑舌鳎雌性个体平均体质量约为600 g,而雄性个体平均体质量仅为190 g,只达到雌性体质量的1/3[4]。值得一提的是,半滑舌鳎在早期生长过程中存在性逆转情况,即在自然养殖条件下有些遗传雌性半滑舌鳎在高温等环境刺激下会逆转为生理雄性,即伪雄鱼[5]。伪雄鱼和雄鱼类似,表现出生长缓慢的特点,这一问题严重制约了半滑舌鳎养殖产业的可持续发展。因此,亟需开展半滑舌鳎不同性别间生长差异的分子机制研究。
哺乳动物与模式生物中的研究表明,生长的性别二态性与动物体内的性类固醇激素、生长轴系统(Growth hormone/insulin-like growth factor 1,GH/IGF1) 的相互作用有关[6]。生长激素 (Growth hormone, GH) 是由垂体分泌的重要激素,已证实在动物机体生长、骨骼发育及调控代谢方面发挥关键作用[7],半滑舌鳎中也发现该基因在雌雄个体间存在显著的表达二态性[8]。胰岛素样生长因子(Insulin-like growth factor 1, IGF1) 是受 GH 刺激后在肝脏产生的重要因子,可以促进骨骼和肌肉的生长[9]。细胞因子信号传导抑制因子3 (Suppressor of cytokine signaling 3, SOCS3) 参与多种细胞因子和生长因子的负调控过程,并且内源性和外源性雌激素可以增加大鼠体内Socs3基因的表达[10-12]。此外,Gabrielsson等[13]发现使用雌二醇 (17β-estradiol, E2) 处理大鼠 (Rattus norvegicus),可使大鼠肝脏生长激素受体 (Growth hormone receptor, GHR)mRNA表达水平提高。Domené等[14]则发现雌二醇处理后家兔 (Oryctolagus cuniculus f. domesticus) 肝脏GHR表达水平降低。此外,在不同的物种中,性类固醇激素会诱导促生长激素释放激素 (Growth hormone releasing hormone, GHRH) 和生长抑素释放抑制因子 (Somatotropin release inhibiting factor,SRIF) 释放模式不同,进而导致了性别特异性生长激素分泌模式的产生[15-16]。
性类固醇激素对鱼类的生长性能也具有显著影响[17]。例如,E2显著抑制黄颡鱼的生长,睾酮(17α-Methyltestosterone, T) 显著促进雌鱼生长,但抑制雄鱼生长[18]。在尼罗罗非鱼中,E2明显促进雌鱼的生长,但对雄鱼的生长无显著影响,而T则对雌、雄鱼的生长均有显著性影响[19]。通过注射T刺激麦穗鱼 (Pseudorasbora parva) 可以使幼鱼的生长速度显著减慢,且对雄鱼的抑制作用要强于雌鱼,此外,研究人员还发现,T可以在一定程度上抑制麦穗鱼免疫系统的功能[20]。
笔者前期已开展了半滑舌鳎生长-生殖轴重要组织 (脑、垂体、性腺、肝脏) 的转录组学研究,发现类固醇生物合成通路中的24-脱氢胆固醇还原酶 (Delta24-sterol reductase, dhcr24)、7-脱氢胆固醇还原酶 (Delta7-sterol reductase, dhcr7) 等基因在半滑舌鳎雌性肝脏中呈显著上调趋势[21],暗示胆固醇依赖的性类固醇激素也可能参与半滑舌鳎性别大小异形现象的调控过程。为探究性类固醇激素对半滑舌鳎生长性能的影响,笔者同时对半滑舌鳎雌鱼、雄鱼、伪雄鱼进行了E2、T激素注射处理实验,并对其体长、体宽、体质量等生长数据进行测量,在注射1个月后取生长-生殖轴组织进行荧光定量 PCR (Real-time PCR, RT-PCR) 分析,比较了两种性类固醇激素对雌、雄、伪雄鱼半滑舌鳎生长性能的影响,并选取了半滑舌鳎3个生长相关基因gh1、igf1、socs3进行定量分析,以探究类固醇激素处理半滑舌鳎后对其生长相关基因表达量的影响。
1 材料与方法
1.1 实验材料
实验用鱼均采购于山东日照半滑舌鳎良种养殖场,选取16月龄,体质健康、无机体损伤的普通半滑舌鳎成鱼。整个实验过程中均使用自然海水养殖,盐度约为 30,溶氧 5 mg·L−1以上,pH 曝气后约为8.15,水温约为12.5 ℃,每日投喂饲料3次。
1.2 实验方法
1.2.1 半滑舌鳎生理雄鱼的遗传性别鉴定 剪取288条生理雄鱼的鳍条,加入 200 μL 50 mmol·L−1NaOH 煮沸 10 min 后,加入 20 μL pH 8.0的 1 mol·L−1Tris-HCL,12 000 r·min−1离心 10 min,获得 288条生理雄鱼的模板DNA。取2 μL上清用于后续PCR检测。引物采用刘洋等[22]开发的半滑舌鳎性别特异标记引物 (cs-sex-F: CCTAAATGATGGATGT AGATTCTGTC,cs-sex-R: GATCCAGAGAAAATAAACC CAGG)。PCR 反应体系为 10×Buffer 5.0 μL,dNTP(2.5 mmol·L−1) 4.0 μL,上下游引物 (10 μmol·L−1)各 4.0 μL,rTaqDNA 聚合酶 (5 U·μL−1) 0.5 μL,模板 DNA (50 ng·μL−1) 5.0 μL,ddH2O 33.5 μL,混匀后离心。PCR 扩增程序为 95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,34个循环。采用 2% 琼脂糖凝胶电泳 (180 V, 15 min) 鉴定遗传性别,伪雄鱼可扩增出 169 bp和 134 bp 2条目的条带,雄鱼只能扩增出1条169 bp的目的条带[22]。
1.2.2 激素注射处理 分别取半滑舌鳎雌鱼、雄鱼以及伪雄鱼各90尾开展激素处理实验。共设置9组,包括雌二醇处理雌鱼组 (FE)、雌二醇处理雄鱼组 (ME)、雌二醇处理伪雄鱼组 (PME)、睾酮处理雌鱼组 (FT)、睾酮处理雄鱼组 (MT)、睾酮处理伪雄鱼组 (PMT)、对照雌鱼组 (FC)、对照雄鱼组(MC)、对照伪雄鱼组 (PMT)。每组鱼的数量均为30尾。将E2、T (Solarbio公司) 溶解于无水乙醇后,再以体积比1∶10与玉米油混合,参考罗非鱼、虹鳟等雌雄激素注射相关文献[19,23],按照m(激素)∶m(体质量)为 25 μg ·g−1注射到鱼体腹腔中。每7天注射1次,连续注射3周,每次注射前测量体质量、体长等生长数据。对照组仅注射体积比为1∶10混合的无水乙醇∶玉米油。
1.2.3 生长性能分析 根据测量的生长数据计算本次实验不同组别半滑舌鳎的体质量绝对生长率(Absolute growth rate W, AGRW, %) 和体长绝对生长率 (Absolute growth rate L, AGRL, %)。计算公式为:
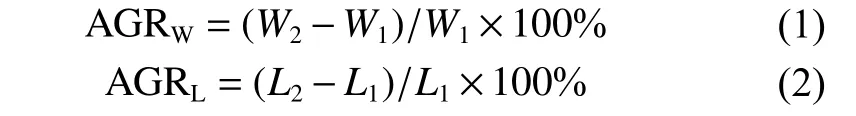
式中W1为初始体质量,W2为实验后体质量;L1为初始体长,L2为实验后体长。
1.2.4 生长相关基因表达量分析 本次实验利用RT-PCR的方法检测gh1、igf1、socs3在正常条件下半滑舌鳎生长相关组织中的表达水平和E2、T处理之后生长相关组织中表达模式的变化。以βactin基因作为内参,每个样品设置3个生物学重复,具体RT-PCR引物参照表1。其反应体系则参照 TaKaRa SYBR®Premix Ex TaqTM试剂盒说明书,利用 ABI 7500 Fast Real-time (Applied Biosystems,美国) 程序进行定量分析。釆用 2−ΔΔCt法计算gh1、igf1、socs3基因的相对表达量,所得数据均采用SPSS 17.0软件进行方差分析,P<0.05为差异显著。

表1 荧光定量PCR分析所用引物Table 1 Primers for real-time PCR
2 结果
2.1 遗传性别鉴定结果
对288条半滑舌鳎生理雄鱼进行遗传性别鉴定,结果检测出104条伪雄鱼和184条遗传雄鱼,部分鉴定结果见图1。

图1 半滑舌鳎伪雄鱼鉴定电泳结果 (部分)ZW. 伪雄鱼;ZZ. 雄鱼;M. DL2000 DNA MarkerFigure 1 Electrophoresis results of pseudo-male identification of C. semilaevis (partial)ZW. Pseudo males; ZZ. Males; M. DL2000 DNA Marker
2.2 类固醇激素注射后生长性能分析
本实验结果显示,相比于对照组,E2和T对雌、雄鱼和伪雄鱼的体质量增长均具有显著抑制作用 (P<0.05);从体长绝对生长率来看,E2对雌鱼和伪雄鱼的体长增长有显著抑制作用 (P<0.05),对雄鱼无显著抑制作用 (P>0.05),而T仅对伪雄鱼的体长增长有显著抑制作用 (P<0.05)。体质量绝对生长率与体长绝对生长率分别见图2、图3,具体生长数据见表2。
表2 对照组、E处理组和T处理组生长参数比较Table 2 Comparison of growth parameters between control group, E treatment group and T treatment group ; n=30

表2 对照组、E处理组和T处理组生长参数比较Table 2 Comparison of growth parameters between control group, E treatment group and T treatment group ; n=30
注:同一处理组、不同性别鱼之间的比较或同一性别鱼、不同处理组之间的比较;标有不同字母表示差异显著 (P<0.05)Note: Comparison between fish of the same treatment group and different sexes or comparison between fish of the same sex and different treatment groups. Different letters indicate significant difference (P<0.05).
体长绝对生长率Absolute growth rate L/%对照组 Control group雌 F734.38±83.84a 775.00±77.47a 48.67±2.56a51.63±2.50a 5.53±0.08c2.73±0.03b雄 M134.39±19.99b 148.93±20.37b 30.26±1.67b 30.38±1.35b 10.82±0.02a 0.41±0.19d伪雄 PM148.90±22.28b 165.24±21.48b 29.60±2.14b 31.33±1.26b 10.97±0.04a 5.84±0.41a E处理组 E treatment group雌 F778.76±94.05a 788.46±73.24a 48.97±2.81a51.56±2.71a 1.25±0.10f 1.96±0.06c雄 M133.75±20.57b 137.52±19.99b 29.80±1.07b 29.95±1.39b 2.82±0.02e 0.52±0.04d伪雄 PM154.83±27.14b 166.73±30.73b 30.18±2.40b 30.41±2.16b 7.69±0.06b 0.75±0.11d T处理组 T treatment group 雌 F721.45±69.85a 750.00±78.54a 48.35±2.07a51.24±2.15a 3.96±0.22d 2.59±0.04b雄 M147.16±14.76b 152.70±19.03b 30.10±1.47b 30.47±1.53b 3.76±0.03d 1.23±0.29c伪雄 PM159.72±26.19b 165.52±24.65b 30.18±1.90b 30.70±2.11b 3.63±0.13d 1.70±0.10c组别Group性别Gender初始体质量Initial body mass/g实验后体质量Body mass after treatment/g初始体长Initial body length/cm实验后体长Body length after treatment/cm体质量绝对生长率Absolute growth rate W/%

图2 性类固醇激素处理后体质量绝对生长率对比C. 对照组;E. 雌二醇处理组;T. 睾酮处理组;标有不同字母表示差异显著 (P<0.05),下同Figure 2 Comparison of absolute growth rate of body mass after treatment with sex steroid hormonesC. Control group; E. Estradiol treated group; T. Testosterone treated group; different letters indicate significant difference(P<0.05). The same below.

图3 性类固醇激素处理后体长绝对生长率对比Figure 3 Comparison of absolute growth rate of body length after treatment with sex steroid hormones
2.3 激素处理后对生长相关基因表达量影响
2.3.1 脑组织中gh1 mRNA 表达量变化 经过T注射处理之后,与对照组相比,gh1 mRNA在雌、雄、伪雄鱼脑中的表达量均显著降低 (P<0.05),且三者的表达量无显著性差异 (P>0.05)。经过E2注射处理之后,gh1 mRNA在雌、雄鱼脑中的表达量显著降低 (P<0.05),且雌、雄鱼之间表达量无显著性差异 (P>0.05),但在伪雄鱼脑中表达量显著升高 (P<0.05,图 4)。

图4 睾酮、雌二醇处理后gh1 mRNA在半滑舌鳎不同性别脑组织中表达量的变化Figure 4 Change of gh1 mRNA expression in brain tissues of different sexes of C. semilaevis after T and E2 treatments
2.3.2 肝脏中igf1 mRNA 表达量变化 经过 T 注射处理之后,与对照组相比,igf1 mRNA在雌鱼肝脏中的表达量显著降低 (P<0.05),在伪雄鱼肝脏中表达量显著升高 (P<0.05),在雄鱼肝脏中的表达量无显著性差异 (P>0.05)。E2注射处理之后,igf1 mRNA在雌、雄、伪雄鱼肝脏中的表达量均显著降低 (P<0.05),且三者表达量无显著性差异 (P>0.05,图 5)。

图5 睾酮、雌二醇处理后igf 1 mRNA在半滑舌鳎不同性别肝脏中表达量的变化Figure 5 Change of igf 1 mRNA expression in liver of different sexes of C. semilaevis after T and E2 treatments
2.3.3 肝脏中socs3 mRNA 表达量变化 经过T注射处理之后,雌、雄、伪雄鱼肝脏中socs3 mRNA的表达量较对照组均显著上升 (P<0.05),且雌鱼相较于雄、伪雄鱼,其表达量有显著性差异 (P<0.05),而雄鱼和伪雄鱼之间的表达量差异不显著 (P>0.05)。E2处理之后,雄鱼与雌鱼肝脏中socs3 mRNA的表达量较对照组有显著上升 (P<0.05),且二者之间的表达量有显著性差异 (P<0.05)。而伪雄鱼相较于对照组则无显著性差异 (P>0.05,图6)。
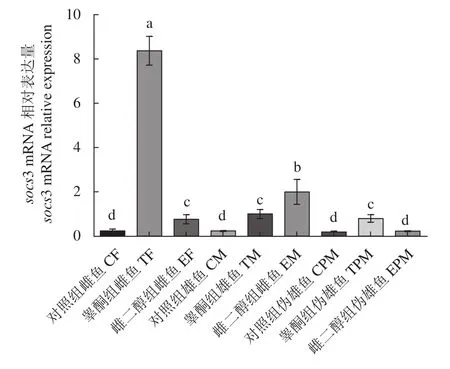
图6 睾酮、雌二醇处理后socs3 mRNA在半滑舌鳎不同性别肝脏中表达量的变化Figure 6 Change of socs3 mRNA expression in liver of different sexes of C. semilaevis after T and E2 treatments
2.3.4 肌肉中socs3 mRNA 表达量变化 同肝脏组织中的表达模式类似,经过T注射处理之后,socs3 mRNA在雌、雄、伪雄鱼肌肉中的表达量相较于对照组均显著上升 (P<0.05),且雌鱼与雄、伪雄鱼之间的表达量有显著差异 (P<0.05),而雄鱼与伪雄鱼之间表达量差异不显著 (P>0.05)。经过E2注射处理之后,socs3 mRNA在雄鱼和伪雄鱼肌肉中的表达量相较于对照组显著上升,在雌鱼中的表达量显著下降 (P<0.05),且雄鱼与伪雄鱼之间表达量差异不显著 (P>0.05,图7)。

图7 睾酮、雌二醇处理后socs3 mRNA在半滑舌鳎不同性别肌肉中表达量的变化Figure 7 Changes of socs3 mRNA expression in muscle of different sexes of C. semilaevis after T and E2 treatments
3 讨论
对哺乳动物的性类固醇激素研究较多,研究发现对家兔[24]、大鼠[25]注射性类固醇激素后,实验个体内的生长激素水平发生明显变化。对鱼类的研究也发现E2可以提高金鱼 (Carassius auratus)、虹鳟[26]血清中的生长激素水平;在黄颡鱼、尼罗罗非鱼等具有生长二态性的典型物种中发现T、E2等性类固醇激素对其生长确实有一定的影响,且这些影响存在明显的性别差异。
本实验中,E2与T对半滑舌鳎个体均有生长抑制作用。参照鱼类生长调控研究相关结果[7,10,27-28],本实验选取半滑舌鳎生长轴相关基因gh1、igf1、socs3进行荧光定量PCR分析,探究了半滑舌鳎不同性别鱼体在性类固醇激素处理后其生长相关基因mRNA在不同组织中表达量的变化。本实验中gh、igf1两个生长正调控基因在T、E2激素注射后的实验组中均呈现类似的下降趋势,暗示Gh/Igf1系统可能是激素处理后生长性能下降的重要原因。研究发现,二氢睾酮 (Double hydrogen testosterone,DHT) 的刺激可以使虹鳟血浆中的Igf1浓度显著升高[29]。本研究也发现雌雄激素处理后socs3 mRNA的表达量在半滑舌鳎肝脏和肌肉中均表现出显著增加趋势,该负调控因子的上调可能是激素处理后生长缓慢的原因之一。另外,在T处理后的伪雄鱼肝脏和E2处理后的伪雄鱼脑组织中,分别观察到了igf1和gh1 mRNA表达量的显著上调,暗示伪雄鱼体内可能存在异于雌、雄鱼的生理生长以及应激调控机制。
性类固醇激素对动物生长性能的影响机制可能是多方面的。1) 性类固醇激素可能通过影响动物的进食与消化系统,进而改变其生长性能。Kaliannan等[30]的研究表明,性类固醇激素与小鼠 (Mus musculus) 肠道微生物群之间存在相互作用。2)注射性类固醇激素后,鱼类生长相关的激素水平、受体浓度均会发生改变,导致其生长速度发生变化[31-32]。如在哺乳动物研究中发现雌雄激素、性类固醇合同通路关键基因Dhcr24及Igf1系统之间可能存在复杂的调控关系[33]。雌雄激素对Dhcr24的影响是通过结合到其启动子上的雌雄激素结合位点来实现的[34-35],同时,雌激素受体与Igf1系统也被证实在脑组织中具有紧密关联[36]。本研究在半滑舌鳎转录组数据中也鉴定到性类固醇合同通路关键基因dhcr24等在雌性肝脏中的上调表达,因此,深入研究半滑舌鳎中雌雄激素、dhcr24基因及Igf1系统之间可能存在的关联机制,将有助于更好地理解鱼类性别生长二态性的分子机理。
另外,本研究中实验鱼的年龄较大及冬季养殖水温过低等,可能也是影响实验结果的重要因素。后续实验将对注射实验的鱼龄等进行优化,并考虑结合性类固醇激素投喂实验,同时控制环境因素变量,进一步探究性类固醇激素对鱼类生长差异的影响。

