基于lncRNA表达谱变化探讨Scoparone对肝损伤的干预效应
潘尚领
(1.广西医科大学 基础医学院, 广西 南宁 530021;2.广西中医药大学 第一附属医院, 广西 南宁 530023)
急性药物性肝损伤(drug-induced liver injury,DILI)是指由于药物或其代谢物引起的肝脏损害,是药物性肝病最常见的发病形式[1]。对乙酰氨基酚(APAP)是目前临床上常用的解热镇痛药,过量的APAP是引起急性药物性肝损伤的最常见原因之一。有研究表明,人体的炎症反应和免疫应答在APAP所致肝损伤中发挥重要作用[2]。近年来,天然药物作为抗炎抗氧化剂预防APAP诱导肝损伤已引起国内外研究者的广泛关注。6,7-二甲氧基香豆素(Scoparone, Sco)是一种香豆素类化合物,是中药茵陈蒿(ArtemisiacapillarisThunb)的活性和有效成分,临床上常在中药方剂(如茵陈合煎剂)中被用于治疗肝功能障碍、胆汁淤积和黄疸[3]。研究结果表明,Sco具有广泛的药理活性,包括抗炎、抗氧化、抗凋亡、抗纤维化和降血脂等特性[4]。长链非编码RNA (long non-coding RNA,lncRNA)为长度大于 200 个核苷酸的非编码,可以通过转录水平、转录后水平和表观遗传水平等角度调控蛋白编码基因的表达,从而广泛参与人体各种生理过程。目前,LncRNA如何参与肝脏疾病的发生开始逐渐成为新的研究热点,多项研究已表明lncRNA分子有望成为肝损伤的治疗靶标和生物标志物[5]。本项目拟从APAP诱导的大鼠肝损伤模型出发,探索Sco在APAP致肝损伤后对大鼠肝脏的保护作用及机制研究。
1 资料与方法
1.1 材料
1.1.1 实验动物
SPF级Wistar大鼠共30只,12周龄雄性,重230~300 g。购自厦门大学实验动物中心。
1.1.2 实验试剂
6,7-二甲氧基香豆素(Sco),购自北京百灵威科技有限公司;对乙酰氨基酚(APAP),购自上海源叶生物科技有限公司。
1.2 方法
1.2.1 实验分组
30只大鼠随机分为正常对照组、模型组和6,7-二甲氧基香豆素干预组(Sco),每组10只。模型组及Sco干预组给予APAP(800 mg/kg)腹腔注射,建立急性药物性肝损伤模型,正常对照组大鼠给予同等剂量生理盐水。造模48 h后,空白组和模型对照组给予橄榄油,Sco干预组给予Sco(500 μmol)灌胃干预,连续干预5 d后取材。大鼠麻醉处死后进行心脏取血,收集大鼠血清进行血清转氨酶和胆红素测定,同时取大鼠肝脏,用于lncRNA表达谱检测。
1.2.2 血清指标检检测
采用全自动生化分析仪检测大鼠血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、总胆红素(T-BIL)含量。
1.2.3 LncRNA表达谱检测
① 芯片:采用安捷伦lncRNA表达谱芯片,探针设计基于最新版本的人类基因组。
② RNA提取和质控:对每组10例大鼠肝组织进行RNA抽提,根据制造商的说明,使用TRIzol(Invitrogen, USA)从肝脏组织中提取总RNA,随后进行Dnase I处理以去除DNA污染。RNA样本进行变性琼脂糖凝胶电泳质检,用NanoDrop分光光度计(NanoDrop,USA)进行定量,评估总RNA的含量。在RNA样品浓度≥100 ng/μL,总量>2 μg,OD260/280在1.8~2.2,OD260/230≥2.0,且Agilent 2100 Bioanalyzer检测的RIN≥7的条件下,每组选择5例进行芯片检测。
③ 体系扩增和标记:采用 Agilent 表达谱芯片配套试剂盒并按标准操作流程分别对15份样品的总 RNA进行PCR扩增和荧光标记,并用RNA 提取纯化试剂盒纯化标记后的 cRNA。
④ 芯片杂交和荧光信号扫描:按照 Agilent 表达谱芯片提供的杂交标准流程和配套试剂盒,使用15张芯片对15 份样品进行杂交,在滚动杂交炉中以 65 ℃,10 r/min,滚动杂交 17 h,杂交 cRNA 上样量为 600 μg,并在洗缸中洗片。完成杂交的芯片采用 Microarray Scanner 软件设置染料通道,并用Feature Extraction Software 12.0 读取数据,最后采用 R 软件中的limma包进行归一化处理。
⑤ LncRNA靶基因预测:采用lncTar软件对鉴定出来的差异表达lncRNA进行靶基因预测。
⑥ RT-PCR验证:采用全式金的TransScriptII First-Strand cDNA Synthesisi SuperMix的逆转录试剂盒,反转RNA为cDNA。RT-PCR采用Takara公司的TB Green Premix Ex TaqTM试剂盒。采用2-△△Ct法进行组间差异统计分析。
1.3 统计分析
采用IBM SPSS 19.0 软件进行统计学分析。计量资料以均数±标准差表示,两组间的差异比较采用t检验。使用组成分分析法(principal component analysis, PCA)对lncRNA表达谱数据集进行降维,并可视化其降维后的特征分布。所有检验均为双侧检验,P<0.05为有统计学意义。
2 结果
2.1 Sco干预缓解了APAP引发的肝脏损伤
采用全自动生化分析仪检测大鼠血清ALT、AST和T-BIL含量,探究Sco是否能缓解APAP引发的大鼠药物性肝损伤(图1)。从图1可见,大鼠血清ALT、AST和T-BIL含量相对于对照组,模型组显著升高(均P<0.000 1)。但Sco干预后,大鼠血清ALT、AST和FBIL含量均显著下降(均P<0.000 1)。这些结果表明Sco对APAP引起的药物性肝损伤有保护作用。

(a) ALT

(b) AST

(c) T-BIL

图2 基于lncRNA表达谱数据的3组样本主成分分析Fig.2 Principal component analysis (PCA) plots of lncRNA expression data among the control, model and Sco group
2.2 lncRNA芯片检测结果
依据3组大鼠肝组织lncRNA表达谱结果绘制的PCA(图2)显示,lncRNA 可以良好区分3组样本,第一主成分(X轴)出现了15.957%的变异度,说明3组样本在lncRNA的表达谱层面存在显著差异。与正常对照组相比,模型组有475个显著上调lncRNA,185个显著下调lncRNA;与模型组相比,Sco干预组有123个上调lncRNA,249个下调lncRNA。使用 KOBAS 软件对Sco干预组和模型组间差异表达的 lncRNA 靶基因进行KEGG(kyoto encyclopedia of genes and genomes)通路富集分析。结果发现,差异表达lncRNA 的靶基因存在通路富集,且泛素介导的蛋白水解和cGMP-PKG信号传导途径的通路富集结果最显著(Q<0.05)(表1)。
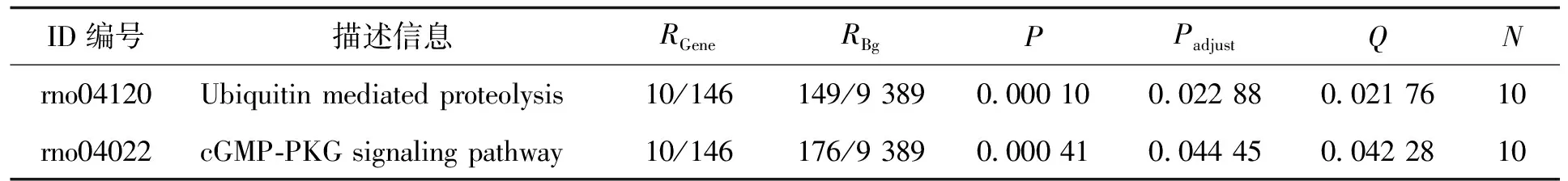
表1 差异lncRNA靶基因的KEGG通路富集分析Tab.1 KEGG pathway enrichment analysis of target genes of differentially expressed lncRNAs
在差异表达lncRNA中,9个lncRNA在模型组显著上调,但Sco干预后显著下调(差异倍数均大于2);6个lncRNA在模型组显著下调,但Sco干预后显著上调(差异倍数均大于2)(表2)。

表2 3组样本差异lncRNA分析结果Tab.2 Results of differentially expressed lncRNA analysis for the three groups of samples
2.3 差异表达lncRNA的靶基因预测
基于lncTar软件对鉴定出来的差异表达lncRNA进行靶基因预测, 有5个lncRNA存在靶基因,且和靶基因mRNA结合位点的最小自由能 (ndG)小于-0.1 kcal/mol(表3)。二者结合的结构其自由能越小,说明结构越稳定,靶向关系可信度越高。

表3 差异表达lncRNA预测靶基因结果Tab.3 Target gene prediction of differentially expressed lncRNA
2.4 差异表达lncRNA靶基因的表达验证
基于靶基因预测结果,进一步反映RT-PCR检测3组样本肝组织的靶基因表达水平。结果表明,Vdr的mRNA水平在3组间差异显著。相对于对照组,模型组Vdr表达水平显著下降(P<0.001),但Sco干预后,Vdr表达水平显著提高(P<0.01)(图3)。

图3 3组样本肝组织中lncRNA靶基因的RT-PCR验证结果Fig.3 RT-PCR validation of target genes in three groupsP*<0.05; P**<0.01; P***<0.001; NS: not significant
3 讨论
本研究通过构建对乙酰氨基酚急性药物性大鼠肝损伤模型,基于 lncRNA 芯片技术,探究了6,7-二甲氧基香豆素对急性药物性肝损伤的干预效应。结果显示,lncRNA 表达谱可以良好的区分对照组、模型组和Sco干预组,提示lncRNA 可能是参与药物性肝损伤发生、Sco干预急性药物性肝损伤过程的的关键分子。
本研究首先测定了各组的肝脏损伤生化指标,以反映Sco对APAP诱导的肝损伤的肝脏保护作用。模型组的AST和ALT与对照组的AST、ALT相比有显著提高。同时,这些变化在Sco处理后得以逆转,表明在Sco处理对APAP引起的肝脏损伤具有保肝作用。
为了进一步研究Sco干预对宿主基因表达的影响,本研究对3组大鼠肝组织进行了lncRNA表达谱检测,结果显示lncRNA在组间具有良好的区分能力。和模型组相比,Sco干预组有123个上调lncRNA,249个下调lncRNA。KEGG通路富集分析结果发现,差异表达lncRNA 的靶基因存在通路富集,且泛素介导的蛋白水解和cGMP-PKG信号传导途径这2个通路富集结果最显著。目前,很多研究已经探讨了泛素-蛋白体系统对肝脏损伤的影响。研究提示泛素-蛋白体系统抑制剂能够在不同的肝损伤模型中减少肝组织损伤、氧化应激和细胞凋亡[6]。另一方面,一些研究表明蛋白酶体抑制剂可能对肝脏有害[7]。因此,对于使用泛素-蛋白体系统抑制剂是有益还是有害,仍然存在着争议。因此,Sco是否可能通过类似泛素-蛋白体系统抑制剂的作用改善肝损伤,尚需要深入研究。2014年,REN等[8]报道了cGMP/PKG信号通路在调节人类肾癌细胞的增殖和生存中的重要作用,但未有报道提示cGMP/PKG信号通路与肝脏损伤相关。该通路有10个基因,有4个基因在Sco组上调,6个基因下调。后续在肝组织中需要进一步的表达验证,来探究Sco是否通过干预这些基因,参与肝损伤的表达。
进一步筛选两组间差异倍数大于2的lncRNA,其中9个lncRNA在模型组显著上调,但Sco干预后显著下调;6个lncRNA在模型组显著下调,但Sco干预后显著上调。经过靶基因预测,lncRNANONRATG022224.2的靶基因Vdr在组间表达差异显著,相对于对照组,模型组Vdr表达水平显著下降,但Sco干预后,Vdr表达水平显著提高,提示lncRNANONRATG022224.2可能靶向调控Vdr参与Sco干预肝损伤的过程。据报道,在遗传性或获得性胆道疾病中,顶端连接复合物(AJCs)发生了改变。维生素D核受体(VDR)主要在肝脏的胆道上皮细胞中表达,已被证明可以调节AJCs。研究发现,VDR的缺乏可通过破坏小鼠胆汁上皮细胞的连接促进胆汁淤积性肝损伤[9]。2020年,DONG等[10]的研究也提示,肝脏巨噬细胞中的维生素D受体激活可改善小鼠的肝脏炎症、脂肪变性和胰岛素抵抗。和以上研究结果一致,本研究在模型组观察到Vdr低表达,而Sco干预后Vdr表达升高。提示Sco可能通过靶向lncRNANONRATG022224.2,进而提高Vdr表达,体现干预肝损伤的作用。
综上所述,Sco对大鼠急性药物性肝损伤具有一定的保护作用, lncRNANONRATG022224.2靶向调控Vdr基因可能在Sco保护大鼠急性药物性肝损伤中发挥重要作用。在后续的研究中,将进一步验证研究lncRNANONRATG022224.2对Vdr的靶向调控关系,从lncRNA调控靶基因的角度探究Sco干预肝损伤的具体分子机制。

