黄芩苷改善慢性脑低灌注大鼠认知障碍的作用及机制研究
陈景,杨磊,左亚杰,张琴,彭词艳(.湖南省中医药大学第一附属医院制剂部,长沙 40007;2.中南大学湘雅二医院药学部,长沙 400)
慢性脑低灌注(chronic cerebral hypoperfusion,CCH)又称为慢性脑缺血,它是指由各种原因引发的长期脑血流灌注不足。CCH 可导致脑关键部位(尤其是海马CA1 区)缺血缺氧,诱发迟发性神经元损害,进而引起认知障碍[1]。因此,CCH被认为是造成血管性痴呆(vascular dementia,VaD)的一个主要诱因[2]。VaD 是继阿尔茨海默症之后最常见的一种痴呆类型,目前尚无有效的治疗药物[3]。借助CCH 模型,大量研究对VaD 的发生发展进行了探讨,但其详细机制仍未完全阐明。因此,通过CCH 模型研究VaD 的发病机制、寻找有效的治疗药物仍是一个亟待解决的问题。
黄芩苷是从黄芩干燥根中提取分离出来的一种黄酮类化合物,在中枢神经系统中显示出多种药理活性[4]。动物研究显示黄芩苷对局灶性脑缺血损伤具有保护作用,其机制主要是通过抗氧化实现的[5]。然而,黄芩苷能否改善CCH 所致的认知损伤,以及其所涉及的分子机制,目前尚未见报道。因此,本研究拟观察黄芩苷对CCH 所致认知障碍的作用,并探讨其机制,从而为VaD 的临床治疗提供可靠依据。
1 材料
1.1 动物
SD 雄性大鼠90 只,体质量180~200 g [湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2016-0002,质量合格证号:43004700042552]。大鼠自由饮水摄食,随机分笼饲养。饲养环境温度(25±2)℃,光照遵循明暗交替12/12 h 的节律。所有实验操作均遵循国际卫生研究机构关于动物使用伦理学方面的原则。
1.2 试药及仪器
黄芩苷(批号:021608102,Sigma 公司,纯度≥95%)。水合氯醛(批号:20170302,天津市科密欧化学试剂有限公司),乌拉坦(批号:51-79-6,上海山浦化工有限公司)。神经元核(NeuN)抗体(批号:ab177487)、突触素(SYP)抗体(批号:ab32127)(Abcam 公司),磷酸化核因子E2相关因子2(p-Nrf2)抗体(批号:LM-2013R,上海联迈生物工程有限公司),血红素加氧酶-1(HO-1)抗体(批号:10701-1-AP,Proteintech),内参甘油醛-3-磷酸脱氢酶(GAPDH)抗体(批号:cw0100,Cwbiotech 公司)。谷胱甘肽过氧化物酶(GSH-Px)试剂盒、超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒(南京建成生物工程研究所)。水迷宫实验记录分析系统(MT-200,成都泰盟科技有限公司),电生理在体场电位记录分析系统(RM6240BD,成都仪器厂),凝胶电泳仪(DYY-8C,北京六一仪器厂)。其余试剂均为市售分析纯。
2 方法
2.1 CCH 模型建立
采用双侧颈总动脉结扎手术建立大鼠CCH模型。术前大鼠禁食12 h,禁食后大鼠腹腔注射350 mg·kg-1水合氯醛麻醉,小心分离双侧颈总动脉,剥离迷走神经。用手术线分别在双侧颈总动脉的远心端与近心端进行双结扎,将两个结扎点之间血管剪断。假手术组大鼠不结扎和剪断血管,其他操作同上。整个实验过程中保持大鼠体温在36~38℃。手术过程中,大鼠的双侧颈总动脉血管被剪断,故最终纳入观察的大鼠均默认为缺血成功。
2.2 动物分组及给药
18 只大鼠在双侧颈总动脉结扎造模后死亡。剩余大鼠按随机数字表法分为6 组,即假手术组、模型组、缺血+黄芩苷低剂量组(50 mg·kg-1)、缺血+黄芩苷中剂量组(100 mg·kg-1)、缺血+黄芩苷高剂量组(200 mg·kg-1)、假手术+黄芩苷组(100 mg·kg-1),每组12 只。黄芩苷溶液用生理盐水配制,于造模1 周后开始灌胃给药,给药剂量参考文献方法[6],每日一次,持续给药2 周。
2.3 水迷宫实验
在造模后的第14~19日采用水迷宫实验评价大鼠的空间学习记忆。将大鼠置于水迷宫中进行连续5 d 的定位航行训练让其寻找平台,每日4 次,每次间隔约10 min。每次实验大鼠共游泳60 s 来寻找隐藏的平台,若大鼠在60 s 内找到平台,记录该时间为逃逸潜伏期,并让其在平台上停留10 s;若大鼠在60 s 未找到平台,其逃逸潜伏期默认为60 s,并人工诱导大鼠至平台上停留10 s。于第6日将平台移去进行探索实验,记录大鼠60 s 内在目标象限所待的时间。逃逸潜伏期用以评价大鼠的学习能力,目标象限所待时间用以评价大鼠的记忆功能。
2.4 新事物认知实验
在造模后的第20日采用新事物认知实验评价大鼠的非空间学习记忆。实验装置由一个开口木制敞箱(50 cm×50 cm×90 cm)组成。在实验前一日,将大鼠放置木箱中探索5 min 以适应环境。第2日为正式实验,由间隔1 h 的两个阶段组成。第一阶段,将一个棕色木制正方体(边长5 cm)与黑色橡胶圆锥体(底面直径5 cm,高5 cm)分别放置敞箱的两个对角。将大鼠从敞箱中间位置放入,让其自由探索两个物体。探索行为定义为:大鼠鼻尖接触物体或鼻尖指向物体且距离小于1 cm。第一阶段实验中,当大鼠累积探索时间达到20 s 时,将大鼠取出。在第二阶段实验,将黑色橡胶圆锥体(旧事物)换成一个直径5 cm 的蓝色玻璃球(新事物),记录5 min 内大鼠探索两个物品各自的时间。数据分析采用分辨指数对各组大鼠进行比较。分辨指数=(探索新事物的时间-探索旧事物的时间)/(探索新事物的时间+探索旧事物的时间)。
2.5 电生理长时程增强(long-term potentiation,LTP)记录
新事物认知实验后的第2日,大鼠用1.5 g·kg-1乌拉坦腹腔注射麻醉后进行海马Schaffer侧枝-CA1 区LTP 的记录。刺激电极定位:前囟后3.7 mm;旁开3.2 mm;硬膜下2.0 mm;记录电极定位:前囟后3.3 mm;旁开2.2 mm;硬膜下1.8 mm。选择诱发最大兴奋性突触后电位(EPSPs)幅度40%所对应的电压强度作为基础刺激,刺激间隔30 s,频率0.3 Hz。记录基线20 min 后,采用高频高强刺激诱导LTP,参数为:连续4 串脉冲,每串脉冲间隔5 min,每串脉冲持续1 s,频率100 Hz;刺激强度为最大EPSPs 幅度80%所对应的电压强度。高频高强刺激后休息5 min,然后将刺激参数调为与基础刺激一致,继续记录1 h。将高频高强诱导后的EPSPs 平均值与诱导前基线平均值进行标准化,比较标准化后各组间诱导后的平均值。
2.6 大鼠海马CA1 区NeuN 及SYP 的表达
大鼠LTP 记录完成后,立马断头取脑分离出海马CA1 区组织备用。将其中6 只大鼠的组织分别提取总蛋白后,取等量蛋白进行凝胶电泳,电泳分离完成后转印至PVDF 膜上。经脱脂奶粉封闭后,4℃孵育NeuN 抗体、SYP 抗体、p-Nrf2 抗体、HO-1 抗体及内参GAPDH 抗体过夜。次日,将条带洗涤后孵育相应二抗1 h。孵育完成后,将条带进行清洗并用ECL 显影成像。曝光图像用NIH Image J 对灰度值进行分析,GAPDH 抗体所对应条带的灰度值作为内参进行校正。统计时将假手术组的灰度值标准化为1,计算各组的相对灰度值。
2.7 脑组织中氧化应激指标检测
将剩余的6 只大鼠海马CA1 区组织称重后置于9 倍质量的生理盐水中,冰浴制备匀浆。离心后取上清液,按照试剂盒说明书对GSH-Px、SOD 的活性以及MDA 的含量进行测定。
2.8 统计学处理
实验数据采用SPSS 软件进行统计分析,用均数±标准差表示。水迷宫实验中逃逸潜伏期结果采用重复测量双因素方差分析;多组间比较采用单因素方差分析(ANOVA),组间两两比较采用LSD-t检验。P<0.05 表示差异有统计学意义。
3 结果
3.1 黄芩苷改善CCH 大鼠空间学习记忆损伤
大鼠定位航行训练结果如表1和图1所示,与假手术组大鼠相比,模型组大鼠在第2~5日的逃逸潜伏期明显延长(P<0.01);给予中、高剂量黄芩苷处理后,缺血大鼠逃逸潜伏期的延长得到了逆转(P<0.05 或P<0.01)。在探索实验中,与假手术组大鼠比较,模型组大鼠在目标象限所待时间明显缩短(P<0.01),给予中、高剂量黄芩苷能显著延长缺血大鼠在目标象限所待时间(P<0.01)。
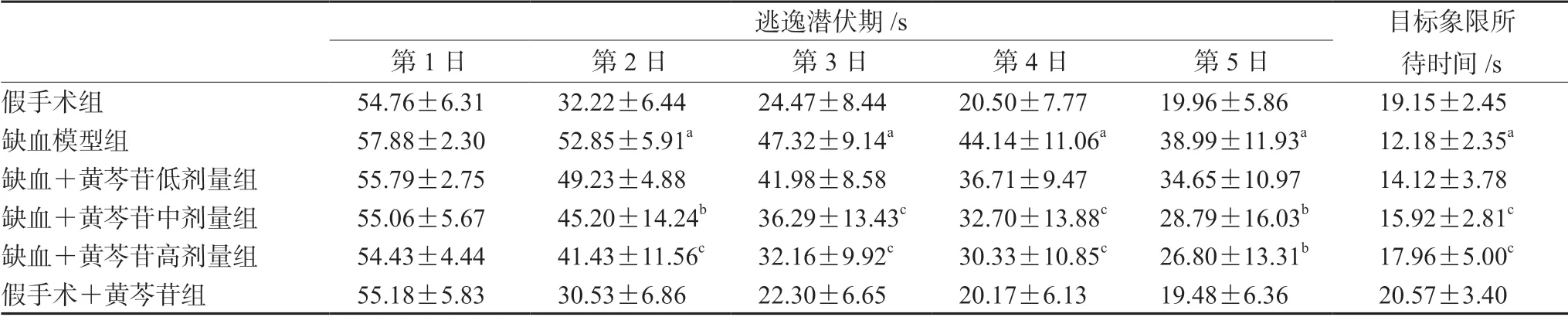
表1 黄芩苷改善CCH 大鼠空间学习记忆损伤(n=12)Tab 1 Baicalin ameliorated the spatial learning and memory impairment induced by CCH in rats (n=12)
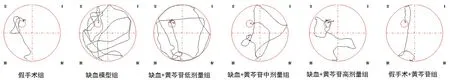
图1 各组大鼠水迷宫实验典型游泳轨迹图Fig 1 Typical swimming paths of different groups in the Morris water maze task
3.2 黄芩苷改善CCH 大鼠非空间学习记忆损伤
图2A 为新事物认知实验的示意图。图2B 结果显示,与假手术组大鼠相比,模型组大鼠的分辨指数明显降低(P<0.01)。给予中、高剂量黄芩苷治疗能显著改善脑缺血所引起的分辨指数降低(均P<0.01)。
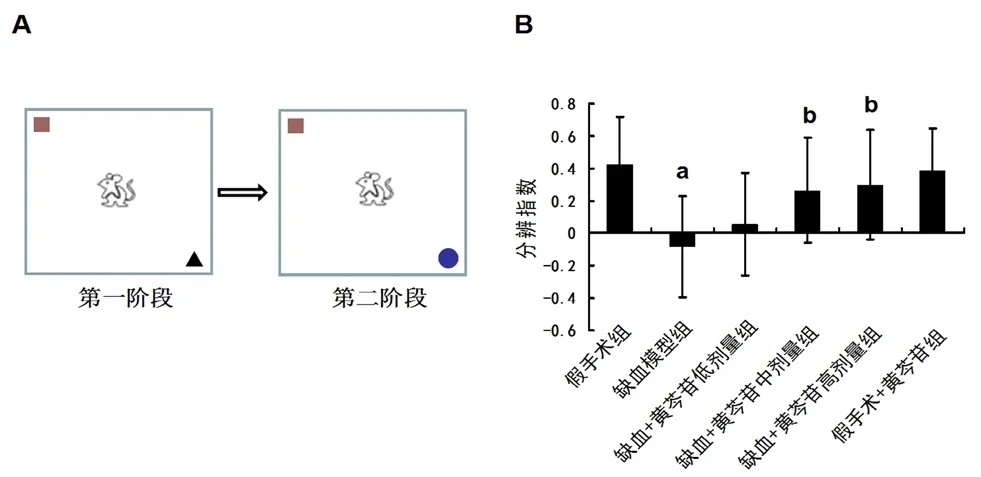
图2 黄芩苷对CCH 大鼠非空间学习记忆损伤的影响(n=12)Fig 2 Effect of baicalin on the non-spatial learning and memory impairment induced by CCH in rats(n=12)
3.3 黄芩苷改善CCH 大鼠海马CA1 区LTP 的抑制
图3A 为大鼠海马Schaffer 侧枝-CA1 区LTP诱导前后EPSPs 图。图3B 显示,与假手术组大鼠相比,模型组大鼠的LTP 的诱导明显受到抑制(P<0.01)。给予中、高剂量黄芩苷后能部分逆转缺血大鼠LTP 诱导的抑制(P<0.05)。
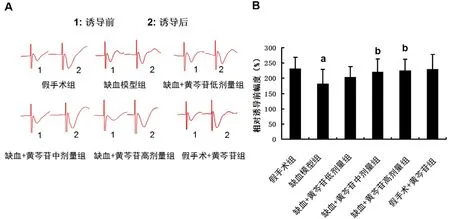
图3 黄芩苷改善CCH 大鼠海马CA1 区LTP 的抑制(n=12)Fig 3 Baicalin ameliorated the CCH-induced inhibition on LTP at the CA1 area of the hippocampus in rats(n=12)
3.4 黄芩苷改善CCH 大鼠海马CA1 区神经元及突触损伤
为进一步探讨黄芩苷改善慢性脑缺血的分子生物学途径,我们选择黄芩苷中剂量给药组进行后续机制分析。如图4A 及4B 所示,与假手术组大鼠相比,模型组大鼠NeuN 及SYP 的表达显著降低(P均<0.01)。给予100 mg·kg-1黄芩苷后能显著上调缺血大鼠NeuN 及SYP 的表达(P均<0.05)。
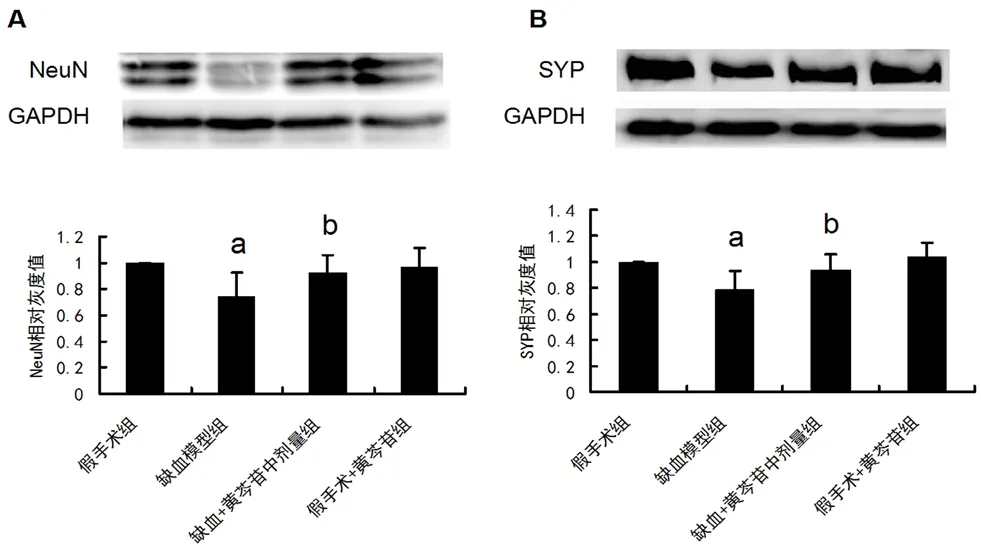
图4 黄芩苷对CCH 大鼠海马CA1区NeuN 及SYP 表达的影响(n=6)Fig 4 Effect of baicalin on the expression of NeuN and SYP induced by CCH in hippocampal CA1 area of rats(n=6)
3.5 黄芩苷改善CCH 大鼠海马CA1 区的氧化应激指标
如表2所示,与假手术组大鼠比较,缺血大鼠海马CA1 区GSH-Px 及SOD 的活性显著降低(均P<0.01),MDA 的含量显著升高(P<0.01);给予100 mg·kg-1黄芩苷后能显著上调GSH-Px 和SOD 的活性以及降低MDA 的含量(P均<0.05)。
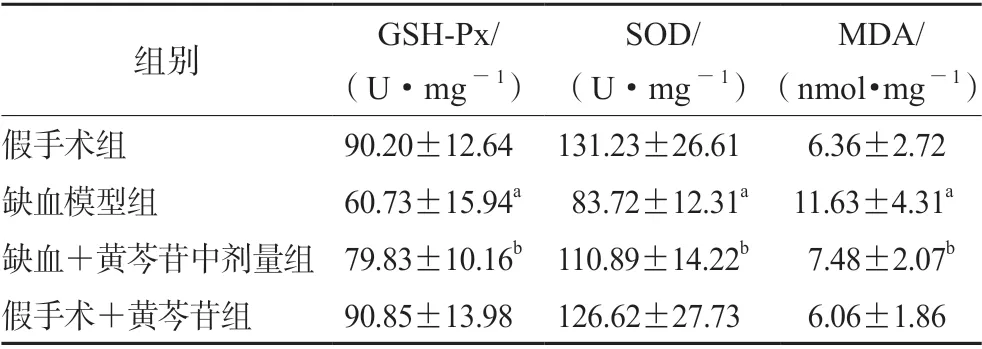
表2 黄芩苷对CCH 大鼠海马CA1 区氧化应激指标的影响(n=6)Tab 2 Effect of baicalin on the oxidative stress induced by CCH in hippocampal CA1 area of rats (n=6)
3.6 黄芩苷促进CCH 大鼠海马CA1 区Nrf2/HO-1 信号通路的激活
如图5所示,与假手术组大鼠相比,模型组大鼠海马CA1 区p-Nrf2 及HO-1 的表达显著升高(均P<0.05)。给予100 mg·kg-1黄芩苷后能进一步促进缺血大鼠p-Nrf2 及HO-1 的表达上调(P<0.05,P<0.01)。
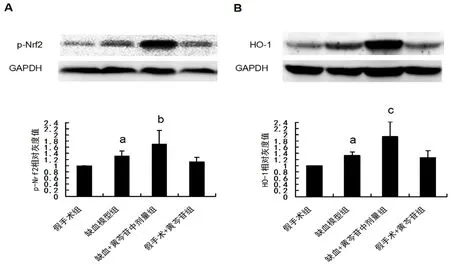
图5 黄芩苷对CCH 大鼠海马CA1 区Nrf2/HO-1 信号通路的影响(n=6)Fig 5 Effect of baicalin on the activation of Nrf2/HO-1 signaling pathway in the hippocampal CA1 of rats after CCH(n=6)
4 讨论
VaD 是一种年龄相关性的痴呆类型。近年来,随着人口老龄化进程的加剧,VaD 越来越受到人们的关注,但关于VaD 的发病机制目前还未研究清楚,其治疗也尚无批准的有效药物。因此深入VaD 的研究迫在眉睫。通过双侧颈总动脉结扎手术建立大鼠CCH 模型是研究VaD 最常用的一种模型[2]。借助此模型,本研究发现CCH 能导致大鼠出现显著的空间及非空间学习记忆损伤,给予中、高剂量黄芩苷(100、200 mg·kg-1)可显著改善CCH 所致的学习记忆损伤。
LTP 可以从突触可塑性的角度阐明学习记忆形成的细胞分子机制[7];而神经元和突触变化可以从结构可塑性的机制阐明学习记忆的改变[8]。本研究通过在体场电位记录大鼠海马CA1 区LTP,进一步证实中、高剂量黄芩苷可以改善CCH 所致的学习记忆损伤。并且,黄芩苷改善CCH 所致的学习记忆损伤可能与抑制海马CA1 区神经元及突触损伤有关。
事实上,大量研究显示黄芩苷可以改善脑缺血损伤[9-10],并且对多种模型引起的认知障碍有改善作用[11-12]。黄芩苷改善缺血损伤的一个重要机制是缓解缺血引起的氧化应激[5,10]。氧化应激是由于组织氧化还原的平衡状态被破坏,从而引起自由基大量聚集、膜脂质破坏、DNA 裂解、蛋白氧化;最终可导致突触丢失,神经元死亡,突触可塑性减弱。抑制氧化应激损伤已被充分证实可以减少神经元的丢失和突触的破坏,改善认知功能[13-14]。GSH-Px活性、SOD 活性降低及MDA 含量通常联系起来作为评估氧化应激程度的指标。GSH-Px 和SOD 是机体内清除自由基的重要抗氧化酶;而MDA 含量可以间接反映出细胞受自由基损害的程度。本研究发现给予黄芩苷后能显著逆转CCH 引起的GSH-Px 和SOD 活性降低及MDA 含量升高。提示黄芩苷改善CCH 所致的学习记忆损伤是通过抗氧化实现的。
Nrf2 作为核转录因子,在细胞防御多种应激损伤中起重要作用。氧化应激时,Nrf2 可发生磷酸化并转位进入细胞核,在细胞核内积聚并进一步识别、结合抗氧化反应元件,从而启动具有细胞保护效应的多种抗氧化酶基因(如HO-1)的转录,达到降低氧化应激水平,保护细胞和组织的作用[15-16]。本研究发现CCH 模型大鼠海马CA1区p-Nrf2 及HO-1 的蛋白表达出现上调,提示Nrf2/HO-1 通路激活,这可能是机体启动的一种自我保护机制,与此前报道相一致[17]。给予黄芩苷后,p-Nrf2 及HO-1 的表达进一步上调,证实黄芩苷可能是通过促进Nrf2/HO-1 通路的激活,缓解氧化应激损伤,从而改善CCH 所致的认知障碍。这与文献报道在其他模型下黄芩苷可经Nrf2/HO-1 通路调控氧化应激损伤相一致[18]。
综上所述,本研究通过大鼠CCH 模型,发现黄芩苷能改善CCH 所致的认知障碍,其机制可能与促进Nrf2/HO-1 信号通路的激活,抑制CCH 所引起的氧化应激,缓解神经元及突触损伤有关。

