抗菌肽对于病原微生物的抗菌及耐药机制
王撼宇,孙晓仲,雷志鹏,陈 欢,王 刚,张斯童,陈 光,孙 旸*
(1.吉林农业大学 生命科学学院 秸秆生物学与利用教育部重点实验室,吉林 长春 130118;2.吉林省产品质量监督检验院,吉林 长春 130118)
微生物感染致死已经可以影响全球死亡的趋势。抗生素的出现则打破了这种趋势,并给予了人们战胜病原微生物的希望。虽然抗生素曾经能够治疗生物体内绝大多数的感染,但使用抗生素后生物体内不断产生的耐药性会逐渐减弱抗生素的作用效果。在现代医学治疗中已经发现了人体内许多部位(如泌尿道、呼吸道等)的病原体会产生出对抗生素的耐药性。所以说设计出比传统抗生素更不易受进化抗性机制影响的抗菌药物是一个新的挑战。抗菌肽(antimicrobial peptides,AMPs)是生物在长期进化过程中为适应环境、求得生存而最早产生的免疫活性分子,是天然免疫的重要介质,在宿主对抗病原入侵的免疫防御中起着极其重要的作用,被形象地称为“天然抗菌剂”。抗菌肽在体内除了能以直接杀死病原菌的方式起作用外,更多的时候是作为免疫效应分子来启动、调节宿主免疫防御体系。它们的工作原理是破坏细胞膜,调节免疫反应,减缓炎症。由于它们引起抗药性的可能性相对较低,因此一直认为AMPs是常规抗生素的潜在替代品。因此,AMPs成为国内外研究和开发的热点,具有着广阔的开发应用前景。本文对抗菌肽杀灭细菌作用机理及病原微生物耐受抗菌肽的基本原理进行综述,旨在深入了解AMPs的抗菌机制和微生物对其耐药机制,将为AMPs进一步开发与利用提供理论基础。
1 抗生素的发展史
目前可能存在一个误解,误认为人类最早接触抗生素的时间在20世纪初,但其实际接触的时间要远远早于这个时间。早在古埃及、中国、希腊和罗马中都有记载使用抗生素来治疗细菌感染的记录,当时使用发霉的面包对感染的患者进行治疗[1]。在古苏丹努比亚人(公元350-550年)和古埃及人的骨骼遗骸中发现了与现代抗生素有关的四环素结构物质等[2-4]。因此从这些证据可以看出,人类接触并使用抗生素要比认知的时间早得多。
GERHARD DOMAGK于1935年介绍了第一个广泛使用的抗生素,即磺胺嘧啶,在多种传染性疾病中均具有抗菌活性。随后发现偶氮磺胺是合成对氨基苯磺胺的前体,并且还没有申请相对应的专利,这才导致了后续其衍生物以及磺酰胺类抗生素的时代的到来[5]。青霉素是最著名的抗生素之一,于1928年由亚历山大·弗莱明发现,在第二次世界大战期间开始大规模生产以及使用,随后霍华德·弗洛里和欧内斯特·链进行了合成和纯化[2,6]。1944年,塞尔曼·瓦克斯曼从灰链霉菌中发现了一种氨基糖苷类抗生素,并将其命名为链霉素[7-8],因此他被称为是“抗生素之父”,这标志着抗生素黄金时代的开始。在随后的几十年中,发现了20多种不同类型的抗生素,包括几种不同的类型:磺酰胺,β-内酰胺类(青霉素、头孢菌素),氨基糖苷类,喹诺酮类,环肽(包括短杆菌肽、多粘菌素、糖肽、脂肽和脂糖肽),四环素,大环内酯类(包括酮醇类),苯甲酚,硝基咪唑,二氢叶酸还原酶抑制剂,林沙酰胺等。自从抗生素首次出现以来,它已经改变了医学的进程,并且拯救了全世界无数的生命。以前无法治疗的传染病及其灾难性后果现在可以很容易控制。但是,耐药性问题随之也出现了。在1940年,青霉素还没有开始大规模生产时候,就已经报道出了葡萄球菌对青霉素产生了耐药性。在1958年,古霉素被报道出现了耐药性。在那个抗生素生产的黄金时代,新型抗生素不断被发现和开发用于临床。但耐药性的细菌以及真菌也在不断的进化,因此,迫切需要具有替代作用模式的新型抗感染药物来对抗不断进化的耐药性的细菌与真菌。AMPs被认为是传统抗生素在某些治疗用途上的可能替代品,它引起耐药性[9]的可能性相对较小,因此有很大的应用和发展潜力。
2 抗菌肽介绍
AMPs是生物体内由特定基因编码并通过诱导产生的,以一种非常重要的防御体系广泛的存在与植物、动物以及微生物中。迄今为止,已发现许多不同AMPs,据报道,它们对革兰氏阴性菌和革兰氏阳性菌、感染性真菌均有抗菌活性,有时还具有对病毒、寄生虫或疟原虫的抗菌抗活性[10-11]。其中许多还被证明通过激活免疫细胞来调节宿主免疫、炎症或者抑制炎症。为了强调其在高等生物中的多效性,天然AMPs通常被称为“宿主防御肽”(host defense peptide,HDP),或者称为“先天性防御调节肽(innate defense regulatory peptide,IDR)”。关于其免疫调节活性的报告大多在先天免疫水平上[12]。它们在所有真核生物(真菌、藻类、植物、无脊椎动物和脊椎动物)中含量丰富,分布在宿主防御感染前线的细胞和组织中(主要是循环免疫细胞和上皮细胞),证明了它们对先天免疫的影响和重要性。抗微生物肽的专门收集数据库中(CAMPR3)目前包含8164个肽条目,一个特别丰富的来源是无尾物种,已经报告了近2 000个肽序列[13]。然而,AMPs在原核生物中也有很好的代表性,由革兰氏阴性菌和革兰氏阳性菌产生,其中一个丰富的类别就是细菌素[14]。AMPs是一种天然的低分子质量多聚肽,长度为9~100个氨基酸。尽管AMPs在结构和生化特性上具有高度的多样性,但大多数AMPs都含有带正电荷的氨基酸残基、疏水或亲水基序,这些决定了它们的水溶性且可以与带负电荷的微生物细胞膜相互作用[15-19]。虽然抗菌肽的抗菌作用机制比较复杂,但许多抗菌肽通过与细胞质膜的结合和改变细胞膜的通透性来快速杀伤细胞或穿透细胞,抑制蛋白质合成、脱氧核糖核酸(deoxyribonucleic acid,DNA)转录/复制、细胞壁生物合成或使基本酶活性失活。革兰氏阳性细菌产生的AMPs具有特殊的抑制谱,并且已经应用在很多方面[20-25]。AMPs除了用于治疗感染外,还可用于控制植物病害。天然AMPs的合成类似物已在转基因植物中表达,以保护植物免受感染,或被微生物分泌,然后用作商业生物农药的活性成分。重组或合成的AMPs可以安全地用于水产养殖的治疗、牲畜的食品添加剂或食品防腐剂。
3 AMPs的抗菌机制
3.1 靶点结合
尽管已经证实了AMPs是通过让细胞膜破裂来使细胞溶解,达到抗菌作用[26](见图1)。
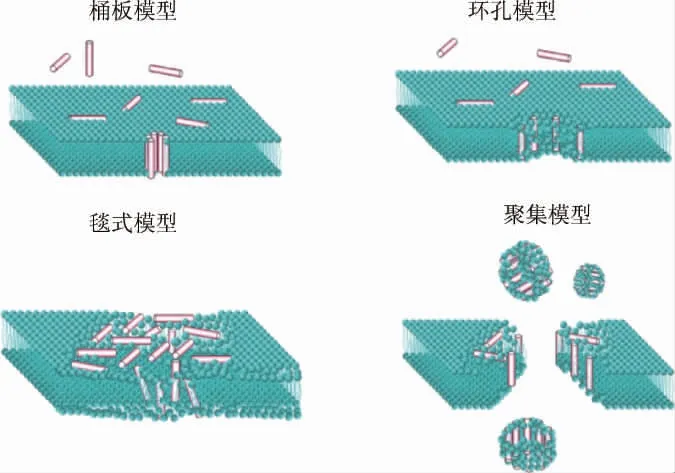
图1 抗菌肽对细胞膜的作用机制Fig.1 Mechanism of antimicrobial peptides on cell membrane
但随后发现抗菌机制不只有这一种,在致病细菌中加入AMPs后所进行的分析中发现,有些AMPs并没有改变致病细菌细胞膜的通透性,但却仍然能够起到了抗菌的效果,因此AMPs除了形成细胞膜孔隙之外,还与细胞内的肽作用靶点相结合[27-28],且许多微生物即使在其膜受到广泛损害后仍能存活,这表明不涉及膜溶解的其他机制可能也会导致细胞死亡[29]。需要注意的是,为了使AMPs和靶细胞内成分之间发生相互作用,肽需要通过易位过程被运输到微生物中[30]。但这一过程的机制尚未明确,但推测细胞膜上的孔隙在AMPs的促进下,使得一些肽转移到细胞内部,并将作用于细胞内靶点。AMPs进入到细胞内并与其靶点结合,起到抗菌的效果[31-32]。
3.2 干扰细胞壁的合成
羊毛硫抗生素是由革兰氏阳性细菌产生的一类细菌素,其中有些AMPs作为酶抑制剂,主要干扰竞争性微生物的细胞壁合成。其机制是AMPs与脂质II结合,从而阻止合成细胞壁的前体—肽聚糖的聚合[33-34]。这种抑制作用也可能是由AMPs与细胞壁合成过程中的其他酶(如与肽聚糖易位有关的酶)结合引起的。一般来说,这是一种对抗革兰氏阳性细菌更有效的方法,因为它们的细胞壁中含有大量的肽聚糖[35]。从植物和昆虫中分离到了有效的抗真菌抗菌肽。ZENG H等[36]通过研究从阿克苏芽孢杆菌中提取出来的TUBP1蛋白,发现破坏真菌细胞壁合成(由几丁质组成)也是由一些以AMPs主导的机制。KLAUS K等[37]从甜菜(Beta vulgarisL.)中提取的IWF4是一种富含半胱氨酸和甘氨酸的30个氨基酸肽,显示出一个具有几丁质结合特性的结构域,能够有效的抵抗真菌对于甜菜的破坏。FEHLBAUM P等[38]从果蝇昆虫中分离出来的一种44氨基酸的抗真菌果蝇霉素。
3.3 其他机制
其他机制,如作用在细胞生长和增殖所必需的复制、转录和翻译过程中,AMPs可以与DNA和RNA的结合,致使涉及这些核酸的合成过程受到抑制(见图2)。
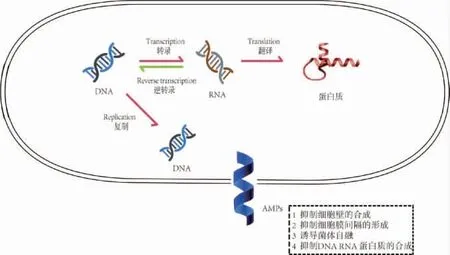
图2 抗菌肽对细胞内的作用机制Fig.2 Mechanism of antimicrobial peptides in cells
如抑制主要的DNA复制酶,这已经是一种非常普遍的抗菌机制[39-40]。通过对CF-14肽抗菌作用观察发现,其对DNA具有高度亲和力,因此可以导致微生物功能的改变,达到抗菌效果[41]。通过对富含脯氨酸的抗菌肽观察发现,其中含有其他配体,它们与主要热休克蛋白特异结合,而与细菌伴侣无特异性结合。这些机制抑制了这些蛋白质的活性,从而破坏基本的细胞合成过程[42-43]。一些AMPs可能与真菌细胞膜上的受体结合,促进其插入细胞质,然后以非溶解方式诱导三磷酸腺苷(adenosine triphosphate,ATP)的丢失,这将会破坏细胞周期,导致对细胞有毒有害的活性氧的产生[44],致使细胞死亡。
4 微生物对AMPs的耐药机制
多年来,由于滥用和不加控制地使用抗菌物质导致了过去一些非常高效的抗生素和抗菌分子已经不能够有效的抑菌抵抗,尽管这种现象是微生物进化的自然现象[45],但这对人类抵抗致病微生物是一个非常大的挑战。对于微生物来说,仍然有很多机制来应对抗生素和抗菌分子对其造成的威胁。总体来说,微生物应对AMPs的主要策略为:组成型抗性和诱导型抗性。组成型抗性,也称为被动型抗性,表现出利用微生物机体固有的用来抵抗的机制(见图2)。诱导或适应型抗性是为了响应AMPs的存在或其作用而触发的机制[46]。
4.1 组成型抗性
组成型抗性的形成是由膜能量的改变和静电屏蔽所形成的。膜能量的改变主要是碱性氨基酸向膜表面的移位,这将会导致其液体电荷发生变化。这样一来,AMPs与膜的亲和力降低,从而改变了它们的连接机制,这也是静电屏蔽形成的结果,电荷变化主要是发生在革兰氏阳性菌(外膜)中[47-48]。组成型抗性的一个例子是金黄色葡萄球菌中dlt操纵子的激活,dltA,dltB,dltC和dltD基因通过将碱性氨基酸D-丙氨酸转运到膜的表面来影响菌壁磷壁酸的电荷,主要表现为电荷的减少。膜上电荷的这种变化降低了膜与AMPs的亲和力,破坏了最开始形成的和随后形成的的抗菌作用。在其他革兰氏阳性细菌中也发现了类似的机制[49-50]。在革兰氏阴性中,组成型抗性有两个主要机理。其中一种抗性机制的形成是在外膜上的脂多糖类的脂质A形成静电屏蔽来减少外膜净负电荷来实现的[51-52]。另外一种抗性机制是因为脂质A之间的疏水相互作用增加,改变了膜的通透性,从而减少或完全阻止了AMPs的插入以及随后形成的孔和分子的移位[53]。

图3 微生物对抗菌肽的抗性机制Fig.3 Resistance mechanism of microbial to antimicrobial peptides
4.2 诱导型抗性
在诱导型抗性的机制中,主要是指蛋白酶和肽酶的流动、外排泵的激活以及靶点的突变修饰。第一种机制是指使用降解蛋白质和肽的酶来“杀死”威胁细胞活力的AMPs。这些酶可以被转移到细胞外环境中起到作用,也可以作用于受到攻击的细胞的细胞质中,降解转位肽并阻止它们作用于细胞内靶点[54]。在这种情况下,外排泵被激活并开始工作,将转运肽泵回到细胞外环境并保护细胞内部[55-56]。SHAFER W M等[57]在观察淋病奈瑟菌在暴露于蛋白朊pro tegrin-1和人源抗菌肽LL-37之后,这种外排泵激活才被发现。SIEPRAWSKA-LUPA M等[58]研究发现,人源抗菌肽LL-37会被金黄色葡萄球菌溶血素蛋白酶所灭活。最后,靶点的突变修饰是需要更详细地阐明的机制,它被认为是基于细胞膜和胞内AMPs靶点的瞬时突变,以减少甚至阻止肽与其受体的结合[59-60]。如VISSER L G等[61]研究发现,病原体小肠结肠炎耶尔森氏菌会改变外膜蛋白的产生,以防止AMPs相互作用。NURI R等[62]研究发现,细胞内部吞噬作用的发生会受到细胞外信号(如pH和盐浓度变化,例如镁和钙)的调节影响。
5 AMPs的应用前景展望
目前,AMPs在人类和动物健康以及食品工业中的应用越来越多,人们逐渐的在寻找传统合成化学品的替代品,因为这些传统的化学品已经失去了有效性或消费者的可接受性。
据报道,MARTINEZ M等[63]通过人工设计并合成的阳离子抗菌肽P5通过增加质膜的通透性来抑制耐碳青霉烯类抗生素的铜绿假单胞菌(该耐药微生物是引起医院感染的主要病原体之一),此外,P5肽还能抑制生物膜产生的能力,这是为了应对出现的持续和反复的污染。类似的研究表明,BUONOCORE F等[64]从南极冰鱼中提取出的氯霉素m3a肽对大肠杆菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、金黄色葡萄球菌、表皮葡萄球菌和肠球菌属(与抗生素耐药感染相关的重要病原体)都具有很好的抗菌效果。这些研究证明了AMPs在治疗中的巨大潜力。
尽管已经研究了AMPs的几种功能,但是由于缺乏对其观察和使用可行模式的研究,其应用仍然受到限制。很少有AMPs被批准用于临床用途,MARGIT M等[65]研究发现,多粘菌素B可以用于治疗具有多重耐药性的革兰氏阴性细菌感染。大多数研究集中在AMPs的使用,如包装和医院用品。例如,与标准卫生技术相比,RIORDAN L等[66]在医院使用的金属表面加入了合成的人类抗生素,可有效降低微生物数量,减少耐甲氧西林的金黄色葡萄球菌、大肠杆菌、表皮葡萄球菌、肠球菌和铜绿假单胞菌的数量。对于AMPs的生物活性改性包装,这不仅是将其高科技的应用还具有潜在的消费市场。研究表明,与直接在食品中施用相比,乳链菌肽在包装中的应用具有优越性,可降低生产成本并改善抗菌作用。IMRAN M等[67]将乳链菌肽Z(nisin Z)制成生物可降解薄膜,SOTO K M等[68]将Nisin制成电纺纤维,BARBOSA A A T等[69]所研制的乳链菌素纤维素膜,这些在运用于食品包装时,能够有效的减少与食物中毒和/或腐败相关的李斯特菌、鼠伤寒沙门氏菌、肠膜明串珠菌、金黄色葡萄球菌、酸热脂环酸杆菌和蜡状芽孢杆菌的数量。其他几种多肽也在被研究应用在食品工业中,如SHWAIKI L N等[70]通过人工合成肽Dip KK-14和KK-14 R10能够良好的抵抗食物之中的食品腐败菌,然而对于其的包装应用在食品工业还需要进一步研究。
考虑到当前对传统消毒和治疗物质的抗性问题,AMPs的使用已成为将来控制病原体的主要替代方法之一。AMPs的副作用小,同时对于耐药性细菌能够产生出很好的抑菌效果,这些特点表明着AMPs和抗生素在未来可以进行相互结合,应用于治疗多种耐药性的细菌病症,从而降低药物对人体产生的毒性。同时AMPs同样也可在人体内进行作用,因为其可以发挥人体内部免疫调节的作用,刺激血管的生成,促进损伤的修复,代表着AMPs未来可以作为医疗产品从而更加方便且安全的调节人体内部的免疫系统。因此,该领域的研究需要不断增加,对AMPs的功能分子原理的深入了解将使研究人员能够更好地设计该领域的项目,防止浪费人力和财力并掌握成果。
6 结束语
深入了解AMPs的抗菌机制对于成功应用具有重要意义。在AMPs的抗菌机制上了解与微生物对AMPs耐药性机制,对其从宏观到微观方面充分的理解,可以使研究人员开发出更好的方法来探索和评估AMPs的潜力。了解AMPs对病原微生物的抗菌以及病原微生物对抗菌肽的耐药机制,有助于研究开发出更加完备的AMPs。目前,对AMPs的合成研究较多,随着对其机理的进一步了解,对这些工程肽的优化迫在眉睫。尽管大多数AMPs抗性机制尚未得到证实和/或充分阐明,但新的研究和技术可以对其探究。需要注意的是,现在许多AMPs分子之间起共同作用,并且还有一些其他互补因素会影响抗菌作用。对AMPs研究中,不同肽之间协同作用的出现是一个日益突出的话题,并且也显示出巨大的研究潜力。最后需要强调的是有时候AMPs作用和抗性的分子机制却被多次忽略,因此需要进行基础研究以阐明AMP的作用基础机制,以避免资源浪费和优化适用结果。

